大孔吸附树脂富集茶多酚中低苦涩味儿茶素
张有发,王普
1(浙江工业大学药学院,浙江杭州,310032)2(湖南金农生物资源股份有限公司,湖南长沙,410100)
茶叶中的儿茶素属黄烷醇类化合物,占茶叶干重的12%~24%。儿茶素分子结构中含没食子酰基的称为酯型儿茶素或复杂儿茶素,主要有表没食子儿茶素没食子酸酯(EGCG)、没食子儿茶素没食子酸酯(GCG)和表儿茶素没食子酸酯(ECG);不含没食子酰基的称为非酯型儿茶素或简单儿茶素,主要组成有表没食子儿茶素(EGC)、儿茶素(DL-C)和表儿茶素(EC)。以EGCG为代表的酯型儿茶素占儿茶素总量的80%左右,具有较强的苦涩味,收剑性强,限制了儿茶素在袋泡茶、强化儿茶素饮料等领域中的应用。以EGC为代表的非酯型儿茶素苦涩味低,收剑性弱,回味爽口。如能提高非酯型儿茶素的比例,制作成低苦涩味产品,则可填补该应用领域的空白,前景十分广阔。
采用外源单宁酶降解酯型儿茶素为简单儿茶素,可得低苦涩味的产品[1-2],但单宁酶未被列入食品添加剂使用卫生标准GB2760-2007目录中,不是合法的添加剂,不能用于食品。文献报道的工艺研究主要集中在如何富集以EGCG为代表的酯型儿茶素和分离咖啡因(CAF)方面[3-10],也有文献报道通过控制提取温度与提取时间来富集 EGC[11-12],但均不脱除EGCG,且由于产品中的酯型儿茶素比例较高,苦涩味仍过重。本文以绿茶多酚(TP)为原料,EGC含量为指标,采用大孔吸附树脂处理,研究低苦涩味儿茶素制备新工艺。
1 材料与方法
1.1 材料与试剂
茶多酚40%:EGC含量6.22%,总儿茶素含量21.6%,由湖南金农生物资源股份有限公司提供;儿茶素标准品(CAF、EGC、DL-C、EC、EGCG、GCG 和ECG):由日本三井农林株式会社提供;甲醇(色谱纯),冰醋酸(分析纯),甲酰胺(分析纯),重蒸水。
HP-20,SP70大孔吸附树脂(日本三菱化学公司);DM-130,DM-131大孔吸附树脂(山东鲁抗医药股份有限公司);HPD-722大孔吸附树脂(沧州保恩化工有限公司);HZ011大孔吸附树脂(上海华震科技有限公司);Seplite Lx-60和Seplite LSA-7大孔吸附树脂(西安蓝晓科技特种树脂厂);ADS-17大孔吸附树脂(天津南开合成科技有限公司)。
1.2 试验仪器与设备
高效液相色谱仪(Waters),分析天平(METTLER TOLEDO),旋转蒸发仪(上海申生科技有限公司),真空干燥箱(上海市实验仪器总厂)。
1.3 树脂预处理
大孔吸附树脂用体积分数95%乙醇浸泡溶胀12 h,然后装于玻璃层析柱中,用95%的乙醇淋洗,待流出液1 mL用5 mL纯水稀释不浑浊时改用重蒸水淋洗,洗至无明显乙醇气味,低温干燥至恒重后备用。
1.4 分析方法
儿茶素含量测定采用HPLC法。色谱柱:Shimpack,ODS C185 μm,4.6 ~150 mm,波长:278 nm,流动相A:水,B:V(甲酰胺)∶V(甲醇)∶V(冰醋酸)=40∶2∶1.5,流速:1.1 mL/min,进样量:10 μL。

HPLC梯度条件
1.5 试验方法
1.5.1 以EGC/EGCG比值为指标进行树脂的筛选
准确称取经60℃干燥至恒重的不同型号树脂5.0 g置250 mL锥形瓶中,加入100 mL质量浓度为30 g/L的茶多酚水溶液,室温振荡平衡4 h,测定平衡浓度;将吸附平衡后的树脂抽滤,重蒸水淋洗树脂直至抽滤液为无色,然后将树脂转移至250 mL锥形瓶中,加入体积分数85%乙醇水溶液100 mL,室温振荡平衡1 h,测定平衡浓度。
树脂吸附量/(mg·g-1)=溶液体积(mL)×[吸附前质量浓度(mg/mL)–吸附后质量浓度(mg/mL)]/树脂质量(g)
解吸率/%=洗脱液的平衡质量浓度(mg/mL)×洗液体积(mL)/[树脂质量(g)×吸附量(mg/g)]×100
1.5.2 茶多酚浓度对吸附率的影响
准确称取经60℃干燥至恒重的树脂5.0 g置250 mL锥形瓶中,各加入100 mL质量浓度分别为10、30、50、70和100 g/L的茶多酚水溶液,室温振荡平衡4 h,测定平衡浓度,考察茶多酚浓度对树脂吸附量和吸附率的影响。
1.5.3 等温吸附曲线
以质量浓度为30 g/L的茶多酚溶液为试验对象,考察其在室温下的静态吸附动力学过程,得到静态吸附曲线。
1.5.4 大孔树脂动态吸附穿透曲线
选用Φ50 mm×500 mm层析柱,柱体积为500 mL,将质量浓度为30 g/L的茶多酚溶液5 000 mL以1 500 mL/h的流速(3 BV)通过吸附柱,每500 mL(1 BV)收集一个点样,采用HPLC法检测EGC浓度,考察穿透曲线。
1.5.5 吸附树脂的动态酒精梯度脱附
将上述动态吸附后的树脂用重蒸水洗去水溶性杂质,至流出液澄清,然后用体积分数10%、30%、50%、70%和90%乙醇水溶液各1 000 mL脱附,分别收集不同体积分数的乙醇脱附液,采用旋转蒸发仪进行减压浓缩,60℃真空干燥,称重,采用HPLC法检测咖啡因及儿茶素含量。
2 结果与讨论
2.1 树脂的筛选结果
大孔吸附树脂主要是通过吸附剂与吸附物质分子间作用力而实现的物理吸附。由于不同树脂的极性、孔径和表面积等物理化学性质的不同,导致其对不同物质的选择性能不同。工业生产上要求吸附树脂不仅具有吸附容量大的特点,而且要求其解吸率高,可最大限度地提高目标产物的回收率。EGC属非酯型儿茶素,是低苦涩味儿茶素的主要成分,而EGCG属酯型儿茶素,为苦涩味儿茶素的主要成分,儿茶素组分中EGC/EGCG的比值越高,表示该树脂富集低苦涩味儿茶素能力越强。试验中按照1.5所述的方法,在相同实验条件下,测得9种不同树脂的静态吸附及脱附结果(见表1)。
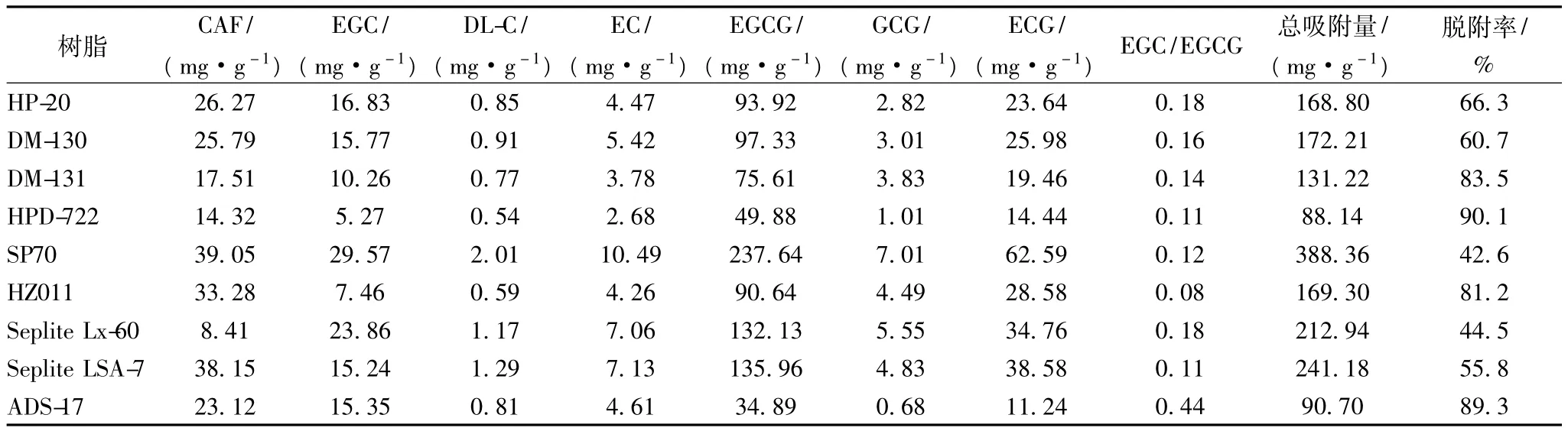
表1 9种树脂对不同儿茶素组分及咖啡因的吸附与脱附结果
结果表明,ADS-17树脂所吸附的儿茶素中EGC/EGCG比值为0.44,且脱附回收率达89.3%,是一种比较理想的目标树脂,其对咖啡因及儿茶素成分的饱和吸附量为90.7 mg/g。
2.2 茶多酚浓度对树脂吸附性能的影响
对筛选出的ADS-17树脂,考察其在不同茶多酚质量浓度下的吸附量与吸附率,数据见表2与图1。结果表明,随着茶多酚浓度的增加,树脂的吸附量基本保持不变,但吸附率却明显下降,茶多酚质量浓度为30 g/L时的吸附率较10 g/L的相应值下降了近50%。为此,要保证目标产物的有效回收,则进行吸附操作时其质量浓度不宜过高。
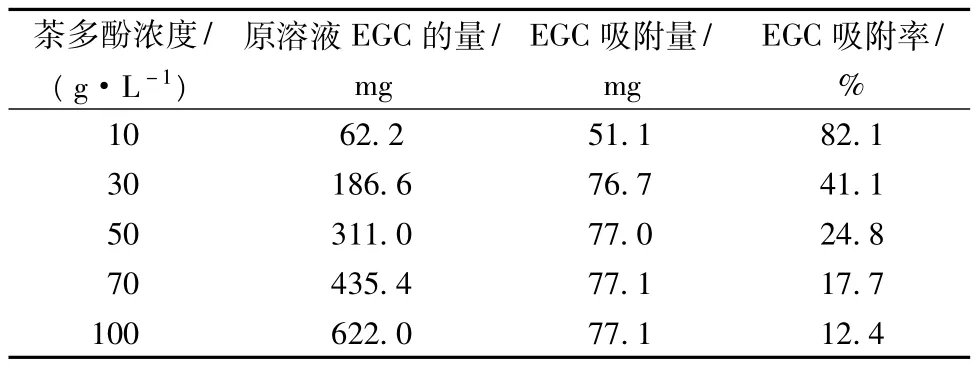
表2 茶多酚浓度对树脂吸附性能的影响

图1 茶多酚浓度对脂吸附性能的影响
2.3 吸附时间对吸附量的影响
ADS-17树脂在室温下的吸附量随时间的变化见表3,其动力学吸附过程曲线见图2。结果表明,ADS-17树脂的吸附量随时间的延长而增大,在前60 min的增加速度很快,在120 min时达到最大吸附量的94.5%,随后吸附量趋于稳定,较佳的吸附时间宜选120 min。
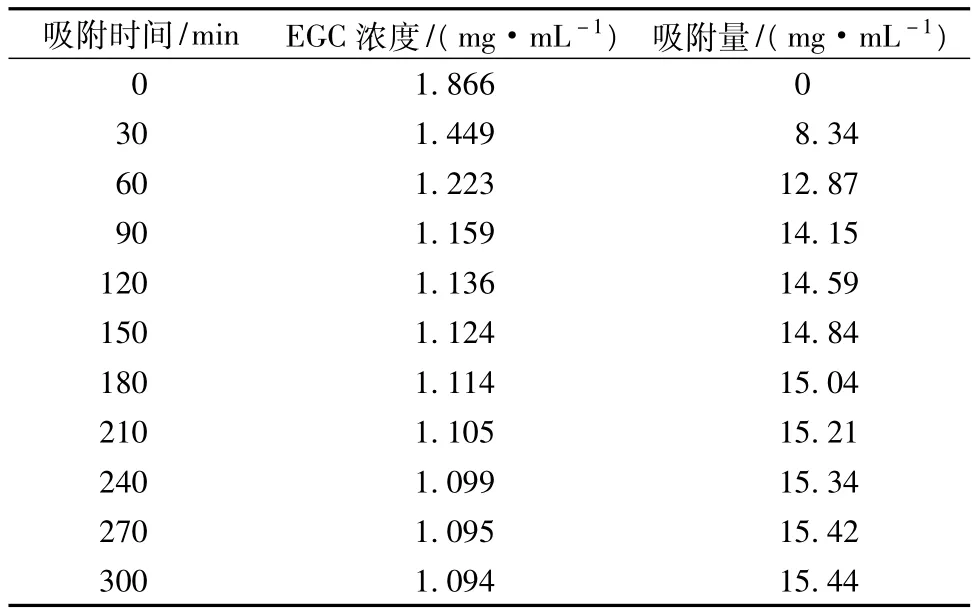
表3 吸附时间对吸附量的影响
2.4 树脂的动态吸附结果
考察ADS-17树脂的动态吸附能力,得到动态吸附曲线,确认穿透点。按1.5实验条件所得结果见表4及图3。穿透点的确认:当流出液中EGC浓度达到起始浓度的10%时即认为达到穿透点。为保证目标成分的回收率,到达该点时应当终止吸附。实验结果表明,在所述的实验条件下,当流出液体积达7 BV时,EGC的浓度显著增大,很快达到穿透点。因而,在实际操作中应注意控制吸附体积,以5~6 BV/批为宜。

图2 吸附时间对吸附量的影响

表4 动态吸附结果

图3 动态吸附曲线
2.5 动态脱附实验
对饱和吸附的ADS-17树脂用重蒸水洗去水溶性杂质,至流出液澄清后进行乙醇浓度梯度脱附,考察咖啡因及儿茶素组分在各个浓度梯度脱附液中的分布情况,结果见表5。实验表明,咖啡因基本分布在10%的乙醇脱附溶液中,30%乙醇能脱附EGC,乙醇浓度达50%以上才能对EGCG有效脱附,由此可推出吸附树脂吸附操作完成之后,先水洗去杂,然后以10%乙醇脱咖啡因,再以30%乙醇脱附EGC,可制得低咖啡因和低EGCG含量的低苦涩味儿茶素。

表5 乙醇溶液梯度洗脱结果 %
2.6 工艺验证
取质量浓度为30 g/L的茶多酚溶液2 500 mL上ADS-17大孔吸附树脂柱,依次用3 BV重蒸水洗,3 BV体积分数10%乙醇洗与3 BV体积分数30%乙醇洗,收集30%乙醇洗脱液,减压浓缩、真空干燥,所得儿茶素中咖啡因、EGC、EGCG及儿茶素的总量分别为1.08%、43.84%、10.39%和67.9%,其中EGC占儿茶素总量的64.57%,是主要的呈味物质,与儿茶素的天然组成相比,非酯型儿茶素比例大幅提高,苦涩味降低。
3 结论
利用ADS-17大孔吸附树脂实现富集以EGC为代表的低苦涩味儿茶素是完全可行的。本论文提出的新工艺仅采用水和食用乙醇作溶剂,可完全替代传统的三氯甲烷脱咖啡因、乙酸乙酯萃取儿茶素的工艺路线,所得产品中无有害溶剂残留,生产过程绿色、环保,且制备工艺简单,非常适宜于工业化推广。
[1] 肖文军,龚志华,黄建安,等.无苦味茶叶提取物加工技术研究[J].湖南农业大学学报:自然科学版,2007,33(2):208-212.
[2] Lu Min-jer,Chu Sheng-che,Yan Lipyng,et al.Effect of tannase treatment on protein-tannin aggregation and sensory attributes of green tea infusion[J].LWT-Food Science and Technology,2009(42):338-342.
[3] 熊何建,胡慰望,谢笔钧.茶多酚分离制备的新工艺[J].食品工业科技,1997(6):32-34.
[4] 胡秋辉,姜梅,朱建成.茶叶中咖啡因和茶多酚提取技术研究[J].天然产物研究与开发,1997,9(2):63-66.
[5] 寿根,李晨曦,宋正纪,等.树脂对茶多酚与咖啡因的吸附分离[J].离子交换与吸附,1998,14(1):73-77.
[6] 陈海霞,谢笔钧,胡慰望.茶多酚中脱咖啡因方法的研究[J].江苏食品与发酵,1999(3):13-14.
[7] 袁华,塞塑,曹海田,等.低咖啡因茶多酚提取新工艺研究[J].湖北化工,2000(3):12-13.
[8] 龚雨顺,刘仲华,黄建安,等.大孔吸附树脂分离茶儿茶素和咖啡因的研究[J].湖南农业大学学报:自然科学版,2005,31(1):50-52.
[9] 叶俭慧,梁月荣.大孔吸附树脂分离茶多酚的研究[J].茶叶,2006,32(3):128-132.
[10] 唐课文,周春山,钟世安,等.聚酰胺树脂对茶多酚和咖啡因吸附选择性研究[J].光谱学与光谱分析,2003,23(1):143-145.
[11] David Labb'e ,Tremblay Angelo,Laurent Bazinet.Effect of brewing temperature and duration on green tea catechin solubilization:Basis for production of EGC and EGCG-enriched fractions[J].Separation and Purification Technology,2006(49):1-9.
[12] Laurent Bazinet D L,Angelo Tremblay.Production of green tea EGC-and EGCG-enriched fractions by a twostep extraction procedure[J].Separation and purification Technology,2007(56):53-56.

