乌龙茶与普洱茶浸提液对胰α-淀粉酶的抑制作用
刘艳丰,黄惠华
(华南理工大学轻工与食品学院,广东 广州,510640)
茶叶中含有生物碱、茶多酚等生物活性成分,因而茶叶具有抗氧化、抗菌、减肥、降血脂、降血糖、防止动脉硬化和血栓形成等多种保健功能[1]。对各种疾病的具体影响机理尚不明确。淀粉在人体内的转化是食物消化的重要部分,淀粉酶抑制剂能有效抑制唾液和胰α-淀粉酶活性,阻碍食物中碳水化合物的分解和消化,减少葡萄糖产生和摄取,降低人体血糖水平,减少糖类向脂肪的转化,有效预防和改善糖尿病以及肥胖症等疾病[2]。茶多酚是茶中最重要的功能活性物质,20世纪90年代,日本学者在体外模拟淀粉消化试验基础上,通过动物试验发现儿茶素可以抑制大鼠体内α-淀粉酶和蔗糖酶的活性[3]。另外,张冬英等的研究也表明,普洱茶茶液中的没食子酸对α-淀粉酶有较强的抑制作用,且普洱茶对α-淀粉酶的抑制效果随着茶叶贮存年代与产地的不同而各异[4-5]。目前国内外对茶多酚在体外对α-淀粉酶作用机理研究以及发酵程度不同的茶对淀粉酶的抑制作用研究比较缺乏。
本实验以铁观音与黑茶六堡茶的茶提取液为α-淀粉酶抑制剂,以茶浸提液中的固形物含量为表征,通过非连续测定和Dixon作图分析,探求这2种发酵程度不同茶的茶液对胰α-淀粉酶的抑制动力学特征。
1 材料与方法
1.1 材料与仪器
铁观音,福建省安溪县丰发茶厂;六堡茶,广西苍梧六堡茶叶有限公司;茶多酚,购于福建市场;猪胰α-淀粉酶(porcine pancreas amylase,PPA),Sigma 公司;可溶性淀粉和麦芽糖等,均为分析纯。DNS(3,5-二硝基水杨酸)显色剂溶液。
pHS22C型pH计,上海雷磁仪器厂;棱光752N型紫外可见分光光度计,上海精密科学仪器有限公司;电热恒温水浴锅,浙江临海市东方仪器厂。
1.2 实验方法
1.2.1 茶溶液的制备
称取磨碎的2种茶的茶样各10 g,80 mL水,80℃水浴提取25 min,重复3次,然后4 000 r/min离心20 min,取上清液过滤后加水定容至250 mL。
1.2.2 茶浸提液中固形物与茶多酚含量测定
固形物含量测定:准确量取按1.2.1方法获得的茶液50 mL到已知重量的烧杯中,经真空冷冻干燥后称重,经计算,得出茶浸提液中的可溶性固形物总含量。
茶多酚含量测定:福林法[6]。以茶多酚含量表征茶液中的抑制剂含量。
1.2.3 酶活性的测定
采用Bernfeld法测定[7]。酶活性定义:在pH值为7,37℃的条件下,1 min内生成1 μmoL还原糖所需的酶量定义为1个酶活力单位(U)。测定酶的活性时,移取0.5 mL胰α-淀粉酶溶液到15 mL试管,37℃恒温,然后加入37℃预热的0.5 mL浓度为1%淀粉溶液作为反应底物,37℃反应3 min,加入l mL DNS显色溶液,混合,沸水浴8 min,放置20 min使其冷却至室温,加蒸馏水10 mL稀释,于540 nm处测定吸光值。以0.5 mL磷酸盐缓冲溶液作为空白对照。
1.2.4 两种茶浸提液对胰α-淀粉酶半抑制浓度的确定
取0.25 mL浓度为0.08 mg/mL的酶液于试管,分别加入0.25 mL稀释不同倍数后的茶浸提液,混合均匀并置于37℃水浴中预热。10 min后加入0.5 mL

式中,T1和T2分别代表无抑制剂和有抑制剂时的酶活力。
1.2.5 两种茶浸提液对胰α-淀粉酶的抑制类型
1.2.5.1 抑制类型(可逆或不可逆)的研究
固定2种茶浸提液的稀释倍数均为6倍,分别在酶浓度为 0.04 mg/mL、0.06 mg/mL、0.08 mg/mL、0.1 mg/mL的条件下,按照1.2.3所示方法测定吸光值,作为加抑制剂的反应组。再以蒸馏水代替2种茶液,作为不添加抑制剂的反应组,以上述各酶浓度进行反应,同样按1.2.3所示方法测定吸光值,作为未加入抑制剂的反应组,2组都以缓冲液代替酶液,蒸馏水代替茶液在同样的条件下反应作为空白对照。根据酶活性的变化与浸提液浓度之间的关系判断抑制类型。
1.2.5.2 可逆性抑制类型的研究
固定酶浓度为0.06 mg/mL,底物淀粉溶液的浓度在0.5%和1%之间变化,加入稀释倍数分别为4倍,6倍,8倍、10倍的2种茶浸提液,按照1.2.3所示方法测定反应吸光度值,然后通过dixon作图,得到2条直线,根据获得的dixon图判断2种茶浸提液对胰α-淀粉酶的抑制类型并计算其抑制常数Ki。
1.2.6 两种茶液对胰α-淀粉酶的光谱性质影响
移取3 mL浓度为0.06 mg/mL的胰α-淀粉酶溶液于石英比色池中,扫描200~300 nm的吸收光谱后,用微量进样器加入不同体积的同样稀释10倍的2种茶提液到含有酶液的比色池中,混匀,放置3~5 min后再次扫描200~300 nm的吸收光谱。移取2 mL浓度分别从0.5 mg/mL至1 mg/mL茶多酚溶液于石英比色池中,扫描200~300 nm的吸收光谱,获得2种茶液各自在不同浓度下作用于胰α-淀粉酶溶液的紫外吸收差谱。预热到37℃的1%淀粉溶液。反应3 min立即加1.0 mL DNS显色剂,混合,沸水浴8 min,冷却后用10 mL蒸馏水稀释,540 nm处测定吸光值。另取0.25 mL缓冲溶液替代酶溶液作空白对照,以0.25 mL蒸馏水代替茶提液作无抑制剂的酶活测定,求出抑制效率,进行多元非线性拟合,得回归方程,求出半抑制浓度。抑制活性计算公式为[8]:
2 结果与讨论
2.1 两种茶浸提液中的固形物与茶多酚含量及对胰α-淀粉酶半抑制浓度
250 mL的铁观音与六堡茶茶浸提液中的可溶性固形物含量分别为3.25 g与2.56 g,总茶多酚含量分别为1.17 g与0.74 g,铁观音与六堡茶茶液中茶多酚浓度分别为4.69 mg/mL与2.95 mg/mL,即铁观音中的茶多酚含量明显高于六堡茶,这可能与六堡茶的发酵程度比铁观音的发酵程度高有关,因为茶多酚在茶的发酵过程中会不断转化成茶黄素、茶红素等物质,且发酵程度越高,茶多酚减少量越大[9]。

图1 铁观音茶浸提液对胰α-淀粉酶的抑制曲线
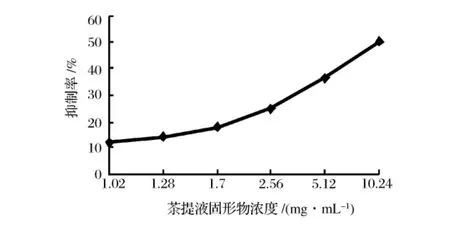
图2 六堡茶茶浸提液对胰α-淀粉酶的抑制曲线
图1 与图2所示分别为2种茶浸提液对胰α-淀粉酶的抑制效果曲线。在EXCLE中进行多元非线性拟合,得铁观音茶茶浸提液抑制曲线回归方程为:y=-0.007 1x4+0.100 4 x3-0.461 1 x2+0.883 8 x-0.228 7,R2=0.999 7,六堡茶茶浸提液抑制曲线回归方程为:y=0.000 8x3+0.007 5x2-0.010 6x+0.123 6,R2=0.998 9,2 种茶对胰 α-淀粉酶的半抑制浓度分别为茶浸提液中的固形物浓度为2.88 mg/mL和10.48 mg/mL。
2.2 两种茶浸提液对胰α-淀粉酶的抑制类型
铁观音与六堡茶茶液对胰α-淀粉酶的抑制动力学曲线如图3、图4所示。根据抑制剂与酶的作用方式与特点,抑制作用分为可逆抑制与不可逆抑制作用两种。不可逆抑制作用是通过抑制剂与酶的作用,通过价键结合的方式引起酶的失活,又被称为酶的修饰抑制,可逆抑制作用的抑制剂与酶通过非共价键结合,去除抑制剂后酶的活性可以恢回复。当反应体系中有可逆性抑制剂存在时,得到的直线为通过原点,但斜率小于不加入抑制剂组的直线斜率,当体系中存在不可逆抑制剂时,得到的直线不通过原点[10]。因此,由图3、图4可推断铁观音与六堡茶茶液对猪胰α-淀粉酶的抑制类型都为可逆抑制作用。
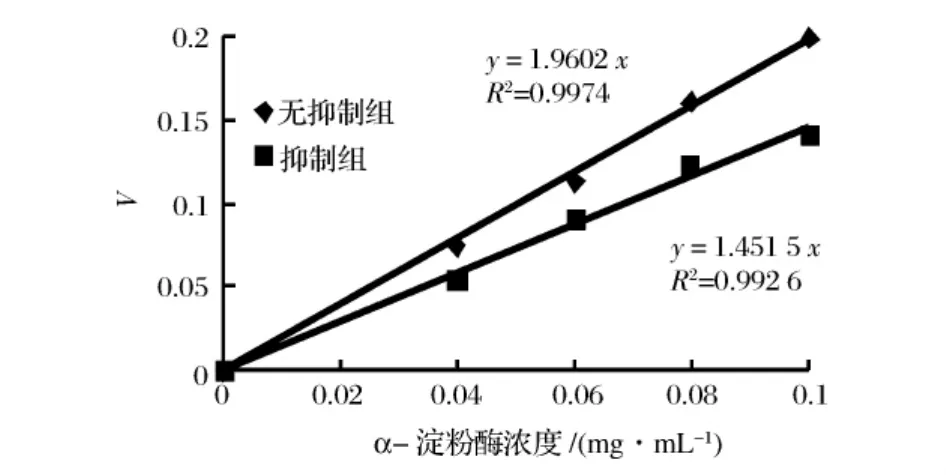
图3 铁观音茶浸提液对胰α-淀粉酶的抑制动力学曲线
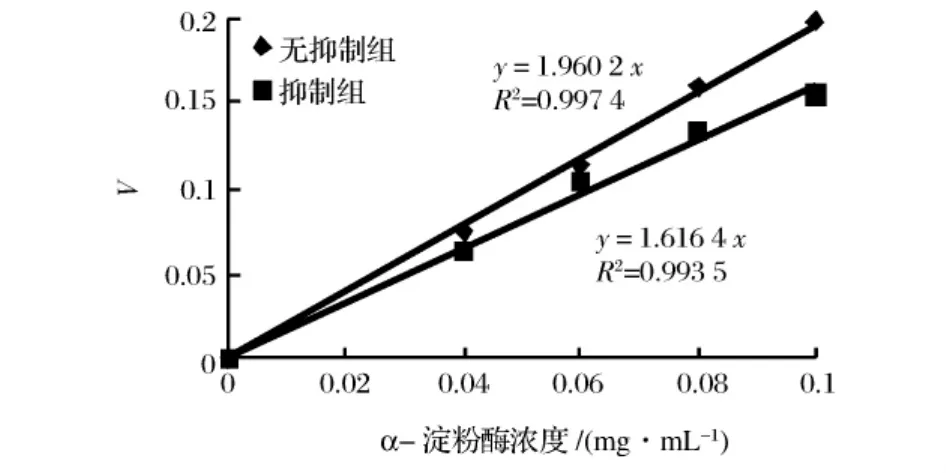
图4 六堡茶茶浸提液对胰α-淀粉酶的抑制动力学曲线
2.3 两种茶浸提液对胰α-淀粉酶的可逆抑制类型
可逆抑制作用根据可逆抑制剂与底物的关系分为竞争性、非竞争性、反竞争性抑制3种类型。当dixon图中的直线交点位于横坐标轴上时,非竞争性可逆抑制,若直线都与横坐标轴相交但交点不在横坐标轴上时,为竞争性可逆抑制,若有直线与横坐标轴平行,且交点不在横坐标轴上时为竞争性可逆抑制。
因此,由图5、图6可推断出铁观音与六堡茶茶液对猪胰α-淀粉酶的可逆性抑制类型都为非竞争性抑制。另由于dixon图中各直线交点的横坐标即为抑制剂常数,故计算得知铁观音与六堡茶茶液对胰α-淀粉酶的抑制常数分别为茶浸提液中固形物浓度为3.96 mg/mL与13.30 mg/mL。
2.4 两种茶液与胰α-淀粉酶溶液作用的紫外光谱
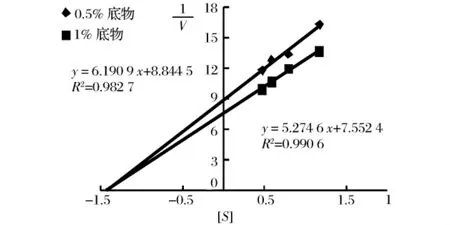
图5 铁观音茶浸提液对胰α-淀粉酶的可逆性抑制dixon图
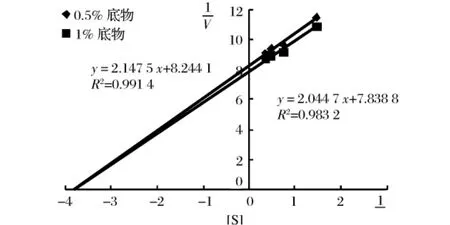
图6 六堡茶茶浸提液对胰α-淀粉酶的可逆性抑制dixon图
胰α-淀粉酶溶液在200~300 nm范围内具有212 nm处与259 nm处2个较大的吸收峰,由于212 nm处的波谱产生跳跃,影响比较结果,故选定245~275 nm作为考察范围,研究加入不同固形物总量的两种茶浸提液与胰α-淀粉酶溶液作用后的紫外吸收差谱,如图7所示,图中的曲线1为50 μL稀释10倍的铁观音茶液(固形物总量为65 μg)与3 mL胰α-淀粉酶溶液的紫外光谱图,曲线2为100 μL稀释10倍的铁观音茶液(固形物总量为130 μg)与3 mL胰α-淀粉酶溶液的紫外光谱图,曲线3为60 μL稀释10倍后的六堡茶茶液(固形物总量为19.2 μg)与3 mL胰α-淀粉酶溶液作用的紫外吸收光谱图,曲线4为80μL稀释10倍后的六堡茶茶液(固形物总量为25.6 μg)与3 mL胰α-淀粉酶溶液作用的紫外吸收光谱图。酶在近紫外光区域之的光吸收能力是由分子中的 Trp,Tyr,Phe 等残基引起[11],这些基团的微环境改变引起基团的结构变化,进一步影响吸光性质,如环境中剂型的改变会引起吸收峰的蓝移或红移。因此,从图7可知,在259 nm处,铁观音与六堡茶茶浸提液与胰α-淀粉酶溶液作用后的紫外吸收强度随着各自加入茶液的固形物含量增多而增强,即胰α-淀粉酶的结构变化越大。
3 结论
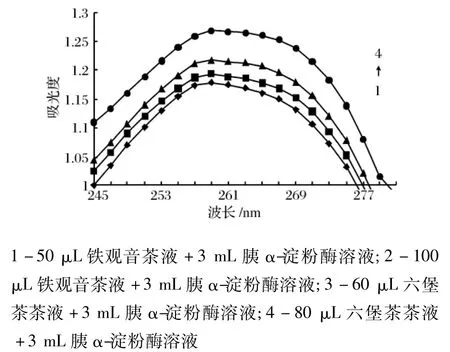
图7 两种茶浸提液与胰α-淀粉酶溶液作用的紫外吸收差示光谱
铁观音与六堡茶的茶液对猪胰α-淀粉酶都存在抑制作用,且抑制类型都为非竞争型可逆抑制 ,得铁观音茶浸提液对胰α-淀粉酶的半抑制浓度(IC50)为固形物浓度2.88 mg/mL,六堡茶茶浸提液对胰α-淀粉酶的半抑制浓度(IC50)为固形物浓度10.48 mg/mL,即铁观音对猪胰α-淀粉酶抑制作用明显强于六堡茶,得铁观音茶浸提液的Ki值为固形物含量3.96 mg/mL,六堡茶茶浸提液的Ki值为固形物含量13.30 mg/mL。紫外吸收差谱结果表明,一定范围内,2种茶液浓度的增加,使经茶液处理的α-淀粉酶溶液在259 nm处吸收峰增强,但不发生明显红移。可作为不同品种的茶对胰α-淀粉酶的机理分析和应用评价。
[1] 陈宗懋.茶叶内含成分及其保健功效[J].中国茶业,2009(5):4-5.
[2] 陈睿,曾阳,黄元,等.灰栒子提取物对α-淀粉酶抑制作用的初步研究[J].食品科技,2009,34(11):243-245.
[3] Matsumoto Natsuki,Ishigaki Fumiko,Ishigaki Akiyo,et al.Reduction of blood glucose level by tea catechin[J].Bioscience,Biotechnology and Biochemistry,1993,57(4):525-527.
[4] 张冬英,邵宛芳,刘仲华,等.普洱茶化学成分及对α-淀粉酶抑制作用的研究[J].西南农业学报,2009,22(1):52-53.
[5] 张冬英,余霜,黄业伟,等.普洱茶对α-淀粉酶抑制作用的影响研究[J].食品工业科技,2009,30(2):77-79.
[6] 周卫龙,许凌,徐建峰,等.GB/T8313-2008第二法茶叶中茶多酚测定的研究比较[J].中国茶叶加工,2009(1):40-41.
[7] B.施特尔巴赫著,钱喜渊译.酶的测定方法[M].北京:中国轻工业出版社,1992:37-41.
[8] 雷芳.茶碱、咖啡因、可可碱对胰a-淀粉酶部分理化性质的影响[D].成都:四川大学,2006.
[9] 王霞赖,穗生.几种茶叶中茶多酚含量的比较[J].科技资讯,2009,24:212.
[10] 王镜岩,朱圣庚,徐长法,等.生物化学[M].北京:高等教育出版社,2002:170-173.
[11] 刘雯,裘晓丹,雷芳,等.茶碱对胰α-淀粉酶的抑制类型及光谱性质[J].天然产物研究与开发,2008,20:298-300.

