Eremomycin的发酵条件优化及发酵产物的分离纯化
尹明明,陈代杰,张怡轩*,阮林高*
(1.沈阳药科大学生命科学与生物制药学院,辽宁沈阳 100016;2.上海来益生物药物研发中心,上海 200240)
大多数手性药物的分析是通过高效液相色谱来完成的,因此手性固定相的选择至关重要。自从1994年Ar mstrong等[1]首次将糖肽类抗生素作为手性选择剂应用于高效液相色谱手性固定相并获得成功以来,万古霉素(vancomycin)[2]、替考拉宁(teicoplain)[3]、瑞斯托菌素A(ristocetin A)[4]、去甲万古霉素(norvancomycin)[5]等大环糖肽类抗生素相继被作为液相色谱的手性固定相。2006年,Staroverov教授[6]利用糖肽类抗生素eremomycin合成了一种新的手性固定相,并在高效液相色谱中用来分离19种手性药物,其中12种获得分离。之后的研究证明,eremomycin作为手性固定相能很好地分离天然氨基酸尤其是芳香类氨基酸[7-8]。东方诺卡菌(Nocardia orientalis)NRRL 18098产生3种结构相似的糖肽类抗生素,分别为A82846A、A82846B和A82846C,其中A82846A又称作eremomycin,其化学结构在上世纪80年代得到确证[9-10],化学结构式如图1所示。由于东方诺卡菌NRRL 18098发酵生产A82846抗生素的发酵产量均较低,因此选择合适发酵条件,提高eremomycin的发酵单位是大量制备并降低其成本的关键。本实验考察了培养基组成和发酵条件对eremomycin发酵的影响,以期得到发酵eremomycin的最佳工艺条件,并利用树脂吸附、中压液相色谱技术相结合的方法分离得到高纯度的eremomycin。

图1 Eremomycin的化学结构Fig.1 Chemicial structure of eremomycin
1 材料与方法
1.1 材料
1.1.1 菌种 东方诺卡菌(Nocardia orientalis)NRRL 18098,上海来益生物药物研发中心保藏。
1.1.2 仪器 高效液相色谱仪:Agilent1100-DAD(安捷伦科技有限公司);色谱柱:Agilent Zorbax-SB-C18(4.6 mm×150 mm,5μm)(安捷伦科技有限公司);中压层析色谱柱:Unips 25-300(苏州纳微生物科技有限公司);大孔离子交换树脂001×4(上海华震科技有限公司);大孔吸附树脂1600(美国罗门哈斯公司);254 nm紫外吸收检测仪(上海金达生化仪器有限公司)。Agilent液质联用色谱仪:含6110型单四极杆质谱仪,配有大气压电离-电喷雾电离源(API-ES)和大气压化学电离源(APCI),含Agilent-1100系列四元泵、VWD检测器、Agilent Chemstation色谱工作站,(美国Agilent公司)。
1.1.3 试剂 本实验所用试剂纯度均为分析纯,购于国药集团化学试剂有限公司。
1.2 方法
1.2.1 发酵及发酵液预处理 ①斜面培养基(g/L):葡萄糖10,可溶性淀粉20,酵母浸出粉5,酪蛋白水解物5,碳酸钙1,琼脂粉25。消前pH 7.5。培养条件:30℃恒温培养培养120 h;②种子培养基(g/L):可溶性淀粉1,酵母浸出粉5,酪蛋白水解物5,碳酸钙1。消前pH 7.5。培养条件:30℃,摇床转速250 r/min、培养72 h;③发酵基础培养基(g/L):葡萄糖25,糊精30,蔗糖2,玉米浆粉1,黄豆饼粉15,酪蛋白水解物5,碳酸钙2.5。消前pH 7.5。培养条件:30℃,摇床转速250 r/min、培养120 h。本试验采用500 mL的摇瓶以15%(体积比)装量发酵,发酵结束用4 mol/L盐酸酸化发酵液,调pH至4.5离心收集上清,供HPLC分析及后续分离纯化用。
1.2.2 Eremomycin含量检测 用HPLC法检测eremomycin含量。流动相:A=0.1%三氟乙酸水溶液(体积比),B=乙腈。梯度洗脱程序:0~20 min,A∶B(95∶5)(体积比)~A∶B(85∶15)(体积比);20~30 min,A∶B(85∶15)(体积比)~A∶B(40∶60)(体积比)。流速:1.0 mL/min。紫外检测:240 nm。柱温:30℃。
1.2.3 Eremomycin的分离纯化方法 大孔吸附树脂001×4预处理后,每1 g树脂中加入20 mL发酵液置于磁力搅拌器上搅拌2 h除色素,然后以流速1.5 mL/min流入填好的经过预处理的大孔吸附树脂1600玻璃层析柱中,用乙醇∶0.05%(质量分数)盐酸水溶液(体积比0∶100)~乙醇∶0.05%(质量分数)盐酸水溶液(体积比15∶85)梯度洗脱。HPLC法检测流分的组成及目标产物浓度,合并、纳滤膜过滤去除小分子、浓缩含有目标组分的溶液。取经树脂分离后浓缩样品80~100 mg,溶于10 mL无水甲醇中。过Unips 25-300中压柱,用甲醇∶0.005%(质量分数)盐酸水溶液(体积比1∶99)~甲醇∶0.005%(质量分数)盐酸水溶液(体积比20∶80)梯度洗脱,254 nm检测,分步收集有紫外吸收部分洗脱液(10 mL/瓶),HPLC测定洗脱液中各组分的组成及浓度,合并含有目的组分的溶液,减压浓缩。
1.2.4 Eremomycin质谱分析 质谱条件:离子源为大气压电离源(APCI)的,雾化气压力为0.41 MPa,干燥气温度为350℃,干燥气流速6 L/min,蒸发室气化温度350℃,毛细管电压2 000 V,电流4μA,正离子方式检测。
2 结 果
2.1 自然分离
以东方诺卡菌NRRL 18098为出发菌种,经自然分离纯化处理后,再经摇瓶初筛、复筛获得较高效价菌株Y311,其发酵单位为70.3 mg/L,确定为本实验发酵用出发菌株。
2.2 种龄
取100μL菌株Y311孢子液(>108个/mL)接种至种子培养基中,30℃振荡(250 r/min)培养2~7 d,观察菌丝体的生长情况。将种龄分别为2、3、4、5、6 d的种子液按照1%(体积比)接种至摇瓶发酵培养基中,继续培养4 d。以4 d种龄所得效价为对照,发酵结果见图2。由图2可知,种龄为3 d和4 d时,eremomycin发酵产量迅速提高,但当种龄延长到5 d或者更长时间,均不利于eremomycin的生物合成。综合考虑菌丝量,确定种龄为4 d比较适宜。
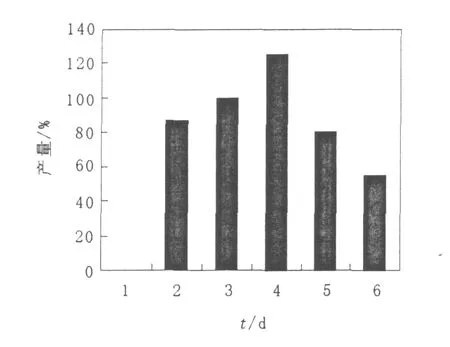
图2 种龄对eremomyc in产量的影响Fig.2 Effect of seeds ages on the production of eremomycin
2.3 复合碳源对eremomycin发酵的影响
将4 d种子液按照1%的接种量接种至含不同的复合碳源组成的发酵培养基中,于30℃、250 r/min振荡培养4 d。以第1组为对照,发酵结果见表1。实验结果表明,4号实验组(复合碳源为葡萄糖2.5%、糊精3.0%、蔗糖0.3%)的eremomycin发酵效价最高,比较各组碳源组成,葡萄糖和蔗糖可能有利于效价的提高。
2.4 复合氮源对eremomycin发酵的影响
将4 d的种子培养液按照1%的接种量接种至含不同复合氮源的发酵培养基中,于30℃振荡、250 r/min培养4 d。以第8组为对照,试验结果见表2。

表1 不同碳源对eremomycin产量的影响Table 1 Effect of different carbon sources on the production of eremomycin

表2 不同氮源对eremomycin产量的影响Table 2 Effect of different nitrogen sources on the production of eremomycin
实验结果表明,11号实验组(复合氮源为黄豆饼粉1.5%、蛋白胨0.5%)的eremomycin发酵效价最高,比较各组氮源组成,黄豆饼粉和蛋白胨可能有利于效价的提高。
2.5 培养基优化
考虑到发酵成本以及产物分离提取的便利,利用L9(34)正交表设计试验,其他成分不变,考察蛋白胨、葡萄糖、糊精和蔗糖对eremomycin产量的影响,实验结果及极差分析见表3。

表3 正交实验的结果Table 3 The result of orthogonal experiment
试验结果表明,蛋白胨的极差最大,其次是葡萄糖和糊精,蔗糖极差最小,因此各因素对产量影响的顺序为:A>B>D>C。4种因素最佳组合(质量分数,%)为蛋白胨1.5、葡萄糖2.5、糊精3.0、蔗糖0.2。该组合不在正交实验表中,所以按照培养基组成(质量分数,%)为葡萄糖2.5、糊精3.0、蔗糖0.2、黄豆饼粉1.5、蛋白胨1.5、碳酸钙0.25验证试验,发酵效价为115 mg/L,高于107 mg/L,说明正交实验取得成功,比优化前发酵效价提高了63.5%。
2.6 Eremomycin的分离纯化与鉴定
实验证明,在大孔吸附树脂1600柱层析过程中,用0.05%(质量分数,%)盐酸水溶液(体积比)~乙醇∶0.05%(质量分数,%)盐酸水溶液(体积比15∶85)梯度洗脱,目标组分eremomycin集中于乙醇∶0.05%(质量分数,%)盐酸水溶液(体积比5∶95)的洗脱流分中。在Unips25-300中压柱层析过程中,当梯度洗脱液浓度为甲醇∶0.005%(质量分数,%)盐酸水溶液(4∶96,体积比)时,eremomycin流出,其纯度经HPLC法检测达到93%(图3)。
收集此梯度下洗脱液,调至中性,再经过脱盐、减压浓缩即能得到精制品,其纯度经HPLC法检测达到97%(图4)。
取自制精制品进行检测其质谱(图5),主要峰值与文献[10]中的鉴别峰数据均一致(表4),说明获得的纯品确实为eremomycin。

图3 Un ips25-300中压树脂洗脱后的含eremomyc in的流份HPLC图谱Fig.3 HPLC analysis of eremomycin afterUnips25-300 medium pressure liquid chromatography

图4 纯化后的eremomycin的HPLC图谱Fig.4 HPLC analysis of purified eremomycin

图5 Eremomycin的质谱Fig.5 The mass spectrum of eremomycin

表4 对eremomycin的质谱和文献报道解析的对比Table 4 Mass spectrum comparision of reference eremomycin and purified eremomycin
3 讨 论
正交实验法是利用排列整齐的正交表来对试验进行整体设计、综合比较、统计分析,实现通过少数的实验次数找到较好的生产条件,以获得最佳生产工艺。本实验通过正交设计确定了对eremomycin发酵水平贡献度大的各种碳、氮源种类和最佳浓度,获得的最佳培养基配方使eremomycind的发酵水平显著提高了63.5%,说明发酵配方的优化对提高抗生素产量至关重要,而且正交设计法是一种快速、效果显著的优化培养基的方法。
东方诺卡菌(Nocardiaorientalis)NRRL 18098产生3种结构相似的糖肽类抗生素,分别为A82846A(eremomycin)、A82846B和A82846C。由于它们结构的相似性,导致这3种组分很难分离。本实验在树脂吸附洗脱的基础上,首次将中压液相层析技术引入eremomycin的分离过程中,获得了纯品,方法简便、快速,为今后更好地分离A82846抗生素的3种组分进行了有益的探索。
[1] Ar mstrong D W,Tang Yu-bing,Chen Shu-shi,et al.Macrocyclic antibiotics as a new class of chiral selectors for liquid chromatography[J].Anal Chem,1994,66(9):1473-1484.
[2] Mostafag A E,Hefnawy M M,El-majedA.Separation and determination of clenbuterol by HPLC using a vancomycin chiral stationary phase[J].J AOAC Int,2009,92(3):824-829.
[3] Armsrong DW,Liu You-bang,Ekborgott KH.A covalently bonded teicoplanin chiral stationary phase for HPLC enantioseparations[J].Chirality,1995,7(6):474-497.
[4] PiccininiA M,Schmid M G,Pajpanova T,et al.Chiral separation of natural and unnatural amino acid derivatives bymicro-HPLC on a Ristocetin a stationary phase[J].J Biochem Bioph Methods,2004,61(1):11-21.
[5] Ding Guo-sheng,Liu Ying,Cong Ruan-zi,et al.Chiral separation of enantiomers of amino acid derivatives by high-performance liquid chromatography on a norvancomycin-bonded chiral stationary phase[J].Talanta,2004,62(5):997-1003.
[6] Staroverov SM,KuznetsovM A,Nesterenko P N,et al.New chiral stationary phase with macrocyclic glycopeptide antibiotic eremomycin chemically bonded to silica[J].J Chroma A,2006,1108(2):263-267.
[7] Zhanga L,Gedicke K,KuznetsovM A,et al.Application of an eremomycin-chiral stationary phase for the separation ofDL-methionine using simulated moving bed technology[J].J ChromatogrA,2007,1162(1):90-96.
[8] Petrusevska K,KuznetsovM A,Gedicke K,et al.Chromatographic enantioseparation of amino acids using a new chiral stationary phase based on a macrocyclic glycopeptide antibiotic[J].J Sep Sci,2006,29(10):1447-1457.
[9] Gauze G F,Brazhnikova M G,LaǐkoA V,et al.Eremomycina new antibiotic from the cyclic glycopeptide group[J].AntibiotMed Biotekhnol,1987,32(8):571-576.
[10] Hamill R L,Mabe JM,MahoneyD F,et al.A82846 antibiotics:USA,5843437[P].1998-12-01.

