高赖氨酸蛋白基因在大肠埃希菌中的表达
李学琳,高学军,卢志勇,骆超超,刘晓飞,敖金霞
(东北农业大学乳品科学教育部重点实验室,黑龙江哈尔滨 150030)
L-赖氨酸是动物的“第一限制性必需氨基酸”[1],对调节体内代谢平衡,提高体内对谷类蛋白质的吸收,改善动物营养,促进生长发育均有重要作用[2]。由于大多数植物蛋白质中赖氨酸含量偏低,以致动物对蛋白质的利用率偏低,若在饲料中添加适量的赖氨酸,可提高蛋白质的利用率。赖氨酸作为重要的饲料添加剂,应用量很大。在玉米籽粒加工、配制混合饲料的过程中必须添加优质蛋白和赖氨酸等饲料添加剂才能满足畜禽生长发育的需要[3]。在四棱豆(Psophocarpus tetragonolobus)中发现的高赖氨酸蛋白基因,已成功地在多种转基因植物中表达并提高了赖氨酸含量[4-6],而高赖氨酸蛋白基因是否可以在微生物中表达,进而提高赖氨酸含量,尚未见报道。本实验前期工作发现益生菌可提高动物的生产性能,可能与其赖氨酸含量有关。本实验研究高赖氨酸蛋白基因在大肠埃希菌中的表达,为益生菌中表达该基因,进而提高饲料转化率提供研究基础。
1 材料与方法
1.1 材料
1.1.1 原料 四棱豆购于河南顺强农科院;E.coliRosetta由东北农业大学徐世文教授惠赠;质粒载体pGEX-4T-1由东北农业大学高继国教授惠赠。
1.1.2 仪器与设备 Trizol购自invitrogen公司;PrimeScript RT-PCR Kit、TaqDNA聚合酶、dNTP、限制性内切酶、T4 DNA连接酶、蛋白质Marker购自大连宝生物科技有限公司;氨苄青霉素、异丙基硫代-β-D-半乳糖苷(IPTG)购自上海生工生物工程公司;胶回收试剂盒、质粒提取试剂盒购自Axygen公司;引物由大连宝生物工程公司合成;其他试剂均为进口或国产分析纯。
1.2 方法
1.2.1 四棱豆总RNA的提取 采用Trizol法提取总RNA,cDNA的合成采用试剂盒方法(见宝生物PrimeScript RT-PCR Kit说明书)。
1.2.2 wblys的PCR扩增 根据文献[7]与Uninted States Patent(登录号:US 6,184,437 B1)报道的相关序列设计引物。5′端分别引入B amH I酶切位点和SalI酶切位点(下划线表示),用于wblys基因PCR扩增的引物:上游:5′-CG GGATCC CATTATGGGTGTTTTCACATATGAG-3′;下游:5′-GC GTCGACATTGTATTCAGGATGGGCCAAAAGG-3′。以四棱豆的cDNA为模板,进行PCR扩增,条件如下:94℃预变性5 min;94℃变性50 s,56℃退火60 s,72℃延伸80 s,36个循环;4℃保温。取5μL PCR产物用于1%的琼脂糖凝胶电泳。按Axygen凝胶回收试剂盒说明,对PCR产物进行回收纯化。
1.2.3 表达载体的构建和目的基因测序 分别用BamHⅠ和SalⅠ双酶切PCR扩增的高赖氨酸蛋白基因片段和质粒pGEX-4T-1,利用T4 DNA连接酶与高赖氨酸蛋白基因片段连接,构建重组质粒pGEX-4T-1/wblys,将pGEX-4T-1/wblys转化到E.coliRosetta,涂布于含有Ampicillin 100μg/mL的LB固体培养基,采用菌落PCR鉴定出阳性转化子,送大连宝生物工程公司进行目的基因测序。
1.2.4 wblys的诱导和表达 将阳性转化子从固体培养基接入含Ampicillin 100μg/mL的20 mL LB液体培养基中,于37℃、200 r/min振荡培养过夜,以1%的接种量转接至5 mL新鲜液体LB培养基,继续于37℃、200 r/min培养至OD600=0.6左右,在37℃下采用1 mmol/L的IPTG诱导4 h。
1.2.5 SDS-PAGE分析 取诱导后的菌体培养液离心收集菌体,重悬于100μL 2×样品缓冲液中,100℃煮沸,进行SDS-PAGE分析,具体方法参照文献[8]。
1.2.6 高效液相色谱检测赖氨酸含量 测定菌株的总赖氨酸含量,取菌体沉淀和上清,按照GB/T 18246-2000[9]中酸水解法进行水解。水解后,定容至25 mL。吸取1 mL滤液,分别置于25 mL具塞离心管中,再分别吸取pH 9.0 Na2CO3-NaHCO3缓冲液2 mL,混匀后,加入CDNB溶液各1 mL,混匀,经0.22μm滤膜过滤后直接上样,体积10μL,测定其中赖氨酸含量。具体方法参照文献[9]。
2 结果与讨论
2.1 高赖氨酸蛋白基因(wblys)的扩增和测序
PCR扩增出约500 bp的DNA片段,与预期大小基本一致,见图1。测序结果表明,该片段全长495 bp,与US 6,184,437 B1报道序列的同源性达100%。

图1 四棱豆wblys基因PCR产物电泳图谱Fig.1 PCR products ofwblysgene of Psophocarpus tetragonolobus
2.2 表达载体pGEX-4T-1/wblys的构建
宿主的阳性转化子均扩增出一条约500 bp的条带,条带大小符合预测值,并对相应的阳性克隆子进行酶切验证和测序验证,结果均完全符合要求,见图2。

图2 重组质粒pGEX-4T-1/wblys酶切鉴定Fig.2 Identification of the recombinant plas mid pGEX-4T-1/wblys
2.3 表达载体pGEX-4T-1/wblys在宿主菌中的诱导表达
经过诱导的重组菌均有比较明显的重组蛋白表达带(图3),重组蛋白的分子质量约为44 ku,与预测的GST融合表达的44 ku的分子质量基本一致。

图3 大肠埃希菌蛋白表达产物的SDS-PAGE分析Fig.3 SDS-PAGE analysis ofE.coliprotein induced by IPTG
2.4 细菌发酵液及菌体中赖氨酸含量检测的结果
诱导前后发酵液中赖氨酸含量几乎没有变化,菌体赖氨酸含量检测的结果见表1。由表1可以看出,诱导后pGEX-4T-1/wblys/Rosetta的赖氨酸含量明显高于其他组,诱导后菌体总赖氨酸含量比正常菌体提高15.84 mg/g,诱导后pGEX-4T-1/Rosetta的赖氨酸含量显著低于其他组,可能是由于GST标签的存在降低了赖氨酸的量。
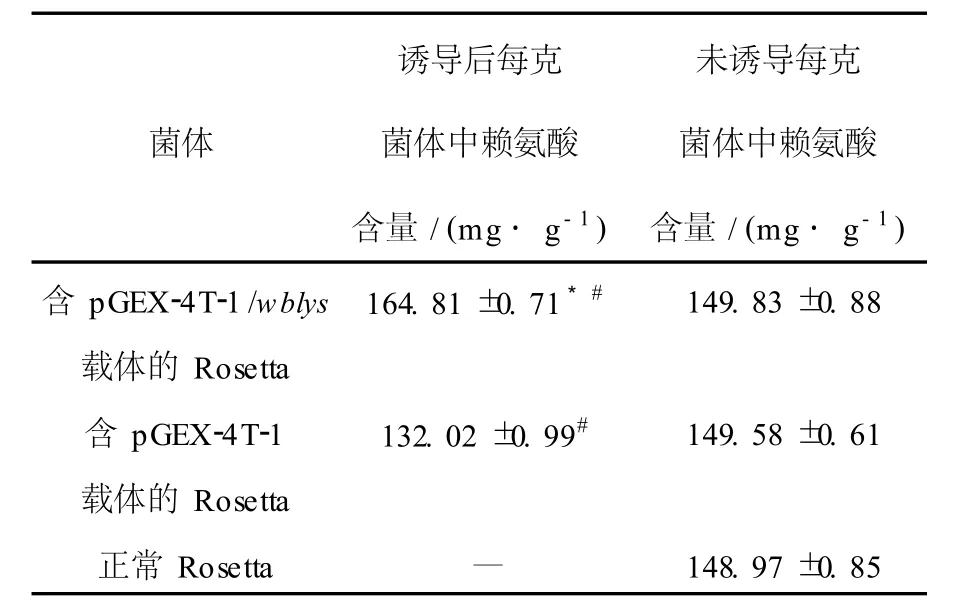
表1 3种菌体中赖氨酸含量Table 1 The lysine produced in the fermentation broths of 3 kinds of strains
3 结 论
本研究所用的富含高赖氨酸的cDNA为四棱豆(Psophocarpus tetragonolobus,又名翅豆,winged bean)富含高赖氨酸的编码蛋白cDNA,从cDNA推论的氨基酸序列可知该蛋白质的赖氨酸含量占10.8%,是这个蛋白质中最丰富的氨基酸[7]。本研究采用转基因的方法将其转入大肠埃希菌中,从而使大肠埃希菌中赖氨酸含量提高15.84 mg/g,也是第一次将高赖氨酸蛋白基因由植物转入微生物中。在本研究中使用的是pGEX-4T-1载体,是原核表达的高效载体,但由于该载体存在GST标签可能使诱导后pGEX-4T-1/Rosetta的赖氨酸含量下降,具体的原因需要进一步的研究,接下来的研究要实现更高效的表达,本研究成功的为今后开展该基因在益生菌中高效表达并应用于动物生产提供了重要工作基础。
[1] Stewart JN,Jane DB,Peter HB.The effect of controlled fer mentation on the fate of synthetic lysine in liquid diets forpigs[J].Animal Feed Science and Technology,2006,129(3-4):304-315.
[2] SzabóC,Jans man AJ,Babinszky L,et al.Effect of dietary protein source and lysine:DE ratio on growth performance,meat quality,and body composition of growing-finishing pigs[J].J Anim Sci,2001,79(11):2857-2865.
[3] 赵倩,于静娟,朱登云,等.番茄花粉特异表达的高赖氨酸蛋白基因(tsb)的克隆与特性分析[J].中国生物化学与分子生物学报,2004,20(2):275-279.
[4] 高越峰,荆玉祥,沈世华,等.高赖氨酸蛋白基因导入水稻及可育转基因植株的获得[J].植物学报,2001,43(5):506-511.
[5] 孟超敏,陈绪清,梁荣奇,等.高赖氨酸含量基因在转基因小麦的表达及其赖氨酸含量分析[J].科学通报,2004,49(17):1731-1736.
[6] 李兴涛,李霞,张金文,等.高赖氨酸蛋白基因在转基因生菜中的表达和遗传转化[J].应用与环境生物学报,2006,12(4):472-475.
[7] Sun SS M,Xiang LW,Jing XY,et al.Lysine rich protein from winged bean[P].US PatentApplication,1998,08/946,722.
[8] 萨姆布鲁克J,弗里奇EF,曼尼阿蒂斯T著.金冬雁,黎孟枫等译.分子克隆实验指南(第2版)[M].北京:科学出版社,1992:19222.
[9] 中华人民共和国国家标准饲料中氨基酸的测定[S].GB/T18246-2000:280-285.
[10] 黄建国,高学军,佟慧丽,等.HPLC测定饲料源小肽产品中赖氨酸含量[J].乳业科学与技术,2009,32(2):78-80.

