酿酒酵母W5及休哈塔假丝酵母20335原生质体制备条件的确定
张麓岩,张梦云,葛菁萍
(黑龙江大学生命科学学院微生物黑龙江省高校重点实验室,黑龙江哈尔滨 150080)
自1974年匈牙利学者Ferenczy报道了白地霉(Geotrichum candidum)营养缺陷型突变株的原生质体融合后[1],微生物原生质体融合技术迅速发展。融合的种属范围逐渐扩大,融合的亲缘关系由最初的种内株间融合,发展到种间、属间,甚至科间的远源融合,融合的技术也由最初的化学融合法扩展到电细胞融合法、电磁融合法、激光融合法等[2]。发展至今,原生质体融合技术已成为一种系统、成熟的微生物育种手段,在微生物工业育种中发挥着重要的作用。木质纤维素原料是地球上最丰富、最廉价的可再生资源,但目前大部分木质纤维素资源尚不能够被人类利用。随着石油等不可再生资源的日渐匮乏以及粮食危机的继续存在,如何以丰富的木质纤维素类资源为原料,代替粮食进行可再生清洁能源—生物乙醇的发酵成为当前研究的热点[3]。由于木糖是木质纤维素水解物中含量仅次于葡萄糖的一种单糖[4],因此如何有效地利用木糖,成为木质纤维素生物转化生产乙醇的关键环节之一。酿酒酵母(Saccharom yces cerevisiae)具有细胞大、细胞壁厚、乙醇耐受性好、耐高糖、耐抑制物、代谢副产物少且在发酵过程中不易污染杂菌等特点[5],成为生物乙醇发酵的首选微生物。但由于酿酒酵母本身缺少木糖代谢途径中的关键酶,从而不能利用木糖生产乙醇。休哈塔假丝酵母(Candida shehatae)具有木糖代谢流,能较好地利用木糖产生乙醇[6]。利用原生质体融合的方法,构建酿酒酵母与休哈塔假丝酵母融合株,避免了其他常规育种手段的冗繁环节,可在较短的时间内实现双亲株遗传物质较大程度上的重组,获得优良性状的融合子。本文旨在确定酿酒酵母W5、休哈塔假丝酵母20335原生质体制备的条件,为双亲株原生质体融合工作奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种 酿酒酵母W5,原养型,由本实验室保存;休哈塔假丝酵母20335,原养型,由本实验室保存。
1.1.2 培养基 ①YEPD液体培养基:酵母膏1%,蛋白胨2%,葡萄糖2%;②YEPDS液体培养基:在YEPD液体培养基中加入17%的蔗糖;③YEPD、YEPDS固体培养基均在对应液体培养基中添加2%的琼脂粉。以上培养基于108℃,灭菌20 min。
1.1.3 试剂 ①脱壁预处理剂:0.1 mol/L pH 5.8柠檬酸-磷酸盐缓冲液(CPB)中含0.2%β-巯基乙醇(体积比)及0.06 mol/L EDTA;②原生质体制备液:0.1 mol/L pH 5.8柠檬酸-磷酸盐缓冲液(CPB)中含0.8 mol/L山梨醇和0.01 mol/L EDTA;③2%蜗牛酶液:用0.1 mol/L pH 5.8柠檬酸-磷酸盐缓冲液配置,0.22μm细菌滤器过滤除菌;④高渗溶液:15%的蔗糖溶液。
1.2 方法
1.2.1 双亲株对数生长期的测定 取4℃保藏的双亲株斜面菌种,活化1~2代。挑取活化后的菌体,接种于100 mL/250 mL YEPD培养基中,30℃、140 r/min摇瓶培养14 h。吸取菌悬液,按5%接种量转接于100 mL/250 mL YEPD培养基中,30℃、140 r/min摇瓶培养。每隔1 h取菌液,于600 nm下测定其OD值,并绘制曲线。
1.2.2 双亲株原生质体制备及再生 菌体培养至对数生长期中期,4 500 r/min离心10 min收集菌体沉淀。无菌水洗涤菌体沉淀2次,并调整细胞数为108个/mL,吸取6 mL调整细胞数后的菌悬液,4 500 r/min离心10 min。向得到的菌体沉淀中加入3 mL脱壁预处理剂,30℃、100 r/min处理30 min,4 500 r/min离心收集菌体沉淀。用原生质体制备液洗涤菌体沉淀,并用4 mL制备液重悬菌体沉淀于50 mL三角瓶内。向三角瓶内加入预先用2 mL CPB溶解的0.12 g蜗牛酶,使得酶的终浓度为2%,30℃、100 r/min酶解处理30 min。吸取酶解处理后的菌液,分别用高渗溶液和无菌水进行梯度稀释,依次涂布YEPDS及YEPD平板,30℃培养36~48 h,计数再生菌落数(B)及裂解计数(C)。
以未经酶解的菌悬液作为对照组,无菌水梯度稀释后涂布YEPD平板,记录为总菌数(A)。根据A、B、C值计算原生质体的制备率及再生率。

式中:A—蜗牛酶处理前的活菌数(个/mL)
B—酶处理组高渗溶液稀释后再生菌落数(个/mL)
C—蜗牛酶处理后,经无菌水裂解处理,在YEPD平板上长出的菌落数(个/mL)
1.2.3 脱壁预处理时间对原生质体制备率的影响 将脱壁预处理时间调整为20、30和40 min,其他条件按照1.2.2的过程制备双亲株原生质体,研究不同预处理时间对双亲株原生质体制备率的影响。
1.2.4 酶解时间对原生质体制备率及再生率的影响 将1.2.2中的酶解时间调整为15、30、45、60和75 min,制备双亲株原生质体,计算原生质体的制备率及再生率,研究不同酶解时间对原生质体制备率及再生率的影响。
2 结果与分析
2.1 双亲株对数生长期的测定
由于菌体的生理状态不同,其细胞壁结构、代谢水平、菌体活力等均不相同。研究发现酵母菌对数生长期的细胞代谢活跃,生长率高,群体细胞的化学组成、形态及生理特征比较一致[7]。因此,酵母菌原生质体制备时一般取对数生长期的细胞。W5与20335在培养3 h后均进入对数生长期,W5培养3~7 h时生长较迅速,当培养至8小时后生长减慢,基本进入稳定期,选用培养4~5 h的菌体进行原生质体的制备;20335生长较W5缓慢,培养3~10 h为对数生长期,10 h后进入稳定期,选用培养6~7 h的菌体用于原生质体的制备,见图1。
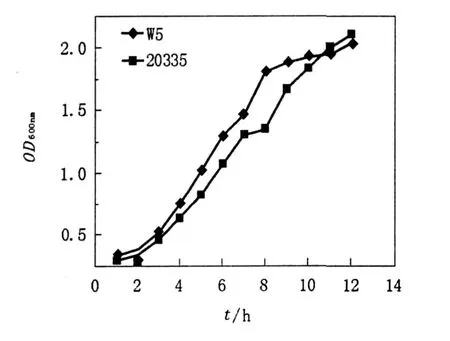
图1 双亲株生长曲线Fig.1 The growth curve of the two parent strains
2.2 脱壁预处理时间对原生质体制备率的影响
原生质体制备时,所使用的脱壁预处理剂中含有β-巯基乙醇及EDTA,前者可以使细胞壁中蛋白质分子内的二硫键被还原,从而切开分子链,使酶更容易渗入,发挥更好的酶解作用[8]。EDTA则是一种金属螯合剂,加入EDTA后,可以有效地去除反应体系中金属离子对酶的影响,从而提高酶的水解效率[9]。通过试验结果可以看出,在一定的预处理时间范围内对菌体进行处理后,可以在较短时间内获得较高的原生质体得率,但当原生质体制备率较高时,继续增加脱壁预处理时间,对原生质体得率的影响并不显著。当预处理20 min时,W5、20335原生质体制备率均为90%左右,处理时间延长10 min后,制备率分别上升为98.3%及94.4%,见表1。在此基础上再延长10 min后,双亲株原生质体得率均没有明显的提高。鉴于脱壁预处理剂可能会损伤原生质体膜,影响原生质体的再生,因此,选择30 min作为预处理的最佳时间。

表1 不同脱壁预处理时间对W5、20335原生质体制备率影响Table 1 The effect of different preprocessing time to the protoplast preparation ratio of W5 and 20335
2.3 酶解时间对原生质体制备率及再生率的影响
酶作用时间及体系中酶的终浓度是原生质体制备过程中较为重要的影响因素。酶解时间过长,对于先形成的原生质体膜有毒害作用,并且酶解时间过长,微生物细胞去壁太彻底,严重影响原生质体的再生。但如果酶解时间太短,则导致原生质体的形成率太低,也不利于原生质体的融合[10]。同时,酶用量过大,就会导致酶中带有的对原生质体有害的杂酶量增加,当杂酶浓度达到一定值时,必然会影响原生质体的活性,从而影响原生质体的融合与再生[11]。
本试验以体系中使用的固体酶量0.12 g为基准,分别研究了酶解15、30、45、60和75 min时,W5和20335原生质体制备率与再生率。由图2和图3可知,随着酶解时间的延长,W5、20335原生质体的制备率不断升高,并且趋近于100%。原生质体的再生率则随着酶解时间的增加呈现降低的趋势。其中,酶解15 min时,W5原生质体的制备率为86.4%,再生率为9.4%,当酶解时间为75 min时,制备率增加为99.5%,再生率却下降为1.4%。同样,酶解15 min时20335原生质体的制备率为97.1%,随着酶解时间增加到75 min时,制备率为99.9%,再生率却由31.4%下降到5.2%。根据试验结果,选择制备率与再生率乘积最大的酶处理时间为最佳的原生质体制备时间。因此,确定W5、20335的酶解时间均以15 min为宜。

图2 酶解时间对W5原生质体制备率及再生率的影响Fig.2 The effect of different enzymolysis time to the protoplast preparation ratio and regeneration ratio ofW5

图3 酶解时间对20335原生质体制备率及再生率的影响Fig.3 The effect of different enzymolysis time to the protoplast preparation ratio and regeneration ratio of 20335
3 结 论
试验研究了脱壁预处理时间及酶解时间对W5、20335原生质体制备率及再生率的影响。结果发现,其他条件相同时,经过脱壁预处理的菌体更容易在较短的时间内得到原生质体,且原生质体的得率与脱壁预处理时间有关。在一定时间范围内,原生质体的得率随脱壁预处理时间的增加而上升,但达到一定制备率后,继续延长预处理时间原生质体得率上升不明显。综合考虑预处理剂对原生质体制备和再生的影响,最终确定30 min为最佳预处理时间。随着酶解时间的延长,W5、20335原生质体制备率呈现上升的趋势,再生率则呈下降趋势。根据制备率与再生率乘积最大的原则,最终确定了W5、20335酶解处理时间均为15 min。综上所述,最终确定W5、20335原生质体制备的最佳条件为:选取W5、20335培养4~5 h及6~7 h的菌体,30℃、100 r/min预处理30 min,固体酶用量0.12 g,30℃、100 r/min酶解处理15 min,可以达到W5、20335原生质体融合的较理想的制备率及再生率。
[1] 谭周进,肖启明,肖克宇,等.原生质体融合技术在微生物菌种选育中的应用[J].生物技术,2003,13(1):35-37.
[2] 平文祥,周东坡.微生物原生质体融合[M].哈尔滨:黑龙江科学技术出版社,1990:8-9.
[3] 王凡强,许平.产乙醇工程菌研究进展[J].微生物学报,2006,46(4):673-675.
[4] 宋昕磊.植物纤维的酒精发酵[D].北京:北京化工大学,2007:6.
[5] Cheng ChangLina,Pao Chuan Hsieha,JengLeunMaub.Construction of an intergeneric fusion fromSchizosaccharomyces pombeandLentinula edodesfor xylan degradation and polyol production[J].Enzyme and Microbial Technology,2005,36:107-117.
[6] 岳瑞雪,陈叶福,肖冬光,等.休哈塔假丝酵母发酵木糖生产乙醇的研究[J].酿酒科技,2007,9:45-52.
[7] 谭文辉,李燕萍,许杨.微生物原生质体制备及再生的影响因素[J].现代食品科技,2006,22(3):263-265.
[8] Yali Cheng,Richard R.Belanger.Protoplast preparation and regeneration from spores of the biocontrol fungus Pseudo-zyma focculosa[J].FEMS Microbiology Letters,2000,190:287-291.
[9] MingHua Dai,Sara Ziesman,Thomas Ratclife.Visualization of protoplast fusion and quantitation of recombination in fused protoplasts of auxotrophic strains of Escherichia coli[J].Metabolic Engineering,2005,2(7):45-52.
[10] 郑重谊,谭周进,肖克宇,等.不同因素对两株细菌原生质体制备的影响[J].生物技术通报,2007,5:131-135.
[11] 孙剑秋,周东坡.微生物原生质体技术[J].生物学通报,2002,37(7):9-11.

