真菌营养亲和群鉴定方法的改进
陈 强,张金霞
(中国农业科学院农业资源与农业区划研究所,北京 100081)
真菌营养亲和现象反映的是同种群体内个体的表型差异(或相似性)[1]。而真菌种内拥有相同的异核体(heterokaryon,het)或营养不亲和(vegetative imcompatibility,vic)位点的个体(基因型)能够融合形成异核体[2],能形成稳定异核体的真菌个体被认为属于相同的营养亲种群(vegetative compatible group,VCG)。相反,存在一个或多个het或vic位点差异的个体不能融合,菌丝细胞接触出现程序性死亡或凋亡的个体属于不同的VCG[1,3]。某些真菌的菌丝分泌色素或颜色深,如葡萄座腔菌科(Botryosphaeriaceae)和Cryphonectriaceae科的多数种,菌丝不能融合,在不同的个体间能观察到一条沟带,对于这些种而言,在培养皿上测试它们的亲缘关系,很容易确定它们的VCG,它可以为研究群体多样性提供一个有力的视角[4-5]。对于菌丝的颜色浅的某些真菌,如镰刀菌(Fusarium)中的种,属于不同VCG的个体间的沟带很难辨认,它们需要构建nit突变体才能确定个体[6-7]。真菌VCG是研究物种起源、进化和群体分化的一种有效手段。应用营养不亲和反应可用来鉴定菌株,特别是在食用菌生产实践中应用比较广泛,一般认为:2个菌株对峙培养,若发生营养不亲和反应,则可以认定它们为不同的菌株;若它们营养亲和,则不能判定它们相同,需要采用其他方法进一步鉴定。在日本的香菇、平菇、肺形侧耳、杏鲍菇、毛木耳、金针菇、滑菇、黄伞、灰树花、斑玉蕈、真姬菇、荷叶离褶伞、茶树菇和砖红离褶伞等14种食用菌新品种DUS(Distinctness、Uniformity、Stability,特异性、一致性、稳定性)测试指南中,营养不亲和反应均是测试项目之一。目前鉴定营养亲和群的方法通常是将群体内的个体两两配对,观察个体的接触区域是否产生沟带或分泌色素,这个方法简单而且成本低,但是它的缺点就是工作量大,1个菌株要与群体中其他的每个菌株两两配对,若有N个菌株,则需要的配对是C2N个,当N>100时,配对的组合数超过5 000,工作量非常大。本文改进配对方法,减少配对的工作量,大大减少培养皿和培养基的使用量,节约材料和时间,提高配对效率。
1 材料与方法
1.1 材料的处理
以香菇Lentinula edodes为例,取7个菌株241、879、892、898、910、917、923,将它们分别接种PDA培养基上,25℃培养活化。
1.2 试验设计
取3个装有PDA培养基的培养皿(直径9 cm)。剪一个边长3 cm的正六边形纸片,纸片中心留有小孔。把纸片盖在培养皿底的外表面,用记号笔在培养皿底上标记正六边形的顶点和中心。将菌株241、879、892、898、910、917、923按序号从小到大重新依次命名为A、B、C、D、E、F、G,按照图1的顺序,取相同大小的菌种块(直径0.4 cm左右),分别接种于3个培养皿的相应的位置,25℃培养,培养皿正置。
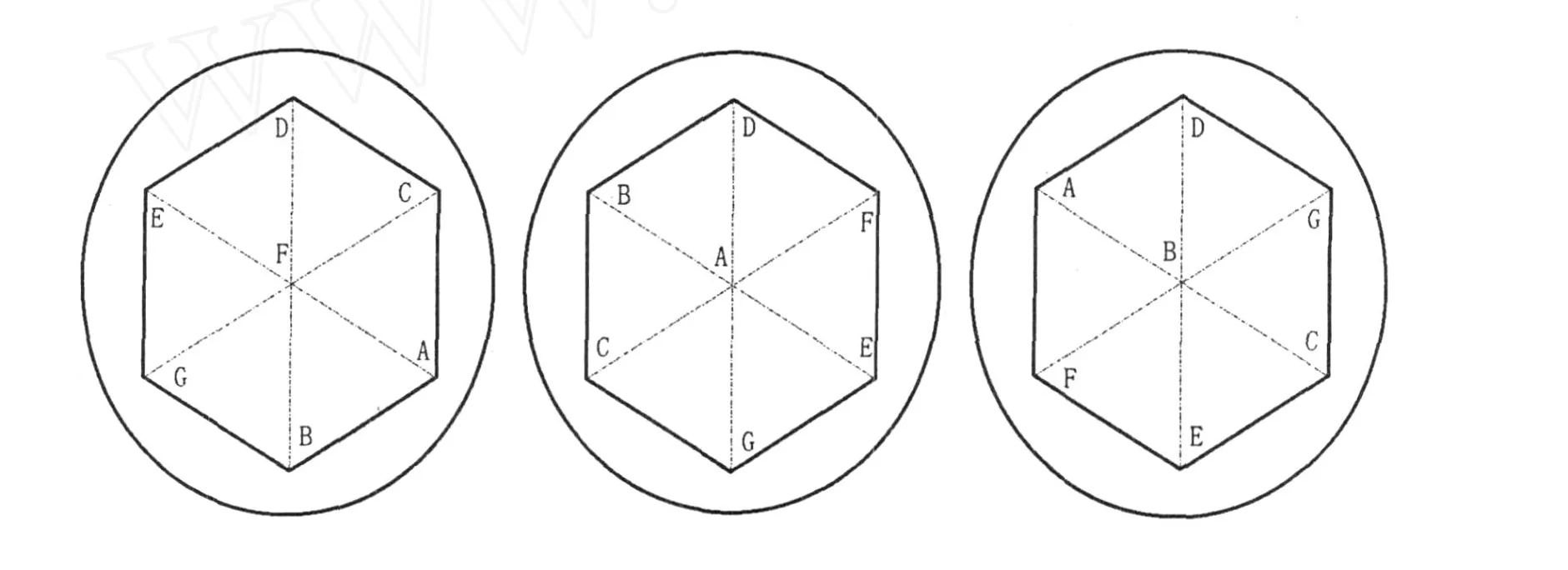
图1 供试菌株接种点示意图Fig.1 Illustration of sites of tested strains inoculation
2 结 果
采用图1的实验设计,7个菌株两两间的配对接触次数见表1。能够保障每个菌株之间至少1次两两接触,完全能够正确反应出7个菌株之间营养不亲和关系。实例证明(如图2),采用3个培养皿就能判定7个菌株两两之间的营养不亲和性。
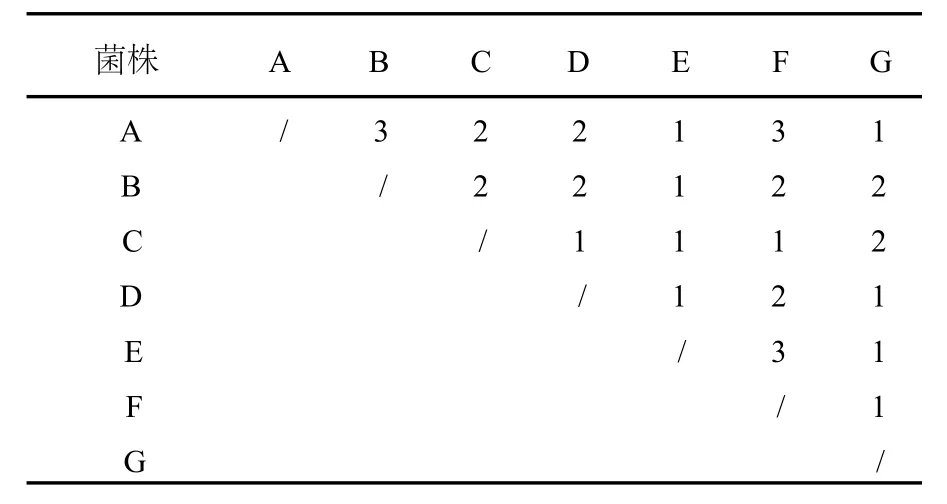
表1 供试菌株接触次数Table 1 Pair times of tested strains
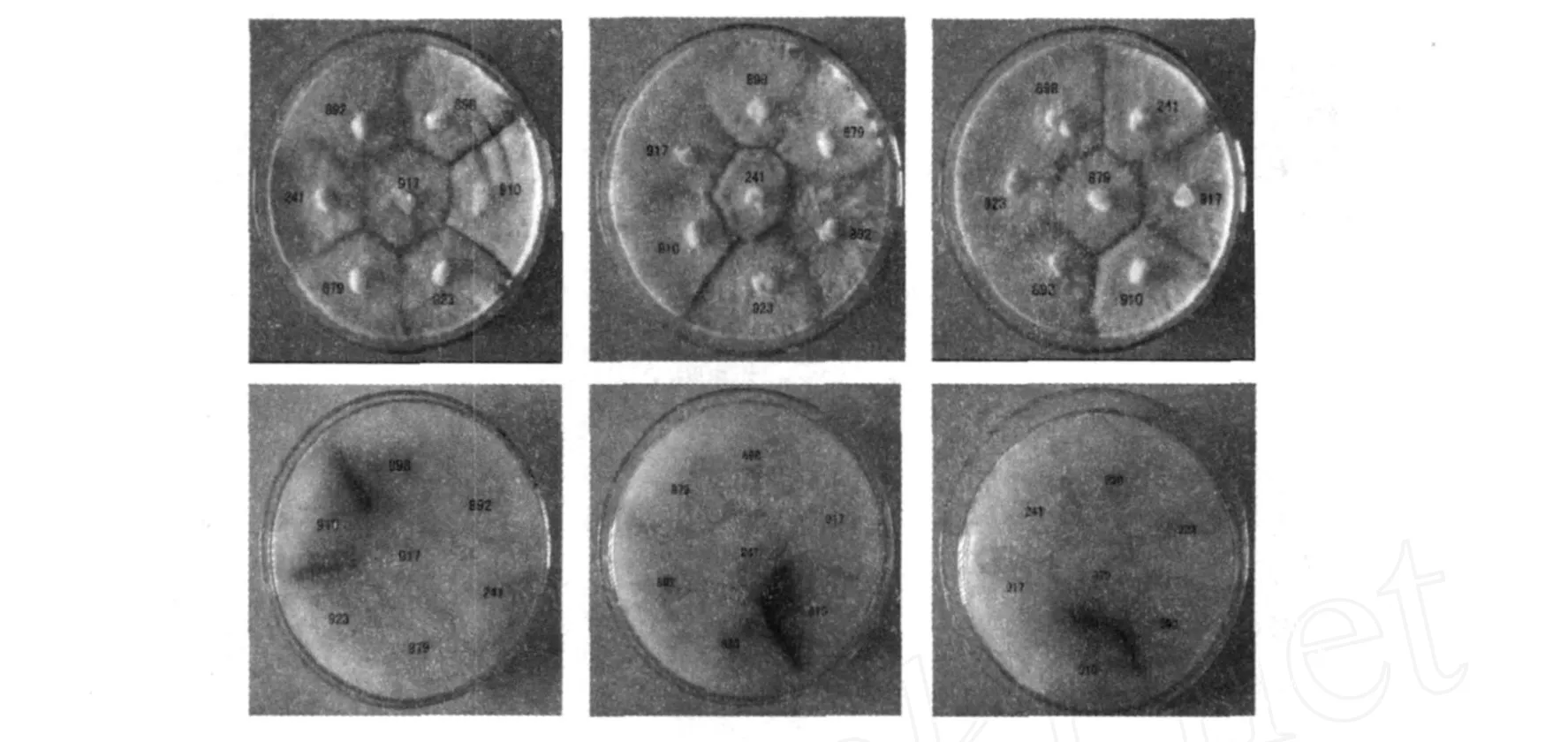
图2 香菇7个菌株营养不亲和反应Fig.2 Vegetative compatible relations of sevenLentinula edodesstrains
3 讨论与结论
采用本文设计的方法,在香菇、平菇、白灵菇鉴定营养不亲和试验中得到了满意的效果,大大缩小了工作量。当菌株比较多时,可以将7个菌株为一组,分成若干组,同时从每组中取出1个菌株,组成新的一组(若菌株不够7个,可以将菌株重复若干次凑成7个),按照以上的方法分别判定组内菌株的营养亲和关系。假设菌株的营养亲和关系是可以类推的,即菌株A分别与B、C亲和,则推测B与C亲和。将营养亲和群内的菌株只保留1个,与其他营养亲和关系未确定的菌株一起,按照以上的方法,继续判断,直到所有菌株的营养亲和关系明确为止。由于并非所有的营养亲和关系都能类推,在点柄粘盖牛肝菌(Suilus granulatus)中曾发现组织分离物VT1993与VT1990、VT1994营养亲和,而VT1990与VT1994营养不亲和[8]。但是这种现象很少见,仍可以假定营养亲和关系可以类推。对于推测营养亲和的菌株,再次配对即可验证。在运用此方法时,要掌握如下要点:若菌株生长速度慢,则需要把培养基倒厚些;若有条件,可能用封口膜封口,以防培养基失水过多而影响结果;同一组的7个菌株,尽量挑选生长速度相近的菌株,接种块大小尽可能一致,以防生长快的菌株侵占生长慢的菌株的生长空间,造成观察不便;同一组的7个菌株实在是生长速度差异比较大,则可以先接种生长慢的菌株,隔一段时间接种生长快的菌株。
[1] Leslie JF.Fungal vegetative compatibility[J].Annual Review of Phytopathology,1993,31:127-150.
[2] GlassNL,JacobsonDJ,Shiu PKT.The genetics of hyphal fusion and vegetative incompatibility in filamentous ascomycete fungi[J].Annual Review of Genetics,2000,34:165-186.
[3] Anagnostakis SL.Chestnut blight:The classical problem of an introduced pathogen[J].Mycologia,1987,79(1):23-37.
[4] Burgess T,WingfieldBD,WingfieldMJ.Comparison of genotypic diversity in native and introduced populations of Sphaeropsis sapineaisolated from Pinusradiata[J].Mycological Research,2001,105(11):1331-1339.
[5] Van Heerden S W,Wingfield MJ.Genetic diversity of Cryphonectria cubensisisolates in South Africa[J].Mycological Research,2001,105(1):94-99.
[6] Klittich CJR,Leslie JF.Nitrate reduction mutants ofFusarium monilifor me(Gibberella fujikuroi)[J].Genetics,1988,118(33):417-423.
[7] Swift CE.Vegetative compatibility groups of Fusarium oxysporumf.sp.cepaefrom onion in Colorado[J].Plant Disease,2002,86(6):606-610.
[8] KathrynMJ,Orson K M,Bruce JT.Randomly amplified polymorphic DNA markers are superior to somatic incompatibility tests for discriminating genotypes in natural populations of the ectomycorrhizal fungus Suillus granulatus[J].PNAS,1993,90:9159-9163.

