北细辛内生真菌的分离鉴定及代谢产物的生物活性
包丽霞,殷 瑜,杨 天,杨和行,钱秀萍*
(1.上海交通大学药学院,上海 200240;2.上海来益生物药物研发中心,上海 201203)
细辛为马兜铃科细辛属药用植物,应用历史悠久,功效显著,史载于《神农本草》。《中国药典》(2005年版)将北细辛(Asarum heterotropoides var.Mandsh uricum(Maxim.)Kitag.)、汉城细辛(Asarum sieboldiivar.seoulense Nakai.)和华细辛(Asarum sieboldii)列为正品,北细辛列正品之首[1]。北细辛为北方主要道地中草药,药用成分为挥发油,全草入药,具有发表散寒、温肺祛痰的功效[2]。体外试验证明,细辛浸膏对金黄色葡萄球菌、枯草杆菌、痢疾杆菌及伤寒杆菌有抑制作用,其煎剂对结核杆菌、伤寒杆菌有抑制作用[3]。植物内生菌具有生物多样性的特点,不仅能够参与植物次生代谢产物的合成以及对植物次生代谢产物进行转化,还能独立产生丰富的次生代谢产物,是天然产物的重要来源和具有高度开发价值的新型生物资源。近十年来植物内生菌及其活性代谢产物成为微生物学研究的一大热点[4-6]。从北细辛中分离植物内生真菌,以及对其内生真菌代谢产物进行活性研究的报道至今未见。文中对3株川北细辛、四川北细辛、陕西北细辛进行了内生真菌的分离和鉴定,并检测其代谢产物对肺癌细胞、乳腺癌细胞和胰腺癌细胞的抑制作用,以及靶向抑制脂肪酸合成的抗菌活性,旨在为开辟抗菌抗肿瘤药物新途径奠定基础。
1 材料与方法
1.1 材料
1.1.1 北细辛(Asarum heterotropoides var.Mandshuricum(Maxim.)Kitag.) 川北细辛、四川北细辛、陕西北细辛于2009年8月采自四川、陕西,由上海交通大学药学院刘忠副教授鉴定。
1.1.2 肿瘤细胞株 A549(肺癌细胞);MDAMB-231(乳腺癌细胞);PANC-1(胰腺癌细胞),由上海来益生物药物研发中心保藏。
1.1.3 检定菌株 E.coliTOP10/pHN678(对照菌株);E.coliTOP10/pHNA(酰基载体蛋白ACP特异性敏感工程菌);E.coliTOP10/pHNF(脂肪酸合成酶FabI特异性敏感工程菌)。由上海来益生物药物研发中心保藏。
1.1.4 培养基 PDA培养基(马铃薯葡萄糖琼脂);固体发酵培养基:大米4 g,水5 mL;LB培养基(Solarbio);F12K培养基(Sigma);RPM I培养基(Gibco);DMEM培养基(Gibco)。
1.1.5 主要试剂和仪器 Tris(Amersco),MTT(Amersco),胎牛血清(Hyclone),SDS、苯酚-氯仿、RNAse、dNTP、热稳定DNA聚合酶、IPTG、Amp、戊基泛酸、三氯生、通用引物ITS1和ITS4(上海生工生物),其他试剂均为化学纯;PCR仪(Eppendorf),MK-2全自动酶标仪(Thermo),CO2培养箱(Thermo)。
1.2 方法
1.2.1 内生真菌的分离[7]将3株新鲜的北细辛冲洗干净,除去泥土等大颗粒,用95%乙醇浸泡1 min,无菌水冲洗2次后用9%次氯酸钠浸泡5 min。再用无菌水冲洗3次后用95%乙醇浸泡30 s,然后用无菌水冲洗3次。将上述处理好的样品切成0.5 cm长的小块置于含氯霉素(80 U/mL)的PDA平板,每个平板放置6~8块,28℃恒温静置培养,3~5 d后,培养基上长出菌丝,挑取菌丝于PDA平板,经纯化后得到表观形态不一的内生真菌。表面消毒最后1次冲洗后的无菌水,取少量涂布于含氯霉素(80 U/mL)的PDA平板,28℃恒温培养,观察是否有真菌长出。
1.2.2 真菌总DNA的提取 将纯化菌株的孢子和菌丝接入PDA培养基,28℃培养3 d后获得菌体。在2 mL离心管内装入400μL的玻璃珠(Ф=0.5 mm),1×105Pa灭菌20 min,在离心管内加入400~500μL TE(pH 8.0)缓冲液和40μL 10%SDS,然后加入少量菌丝,振荡4 min,10 000 r/min离心8 min;取上清,加入等量(约400μL)苯酚-氯仿,振摇数次,12 000 r/min离心3 min;取上清,加入等量氯仿,振摇数次,12 000 r/min离心3 min;取上清,加入等量异丙醇,混匀,12 000 r/min离心5 min;弃上清,加入500μL 70%乙醇,12 000 r/min离心5 min,重复2次;加入30~40 μL含RNAse TE缓冲液,37℃水浴30 min。
1.2.3 PCR扩增 利用真菌18S rDNA内转录间隔区(internal transcribed spacer,ITS)通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′,正向)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′,反向)扩增纯化菌株的r DNA的ITS区[8]。反应体系(50 μL):超纯水35.75μL,10×扩增缓冲液5μL,25 mmol/L MgCl22μL,2.5 mmol/L dNTP 2μL,10 μmol/L ITS1引物2μL,10μmol/L ITS4引物2 μL,10 U/L热稳定DNA聚合酶0.25μL,模板DNA 1μL。反应条件:94℃预变性5 min,94℃变性1 min,55℃复性30 s,72℃延伸1 min,共30个循环;最后72℃延伸10 min。PCR产物由上海美季生物技术有限公司测序。
1.2.4 序列分析 将获得的序列通过Blast程序在GenBank上进行相似性序列检索,将其序列连同其近似序列导入MEGA version 4.1中进行比对,利用邻位互换算法(CN I)搜索最小进化树(ME tree),并进行500次重复的自展检验(boot-strap),将ME树上与之最接近的种类确定为分离菌株可能的种类,并参照文献[9]进行分类归属。1.2.5 内生真菌发酵产物制备 将纯化内生真菌菌株接种于大米固体发酵培养基中,28℃恒温静置培养30 d后,用甲醇◇丙酮◇丁酮=1◇3◇1浸泡培养物4 h。3 500 r/min离心5 min后,上清液待测。
1.2.6 抗肿瘤活性检测 肿瘤细胞A549采用F12K培养基,MDA-MB-231采用RPM I培养基,PANC-1采用DMEM培养基进行培养。采用四甲基偶氮唑盐微量酶反应比色法(3-(4,5-dimethy-2-thiazoly)-2,5-diphenyl-2H-tetyazoliumbromide,MTT)检测样品的抗肿瘤活性[10]。
1.2.7 体外抑菌活性检测[11]以E.coli TOP10/pHN678为对照菌株,ACP和FabI抑制剂高度敏感的E.coliTOP10/pHNA和E.coli TOP10/pHNF为检定菌株测定抗菌活性。将E.coliTOP10/pHN678、E.coliTOP10/pHNA和E.coliTOP10/pHNF接种于LB液体培养基37℃培养过夜,分别加至反应液(20 mL LB液+7.5μL IPTG)中,使菌浓为OD600nm=0.1、IPTG终浓度为37.5μmol/L,标记为678液、HNA液和HNF液。取96孔板分别加入100μL含对照菌和检定菌的678液、HNA液和HNF液,再分别加入5μL待测样品。E.coliTOP10/pHN678对照菌株组设Amp阴性对照、戊基泛酸阳性对照和三氯生阳性对照;E.coliTOP10/pHNA和E.coliTOP10/pHNF分别设Amp阴性对照和戊基泛酸阳性对照,及Amp阴性对照和三氯生阳性对照。37℃80 r/min过夜培养,用酶标仪测定OD600nm值。按下列算式计算抑制率:
2 结果与讨论
2.1 北细辛优势内生真菌的分离
高浓度杀菌剂短时间处理比低浓度杀菌剂长时间处理更适合植物内生真菌的分离[12]。本实验表面消毒法采用高浓度次氯酸钠(9%)浸泡5 min,最后一次洗涤的无菌水在PDA培养基上没有长菌,说明表面消毒较彻底,分离到的内生真菌确是北细辛的内生真菌,而不是表面的附生菌。川北细辛、四川北细辛、陕西北细辛为北细辛的3个不同种,本实验中分离到川北细辛优势内生真菌6株,四川北细辛和陕西北细辛的优势内生真菌分别为2株。这10株内生真菌的形态特征不同(表1),表明植物生长地区和品种不同,其优势内生真菌的种类和数量也不相同,其中川北细辛的内生真菌生物多样性较为丰富。本实验相对分离到较少内生菌,其原因可能是:①3株北细辛仅生长1~2片真叶,生长年限较短,按植物内生真菌侵入的起源学说[13],内生真菌较少;②在PDA培养基上优势菌株生长很快,抢夺了弱势菌株的营养;③有很多内生真菌(尤其是专性寄生内生真菌)即便用不同的培养基进行分离,也不能在人工培养基上生长[14];④分离时只挑取了表观形态不同的真菌进行培养,导致表观形态相同但可能种属不同的内生真菌的遗漏。

表1 北细辛优势内生真菌的形态特征Table 1 Morphological characteristics of predominant endophytic fungi from Asarum heterotropoides
2.2 北细辛优势内生真菌的鉴定
经PCR扩增和ITS序列测序,10株北细辛优势内生真菌的ITS序列与GenBank登录的17株真菌的相似性在97%以上(表2)。序列结果在NCB I上Blast比对后,构建的系统发育树见图1。根据亲缘关系的远近,再参照文献[9]对内生真菌进行分类归属。10株内生真菌分属于子囊菌门(Ascomycota)和半知菌类(Fungi Imperfecti)的3个纲4个目5个科5个属,如表3所示。北细辛内生真菌中以柄孢壳菌属(Podospora)最多,小丛壳属(Glom erella)和镰孢属(Fusarium)次之。

表2 优势内生真菌ITS序列相似性分析Table 2 Similarity of the ITS sequence from the predominant endophytic fungi

图1 根据ITS序列构建的系统发育树Fig.1 Phylogenetic tree on the basis of ITS sequences

表3 北细辛优势内生真菌的组成Table 3 Predominant endophytic fungi from Asarum heterotropoides
在3株不同来源的北细辛中分离到的优势菌株种类和数量也存在差异,如表4所示。川北细辛中的优势菌株种类和数量最多,而陕西北细辛的优势内生真菌种类仅一种且不同于其余2种北细辛的内生菌。

表4 北细辛优势内生真菌的分类Table 4 Genus of predominant endophytic fungi fromAsarum heterotropoides
2.3 北细辛优势内生真菌代谢产物的抗肿瘤活性
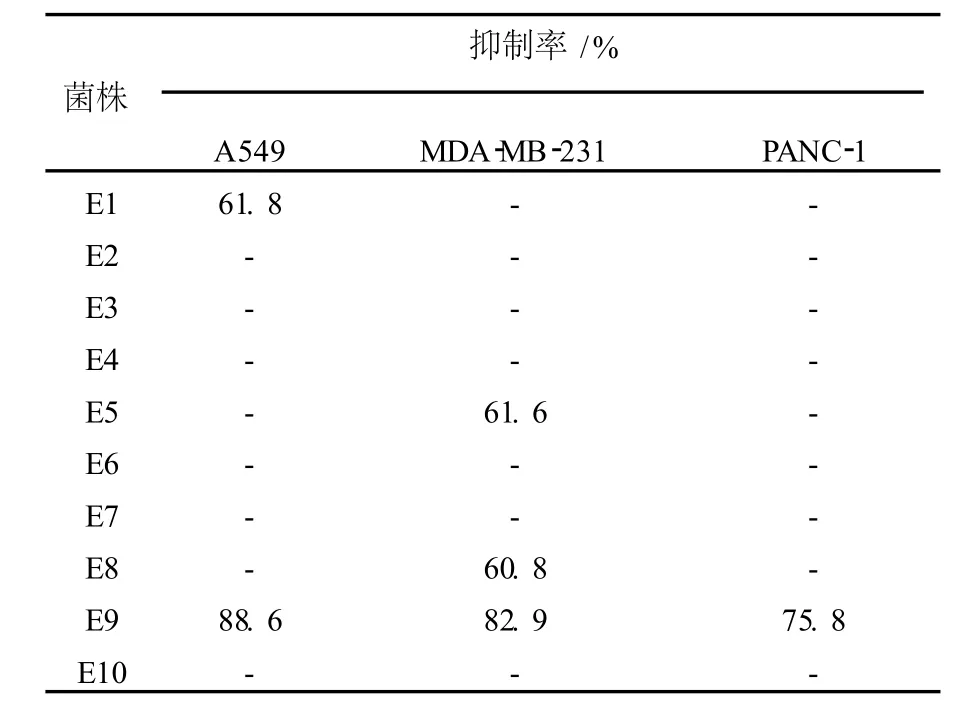
表5 北细辛优势内生真菌的抗肿瘤活性Table 5 Antitumor activities of predominant endophytic fungi fromAsarum heterotropoides
检测10株内生真菌代谢产物抗肺癌细胞(A549)、乳腺癌细胞(MDA-MB-231)和胰腺癌细胞(PANC-1)的活性,结果如表5所示。菌株E1、E5、E8和E9对A549、MDA-MB-231或PANC-1细胞各有不同程度的抑制活性,其中从陕西北细辛中分离的镰孢属(Fusariumsp.)菌株E9的抗肿瘤活性最高,对3种肿瘤细胞均有超过75%的抑制率。
2.4 北细辛优势内生真菌的抗菌活性

表6 北细辛优势内生真菌的抗菌活性Table 6 Antibacterial activities of predominant endophytic fungi from Asarum heterotropoides
脂肪酸合成对细菌的存活至关重要。脂肪酸合成酶(FAS)系统的亚基蛋白已成为基因组驱动的新型抗菌药物靶标研究的热点。酰基载体蛋白(ACP)和NADH依赖的烯酰基-ACP还原酶(FabI)是催化脂肪酸合成的主要功能酶,广泛存在于细菌中,在细菌脂肪酸生物合成中起着必要的调节作用[15]。通过抑制ACP和FabI活性,可抑制脂肪酸的生物合成而致细菌死亡。
本实验以E.coliTOP10/pHNA(酰基载体蛋白ACP特异性敏感工程菌)和E.coliTOP10/pHNF(脂肪酸合成酶FabI特异性敏感工程菌)为生物检定菌,检测10株内生真菌代谢产物对靶点ACP或FabI的抑制活性,结果见表6。刺盘孢属(Colletotrichumsp.)菌株E6和小丛壳属(Glom erellasp.)菌株E7仅有针对FabI靶点的抗菌活性。小丛壳属(Glom erellasp.)菌株E1和叶点霉属(Phyllostictasp.)菌株E2具有靶向ACP和FabI的抗菌活性,且抗FabI的活性较强,抑制率达59%。
3 结 论
内生真菌存在于目前所有已研究的植物中。细辛生长缓慢,通常从播种到开花结果需5~6 a[3],这给细辛有效成分的开发利用带来很大困难。而许多植物内生菌在长期的自然选择下能够产生与寄主植物相同或相似的具生物活性的次级代谢产物,这为发现新的先导化合物、开发新药及保护濒危植物提供了重要的开发和利用途径[16]。
本文对3株不同来源的北细辛优势内生真菌进行了分离鉴定,各自分离到的优势菌株种类和数量各不相同,表明不同种类和生长地区的北细辛其优势内生真菌的种类和数量存在差异。对北细辛中分离到的10株优势内生真菌进行了靶向脂肪酸合成的抗菌活性以及抗肿瘤活性筛选,获得3株活性较高的菌株小丛壳属(Glom erellasp.)菌株E1、叶点霉属(Phyllostictasp.)菌株E2和镰孢菌(Fusariumsp.)菌株E9,具有一定的潜在应用价值,有可能会为抗肿瘤抗菌新药的研究开发利用提供一条新的途径。今后将进一步确定这些菌株发酵液中抗肿瘤抗菌活性物质的组分及相应的化学结构,探明这些内生真菌是否产生与宿主北细辛相同或相似的抗肿瘤抗菌成分或是产生了新的活性物质,并评价其应用前景。
[1] 国家药典委员会.中华人民共和国药典(第一部)[M].北京:化学工业出版社,2005:159.
[2] 穆靖,袁强,吴秀菊,等.北细辛(Asarum heterotropoides)营养器官的形态结构及其挥发油的组织化学定位[J].东北农业大学学报,2009,40(2):51-56.
[3] 张亚玉,王英平,赵兰坡.北细辛的研究现状[J].特产研究,2004,26(4):50-54.
[4] Strobel G A.Endophytes as sources of bioactive products[J].Microbes and Infection,2003,5(5):535-544.
[5] Zhang H W,Song Y C,Tan R X.Biology and Chemistry of Endophytes[J].Natural Product Reports,2006,23(5):753-771.
[6] 陈宜涛,王伟剑.植物内生菌的研究进展[J].现代生物医学进展,2009,9(16):3169-3172.
[7] Reissinger A,Vilich V,Sikora R A.Detection of fungi inplanta:effectiveness of surface sterilization methods[J].Mycological Research,2001,105(5):563-566.
[8] 刘春来,文景芝,杨明秀,等.r DNA-ITS在植物病原真菌分子检测中的应用[J].东北农业大学学报,2007,38(1):101-106.
[9] 邢来君,李明春.普通真菌学[M].北京:高等教育出版社,1999:276-430.
[10] Mos mann F.Rapid colorinetric assay for cellular growth and survival:application to proliferation and cytotoxicity assay[J].J I mmunol Methods,1983,65(1-2):55-63.
[11] Broekaert W F,Marien W,Terras F R G,et al.Antimicrobial peptides from Amaranthus caudatus seeds with sequencehomology to the cysteine/glycine-rich domain of chitin-binding proteins[J].Biochemistry,1992,31(17):4308-4314.
[12] 何佳,刘笑洁,赵启美,等.植物内生真菌分离方法的研究[J].食品科学,2009,30(15):180-183.
[13] 袁志林,章初龙,林福呈.植物与内生真菌互作的生理与分子机制研究进展[J].生态学报,2008,28(9):4430-4439.
[14] 王利娟,贺新生.植物内生真菌分离培养的研究方法[J].微生物学杂志,2006,26(4):55-60.
[15] Heath R J,Rock C O.Regulation of fatty acid elongation and initiation by acyl-acyl carrier protein in Escherichia coli[J].J Biological Chemistry,1996,271(4):1833-1836.
[16] 贾栗,陈疏影,翟永功,等.近年国内外植物内生菌产生物活性物质的研究进展[J].中草药,2007,38(11):1750-1754.

