牛乳中α-乳白蛋白提取工艺
闫序东,尹睿杰,王彩云,云战友,李翠枝,陈忠军,刘丽君
(1.伊利实业集团股份有限公司a.技术中心;b.质量管理部,呼和浩特 010018;2.内蒙古农业大学 食品科学与工程学院,呼和浩特 010080)
牛乳中α-乳白蛋白提取工艺
闫序东1a,尹睿杰1b,王彩云1a,云战友1a,李翠枝1b,陈忠军2,刘丽君1b
(1.伊利实业集团股份有限公司a.技术中心;b.质量管理部,呼和浩特 010018;2.内蒙古农业大学 食品科学与工程学院,呼和浩特 010080)
研究了热附聚法结合凝乳酶处理从鲜牛乳中提取α-乳白蛋白的工艺,对工艺参数进行了优化,得到富含α-乳白蛋白的乳清,其中α-乳白蛋白与β-乳球蛋白的浓度比达到3.03,达到了商业化产品的水平。
α-乳白蛋白;β-乳球蛋白;加热处理
0 引 言
α-La含有高比例的色氨酸及半胱氨酸,色氨酸是5-羟色胺的前体,对胃口、情绪、睡眠及生物钟等神经性反应的调节具有重要功能。而半胱氨酸既是谷胱甘肽的组份,也是合成牛磺酸的前体[1-3]。因此,对牛奶中α-La的研究和对富含α-La的乳清和乳清粉的制备工艺的探索近年来成为热点。
乳清蛋白受热易变性,许多文献研究了乳清蛋白变性的动力学规律并指出[4-6],β-乳球蛋白(β-Lg)与α-La在特定条件下的变性速率存在差异,β-Lg与酪蛋白的附聚速率和附聚程度均高于α-La,因此,采取分离手段将β-Lg/酪蛋白附聚物与未附聚的α-La分离即可以达到富集α-La的目的,本研究即运用该原理来实现对α-La的提取分离。
1 实 验
1.1 材料与设备
鲜牛乳,皱胃酶,α-乳白蛋白标准品,β-乳球蛋白标准品,尿素,1,3-双(三(羟甲基)甲基)丙烷,羟丙基甲基纤维素,柠檬酸,柠檬酸三钠,β-巯基乙醇,盐酸,氢氧化钠。
贝克曼MDQ毛细管电泳仪,配备二级管阵列检测器,Beckman P/ACE Station工作站,未涂层熔融石英毛细管(45cm×50μm i.d.,Polymicro Technologies,Phoenix,AZ,USA),3k30超速离心机(Sigma),BP211D电子天平,DK-8D型电热恒温水槽,LSHZ-300冷冻水浴恒温振荡器,ZC-10型智能超级恒温水槽,CH2122K型电磁炉,785DMP自动电位滴定仪,CS101-2电热鼓风干燥箱,可调式移液器,Milli.Elix-Q超纯水仪,KQ-700VDV医用超声波清洗器,实验室常规玻璃仪器。
1.2 方法
1.2.1 工艺流程

热处理:将脱脂乳分装于试管中,在水浴锅中进行加热处理,热处理后迅速置于冰水中冷却至室温。
酶凝:在热处理的脱脂乳中添加活力为20 000 U/g的凝乳酶0.01%及0.1%的氯化钙,酶凝30 min后,纱布过滤分离乳清与凝块。
1.2.2 α-乳白蛋白和β-乳球蛋白的检测
样品预处理:待测乳样,经60 000 g,10℃,40 min离心处理以沉降变性聚集的乳清蛋白/酪蛋白复合物,取清液并以1︰4的比例与pH值7.50尿素缓冲液混合,加入体积分数为5‰的巯基乙醇后待测。
检测条件:超纯水清洗毛细管柱:压力为1.38×105Pa,时间为3.0 min;运行缓冲液清洗毛细管柱压力为1.38×105Pa,时间为3.0 min;压力进样为3.44×103Pa,时间为10 s;分离电压为28 kV;柱温为25℃;二极管阵列检测波长214 nm;运行缓冲液为pH值为3.00的柠檬酸缓冲液。
1.2.3 提取工艺的优化
pH值:将鲜脱脂乳调节至6.00,5.80,5.60,5.40,5.20,5.00,4.80,4.60;在80℃下保温20 min;之后测定α-乳白蛋白及β-乳球蛋白的质量浓度。
热处理温度:将鲜脱脂乳调节至一定的pH值,在70,75,80,85,90℃保温5 min, 之后测定α-乳白蛋白及β-乳球蛋白质量浓度。
热处理时间:将鲜脱脂乳调节至一定pH值,在一定的温度下保温5,10,15,20,25,30 min,之后测定α-乳白蛋白及β-乳球蛋白质量浓度。
正交试验:选取单因素实验的pH值、热处理温度、时间的较优水平,开展三因素三水平正交实验。
2 结果与讨论
2.1 pH值
加热处理中乳清蛋白会变性并与酪蛋白形成复合物。当pH值大于6.9时,加热处理的过程中β-乳球蛋白会与κ-酪蛋白复合并从酪蛋白胶束上解离[7];pH值为6.83时,约有20%的κ-酪蛋白从酪蛋白胶束上解离,不利于β-乳球蛋白与酪蛋白的结合;pH值在6.5~6.7范围内时,β-乳球蛋白与κ-酪蛋白复合并能够稳定酪蛋白的胶束结构[8]。针对降低pH值是否可以显著改变乳清蛋白与酪蛋白的复合程度[9]进行了试验,结果如图1所示。
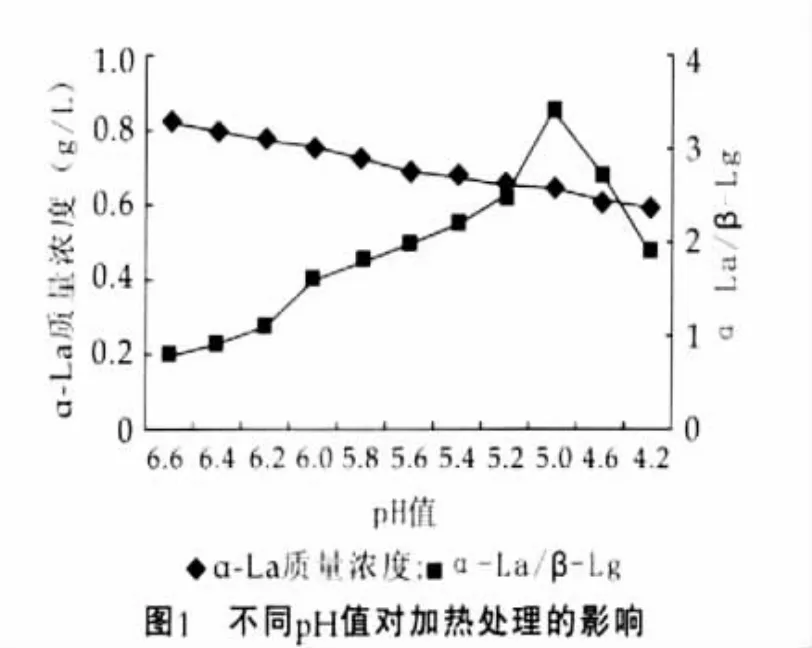
以α-乳白蛋白与β-乳球蛋白质量浓度之比间接代表α-乳白蛋白的纯度。由图1可以看出,脱脂乳的pH值为5.0时,α-乳白蛋白与β-乳球蛋白质量浓度之比最高,即α-乳白蛋白的纯度最高,而α-乳白蛋白的质量浓度随pH值的下降而缓慢降低,综合考虑质量浓度与纯度,选择脱脂乳的最优pH值为5.0。
2.2 热处理温度的确定
将pH值为5.0的脱脂乳,分别加热至70,75,80,85,90℃,保温5 min,超速离心后取上清液,用毛细管电泳法测定其中α-乳白蛋白和β-乳球蛋白的质量浓度,结果如图2所示。
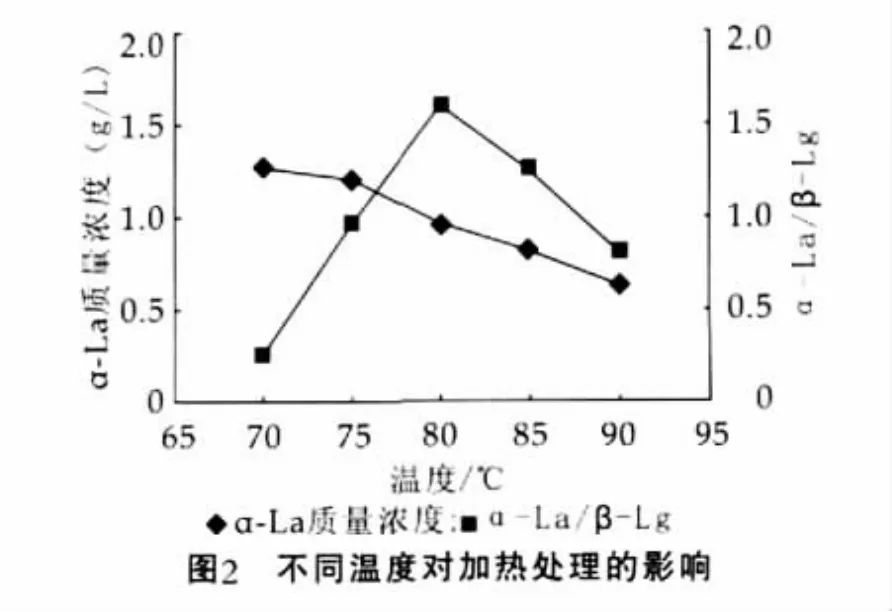
由图2可以看出,随着加热温度的升高,α-乳白蛋白的质量浓度逐渐减少;温度为80℃时,α-乳白蛋白与β-乳球蛋白的质量浓度比最大,对应的值为1.55,因此,80℃是最优的处理温度。
加热过程中,α-乳白蛋白和β-乳球蛋白的变性速率和程度不断升高,β-乳球蛋白与酪蛋白胶束复合的速率及程度高于α-乳白蛋白,所以α-乳白蛋白与β-乳球蛋白的浓度之比逐渐升高,之后,随着α-乳白蛋白和β-乳球蛋白的变性和复合速率差异的缩小,α-乳白蛋白与β-乳球蛋白的质量浓度比又逐渐下降。
2.3 热处理时间的确定
将pH值为5.0的脱脂乳,加热至80℃,分别保温5,10,15,20 min、25 min、30 min后, 超速离心取上清液,用毛细管电泳法测定其中α-乳白蛋白和β-乳球蛋白的质量浓度,结果如图3所示。
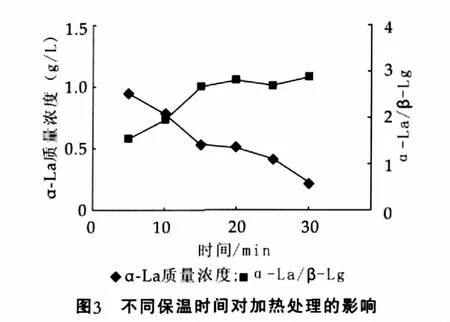
由图3可以看出,随着保温时间的延长,α-乳白蛋白的质量浓度逐渐减少,而α-乳白蛋白与β-乳球蛋白的浓度比则呈上升趋势。保温时间为20 min时,α-乳白蛋白的纯度基本趋于稳定,而它的质量浓度还将继续下降,因此选择20 min为最优热处理时间。
2.4 正交实验
结合单因素实验结果,选择主要影响因素:脱脂乳pH值、加热温度和保温时间,进行三因素三水平的正交实验,结果如表1所示。

表1 L9(33)加热处理正交实验因素水平
2.4.1 考虑α-乳白蛋白的纯度
经过不同加热条件处理后,脱脂乳中α-乳白蛋白和β-乳球蛋白直接或间接地与酪蛋白发生不同程度的复合,加热的温度越高,复合物形成的速度越快,保温时间越长,反应的程度越高[10]。
经过加热处理的脱脂乳,通过超速离心得到上清液,用毛细管电泳法测定其中α-乳白蛋白和β-乳球蛋白的浓度。
α-乳白蛋白的纯度越高,说明与酪蛋白复合的β-乳球蛋白越多,而与酪蛋白复合的α-乳白蛋白则较少。在此,把α-乳白蛋白的纯度作为衡量热处理作用的指标进行实验,结果如表2和图4所示。
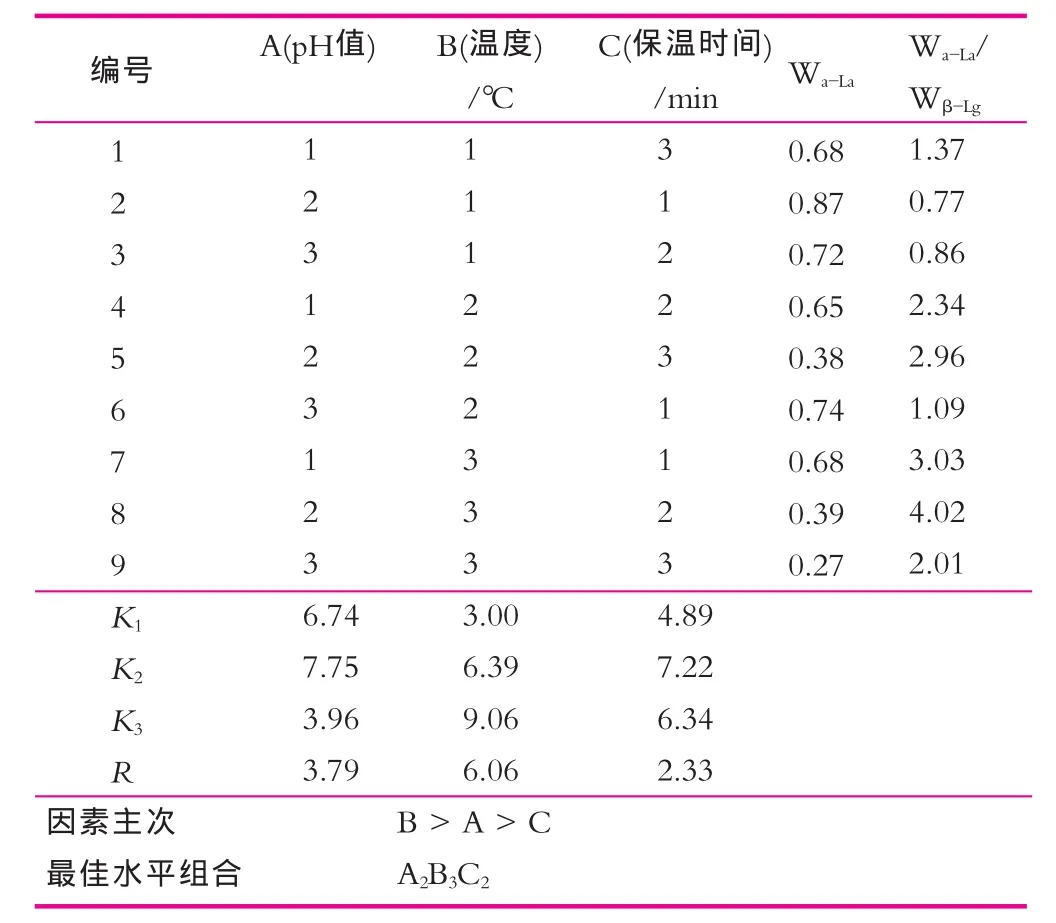
表2 正交实验结果
由表2可以看出,最优的处理组合为A2B3C2,即8号实验组。其α-乳白蛋白与β-乳球蛋白质量浓度之比的值为4.02。比较本研究中A,B,C三因素R值的大小,可以看出:最重要的影响因素为B因素(温度);其次为A因素(pH值);最后为C因素(保温时间)。
对正交实验中的3个因素,即pH值、温度和保温时间,进行方差分析,结果如表3所示。
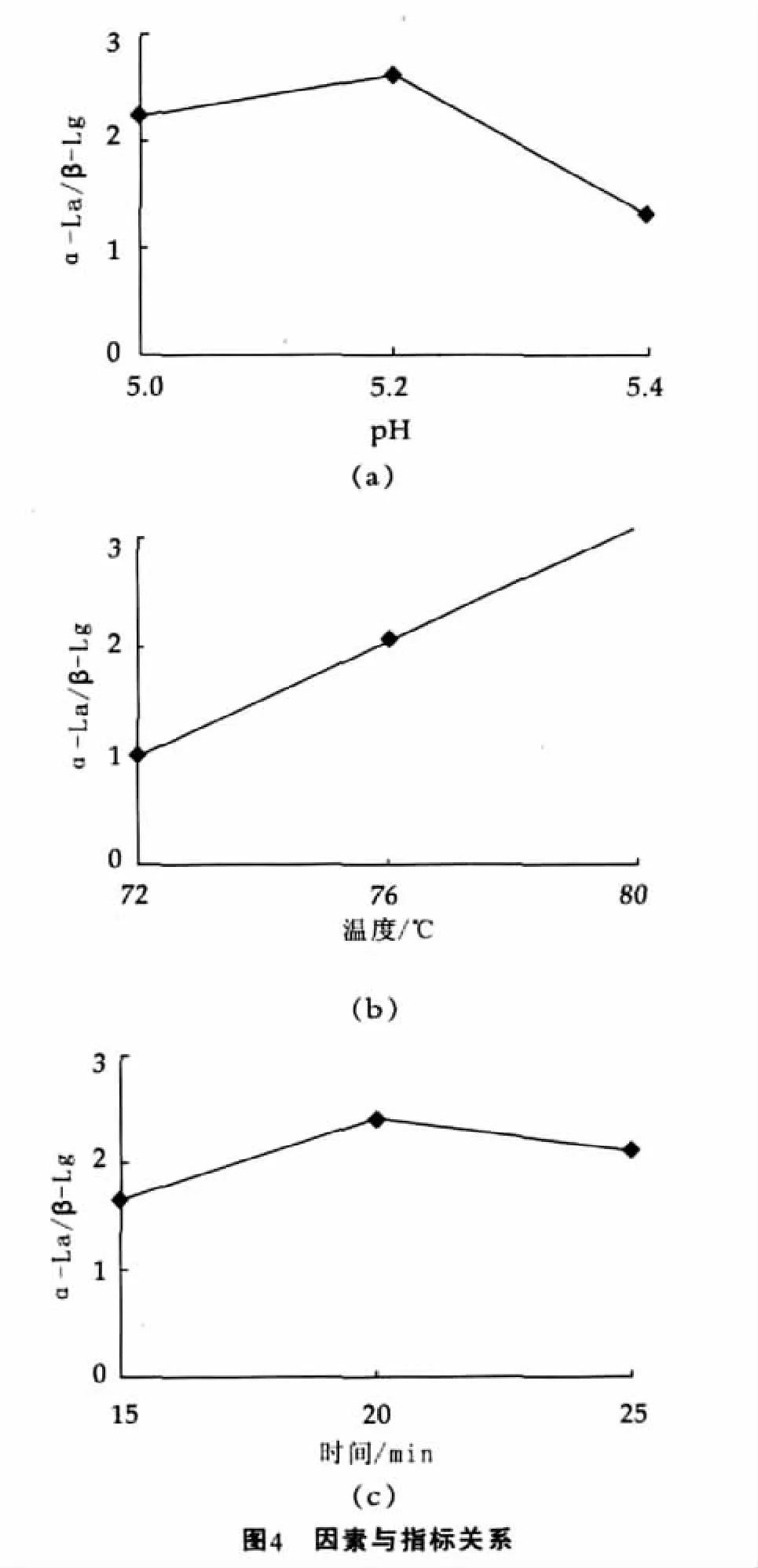
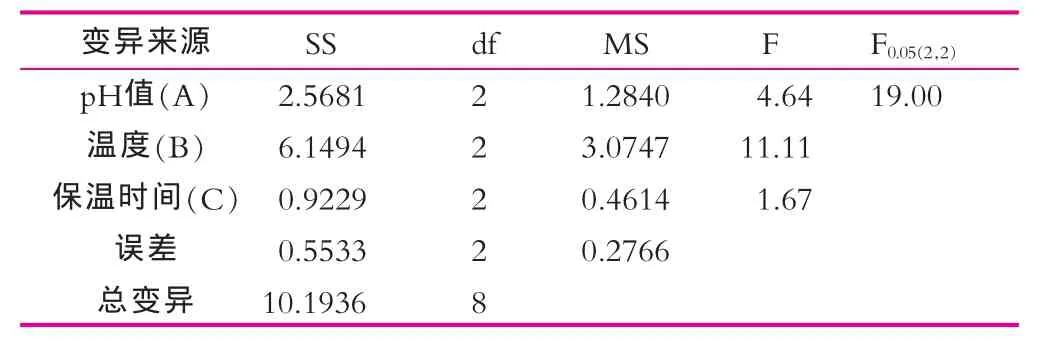
表3 方差分析结果
由表3可以看出,pH值、温度和保温时间3个因素的F值均不显著,但从方差分析的结果中可以看出各因素的相对重要性,即:B因素为重要因素,A因素次之,C因素再次。方差分析结果同直观分析一致。
2.4.2 考虑α-乳白蛋白的质量浓度
α-乳白蛋白的质量浓度在一定程度上反映α-乳白蛋白与其他蛋白质的复合程度,是除α-乳白蛋白的纯度之外另一个衡量热处理作用的指标。实验结果如表2和图5所示;分析结果如表4所示。
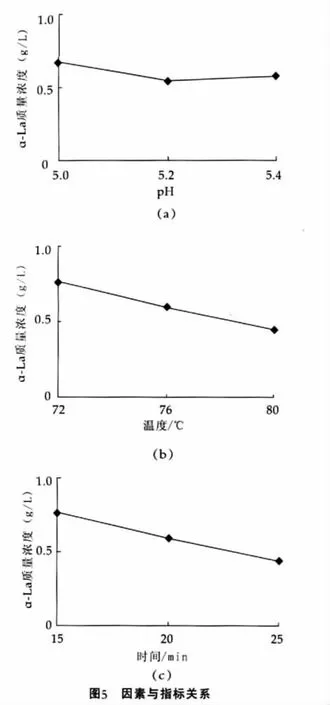
结果表明:最优的处理组合为A1B1C1。比较本试验中A,B,C三因素R值的大小,可以看出:最重要因素为C因素,即保温时间;其次为B因素,即温度;最后为A因素,即pH值。
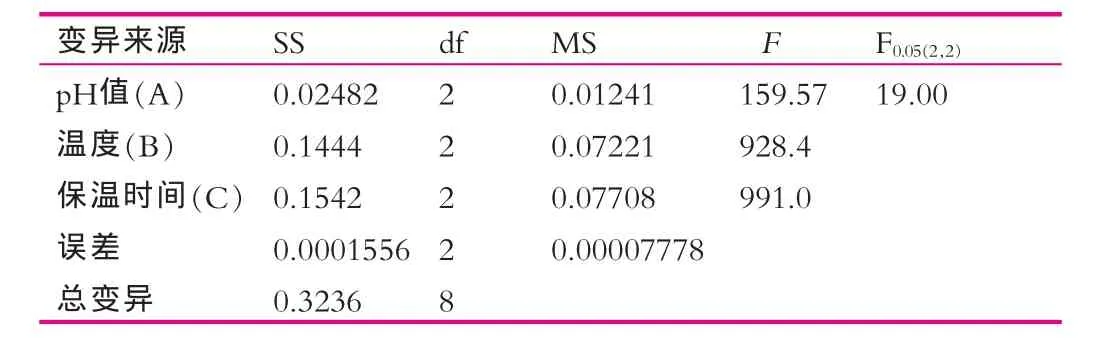
表4 方差分析结果
由表4可以看出,实验总体在0.05水平下显著,其中C因素极显著,B因素极显著,A因素显著,同直观分析的结果一致。
2.5 验证实验
按照正交试验所得的最佳热处理条件重复试验。对A2B3C2和A1B1C1组合分别进行了5次平行试验,A2B3C2组合所得样品中α-乳白蛋白的纯度均大于4.02,组合A1B1C1所得样品中α-乳白蛋白的质量浓度均大于0.99g/L。故有这样的结论:从α-乳白蛋白的浓度方面讲A1B1C1组合是最优的,从α-乳白蛋白的纯度方面讲A2B3C2组合是最优的。
由表2可以看出,质量浓度大于0.60 g/L并且α-乳白蛋白与β-乳球蛋白的比值大于2的试验组有4号和7号,7号的α-乳白蛋白的纯度明显高于4号,α-乳白蛋白的浓度相接近,故7号试验组为最佳组合,即A1B3C1,对应的α-乳白蛋白的质量浓度为0.68 g/L,α-乳白蛋白与β-乳球蛋白的比值为3.03。
3 结 论
脱脂乳热处理的最佳条件为:pH值5.0,温度80℃,保温时间15 min。从α-乳白蛋白的纯度方面考虑,3个因素的主次顺序为:温度>pH值>保温时间;从α-乳白蛋白的浓度方面考虑,3个因素的主次顺序为:保温时间>温度>pH值。
[1]OROSCO M,ROUCHA C.Alpha-Lactalbumin-Enriched Diets Enhance Serotonin Release and Induce Anxiolytic and Rewarding Effects in the Rat[J].Behavioural Brain Research,2004,148:1–10.
[2]EUGENE A P,LAWRENCE J B.α-Lactalbumin:Structure and Function[J].FEBS Letters,2000,473:269-274.
[3]JOLINE W J,BEULENS.Alpha-Lactalbumin Combined with a Regular Diet Increases Lasma Trp–LNAA Ratio[J].Physiology&Behavior 2004,81:585–593.
[4]HAE D J,HAROLD E,SWAlSGOOD.Disulfide Bond Formation Between Thermally Denatured β-Lactoglobulin and κ-Casein in Casein Micelles[J].Journal of Dairy Science,1990,73(4):900-904.
[5]KIESNER K.Manufacturing of α-Lactalbumin-Enriched Whey Systems by Selective Thermal Treatment in Combination with Membrane Processes[J].Lait,2000,80:99-111.
[6]DAVID J,OLDFIELD.Kinetics of Denaturation and Aggregation of Whey Proteins in Skim Milk Heated in an Ultra-high Temperature(UHT)Pilot Plant[J].Dairy Journal,1998,8:311-318.
[7]HOFFMANN M A M,VANMIL P J J M.Heat-Induced Aggregation of β-Lactoglobulin:Role of the Free Thiol Group and Disulphide Bonds[J].Journal of Agriculture and Food Chemistry,1997,45:2942-2945.
[8]CORREDIG M,DALGLEISH D G.Effect of Temperature and pH on the Interactions of Whey Proteins with Casein Micelles in Skim Milk[J].Food Research International,1996,29:49-50.
[9]RHAM O,CHANTON S.Role of Ionic Environment in Insolubilization of Whey Protein during Heat Treatment of Whey Products[J].Journal of Dairy Science,1984,67:939-947.
[10]OLDFIELD D J,SINGH H,TAYLOR M W,et al.Kinetics of Denaturation and Aggregation of Whey Proteins in Skim Milk Heated in an Ultra-High Temperature(UHT)Plant[J].International Dairy Journal,1998,8:311-317.
Process for producing α-lactalbumin-enriched whey
YAN Xu-dong1a,YIN Rui-jie1b,WANG Cai-yun1a,YUN Zhan-you1a,LI Cui-zhi1b,CHEN Zhong-jun2,LIU Li-jun1b
(1.Inner Mongolia Yili Industrial Group Co.Ltd,a.Technology Center;b.Department of Quality Management,,Huhhot 010080,China;2.College of Food Science and Engineering,Inner Mongolia Agricultural University,Huhhot 010018,China)
A process for producing an α-lactalbumin-enriched fraction from milk was investigated.The ratio of the concentration of α-lactalbumin to β-lactoglobulin is 3.03,which is high enough to meet the level of comerical products.
α-lactalbumin;β-lactoglobulin;heat-treatment
Q935
A
1001-2230(2010)11-0007-04
2010-07-02
国家十一五科技支撑计划资助项目(2006BAD04A06)。
闫序东(1983-),男,硕士,研究方向为乳品加工工艺。
云战友

