耐受氟喹诺酮类药物真菌的筛选
高元钢,向云彬 (长江大学生命科学学院,湖北 荆州 434025)
余之焕,周 全 (湖北省黄石市中医院,湖北 黄石 435000)
吴 兴,刘春垒,余知和 (长江大学生命科学学院,湖北 荆州 434025)
耐受氟喹诺酮类药物真菌的筛选
高元钢,向云彬 (长江大学生命科学学院,湖北 荆州 434025)
余之焕,周 全 (湖北省黄石市中医院,湖北 黄石 435000)
吴 兴,刘春垒,余知和 (长江大学生命科学学院,湖北 荆州 434025)
从氟喹诺酮类药物(FQs)的污染土壤中筛选出37株真菌,其中2株真菌对氧氟沙星、诺氟沙星、盐酸左氧氟沙星和盐酸环丙沙星4种FQs的耐受浓度都可分别达到1 800 μg/mL,且能在同时含有这4种FQs浓度为1 000 μg/mL的培养基中生长。经初步鉴定,这2株真菌分别为杂色曲霉(Aspergillusversicolor)和黑曲霉(Aspergillusniger)。
氟喹诺酮类药物;真菌分离;耐受浓度;残留;土壤污染
氟喹诺酮类药物(fluoroquinolones,FQs)是20世纪70年代发展起来的新型抗感染药物。由于能选择性地抑制细菌的DNA螺旋酶,对革兰氏阳性和阴性菌及支原体有良好的抗菌效果,因此被广泛用于人和其他动物细菌性感染的临床治疗[1]。据统计,1997年FQs在全世界范围内的销售额达30.4亿美元,而且呈逐年增加的态势[2]。在我国,目前诺氟沙星、环丙沙星和氧氟沙星的产量较大,年产量分别为3 500 t、1 500 t和1 200 t左右,约占FQs总产量的98%[3]。
FQs在临床治疗上的大量使用,使环境中FQs残留量也在持续增长。由于大多数FQs具有光稳定、耐高温、难水解和易吸附等理化特性[4,5],残留在环境中的FQs很难自然转化和降解,经生物和非生物作用逐渐累积形成FQs和其部分降解产物的混合物。当环境中FQs残留累积达到一定浓度,不仅会改变土壤的正常结构和功能,促进耐药菌株的进化,影响植物的生长发育,而且可通过食物链影响人体健康[6,7]。
有关土壤中FQs残留物的微生物降解菌的筛选和机理探讨国外仅有零星研究,目前国内尚未见报道[8~10]。微生物对土壤中残留药物降解起着十分重要的作用,研究FQs在土壤中的残留、迁移和降解行为对防治由此造成的环境污染具有重要意义。目前已分离的能降解FQs的微生物主要是真菌[1,11]。本研究旨在从FQs污染严重的土壤中分离出耐受FQs的真菌菌株,并初步探讨其降解FQs的能力,从而为环境检测和保护提供有效依据。
1 材料和方法
1.1 供试材料
(1)土壤样品 FQs污染土壤采自湖北省荆州市沙市区红桥养殖场污水排放地。
(2)培养基 PDA、牛肉膏蛋白胨培养基和高氏1号培养基用于菌株的初步筛选。基础培养基用于复筛与驯化,其配方为KH2PO41.0 g,MgSO4·7H2O 0.5 g,H2O 1 000 mL,pH自然。
(3)FQs 氧氟沙星(ofloxacin,OFL)片剂,江西南昌制药有限公司生产;诺氟沙星(norfloxacin,NOR)胶囊,成都锦华药业有限公司生产;盐酸左氧氟沙星(levofloxacin,LEV)片剂,扬子江药业有限公司生产;盐酸环丙沙星(ciprofloxacin,CIF)片剂,宜昌人福药业有限公司生产。FQs的有效浓度用化学方法标定。
1.2 初步筛选
对土壤样品进行风干、去杂和磨细等处理后混匀,取土壤样品10.0 g置于装有90 mL无菌水的三角瓶中,用振荡器振荡30 min,即成10-1的土样悬液。梯度稀释土样悬液,用涂布平板方式将不同浓度梯度的土样悬液分别涂布在氧氟沙星、诺氟沙星、盐酸左氧氟沙星和盐酸环丙沙星浓度为100 μg/mL的PDA、牛肉膏蛋白胨和高氏1号3种常用培养基的平板上,挑取单菌落分离培养,斜面保藏于4 ℃冰箱中备用。
1.3 复筛与驯化
将初步筛选所分离的菌株在PDA中活化,分别接种至以单一FQ(氧氟沙星、诺氟沙星、盐酸左氧氟沙星和盐酸环丙沙星)为唯一碳、氮源的基础培养基中,FQ初始浓度为200 μg/mL,28 ℃,180 r/min摇床培养5 d,然后依次提高浓度至400、600、800、1 000 μg/mL,观察其生长情况。
此外,将获得的菌株接种在同时含有1 000 μg/mL的氧氟沙星、诺氟沙星、盐酸左氧氟沙星和盐酸环丙沙星的基础培养基中,28 ℃、180 r/min摇床培养5 d,观察生长情况。
1.4 FQs降解菌的形态观察及初步鉴定
根据菌落的大小、形态和颜色等特征及显微观察结果按文献[12]的方法对获得的菌株进行鉴定。
1.5 最适培养条件的测定
因初筛过程发现只有在含有氧氟沙星的培养基中可生长的菌株最多,故将驯化获得的菌株接种至氧氟沙星浓度为300 μg/mL的基础培养基中培养3 d,测定在不同温度、pH和摇床转速下培养的菌体干重。
1.6 FQs对分离菌株生长的影响
将驯化获得的菌株分别接种至氧氟沙星、诺氟沙星、盐酸左氧氟沙星和盐酸环丙沙星浓度为300 μg/mL的基础培养基中,在最适培养条件下培养,3次重复,每隔12 h取菌液测定菌体干重。
1.7 分离菌株对4种FQs耐受浓度的测定
将驯化获得的菌株接种到氧氟沙星、诺氟沙星、盐酸左氧氟沙星和盐酸环丙沙星梯度浓度分别为600、1 000、1 400、1 800、2 200 μg/mL的液体基础培养基中,在最适培养条件下培养3 d,3次重复,测菌体干重。
2 结果与分析

表1 初步筛选获得的菌株Table 1 The primary screening of fungal strains from soil
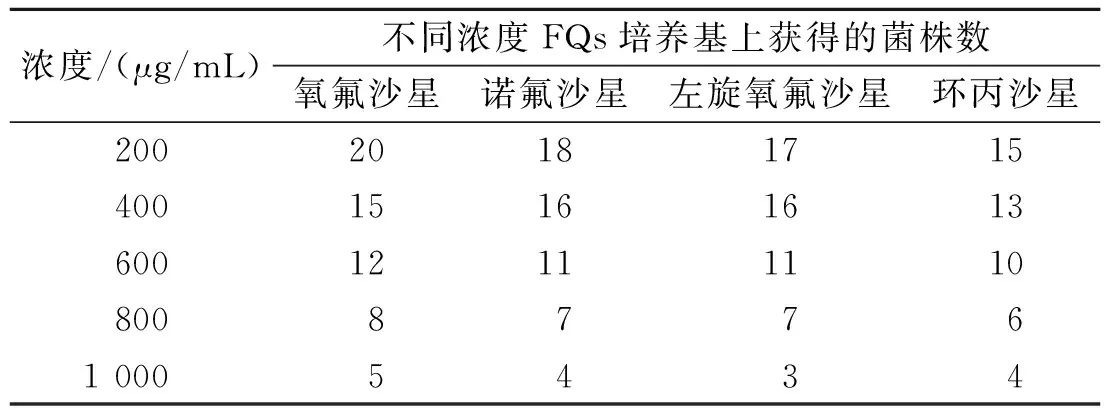
表2 初筛菌株对FQs耐受浓度的差异Table 2 The difference of endurable concentrationof the strains isolated to FQs
2.1 初步筛选
土壤样品分别经浓度为100 μg/mL的氧氟沙星、诺氟沙星、盐酸左氧氟沙星和盐酸环丙沙星的常用培养基上稀释培养后,分离获得一定数量的真菌(表1),未见放线菌和细菌生长。
2.2 复筛与驯化
当FQs浓度为200 μg/mL时,分别获得了15~20株真菌,共37株(表2),已鉴定菌株15株,其中曲霉6种,青霉4种,根霉2种,拟青霉、木霉和毛霉各1种,尚有未鉴定菌株22株。随着FQs浓度的提高,分离得到的菌株逐渐减少。当单一FQ(氧氟沙星、诺氟沙星、盐酸左氧氟沙星和盐酸环丙沙星)浓度分别提高到1 000 μg/mL时,仅分离到3~5种真菌,共6株,它们分别是日本曲霉Aspergillusjaponicus、黑曲霉A.niger、黄曲霉A.flavus、杂色曲霉A.versicolor、根霉Rhizopussp.和产黄青霉Penicilliumchrysogenum(表3)。当培养基中同时含有1 000 μg/mL的氧氟沙星、诺氟沙星、盐酸左氧氟沙星和盐酸环丙沙星时,只有杂色曲霉和黑曲霉形成肉眼可见的菌落。

表3 高浓度FQs条件下耐受菌株筛选Table 3 Isolated strains with tolerance to FQs underthe concentration of 1 000 μg/mL FQs
2.3 最适培养条件的优化
由图1可以看出,分离到的2株真菌杂色曲霉和黑曲霉菌株的培养条件非常相似,在pH 5.0、28 ℃、180 r /min的条件下生长最为旺盛。
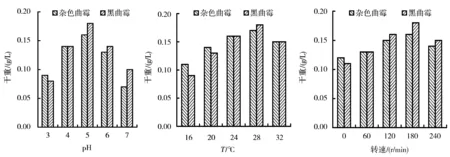
图1 pH、温度、摇床转速对菌株生长的影响Figure 1 Effect of pH, temperature and agitation on the growth of two isolated strains
2.4 FQs对分离菌株生长的影响
由图2A中可以看出,在含氧氟沙星和诺氟沙星的培养基中,杂色曲霉的延滞期较短,最大生长量较高。而在含盐酸左氧氟沙星和盐酸环丙沙星的培养基中,杂色曲霉的延滞期较长,最大生长量相对较低,尤其以盐酸左氧氟沙星的影响最为显著。图2B中,诺氟沙星对黑曲霉的生长影响最小,盐酸左氧氟沙星对其影响最大。

A.杂色曲霉 B.黑曲霉图2 FQs对杂色曲霉和黑曲霉生长的影响Figure 2 Effect of FQs on the growth of A. versicolor and A. niger
2.5 分离菌株对4种FQs的耐受浓度
由图3可以看出,杂色曲霉和黑曲霉对氧氟沙星、诺氟沙星和盐酸环丙沙星的耐受浓度基本相同,而对盐酸左氧氟沙星的耐受浓度明显低于其他3种FQs。当盐酸左氧氟沙星浓度为1 800 μg/mL时,杂色曲霉和黑曲霉几乎不能生长,氧氟沙星、诺氟沙星和盐酸环丙沙星浓度达2 200 μg/mL时,杂色曲霉和黑曲霉也停止了生长。这进一步地说明高浓度的盐酸左氧氟沙星对筛选获得的2株真菌的抑制作用较强。

A.杂色曲霉 B.黑曲霉图3 杂色曲霉和黑曲霉对FQs的耐受浓度Figure 3 The endurable concentration of A. versicolor and A. niger to FQs
3 讨论
近年来,随着工农业生产的快速发展,工农业生产中排放的废水、废气和废渣等对水体和土壤环境的污染日趋严重,引起了社会和科学界的特别关注。关于生态环境中污染物的降解,研究者认为生态系统中普遍存在光解、水解、植物修复和微生物修复等途径,其中光解和水解作用效果相对有限且过程漫长,降解的主要途径是植物修复和微生物修复[13]。因此,在自然生态系统中微生物担负起了环境污染“清洁工”的重任。微生物修复是较为理想的一种治理污染的途径,具有处理费用低、对环境影响小、效率高等优点[14]。目前,有关杀虫剂、除草剂、塑料、洗涤剂和石油烃类等污染物的微生物降解研究颇多。降解谱较广的假单胞菌属的某些菌株能分解90种以上的有机物。对于同一种污染物其降解菌也多种多样,如能够降解石油烃类的微生物有70多个属200余种,其中细菌约有40个属[15]。
本研究从FQs污染的土壤样品中分离筛选出37株真菌,分别属于曲霉、毛霉、木霉、根霉、拟青霉和青霉等属的种类,而未见放线菌和细菌生长。这是因为FQs能选择性地抑制细菌的DNA螺旋酶,低浓度的FQs对真菌几乎没有抑制作用。进一步筛选和驯化,获得2株耐受能力较强的真菌。这2株菌能在同时含有4种FQs浓度为1 000 μg/mL的培养基中生长,经鉴定为杂色曲霉(A.versicolor)和黑曲霉(A.niger),结果似乎说明不同地区筛选的FQs降解菌存在地区性差异。如Martens等[1]在Braunschweig分离到5株能降解恩诺沙星的木腐真菌,它们分别是条纹粘褶菌(Gloephyllumstriatum)、乳白耙菌(Irpexlacteus)、黄孢原毛平革菌(Phanerochaetechrysosporium)、淡黄木层孔菌(Phellinusgilvus)和皱环球盖菇(Strophariarugosoannulata)。同样,Parshikov等[16]在莫斯科近郊筛选出黑曲霉(A.niger)、轮生小克银汉霉(Cunninghamellaverticillata)和简青霉(Penicilliumsimplicissimum)3株真菌,它们能降解氮-已酰吩噻嗪(N-acetylphenothiazine)。同年,Parshikov等[8, 17]又在美国的Arkansas分离到1株拉曼毛霉Mucorramannianus,对环丙沙星和恩诺沙星具有降解作用。在本研究中,杂色曲霉首次从FQs污染的土壤分离得到。
本研究优化了杂色曲霉和黑曲霉的培养条件,为pH 5.0、温度28 ℃、摇床转速180 r /min,同时测定了其对4种FQs的耐受浓度。最适培养条件下,杂色曲霉和黑曲霉对氧氟沙星、诺氟沙星、盐酸左氧氟沙星和盐酸环丙沙星等单一FQ的耐受浓度都达到1 800 μg/mL,远高于环境中存在的FQs浓度[2],这个结果使得应用杂色曲霉和黑曲霉治理FQs污染成为可能。真菌降解FQs的机理非常复杂,国内外仅有零星研究[8~10]。真菌降解FQs代谢产物的分析需借助液相色谱、质谱和核磁共振等仪器,而且不同真菌降解FQs的途径和产物也不相同。如Gloephyllumstriatum降解恩诺沙星的产物经放射性同位素检测为CO2和其他11种代谢产物[11]。环丙沙星经Mucorramannianus的降解后,代谢产物通过LC-MS和1HNMR检测为单一产物氮-已酰环丙沙星[17]。本研究获得的杂色曲霉和黑曲霉菌株降解FQs效率和机理将是进一步开展研究的关注点。
诚挚地感谢中国科学院微生物研究所王龙博士鉴定部分真菌菌株,同时感谢荆州市沙市区红桥养殖场熊三浩场长和长江大学动物科学学院程太平教授在土壤FQs污染调查和样品采集过程中的鼎立帮助。
[1]Martens R,Wetzstein H G,Zadrazil F,etal. Degradation of the fluoroquinolone enrofloxacin by wood-rotting fungi[J]. Appl Environ Microbiol,1996,62:4206~4209.
[2]Picó Y,Andreu V. Fluoroquinolones in soil-risks and challenges[J]. Anal Bioanal Chem,2007,387:1287~1299.
[3]孔维栋,朱永官. 抗生素类兽药对植物和土壤微生物的生态毒理学效应研究进展[J]. 生态毒理学报,2007,(2):1~9.
[4]Thiele-Bruhn S. Pharmaceutical antibiotic compounds in soils[J]. J Plant Nutr Soil Sci,2003,166:145~167.
[5]Turiel E,Martin-Esteban A,Tadeo J L. Multiresidue analysis of quinolones and fluoroquinolones in soil by ultrasonic-assisted extraction in small columns and HPLC-UV[J]. Anal Chim Acta,2006,562:30~35.
[6]Bila D M,Dezotti M. Fármacos no meio ambiente[J]. Quim Nova,2003,26:523~530.
[7]Boxall A B A. The environmental side effects of medication[J]. Embo Rep,2004,5:1110~1116.
[8]Parshikov I A,Freeman J P,Lay J O,etal. Microbiological transformation of enrofloxacin by the fungusMucorramannianus[J]. Appl Environ Microbiol,2000,66:2664~2667.
[9]Pierini E,Famiglini G,Mangani F,etal. Fate of enrofloxacin in swine sewage[J]. J Agric Food Chem,2004,52:3473~3477.
[10]高元钢,向云彬,陈京元,等. 土壤中氟喹诺酮类药物残留的生态效应及归宿[J]. 微生物学通报,2008,35:94~97.
[11]Wetzstein H G,Stadler M,Tichy H V,etal. Degradation of ciprofloxacin by basidiomycetes and identification of metabolites generated by the brown rot fungus[J]. Appl Environ Microbiol,1999,65:1556~1563.
[12]魏景超. 真菌鉴定手册[M]. 上海:上海科学技术出版社,1979. 1~780.
[13]周东美,郝秀珍,薛 艳,等. 污染土壤的修复技术研究进展[J]. 生态环境,2004,13(2):234~242.
[14]曹启民,王 华,郑良永,等. 污染土壤的微生物修复机理及研究进展[J]. 华南热带农业大学学报,2006,(12):29~33.
[15]徐亚同,史家梁,张 明. 生物修复技术的作用机理和应用(上)[J]. 上海化工,2001,(18):4~7.
[16]Parshikov I A,Freeman J P,Williams A J,etal. Biotransformation of N-acetylphenothiazine by fungi[J]. Appl Microbiol Biotechnol,1999,52:553~557.
[17]Parshikov I A,Freeman J P,Lay J O,etal. Regioselective transformation of ciprofloxacin to N-acetylciprofloxacin by the fungusMucorramannianus[J]. FEMS Microbiology Letters,1999,177:131~135.
2008-12-09
湖北省教育厅青年项目(2004Q002);湖北省自然科学基金项目(2004ABA255)
高元钢(1983-),男,湖南衡阳人,理学硕士,主要研究方向为环境微生物学.
余知和,E-mail:zhiheyu@hotmail.com
10.3969/j.issn.1673-1409(S).2009.01.021
X172
A
1673-1409(2009)01-S076-05

