嗜水气单胞菌对盐酸多西环素的耐药性获得与消失速率研究
孟小亮,陈昌福,吴志新,罗宇良 (华中农业大学水产学院,湖北 武汉 430070)
嗜水气单胞菌对盐酸多西环素的耐药性获得与消失速率研究
孟小亮,陈昌福,吴志新,罗宇良 (华中农业大学水产学院,湖北 武汉 430070)
在离体条件下测定了从人工养殖的斑点叉尾鮰患病鱼体上分离的嗜水气单胞菌(Aeromonashydrophila)的4个菌株对盐酸多西环素耐药性获得与消失的速率。结果表明:以25 ℃条件下培养72 h为1代,在含有盐酸多西环素的药物培养基中连续传代9次后,盐酸多西环素对A.hydrophila的最小抑制菌浓度(MIC)上升了31倍,MIC由0.05 mg/L上升至1.56 mg/L;而将已经获得高耐药性的菌株以穿刺法接种在不含药物的BHI(Difco)琼脂培养基中,以4 ℃条件下保存20 d为1代,连续传代5次,供试菌株的耐药性呈现逐渐消失的趋势,至第5次传代后,其MIC由1.56 mg/L下降至0.10 mg/L。
嗜水气单胞菌(Aeromonashydrophila);盐酸多西环素;耐药性;获得;消失
对人工养殖的斑点叉尾鮰能造成严重危害的致病菌种类较多。如嗜水气单胞菌(Aeromonashydrophila)能引起细菌性败血症(haemorrhagic septicemia of channel catfish),叉尾鮰爱德华菌(Edwardsiellaictaluri)能引起肠道败血症(enteric septicaemia of catfish,ESC),柱状嗜纤维菌(Cytophagacolumnaris)能引起柱形菌病(columnaris disease of channel catfish)等[1]。对于由致病细菌引起的疾病大多采用各种抗生素类药物进行治疗[2]。但是,在同一个养殖水体中多次使用同种抗生素会导致病原菌耐药性增加,使药物治疗斑点叉尾鮰的细菌性疾病变得越来越困难[3]。此外,抗菌药物的大量使用还可能造成养殖鱼体内的药物残留超标,甚至引起公共卫生方面的问题[4]。
各种致病菌对不同种类的抗生素产生耐药性的机制不同,而且产生速度和消失速率也是有所不同的[5]。了解致病菌对抗生素的产生和消失速率,是决定抗生素药物的使用程序和方法的基础。在对人工养殖斑点叉尾鮰(IctaluruspunctatusRafinsque)的细菌性疾病治疗的过程中,盐酸多西环素是常用药物,而由嗜水气单胞菌(Aeromonashydrophila)引起的细菌性败血症是人工养殖斑点叉尾鮰的多发病。本研究在离体条件下,检测了从患病斑点叉尾鮰鱼体上分离的A.hydrophila菌株对盐酸多西环素的耐药性获得与消失速率,旨在为制定抗生素类药物在水产养殖动物疾病治疗中的科学用药程序提供基础资料。

表1 供试菌株的来源Table 1 Strains for test
1 材料与方法
1.1 材料
供试药物盐酸多西环素(Oxytetracycline HCl)由Rochi生产,批号为081226。供试菌株为2007年6月至7月从湖北省长阳和宜都清江内人工网箱饲养的患病斑点叉尾鮰分离的A.hydrophila的BH-002、BH-015、BH-017和BH-019 4个菌株。菌株分离的时间、地点和病鱼器官详细见表1。
1.2 试验方法
(1)供试菌株最小抑菌浓度的测定 按照日本化学疗法学会制定的标准法[6],首先将盐酸多西环素采用2倍稀释法分别稀释至1 000~0.25 mg/L的13个浓度。然后用FWA培养基[7]将各浓度的药物液稀释10倍,从而使培养基中各种药物的浓度达到100~0.025 mg/L的2倍稀释的13个浓度。最后向每支盛有3.0 mL FWA培养基的试管中加入0.10 mL浓度约为1.2×107cfu/mL活菌液(比浊法测定),即最终细菌浓度为4×105cfu/mL。在25 ℃条件下培养72 h,经肉眼观察证实无细菌生长的试管中的最低药物浓度,即为药物的最小抑菌浓度(minimum inhibitory concentration,MIC)。
(2)供试菌株耐药性获得速率的测定 在上述测定盐酸多西环素对A.hydrophila的MIC的试管中,从肉眼观察有细菌生长的最高药物浓度的试管中吸取0.1 mL培养基,将其接种在含有不同浓度盐酸多西环素的FWA培养基试管中,在25 ℃条件下培养72 h,从经肉眼观察证实有细菌生长的最高药物浓度的试管中,吸取培养基分别按照前述的方法测定盐酸多西环素对其中A.hydrophila的MIC。相同的操作连续进行9次,使A.hydrophila在含有盐酸多西环素的药物培养基中传代9次,将最后测定的MIC与最初的MIC比较,评价菌株对盐酸多西环素耐药性获得速率。
(3)供试菌株耐药性消失速率的测定 将在药物培养基中经过连续传代9次证明其均已经获得较高耐药性的A.hydrophila4个菌株,以琼脂内穿刺法将菌株分别接种在盛有不含盐酸多西环素的BHIA(Difco)培养基的试管中,在4 ℃条件下保存,每间隔20 d以同样的方法传代1次,连续传代5次。按照前述的方法测定盐酸多西环素对每次传代后培养基中A.hydrophila的MIC。将对传代5次后测定的MIC与最初的MIC比较,评价菌株对盐酸多西环素耐药性消除速率。
2 结果与分析
2.1 供试菌株对盐酸多西环素的敏感性
盐酸多西环素对A.hydrophila4个菌株MIC的测定结果如表2所示。由表2可知,盐酸多西环素对4个菌株的MIC均为0.10 mg/L。
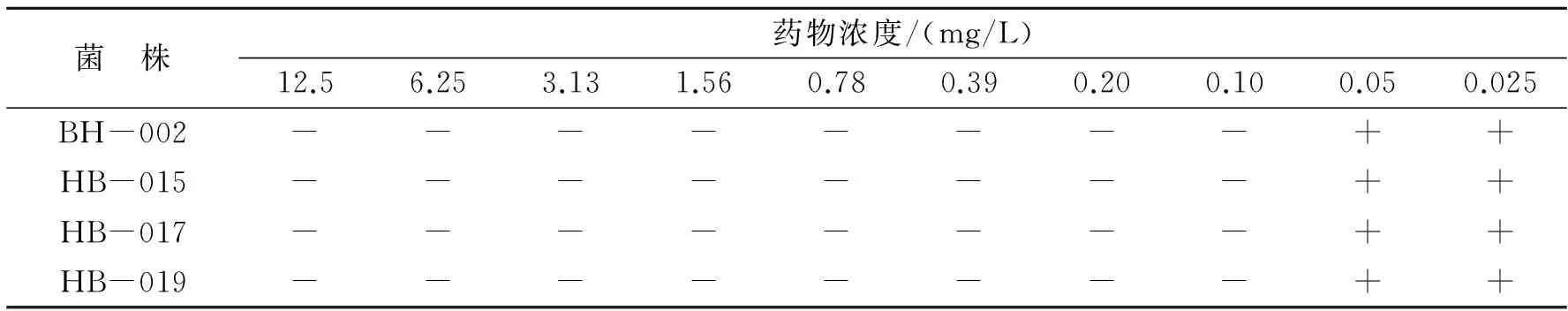
表2 叉尾鮰爱德华菌对盐酸多西环素的敏感性Table 2 Susceptibity of Edwardsiella ictaluri to oxytetracycline
注:“+”表示耐药;“-”表示敏感。
2.2 供试菌株对盐酸多西环素耐药性获得速率
A.hydrophila的4个菌株经过连续9次在带有盐酸多西环素的培养基中传代培养,菌株对盐酸多西环素耐药性变化的情况如表3所示。由表3可以看出,4个菌株在含有盐酸多西环素的培养基中传代9次后,均获得了比较强的耐药性,MIC由0.05 mg/L上升到了1.56 mg/L。
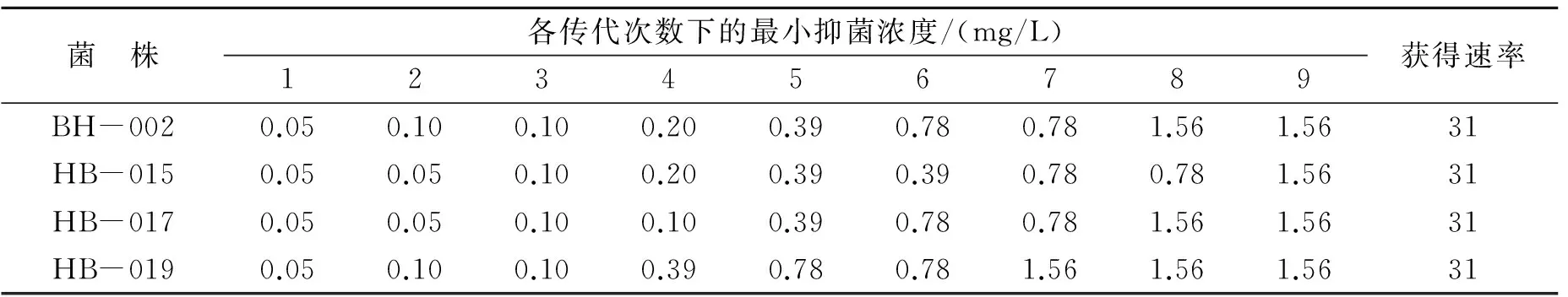
表3 叉尾鮰爱德华菌对盐酸多西环素耐药性获得速率Table 3 Development of drug-resistance of Edwardsiella ictaluri to oxytetracycline
2.3 供试菌株对盐酸多西环素耐药性消失速率
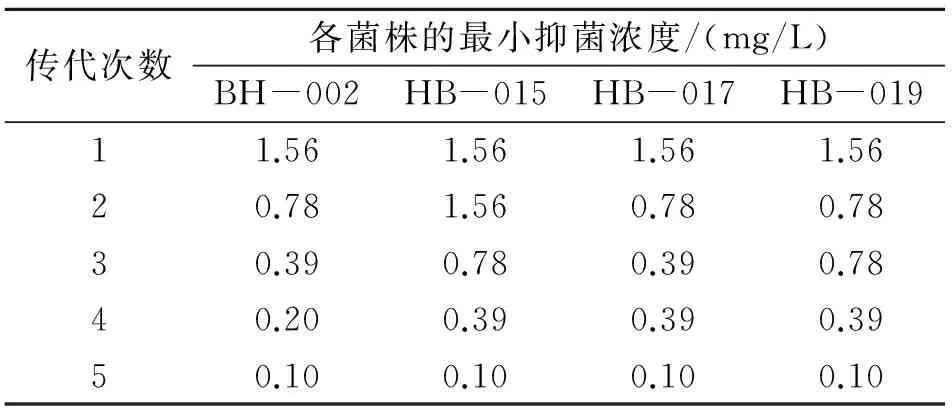
表4 叉尾鮰爱德华菌对盐酸多西环素耐药性消失速率Table 4 Reversion of acquired drug-resistanceof Edwardsiella ictaluri to oxytetracycline
将获得了较强耐药性A.hydrophila的4个菌株在不含盐酸多西环素的BHIA(Difco)培养基中连续5次传代培养后,菌株对盐酸多西环素耐药性变化的状况如表4所示。由表4可以看出,4个菌株在不含有盐酸多西环素的培养基中经过传代5次,耐药性逐渐消失,MIC由1.56 mg/L下降到了0.10 mg/L。
3 讨论
在我国,现在已经有比较多的抗生素类药物被批准作为水产动物细菌性疾病的治疗药物(已经获得农业部批准生产的抗生素类渔药达到25种)。但是,这些药物从渔药生产企业用于申请生产许可证的技术资料,到渔药被水产养殖者使用的各个环节都还存在一些问题。如渔药企业在申请生产某种抗生素药类渔药时,所提供的申请技术资料大多只有药物对某些水产动物致病菌的抑、杀菌效果的相关实验结果,而没有提供药物的在对水产养殖动物使用的过程中,致病菌对药物耐药性产生变化的相关实验结果;又如由于我国的水产兽医制度尚未建立起来,水产养殖业者在选择某种渔药作为水产养殖动物疾病治疗药物时,因为没有针对致病菌(从需要用药的患病水产动物体内分离的致病菌)的药物敏感性实验结果作为选择渔药和使用剂量的依据,就只能根据渔药生产企业提供的使用说明书选择药物和决定药物的使用剂量。
然而,致病菌对抗生素类药物的敏感性是可以随着接触药物次数而变化的,接触某种抗生素的次数越多,致病菌对这种抗生素产生耐药性就越强[8]。楠田等[8]在五条鰤(Seriolaquinqueradiata)养殖现场分离大量的杀鱼巴斯德菌(Pasteurellapiscicida)菌株进行药物敏感性测定结果表明,该菌对多种抗生素产生的耐药性程度是不相同的。楠田等[9]利用离体培养的方法观察P.piscicida对安比西林(ampicillin)和氯霉素(chloramphenicol)耐药性获得与消失速率的结果表明,P.piscicida在含有药物的培养基中经过10次传代培养,供试菌对安比西林的耐药性上升了4~8倍,而对氯霉素的耐药性上升了4倍。本研究观察了A.hydrophila对盐酸多西环素耐药性在离体培养过程中的变化,结果证明A.hydrophila在含有盐酸多西环素培养基中经过9次传代后,供试菌株对盐酸多西环素的耐药性就上升了31倍。这究竟是因为A.hydrophila容易对抗生素药物产生耐药性,还是盐酸多西环素容易诱导A.hydrophila等水产动物致病菌耐药性的生成,尚值得进一步研究。
为了避免水产动物致病菌产生耐药性,水产养殖业者在选择抗生素类药物作为治疗水产动物传染性疾病治疗药物时,应该从患病动物体内分离致病菌并测定致病菌对拟选药物的敏感性,只有在获得各种抗生素类药物对致病菌的MIC的基础上,渔药的使用者才有可能做到正确选择药物和决定药物的准确用量,否则,就有可能因为不知道致病菌对不同种类抗生素耐药性的变化背景,而造成实际上的盲目用药。
水产养殖动物的传染性疾病一旦发生,病程发展速度就比较快,而从患病鱼体中分离病原菌并完成药物敏感测定的试验是需要一定的时间的,养殖业者往往担心做这样的试验会贻误对疾病治疗的时机。为了防止这种情况的发生,养殖业者可以通过做好养殖日记的方法,避免将同类抗生素类药物在同一个养殖环境中多次使用,当饲养的水产动物发生疾病时可以选择与以前选用的药物不同而且致病菌不会产生交叉耐药性的药物;也可以在养殖过程中定期检测养殖水产动物体内携带的致病菌对各种抗生素类药物敏感性的变化,只有掌握了养殖水体和水产养殖动物体内致病菌对各种药物耐药性的变化状况,才有可能做到对症用药和科学用药,否则,用药种类的选择、剂量的控制以及用药程序的决定等就必然会带有盲目性。
[1]陈昌福. 斑点叉尾鮰的主要疾病与防治对策[J]. 科学养鱼,2004,(1):16~17.
[2]杨先乐. 新编渔药手册[M]. 北京:中国农业出版社,2005.113~115.
[3]邹金虎,汪成竹,陈昌福. 防治斑点叉尾鮰细菌病的药物筛选及野外治疗效果[J]. 水利渔业,2007,39(3):35~38.
[4]郑天凌,陈 瑛,李福东,等. 控制对虾细菌病药物的实验研究[J].水产学报,1994,18(4):215~219.
[5]陈代杰. 抗菌药物与细菌耐药性[M]. 上海:华东理工大学出版社,2001.122~234.
[6]日本化学疗法学会. 最小发育阻止浓度の测定方法[J]. 化学疗法,1975,23(8):1~2.
[7]吉水守,木村乔久,坂井埝. サケ科鱼类の肠内细菌丛に关する研究—Ⅰ. 饲育鱼の肠内细菌と细菌丛[J]. 日本水产学会志,1976,42(1):91~99.
[8]楠田理一,板冈睦,川合研儿. 1984年および1985年に养殖ブリから分离されたPasteurella piscicida药剂感受性[J]. 日本水产学会志,1988,54(9):1521~1526.
[9]楠田理一,井上喜久治. 养殖ハマチ类结节症に对するアンピシリンの水产药としての应用に关するる研究—Ⅰ. 类结节症に对するin vitroでの抗菌力、耐药获得および耐性消失[J]. 日本水产学会志,1976,42(9):969~973.
2008-11-13
农业部疫情检测项目(2130108);农业公益性行业科研专项经费资助项目(200803013)
孟小亮(1984-),男,江苏宿迁人,硕士研究生,主要从事水产养殖和鱼病防治研究.
陈昌福,E-mail: chenchangfu@mail.hzau.edu.cn
10.3969/j.issn.1673-1409(S).2009.01.013
S917.1
A
1673-1409(2009)01-S042-03

