沙丁胺醇时间分辨荧光免疫分析检测技术的研究
何明祥 (福建省福清市产品质量检验所,福建 福清 350300)
沙丁胺醇时间分辨荧光免疫分析检测技术的研究
何明祥 (福建省福清市产品质量检验所,福建 福清 350300)
采用包被二抗间接竞争法,以抗SAL二抗体包被96微孔板作为固相二抗,与游离SAL间接竞争限量的以Eu3+标记的SAL-OVA抗原,建立解离增强模式的荧光免疫分析体系检测沙丁胺醇(SAL),以利用时间分辨荧光免疫分析( TRFIA) 技术建立快速、高灵敏度的沙丁胺醇(SAL) 全自动检测方法。结果表明该法的灵敏度为0.04 ng/mL,批内和批间变异系数分别为2.2%和8.7%,平均回收率为106.5%,与盐酸克伦、莱克多巴胺的交叉反应率分别为0.93%和0.73%。由此可见,用TRFIA法检测SAL, 灵敏度高、特异性强、稳定性好,具有良好的应用前景。
沙丁胺醇;检测技术;时间分辨荧光免疫分析
沙丁胺醇(Salbutamol,SAL)又名舒喘宁,是一种人工合成的β2-肾上腺素受体激动剂,对心脏有刺激,久用会导致严重的心率失常,甚至猝死,对人类健康有一定危害。加大使用剂量后,能增强对呼吸系统和中枢神经系统的刺激,提高其速度,可作为兴奋剂使用[1]。20世纪80年代研究表明β2-兴奋剂,此类药物对动物具有促进骨骼肌生长、减少脂肪蓄积、提高胴体部分肉脂比的营养再分配作用,因而被国内外不少养殖场非法用作饲料添加剂,其中盐酸克伦特罗(CBL)和沙丁胺醇是最常被滥用的2种。随着各国政府对CBL监控力度的加大,不法分子不得不寻找新的替代品,SAL成为继CBL之后的营养再分配剂的首选品[2]。近年来,动物性产品中SAL 残留对人类健康造成的危害和对生态食物链所造成的破坏已经引起高度重视,关于CBL、SAL残留引起的中毒事件和负面影响事件不胜枚举[3],深入了解SAL在动物体内的代谢、吸收、残留特点及SAL残留检测方法对广大消费者、研究人员及执法部门具有重要意义[4]。
目前,检测SAL 残留的方法主要有:高效液相色谱法(HPLC) 、气相色谱-质谱法(CG-MS) 、液相色谱-质谱法(LC-MS) 、毛细管区带电泳法(CE)以及免疫分析方法(IA)[5]。仪器检测法精度高,且假阳性率低;但是存在样品前处理繁琐、检测时间长、需要贵重仪器、难于操作、价格昂贵等缺点。免疫分析法检测特异性好、灵敏度高。目前用于检测SAL的免疫分析技术主要有放射免疫分析技术(RIA) 、胶体金免疫分析(ICG) 、酶免疫分析(EIA) 、免疫亲和色谱法(IAC) 以及生物传感器检测法(BS) 等,但均存在着缺点。时间分辨免疫荧光检测法(Time-resolved fluoroimmunoassay,TRFIA) 用三价稀土离子及其螯合物作为示踪物,代替荧光物质、同位素、酶和化学发光物质,标记抗原、抗体、核酸探针等物质。当免疫反应发生后,根据荧光强度和相对荧光强度比值,判断反应体系中分析物的浓度,达到定量分析的目的[6]。该方法具有测量灵敏度高、操作简便、示踪物稳定、定量分析量程宽、无放射性污染和应用范围广等优点,因此越来越多地应用于疾病诊断、疗效观察等医学研究领域[7],但在食品安全监控方面的应用甚少。因此,笔者采用Eu3+标记的抗SAL 单克隆抗体,开展了SAL时间分辨荧光免疫分析方法的研究,现将结果报道如下。
1 材料与方法
1.1 材料
沙丁胺醇、盐酸克伦特罗、莱克多巴胺含量均大于99%,由华南农业大学动物科学院提供;SAL-卵血清蛋白偶合物、抗SAL单克隆抗体为华南农业大学质量安全实验室自制; 96 孔微量反应板为雷博公司产品;纯化离心柱(30 ku) 为美国Minipore 公司产品;阴性猪尿样为广州市兽药监督所提供;其他试剂均为国产分析纯。
恒温振荡器:上海智城分析仪器制造有限公司;1-13 型快速离心机:Sigma 公司;1575 型洗板机:Bio-RAD 公司;微量可调移液枪:吉尔森公司;微量振荡器:江苏康健医疗用品有限公司;1235 型TRFIA 全自动分析仪:Wallac 公司。
1.2 方法
(1)SAL标准液的配制 SAL以标准品稀释液配制成质量浓度为20 μg/mL的溶液,稀释到500 ng/mL作为贮备液,使用前配成质量浓度梯度为0、1.0、5.0、10.0、20.0、50.0 ng/mL 的SAL标准品工作液。
(2)SAL 抗原的纯化及标记 将0.5 mg SAL-OVA抗原加入到纯化离心柱中,8 000 r/min离心5~6 min,加入200 μL 标记缓冲液,离心、弃滤液,再加入200 μL 标记缓冲液,按上述方法离心重复5 次。将离心后的离心管取出,弃滤液,再将离心柱反转,2 000~3 000 r/min 离心1 min,收集滤液,即为待标记抗原。铕标记抗原的方法参照文献[7]。
(3)抗SAL单克隆抗体(第二抗体)最佳包被浓度的选择 将二抗以PBS缓冲液分别稀释至2、5、10、15 μg/mL,每一浓度作一横列,4 ℃冰箱过夜,次日室温平衡后洗板1次,以封闭液室温封闭1 h,洗板3次,于无尘吸水纸上拍干,不同浓度的包被板中每孔加入50 μL系列浓度标准品和100 μL铕标记抗原溶液(以分析缓冲液稀释200倍)及100 μL抗SAL单克隆抗体(以分析缓冲液稀释1 000倍),每孔作一重复,室温振荡1 h,洗板6次拍干,加增强液200 μL,振荡5 min,测荧光值作曲线,确定二抗最佳包被浓度。
(4)铕抗原最佳稀释倍数的选择 以二抗最佳包被浓度包被的固相二抗板,每孔加入标准品和分别稀释100、200、400、800倍的铕标记抗原溶液100 μL及抗SAL单克隆抗体100 μL(以分析缓冲液稀释1 000倍),以下操作同(3),确定铕抗原最佳稀释倍数。
(5)抗SAL单克隆抗体最佳稀释倍数的选择 以二抗最佳包被浓度的包被板,每孔加入标准品和100 μL最佳稀释倍数的铕标记抗原溶液及100 μL分别稀释300、600、1 200、2 400倍的SAL单克隆抗体溶液,以下操作同(3),确定抗SAL单克隆抗体的最佳稀释倍数。
(6)最佳反应时间的选择 在包被好的板条中,加入系列浓度标准品50 μL 和100 μL最佳稀释倍数抗SAL单克隆抗体溶液及最佳稀释度的铕标抗原溶液200 μL,室温分别孵育0.5、1.0、1.5、2.0 h,以下操作同(3),确定最佳反应时间。
一步法:以二抗最佳包被浓度的包被板,每孔加入标准品和100 μL最佳稀释倍数的铕标记抗原溶液及100 μL最佳稀释倍数的SAL单克隆抗体溶液,以下操作同(3)。
二步法:以二抗最佳包被浓度的包被板,每孔加入标准品和100 μL最佳稀释倍数的SAL单克隆抗体溶液,室温振荡反应1 h后,再加入100 μL最佳稀释倍数的铕标记抗原溶液,再次室温振荡反应1 h后,洗板,加增强液,最后测荧光值作抑制曲线。
(7)抗原稀释液的选择 分别以Tris-HCl(pH7.2,0.01 mol/L) 、PBS(pH 6.0,0.01 mol/L) 、PBS(pH7.0,0.01 mol/L) 、PBS(pH 8.0,0.01 mol/L) 4 种缓冲液将铕标抗原稀释相同的倍数,室温孵育1.0 h,以下操作同(3),确定最佳稀释液。
(8)最佳反应体系的选择 在包被好的板条中,分别加入标准品50 μL 和铕标记抗原100 μL,即150 μL 反应体系(体系Ⅰ);标准品100 μL 和铕标抗原100 μL,即200 μL 反应体系(体系Ⅱ);加入标准品50 μL 和铕标记抗原200 μL,即250 μL 反应体系(体系Ⅲ),室温孵育1.0 h,洗板拍干后,根据各反应体系的最终反应体积分别加入增强液150 μL 和200 μL,振荡5 min 后测荧光值,作曲线,确定最佳反应体系。
(9)TRFIA 标准曲线的建立、样品测定及考核 采用最佳条件操作,在1235 型TRFIA 全自动分析仪上测荧光值,得到标准曲线。同时,作SAL 为零浓度的孔12个,以零剂量点计数率(cps) 均值减2 s后的计数率在标准曲线上得到的相应浓度值为检测的灵敏度[8]。将高、中、低3 个已知浓度的SAL标准品溶液添加到阴性尿样中,检测后计算添加回收率,各测3 次,计算平均值。计算公式为:
加标回收率(%) = (分析样品测得量-阴性样品测得量) /加标量×100
以系列浓度的SAL 及沙丁胺醇、莱克多巴胺两种近似抗原分别作竞争抑制曲线,计算各自的结合率,求出各自在IC50时的浓度,按下式计算交叉反应率。
交叉反应率(%)=IC50时抗原浓度/IC50时近似抗原物质的浓度×100
方法的精密度以批内误差和批间误差来表示。
2 结果与分析
2.1抗SAL单克隆抗体(第二抗体)最佳包被浓度的选择
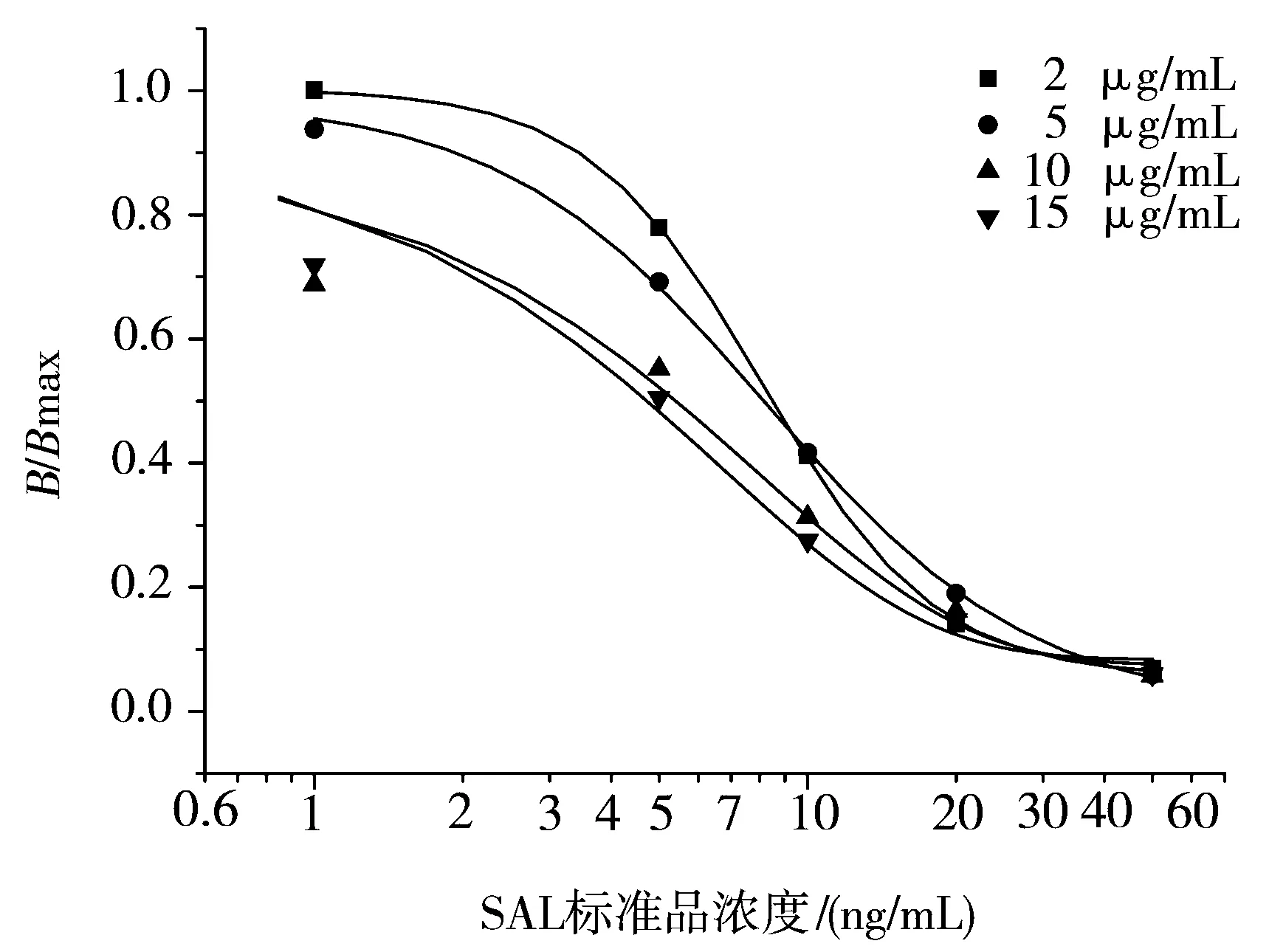
图1 不同二抗包被浓度的TRFIA抑制曲线Figure 1 TRFIA’s inhibitory curves for different coating concentration of secondary antibodies
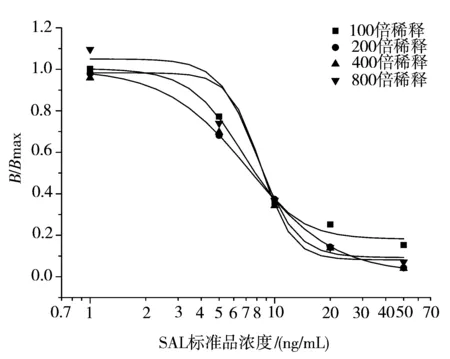
图2 不同铕标记抗原稀释度的TRFIA抑制曲线Figure 2 TRFIA’s inhibitory curves for different antigens dilutions with labels
不同二抗包被浓度下的TRFIA抑制曲线如图1所示,10 μg/mL和15 μg/mL的包被浓度下,IC50分别为4.8、4.6 ng/mL,考虑到实际应用中的成本,选择10 μg/mL为二抗最佳包被浓度。
2.2 铕抗原最佳稀释倍数的选择
不同铕标记抗原稀释度条件下,TRFIA抑制曲线如图2所示,400和800倍稀释时,IC50较好,为8.7 ng/mL,且没有差异。但800倍稀释时,荧光值偏低,选择400倍稀释为铕标记抗原的最佳浓度。
2.3 抗SAL单克隆抗体最佳稀释倍数的选择
不同抗SAL单克隆抗体浓度条件下,TRFIA抑制曲线如图3所示,1 200和2 400倍稀释时,IC50分别为4.07和3.29 ng/mL。但抗体2 400倍稀释时,荧光值过低,故选择1 200为抗体最佳稀释倍数。
2.4 最佳反应时间的选择
不同反应时间所得到的抑制率如表1 所示。虽然室温孵育0.5 h 与孵育1.0 h 计算得到的抑制率相差不大,但孵育1.0 h 后荧光值趋于稳定(荧光值略),说明反应充分,故选择反应时间为1.0 h。
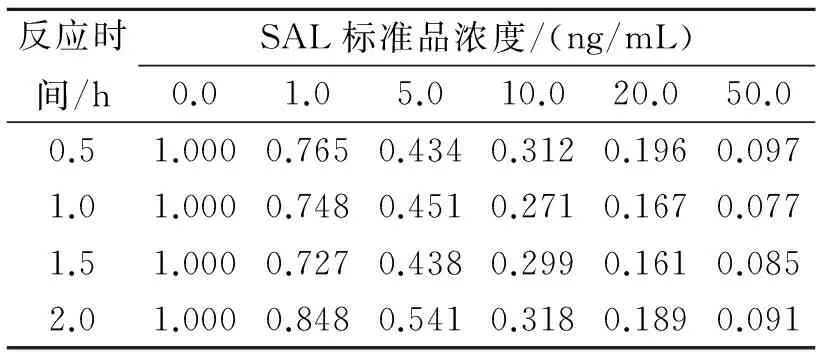
表1 不同反应时间的TRFIA抑制率Table 1 The TRFIA’s inhibitory rate ofdifferent reaction times
一步法同二步法的TRFIA抑制曲线如图4所示,经比较,两者的IC50在0.05置信区间内无显著差异,所以可选择一步法作为最佳反应方式。
2.5 抗原稀释液的选择
本实验抗原抗体反应对pH 值较为敏感,实验结果如图5 所示。pH 中性条件下反应充分,IC50较理想。故宜选择pH 7.0(0.01 mol/L)的PBS作抗原稀释液。
2.6 最佳反应体系的选择
结果见图6所示,体系Ⅰ(A)与体系Ⅲ(C)抑制效果相差不大,但体系Ⅲ各点荧光值较低(荧光值略),主要是因为SAL 标准液的增加使游离SAL 与抗SAL单克隆抗体结合的机会增加,因而结合在固相二抗上的SAL单克隆抗体减少,荧光值相应就会降低。故选用体系Ⅰ为最佳反应体系。
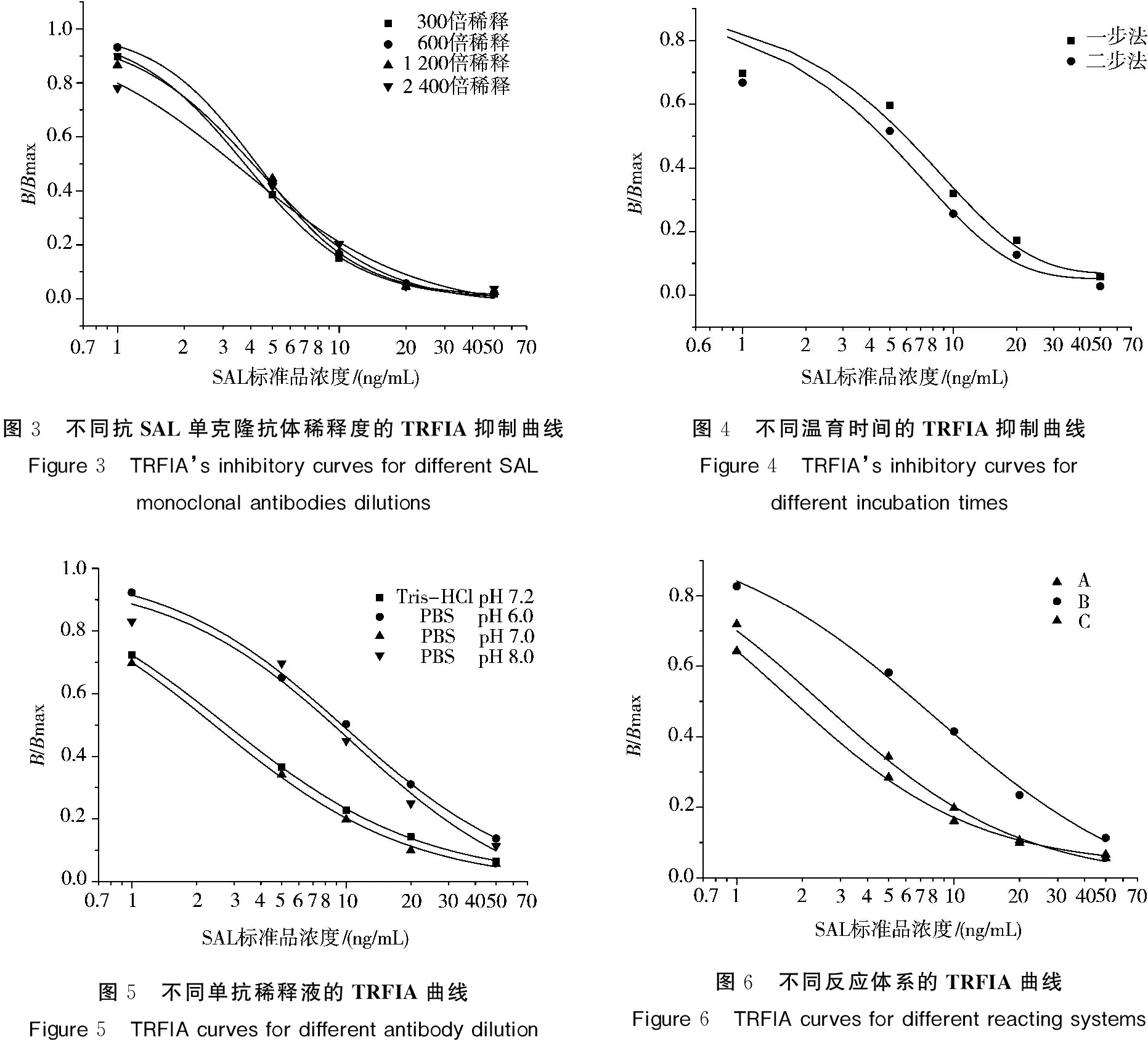
图3 不同抗SAL单克隆抗体稀释度的TRFIA抑制曲线Figure3 TRFIA’sinhibitorycurvesfordifferentSALmonoclonalantibodiesdilutions图4 不同温育时间的TRFIA抑制曲线Figure4 TRFIA’sinhibitorycurvesfordifferentincubationtimes图5 不同单抗稀释液的TRFIA曲线Figure5 TRFIAcurvesfordifferentantibodydilution图6 不同反应体系的TRFIA曲线Figure6 TRFIAcurvesfordifferentreactingsystems
2.7 TRFIA 标准曲线的建立、样品测定及考核
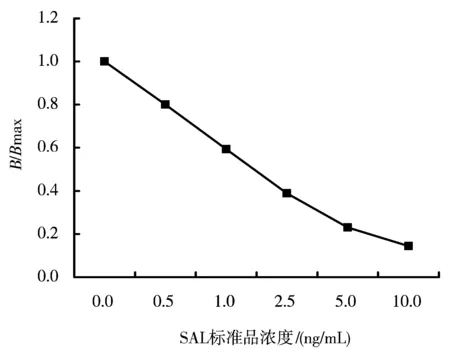
图7 TRFIA最佳模式检测SAL的标准曲线Figure 7 The standard curve of SAL with TRFIA test under optimum mode
实验过程中发现,标准品的质量浓度调整为0、0.5、1.0、2.5、5.0、10.0 ng/mL,曲线的线性好,故标准曲线采用以上各浓度点。最佳条件下,在Wallac1235 型TRFIA 全自动分析仪上得到TRFIA法测定SAL 的标准曲线,如图7 所示。
(1)灵敏度 间接竞争TRFIA 测SAL方法的灵敏度为0.04 ng/mL,曲线的相关系数达0.99 以上,说明方法的线性关系较好。
(2) 精密度和特异性 TRFIA 检测SAL 方法在0~10 ng/mL 质量浓度之间的批内和批间变异系数分别为2.2%和8.7%,与沙丁胺醇、莱克多巴胺交叉反应率分别为0.93%和0.73%,说明方法精密度良好,特异性强。
(3) 加标回收率 由标准曲线测得的结果,计算得到方法的平均加标回收率为106.5%,如表2所示。
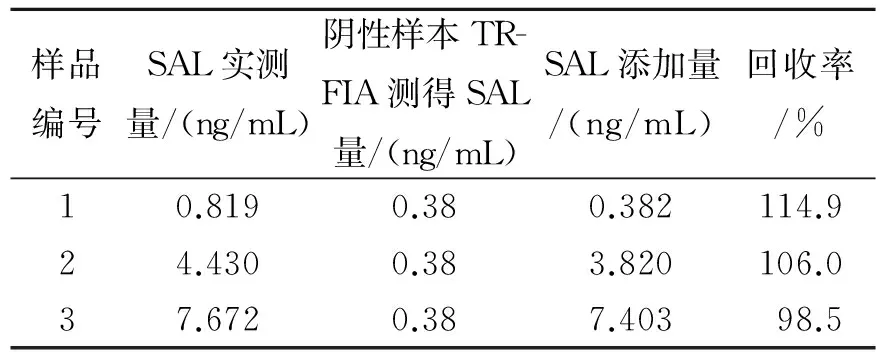
表2 TRFIA检测SAL方法的加标回收率Table 2 The recovery with standardaddition of SAL method with TRFIA test
3 小结与讨论
本研究以沙丁胺醇为研究对象,采用包被抗原间接竞争法,建立了时间分辨荧光免疫分析的检测方法。经试验,其最佳条件为:以10 μg/mL 抗SAL单克隆抗体(第二抗体)包被96微孔板作为固相二抗,SAL标准品50 μL、Eu3+标记抗原(400倍稀释) 100 μL竞争限量抗SAL单克隆抗体(1 200倍稀释)100 μL与固相二抗结合成免疫复合物,一步反应,反应时间1 h,反应体系缓冲液采用PBS(pH 7.0),建立解离增强模式的荧光免疫分析体系检测SAL。该方法的灵敏度为0.04 ng/mL,批内和批间变异系数分别为2.2%和8.7%,平均回收率为106.5%,与盐酸克伦特罗、莱克多巴胺的交叉反应率分别为0.93%和0.73%,方法特异性良好。
采用TRFIA 技术进行SAL检测的方法尚未见报道。国内采用气质联用(GC-MS) 方法作为SAL的确证方法,此法最低检测限为1.0 ng/mL;毛细管区带电泳法(CE) 以及放射免疫分析技术(RIA) 最低检测限为0.5 ng/mL[9];直接竞争ELISA 检测SAL残留量,最低检测限为0.05 ng/g; 本研究建立的TRFIA方法灵敏度为0.04 ng/mL,且反应时间仅需1 h,操作步骤简便。
TRFIA 是以荧光读数为分析基础,零剂量SAL的荧光值越高,灵敏度提高的可能性就越大。由于采用以铕直接标记SAL-OVA抗原,要提高荧光值就必须提高铕标SAL-OVA抗原的量,而对于固相二抗和游离抗原竞争抗体上的结合位点来说,抗原量的增加有可能减弱这种竞争力,对方法的灵敏度产生不利影响,所以如何在保持高灵敏度的条件下提高荧光值,还需要从铕标记效率的提高以及增强液的质量或竞争分析模式方面作进一步的研究。
[1]李 颖.沙丁胺醇单克隆抗体的制备与ELISA检测方法的初步建立[D].长春:吉林农业大学,2006.
[2]朱绍棠,徐友宣,张建丽.禁用药物β_2-激动剂的分析研究[J].中国运动医学杂志,2003,2(5):47~50,70.
[3]潘利华,孙文伟. 固相时间分辨荧光免疫标记技术研究[J].光谱学与光谱分析,2004,24(12):1601~1604.
[4]Harma H,Lovgren T,Lovgren T. Europium nanoparticles and time-resolved fluorescence for ultrasensitive detection of prostate-specific antigen[J]. Clinical Chemistry,2001,47:561~568.
[5]雷红涛,高秀洁,潘 科,等.盐酸克伦特罗时间分辨荧光免疫检测方法的建立[J].中国食品学报,2006,3(6):6~10.
[6]李振甲,陈泮藻,高 平,等.时间分辨荧光分析技术与应用[J].北京:科学出版社,1996.102~103.
[7]田 振,郭周义,贾雅丽.时间分辨荧光免疫分析及其在临床检测中的应用[J].激光生物学报,2002,11(4):290~295.
[8]王永成,唐 棣,常文保,等.时间分辨荧光免疫分析法间接测定雌二醇[J].分析科学学报,2001,17(2):89~93.
[9]黄 飚,陶文沂,张莲芬,等.赭曲霉毒素A的高灵敏时间分辨荧光免疫分析[J].生物化学与生物物理,2005,32(7):662~666.
[10]刘 欣.人尿中沙丁胺醇的测定[J].药学学报,1994,29(6):454~458.
[11]陈 孝,赵香兰.一种简易的检测人体血浆中沙丁胺醇浓度的HPLC法[J].药物分析杂志,1998,12(2):98~100.
[12]袁利鹏,孙远明,雷红涛,等.沙丁胺醇人工抗原合成及鉴定研究[J].中国食品学报,2006,27(12):276~279.
2008-10-10
国家“863”计划项目(2006AA10Z447)
何明祥(1976-),男,福建福清人,工学硕士,工程师,研究方向为食品安全与检测.
10.3969/j.issn.1673-1409(S).2009.01.011
X836;X839.2
A
1673-1409(2009)01-S033-05

