MDM2在结肠黏膜癌变过程中的表达和意义
陈 江 李建蓉 陈任生 何星星
[摘要]目的 探讨MDM2在结肠黏膜癌变过程中的表达和意义。方法 应用免疫组化方法检测MDM2在正常结肠黏膜、结肠腺瘤和结肠腺癌中的表达。结果 DM2在正常结肠黏膜、结肠腺瘤、结肠腺癌中的阳性表达率逐步升高,分别为10%(2/20)、81.8%(18/22)、98.5%(65/66),组间比较差异均有显著性 (P<0.05)。MDM2的表达强度和结肠腺癌的分化程度无相关性(P>0.05)。结论 DM2参与结肠黏膜向癌组织演变的过程,并在早期发挥重要作用。
[关键词]MDM2;结肠腺瘤;结肠腺癌
[中图分类号]R735.3+5 [文献标识码] A [文章编号]1004-8650(2009)10-04-03
结肠癌是常见的消化道肿瘤,近年来其发病率有增加趋势。结肠腺瘤是癌前病变,和结肠癌发生密切相关。目前认为,正常结肠黏膜-结肠腺瘤-结肠癌这一演变过程,是由癌基因和抑癌基因的异常表达积累导致的。MDM2是近来发现的癌基因,和肿瘤的发生密切相关,本研究用免疫组化的方法检测MDM2在结肠黏膜癌变过程中的表达,旨在探讨结肠癌的发病机制。
1 材料和方法
1.1 材料
1.1.1 标本:来源于2007年1月-2008年9月期间南昌大学第一附属医院手术及结肠镜活检的组织,经100ml/ L 福尔马林固定,石蜡包埋,4μm 厚连续切片,并经HE染色病理诊断证实。总共108例标本,正常结肠黏膜20例,腺瘤22例,腺癌66例。
1.1.2 实验试剂:兔抗人突变型p53单克隆抗体、鼠抗人MDM2单克隆抗体、鼠抗人增殖细胞核抗原(PCNA)单克隆抗体、DAB显色试剂盒和PV-9000试剂盒均由北京中杉金桥生物技术有限公司提供。
1.1.3 主要仪器:DNP-9162型电热恒温培养箱(上海);Leica RM-2135型石蜡切片机(德国);Nikon 55i 电子数码显微镜(日本)。
1.2 方法
1.2.1 免疫组织化学检测MDM2的步骤:免疫组化染色按PV-9000试剂盒(购自中杉金桥生物技术有限公司) 操作说明书进行。所有蜡块制成厚4μm 的切片,切片脱蜡至水,充分洗涤后,置枸橼酸修复液中,微波修复15 min。MDM2工作液浓度为1∶100,Ⅰ抗孵育时4 ℃过夜,Ⅱ、Ⅲ抗孵育时37 ℃温箱内各20min,DAB 显色。试验设已知阳性、阴性对照及PBS代替一抗为空白对照,作为质量控制标准。
1.2.2 免疫组化结果判定:MDM2阳性染色主要定位于细胞核,部分出现在胞浆中。结果判断标准参照Fromowitz阳性细胞半定量分级法。随机观察5个高倍视野(×400)计数细胞总数和阳性细胞数,得出阳性细胞百分率。先根据阳性细胞所占的百分数计分:≤5%者为0分,6%-25%者为1分,26%-50%者为2分,>50%者为3分;再根据阳性细胞染色强度计分:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;然后根据两者相乘所得的总分进行结果判定:0分为阴性“-”,1-2分为弱阳性“+”,3-4分为中度阳性“++”,6-9分为强阳性“+++”。
1.2.3 统计方法:采用SPSS11.5统计软件分析,计量资料采用方差分析,组间率的比较采用χ2检验,MDM2表达强度比较采用秩和检验,结肠腺癌中MDM2的表达强度和腺癌分级的相关分析采用Spearman等级相关分析。显著性检验水准选α=0.05。
2 结果
2.1 MDM2在各组织中的表达
总共108例标本,正常结肠黏膜20例,腺瘤22例,腺癌66例,三组间的年龄、性别无显著性统计学差异(P>0.05)。MDM2的阳性表达(见表1)分别为:正常结肠黏膜组2例(10%),腺瘤组18例(81.8%),腺癌组65例(98.5%),经统计学检验,有显著性差异(P<0.05)。
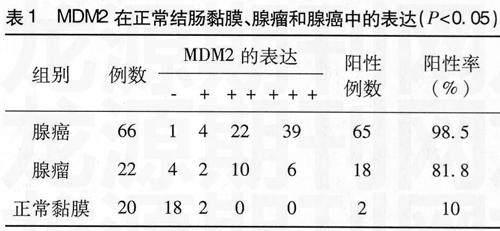
2.2 结肠腺癌的分化程度和MDM2表达强度的关系
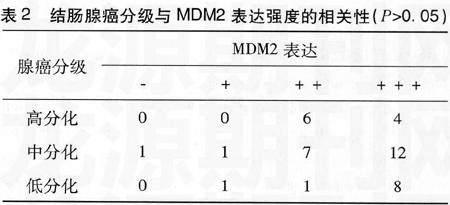
66例腺癌中,能明确分级的有41例,其中高分化腺癌级10例,中分化腺癌21例,低分化腺癌10例,行腺癌分级和MDM2表达强度+,++,+++的等级相关分析,结果无统计学意义(P>0.05)。
3 讨论
结肠癌是常见的消化道肿瘤,在我国发病率呈上升趋势[1],结肠癌被认为大多起源于腺瘤。正常结肠黏膜在各种损伤因素的影响下,使抑制细胞增殖的抑癌基因失活,或使刺激细胞增殖的原癌基因激活,导致细胞增殖过度和失去分化,引起结肠肿瘤的发生和发展。有学者提出了大肠腺瘤—腺癌序列的分子发病模式[2,3]。MDM2 (murine double munite2 ,MDM2) 为小鼠双微体基因,是近年发现的一种癌基因,MDM2蛋白对野生型p53具有负性调节功能,介导p53降解和抑制p53转录活性;而MDM2的表达水平又受野生型p53的调节,当野生型p53水平增高时,便可激活MDM2基因转录并表达;如此,野生型p53和MDM2之间形成了一个负反馈调节环,在维持野生型p53的正常生理功能方面具有重要作用[4]。MDM2除抑制抑癌基因p53产生,其本身也有致癌作用。有关MDM2在结肠腺瘤中的阳性表达结果,各家报道不一致[5,6]。我们的研究显示,在正常结肠黏膜中,MDM2的表达基本为阴性,而在腺瘤中的阳性表达率为81.8%,有显著性差异,说明在结肠癌前病变中,MDM2即发挥作用。MDM2在结肠腺癌中的表达率高达98.5%,其表达强度和阳性表达率均显著高于腺瘤和正常结肠黏膜。我们进一步分析了结肠腺癌分级和MDM2表达强度的关系,结果表明,在结肠腺癌的低分化、中分化和高分化分级中,其MDM2的表达强度无显著性差异。这和其他研究结果相一致[7,8]。这说明MDM2参与了结肠黏膜癌变的过程,在结肠癌的始发和早期形成发展中起重要作用,而在结肠癌的分化中无明显作用。
本研究由于标本资料等限制,未探讨MDM2的表达同结肠癌的分期和转移的关系,还有待于进一步研究。
参考文献:
[1] 项永兵,高立峰,徐望红等.恶性肿瘤发病率的时间趋势分析方法.中华流行病学杂志,2004:86-90.
[2] de Leon M P,Di GC.Pathology of colorectal cancer.Dig Liver Dis, 2001,33:372-88.
[3] Fearon ER.Molecular genetic studies of the adenoma-carcinoma sequence. Adv Intern Med,1994,39:123-47.
[4] Alarcon-Vargas D,Ronai Z.p53-MDM2-the affair that never ends. Carcinogenesis,2002,23:541-547.
[5] 郭洁,沈志祥,谭诗云.MDM2与P14ARF在结肠肿瘤中的表达及意义.胃肠病学和肝病学杂志,2002:144-146.
[6] 熊首先,朱尤庆,何军.MDM2和p53在大肠癌组织中的表达及其意义.长江大学学报(自科版)医学卷,2007:11-13,111.
[7] 闫再宏,张蓉,梁慧霞等.大肠癌中MDM2和p53基因表达及生物学意义.中国全科医学,2006:1067-1068.
[8] 郭洁,沈志祥,谭诗云.凋亡调控通路(p53-MDM2-p14)ARF对结肠癌生物学行为的影响.山东医药,2003:12-14.
(收稿日期2009-06-29)

