不同浓度配比的壳聚糖-胶原复合材料对细胞亲和性的影响
杨漾 邓丹 刘伟 杨瑶斐
·论著·
不同浓度配比的壳聚糖-胶原复合材料对细胞亲和性的影响
杨漾 邓丹 刘伟 杨瑶斐
目的评价不同浓度配比的壳聚糖-胶原支架材料对细胞亲和性的影响,并观察在细胞-支架复合物培养过程中支架材料的物理性质变化情况。方法采用第3代正常人皮肤成纤维细胞作为种子细胞,进行体外培养和扩增至足够数量后,分别种植于100%胶原(实验组1)、70%胶原(壳聚糖∶胶原=3∶7,实验组2)、50%胶原(壳聚糖∶胶原=5∶5,实验组3)、30%胶原(壳聚糖∶胶原=7∶3,实验组4)四种不同浓度配比的壳聚糖-胶原复合支架材料上,培养7 d,通过光镜、电镜等观察和比较细胞在支架上的黏附情况、增殖活力和生长形态,以及材料物理强度的变化情况。结果不同浓度的各组壳聚糖-胶原支架材料上,细胞均能黏附、生长良好,其中实验组2的多孔支架材料上细胞增殖更接近单纯胶原材料(实验组1),且材料收缩降解速度明显低于其他2组。结论不同浓度配比的壳聚糖-胶原支架材料中,壳聚糖∶胶原=3∶7的复合支架材料具有良好的三维空间结构和细胞相容性,且材料形变相对较小。
壳聚糖胶原人皮肤成纤维细胞细胞亲和性
组织工程学的研究涉及种子细胞、支架材料和组织构建等方面。其中,支架材料是组织工程研究的重要领域之一[1]。壳聚糖是几丁质的脱乙酞化产物,是细胞外基质中糖胺聚糖(GAG)的结构类似物,具有生物相容性良好、低抗原性、可生物降解等特点,但其细胞亲和力不够理想,制约了其在组织工程研究中的应用[2]。胶原具有良好的细胞亲和力,可以诱导细胞的黏附和生长,但降解快,不能与细胞的生长速度相匹配,且强度较低[3]。将胶原与壳聚糖复合,使得制备的壳聚糖复合支架上分布有大量的胶原纤维丝构成的网,有可能改善这两种材料的生物学性能,在提高细胞亲和力的同时,使材料的降解速度与组织形成时间相匹配,并提高材料的物理学强度。
在本实验中,我们验证了不同浓度配比下的壳聚糖-胶原膜片的细胞亲和性差异、降解情况以及复合材料的物理学性能,为将来应用该复合材料构建组织工程化组织提供实验依据。
1 材料和方法
1.1 人皮肤成纤维细胞获取
人体皮肤来源于包皮环切术获取的正常小儿包皮(4~15岁),以磷酸盐缓冲液(PBS,含青霉素、链霉素各1 000 000 U/L)冲洗数遍,再以0.25%的氯霉素溶液浸泡20~30 min。刮除表皮并剪去皮下脂肪,剪碎成2 mm3的小块后置于50 mL的离心管内,加入0.1%的Ⅰ型胶原酶30 mL,置于37℃恒温摇床内消化,约2 h后收集过滤后的消化悬液,1 500 rpm离心5 min,获取原代细胞,加入含有10%胎牛血清的L-DMEM(Gibco公司)培养基,置于5%CO2、37℃饱和气相培养箱中培养,待细胞生长至80%~90%融合后传代、扩增。
1.2 材料制备
配制2%醋酸溶液后,称取一定质量的壳聚糖粉末,将其完全溶于醋酸中,然后加入胶原,充分混合,再加2%醋酸至所要容量;加人少量0.25%戊二醛,将配好的混合液放入玻璃培养皿中,在4℃冷藏柜交联12 h,再置于-20℃冷冻柜中,24 h冷冻成型。将成型的支架浸入碱液中和残留的醋酸,用蒸馏水反复冲洗至中性,重新冷冻,即得壳聚糖-胶原复合支架。根据壳聚糖、胶原的不同比例分为:实验组1(100%胶原)、实验组2(壳聚糖∶胶原=3∶7)、实验组3(壳聚糖∶胶原=5∶5)和实验组4(壳聚糖∶胶原=7∶3)。将支架切成35 mm×25 mm大小,环氧乙烷消毒,DMEM培养液浸泡1 d后备用。
1.3 细胞-材料复合物的体外构建
取第3代皮肤成纤维细胞消化、计数,台盼蓝染色检测,扩增的皮肤成纤维细胞活力95%以上,制成细胞浓度为2×107cells/mL的悬液备用。将DMEM培养液浸泡后的4组材料,吸出多余培养液,用上述细胞悬液各1.5 mL均匀接种在每种材料上,4 h后加液,以后每3天换液1次,培养至1周。
1.4 检测
每天以倒置相差显微镜观察皮肤成纤维细胞在材料上的黏附生长情况和材料降解情况。于7 d时分别取细胞-材料复合物进行扫描电镜观察,方法:用PBS冲洗2次,2.5%戊二醛液固定过夜,梯度乙醇脱水,室温下干燥。用扫描电镜观察材料表面形态和细胞在材料上的黏附情况。
2 结果
2.1 细胞形态学观察
获取的原代小儿包皮成纤维细胞为典型成纤维样细胞形态,呈长梭形,胞核居中,胞质丰富。传代到第3代时,其细胞形态与原代细胞仍然基本保持一致(图1)。
2.2 材料的大体观察
制备的不同浓度配比的复合材料均为白色疏松多孔膜片,大小为35 mm×25 mm。经环氧乙烷消毒后,材料均有不同程度的收缩,实验组1收缩最为明显。DMEM培养液浸泡1 d后,各组材料形状有所恢复,但没有达到消毒前的规格。
细胞接种后7 d取材,各组材料均有不同程度的收缩现象。随着胶原含量的增加,材料的收缩程度增大(图2)。且随着壳聚糖浓度的增加,材料收缩率降低,其中实验组1与实验组2之间、实验组3与实验组4之间无明显差别(P>0.05),而实验组3、4的收缩率较实验组1、2低(P<0.05),相对能够较好地维持原有形态。

2.3 相差显微镜观察
各组材料均为三维多孔支架材料,随着材料中胶原含量的增加,孔的连通性增加,且孔径增加。在皮肤成纤维细胞接种后第7天,各组材料上均有细胞黏附,其中实验组2的细胞形态更接近正常皮肤成纤维细胞,细胞数量与实验组1无显著性差异(图3)。
2.4 扫描电镜观察
扫描电镜观察发现,各组材料表面均有不同程度的降解现象,呈现不同的表面形态。其中实验组2的细胞伸展得更充分,形态更接近正常皮肤成纤维细胞(图4)。
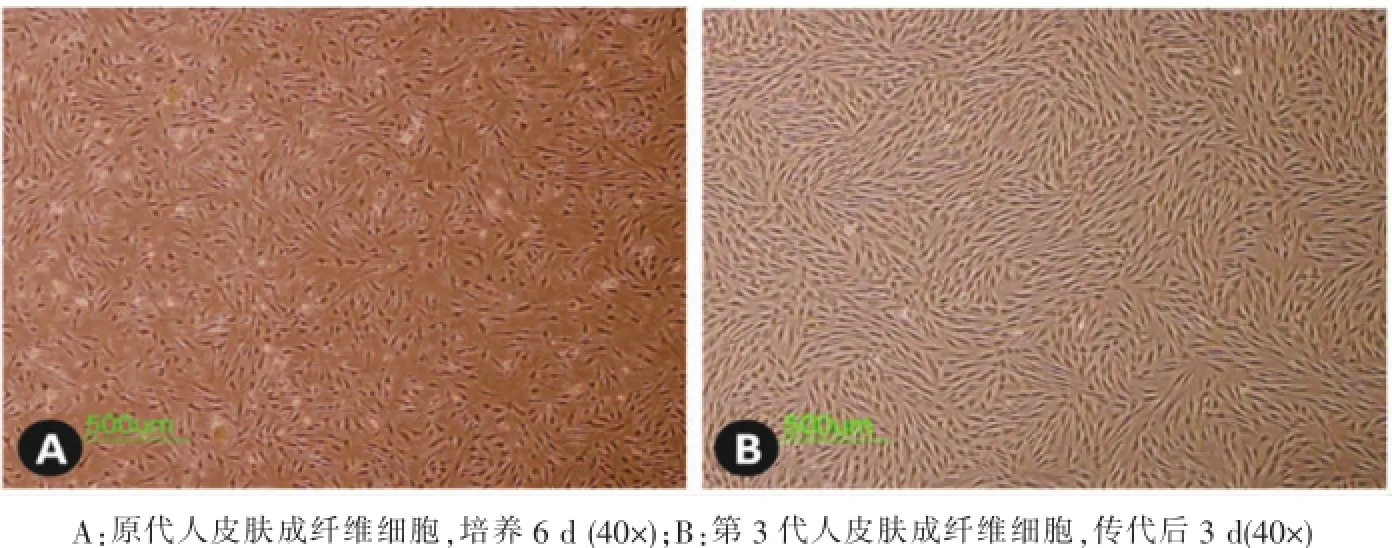
图1 细胞形态学观察
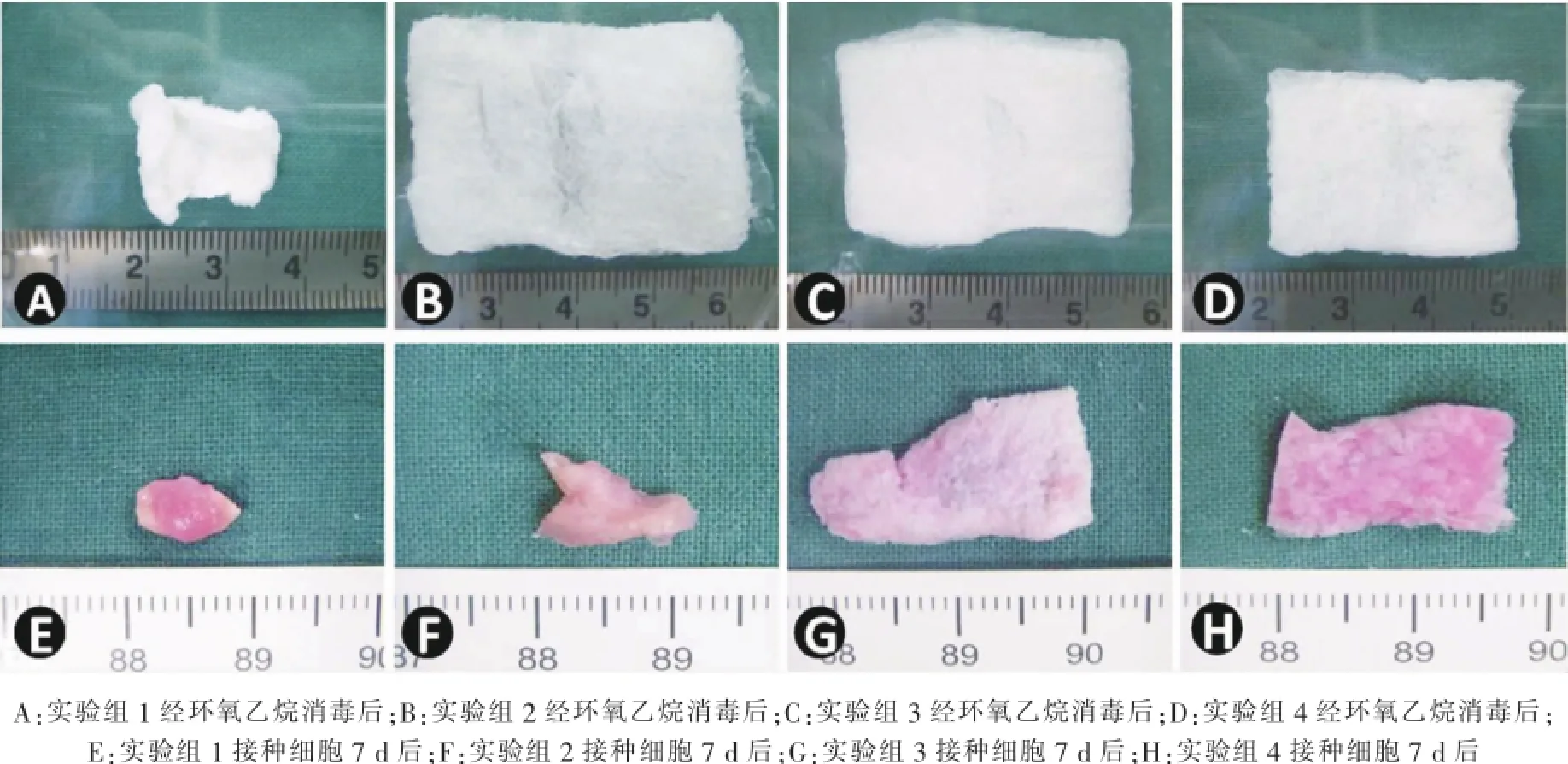
图2 细胞培养7 d后,各组材料的收缩情况比较
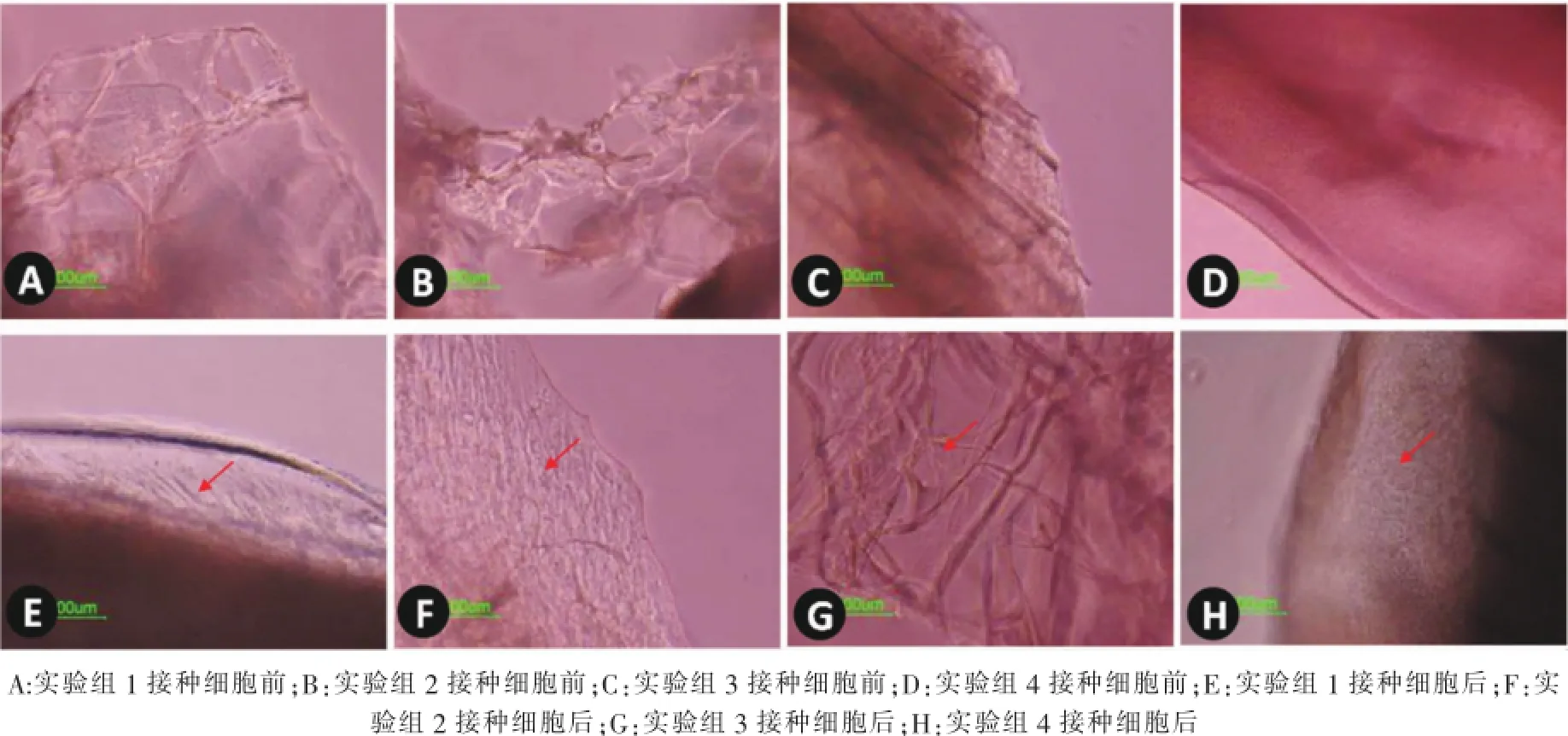
图3 细胞在材料上的黏附

图4 扫描电镜观察各组细胞-材料复合物培养后7 d
3 讨论
支架材料不仅具有连接和支持细胞的作用,而且还影响着细胞的形态、表型,控制着细胞的增殖、分化,并起到了调节细胞运动的作用。理想的支架材料应具备下列条件:①良好的组织相容性,无明显的机体毒性和免疫原性;②多孔的立体结构,孔隙率为70%~90%,微孔直径20~400 μm;③性能较佳的材料微环境,有利于种子细胞增殖分化;④可控的材料降解率,保证材料的降解时间与组织形成时间相匹配;⑤一定的机械性能;⑥易于加工、消毒、储存[4]。
目前用于组织工程构建的材料主要分为可降解生物材料和不可解生物材料两大类。壳聚糖是一种结构与细胞外基质中的主要成分GAG十分类似的优良天然生物可降解材料。壳聚糖具有低毒性、良好的可吸收性和细胞相容性,易于加工成型。但也有文献指出,壳聚糖的细胞亲和力不够理想,需通过表面改性或与其他材料复合来加以改善,使其更有利于细胞的黏附与增殖[5]。胶原是细胞外基质中的主要成分,具有良好的细胞亲和力,可以诱导细胞的黏附和生长[6]。但胶原的物理强度差,降解速度比较快。我们将胶原与壳聚糖复合,使得壳聚糖支架上复合着大量的胶原纤维丝构成的网,改善了对细胞的亲和力。壳聚糖-胶原复合支架材料有着优异的生物学性能,可用于培养不同的细胞,并能促进成纤维细胞在材料表面的早期黏附[7-8]。
在本实验中,我们对不同浓度配比的壳聚糖-胶原复合材料的细胞亲和力进行了初步比较。在实验中,复合材料中壳聚糖含量过高,可使得材料的脆性增加,随着胶原成分的降解,材料形变增加,导致材料出现断裂或部分脱落,不利于组织的形成;复合材料中胶原含量过高,可使得材料收缩增强,同样不利于组织的形成。两者的最佳浓度配比将是我们下一步实验将要解决的问题。
综上所述,壳聚糖-胶原复合支架材料具有较好的细胞相容性,通过调节壳聚糖或胶原的含量,可调控材料的降解速率和细胞相容性。壳聚糖-胶原复合材料将成为组织工程研究中较有应用前景的支架材料。
[1]Larger R,Vacanti JP.Tissue Engineering[J].Sci,1993,260:920-926.
[2]Senel S,lkinci G,Kas S,et al.Chitosan films and hydmgels of chlorhexidine gluconate for oral mucosal delivery[J].Int J Pharm, 2000,193(2):197-203.
[3]Park YJ,Lee YM,Park SN,et al.Platelet derived growth factor releasing chitosan sponge for periodontal bone regeneration[J]. Biomaterials,2000,21(2):153-159.
[4]杨军,杨光辉,刘伟,等.组织工程化表皮膜片的构建及其在增殖性疤痕治疗中的应用[J].上海第二医科大学学报,2004,24(4): 296-298.
[5]David S,Gruber H,Mayer BA,et al.Lumbar spinal fusion using recombinant human bone morphogenetic protein in the canine.A comparison of three dosages and two carriers[J].Spine,1999,24(19): 1973-1979.
[6]Nagai M,Hayakawa T,Fukatsu A,et al.In vitro study of collagen coating of titanium implants for initial cell attachment[J].Dent Mater J,2002,21(3):250-260.
[7]Oshima H,Nakamura M.A study on reference standard for cytotoxicity assay of biomaterials[J].Biomed Mater,1994,4(4):327-332.
[8]Isidor F,Karring T,Nyman S,et al.The significance of coronal growth of periodontal ligament tissue for new tissue for new attachment formation[J].J Clin Periodontol,1986,13:145-150.
Preliminary Study on influence of Chitosan-Collagen Compound with Different ratio for Cell Affinity
ObjectiveTo investigate the influence of chitosan-collagen compound with different ratio for cell affinity and physical variation of the scaffold.MethodsHuman dermal fibroblasts of passage 3 were cultured and amplified in vitro, then seeded on the those scaffolds in different mixed ratio groups as follows:100%collagen as group 1,70%collagen (chitosan-collagen mixed with 3∶7)as group 2,50%collagen(chitosan-collagen mixed with 5∶5)as group 3,30%collagen (chitosan-collagen mixed with 7∶3)as group 4.The attachment efficiency,attachment morphology,proliferation activity and growing morphology of human dermal fibroblasts on all scaffolds were observed by optical microscopy and scanning electronic microscope,and evaluated within 7 days cultivation.ResultsCells adhered well on those compound materials in all groups, stretched along the surface of the scaffold and grew when cultured in vitro.More importantly,the cell attachment and proliferation of the group 2 was closed to the pure collagen group 1,which could maintain the shape well with less degradation and contraction.ConclusionThe compound scaffold of group 2 with chitosan-collagen mixed with 3∶7 has a good cell compatibility and structure.Therefore,this Kind of scaffold may be successfully used for tissue engineering in future.
Chitosan;Collagen;Human dermal fibroblast;Cell affinity
R318.08
A
1673-0364(2009)04-0186-04
2009年5月23日;
2009年7月31日)
10.3969/j.issn.1673-0364.2009.08.002
上海交通大学医工(理)交叉研究基金项目(YG2009MS34)。
200235上海组织工程研究与开发中心。
YANG Yang, DENG Dan,LIU Wei,YANG Yaofei.
Shanghai Tissue Engineering Research and Development Center,Shanghai 200235,China.

