基于网络药理学探讨扶正解毒抗癌汤治疗黑色素瘤的作用机制




〔摘要〕 目的 探讨扶正解毒抗癌汤(FZJDD)治疗黑色素瘤的分子机制。方法 TCMSP和TCMID的数据库和文献中检索FZJDD有效化学成分及各成分对应的作用靶点;GeneCards、OMIM、TTD等数据查询库中筛选黑色素瘤相关靶点,获得“药物-疾病”交集靶点,STRING 11.5与DAVID数据库进行蛋白质-蛋白质相互作用(PPI)网络分析获取核心靶点,Cytoscape 3.8.1构建FZJDD治疗黑色素瘤中药-作用靶标-通路网络,GO富集分析与KEGG富集分析获取FZJDD治疗黑色素瘤的关键生物学过程及信号通路。借助qPCR及Western blot方法验证相关信号通路关键蛋白的作用。结果 获得FZJDD有效成分47个,“药物-疾病”交集靶点168个,富集到的信号通路主要包括磷脂酰肌醇三激酶(PI3K)/蛋白激酶B(AKT)等信号通路;体外细胞实验显示,FZJDD能够有效降低黑色素瘤 A375 细胞增殖,抑制PI3K/AKT信号通路关键蛋白PI3K、AKT、雷帕霉素靶蛋白(mTOR)的蛋白及mRNA表达水平(Plt;0.05)。结论 FZJDD可以通过多成分、多靶点、多通路,发挥抗炎、促进肿瘤细胞凋亡等作用治疗黑色素瘤,其中对PI3K/AKT通路的调控可能是其关键机制。
〔关键词〕 扶正解毒抗癌汤;黑色素瘤;PI3K/AKT信号通路;网络药理学;作用机制
〔中图分类号〕R285.5" " " " "〔文献标志码〕A" " " " " 〔文章编号〕doi:10.3969/j.issn.1674-070X.2025.01.006
Mechanism of action of Fuzheng Jiedu Kang'ai Decoction in treating melanoma based on network pharmacology
TU Yaling1, CHEN Qihua1*, XI Jianyuan1, QI Lin1, ZHAO Duoduo2, YU Huanyu2
1. The First Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China; 2. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China
〔Abstract〕 Objective To explore the molecular mechanism of Fuzheng Jiedu Kang'ai Decoction (FZJDD) in the treatment of melanoma. Methods The effective chemical components of FZJDD and their corresponding targets were retrieved from the databases and literature of TCMSP and TCMID. Melanoma-related targets were screened using databases such as GeneCard, OMIM, and TTD to obtain intersection targets of \"drug-disease\". Protein-protein interaction (PPI) network analysis was performed using STRING11.5 and DAVID databases to identify core targets. Cytoscape 3.8.1 was used to construct a Chinese medicines-action targets-pathway networks for FZJDD in treating melanoma. Gene ontology function (GO) enrichment analysis and Kyoto Encyclopedia of Genes and Genomes (KEGG) enrichment analysis were conducted to identify the key biological processes and signaling pathways involved in treating melanoma with FZJDD. Quantitative real-time PCR (qPCR) and Western blot were used to validate the roles of key proteins in related signaling pathways. Results A total of 47 active components of FZJDD and 168 \"drug-disease\" intersection targets were identified. The enriched signaling pathways mainly included phosphatidylinositol 3-kinase (PI3K)/protein kinase B (AKT) signaling pathway, among others. In vitro cell experiments showed that FZJDD effectively inhibited the proliferation of melanoma A375 cells and suppressed the protein and mRNA expression levels of key proteins in PI3K/AKT signaling pathway, including PI3K, AKT, and the mammalian target of rapamycin (mTOR) (Plt;0.05). Conclusion FZJDD can treat melanoma by exerting anti-inflammatory effects and promoting tumor cell apoptosis through multiple components, targets, and pathways, among which the regulation of the PI3K/AKT pathway may be its key mechanism.
〔Keywords〕 Fuzheng Jiedu Kang'ai Decoction; melanoma; PI3K/AKT signaling pathway; network pharmacology; mechanism of action
黑色素瘤系源自表皮黑素细胞在活化或基因变异后所形成的肿瘤,其是遗传、体质与环境因素间错综复杂的交互作用的结果[1-2],也是皮肤癌中临床症状最为显著、死亡率最高的一种类型[3]。流行病学研究显示,在全球多数区域内黑色素瘤的发病率在男性群体中显著高于女性,且呈年轻化倾向,在25~50岁这一年龄段内本病发病率呈现出线性上升的趋势,给全球的医疗卫生系统带来了沉重的压力与负担[4-6]。在当前的黑色素瘤的临床治疗中手术切除肿瘤及其周围正常组织仍是其核心治疗策略。对于那些肿瘤已经转移的患者,手术治疗难以彻底治愈,迄今为止化学治疗依旧是转移性黑色素瘤患者所依赖的主要治疗方案[7-8],但多数患者在短时间内便面临继发性耐药的棘手难题,且化学治疗存在大量的毒副作用,因此探索临床有效且毒副作用小的治疗方法,以期实现更持久的治疗效果迫在眉睫[9]。中医在黑色素瘤的治疗领域内展现出独特的优势,其治疗手段无论是内服还是外敷,均获得了一定成效[10]。
中医学并无黑色素瘤这一病名,根据其症状、体征及发病特点等,可以将黑色素瘤归属于“黑痣”“黑疔”“恶疮”“失荣”等范畴[11]。《诸病源候论·黑痣候》中记载:“黑痣者,风邪搏于血气,变化所生也。夫人血气充盛,则皮肤润悦,不生疵瘕,若虚损,则黑痣变生。”据此可以推断正虚是黑色素瘤病因之一[12]。《医宗金鉴·卷六十四》中对其记载:“其证初起,状如痰核,推之不动,坚硬如石,皮色如常,日渐长大。由忧思、恚怒、气郁、血逆与火凝结而成,日久难愈……色现紫斑,腐烂浸淫,渗流血水,疮口开大,努肉高突,形似翻花瘤证。”由此可知,黑色素瘤的另一病因为邪毒壅实[13]。扶正解毒抗癌汤(FZJDD)系陈其华教授团队历经多年临床实践与前人智慧结晶,该方秉承益气扶正、除瘤祛邪之核心理念,展现出显著的临床疗效,然其具体作用机制尚待深入探究。陈教授独辟蹊径,指出黑色素瘤之根源在于正气不足、血瘀毒聚,故本方融扶正与祛邪于一体,通过强化脾胃功能、促进气血生成以扶正气,同时强调清热解毒与活血化瘀,旨在消除病邪、抑制肿瘤发展。为进一步探索FZJDD治疗黑色素瘤的分子机制,本研究运用网络药理学研究,科学系统地探索其药效机制,并辅以细胞实验,进一步验证其作用路径与靶点,力求为临床应用提供科学依据。
1 材料与方法
1.1" 网络药理学分析
1.1.1" 中药化学成分收集及靶点预测" 使用中药系统药理学数据库分析平台(Traditional Chinese Medi⁃cine Database and Analysis Platform,TCMSP,https://tcmsp-e.com)及中药综合数据库分析平台(Traditional Chinese Medicine Integrated Database,TCMID,https://www.megabion-et.org/tcmid),针对黄芪、当归、三棱、莪术、半枝莲等中药材,设置口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug-likeness,DL)≥0.18、半衰期(half-life,HL)gt;4 h的筛选条件[14],深入检索并筛选出高活性化学成分。随后,将筛选出的活性成分的“Mol ID”输入TCMSP数据库的“Related Targets”库中,以检索相应的靶点基因信息。进一步利用UniProt蛋白数据库(https://www.uniprot.org)对收集到的靶点进行数据校准,并剔除无效及重复的靶点,最终获取标准化的基因名称。
1.1.2" 黑色素瘤疾病靶点收集及预测" 在GeneCards(https://www.genecards.org)、OMIM(Online Mendelian Inheritance in Man,https://omim.org)以及TTD(Therapeutic Target Database,http://db.idrblab.net/ttd)3个数据库中,通过键入关键词“Melanoma”进行深度检索,旨在发掘与该疾病紧密相关的靶点信息[15]。随后,导出包含这些基因靶点的Excel表格,进行筛选去重,以备后续分析使用。将获得的药物靶点基因和黑色素瘤疾病靶点基因进行映射,获得FZJDD治疗黑色素瘤的靶点基因,并以韦恩图展示。
1.1.3" “药物-疾病-靶点”网络构建" 利用Cytoscape 3.8.1软件,精准映射FZJDD在黑色素瘤治疗中的关键靶点基因及其活性成分;随后,依托STRING数据库(https://string-db.org)与DAVID数据库(https://david.ncifcrf.gov)构建蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络[16]。
1.1.4" GO富集分析和KEGG通路分析" 将FZJDD治疗黑色素瘤的药物-疾病交集靶点上传至DAVID数据库(https://david.ncifcrf.gov/summary.jsp),以Plt;0.05为筛选条件,对交集靶点进行GO富集分析与KEGG富集分析。利用微生信在线平台(http://www.bioinformatics.com.cn)将GO及KEGG通路富集结果绘制成柱状图和气泡图[17-18]。
1.2" 主要试剂与仪器
RPMI 1640细胞培养基、胎牛血清(美国Gibco公司,货号分别为R8758、10099141);胰酶消化液、PBS缓冲液、DNA凝胶加样缓冲液(6×)、Goat anti-Mouse IgG (H+L) Secondary Antibody,HRP及Goat anti-Rabbit IgG (H+L) Secondary Antibody, HRP(美国Abiowell公司,货号:AWC0232、AWC0409、AWR0103、AWS0001、AWS0002);磷脂酰肌醇三激酶(phosphat⁃idylinositol 3-kinase, PI3K)、蛋白激酶B(protein kinase B, AKT)、雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、β肌动蛋白(β-actin)抗体(美国proteintech公司,货号分别为20584-1-AP、10176-2-AP、12789-1-AP、66009-1-Ig)。超净工作台(苏州安泰空气技术有限公司,型号:SW-CJ-2FD);CO2细胞培养箱(日本松下公司,型号:MCO-20AIC);S-23 高速台式离心机(湖南湘仪动力测试仪器有限公司,型号:H1650R);全自动酶标仪(南京贝登医疗股份有限公司,型号:B-2744);电泳仪(北京六一仪器厂,型号:DYY-2C)。其余设备均由湖南中医药大学科技创新中心提供。
1.3" 细胞实验
1.3.1" 细胞来源" 本研究所使用的黑色素瘤A375 细胞株,购自上海细胞研究所,由湖南中医药大学科技创新中心保存。
1.3.2" 动物来源" 选取SPF级雄性SD大鼠30只,体质量200~220 g,购自湖南斯莱克景达实验动物有限公司,动物合格证号SCXK(湘)2019-0004。动物适应性饲养3 d,饲养于湖南中医药大学SPF级实验动物中心,环境温度范围22~26 ℃,湿度范围 55%~60%,自由摄食,按实验动物3R原则给予人道关怀。动物伦理批号:LL20210516025。
1.3.3" 含药血清制备" 本研究中FZJDD(黄芪20 g、当归10 g、三棱10 g、莪术10 g、半枝莲10 g)饮片购自湖南中医药大学第一附属医院中药房。按比例配制好药材进行煎药,将煎药液混合后过滤、去渣、浓缩。根据《中药药理实验方法学》[19]中人与动物临床给药剂量换算后,借助旋转蒸发仪将其浓缩为1.8 g/mL,置于无菌棕色瓶,4 ℃冰箱保存备用。SD大鼠适应性喂养3 d后,随机分为空白血清组及FZJDD组,其中空白血清组15只、FZJDD组15只。FZJDD组大鼠予以2倍临床等效剂量FZJDD水煎剂灌胃,每次3 mL,每天1次;空白血清组大鼠予同体积蒸馏水灌胃。连续灌胃7 d后进行腹主动脉采血,经过离心(3 000 r/min离心5 min,离心半径16 cm)、过滤、灭活后吸出上清液即为含药血清或空白血清。
1.3.4" 细胞培养与分组" 黑色素瘤A375细胞培养基由含10%胎牛血清的RPMI 1640组成,并置于37 ℃、5% CO2的培养箱中培养。将黑色素瘤A375细胞分为4组,分为空白血清组、FZJDD含药血清组、阳性药物组、联合用药组。空白血清组为黑色素瘤A375细胞给予空白血清干预;FZJDD含药血清组给予FZJDD含药血清(最佳浓度14.15%)干预;阳性药物组给予30 μmol/L达卡巴嗪培养基干预;联合用药组给予FZJDD含药血清(最佳浓度14.15%)+30 μmol/L达卡巴嗪培养基干预。各组干预24 h后进行检测。根据前期实验结果显示,扶正解毒抗癌汤含药血清对黑色素瘤A375细胞24 h的 IC50剂量为14.15%,综合用药原则和此次实验的研究目的,拟选择14.15%的含药血清作为后续实验的干预浓度。
1.3.5" 细胞增殖检测" 采用CCK-8法[20]检测各组黑色素瘤A375细胞增殖率,每组6个复孔,重复3次。具体步骤为:将黑色素瘤A375细胞悬液以每孔1.0×105个细胞的密度接种于96孔板中,并在37 ℃、5% CO2的细胞培养箱孵育24 h。之后分组干预,对照组予空白血清干预,FZJDD组给予FZJDD含药血清干预,阳性对照组予达卡巴嗪干预,联合对照组予FZJDD含药血清+达卡巴嗪干预。处理24 h。采用CCK-8检测细胞抑制率,在37 ℃、5% CO2的条件下继续孵育2 h,测定450 nm的波长的吸光度值。细胞抑制率(%)=(1-干预组OD值/对照组OD值)×100%。
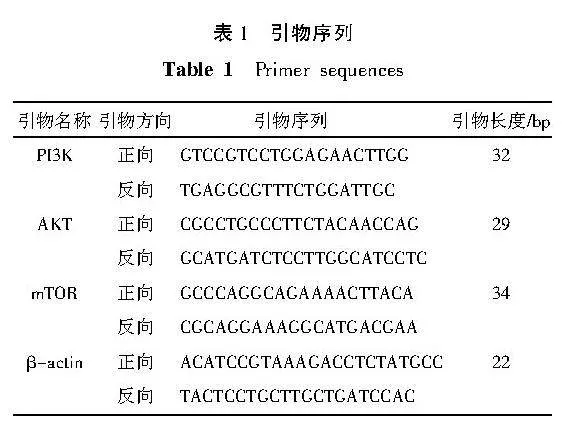
1.3.6" qPCR法检测PI3K、AKT、mTOR mRNA水平表达" 选取处于对数生长期的黑色素瘤A375细胞,分组干预,细胞处理方法同1.3.5,用Trizol试剂提取各组A375细胞总RNA,按照试剂盒操作步骤进行逆转录合成cDNA,PCR扩增。以β-actin为内参,再用2-ΔΔCt法求算目的基因的表达量,引物序列见表1。
在无核酸酶的离心管中加入TB Green Premix Ex Taq 10 μL,加上下游引物各0.4 μL,加入第1步得到的cDNA模板2 μL,混匀,实时上机检测。反应条件:95 ℃ 30 s预变性,95 ℃ 5 s变性,60 ℃ 30 s退火,同时收集荧光,40个循环。用相对表达量=2-△△Ct公式分析计算各个组的表达情况。
1.3.7" Western blot法检测PI3K、AKT、mTOR蛋白表达" 黑色素瘤A375细胞在分组干预24 h 后,在4 ℃环境下,向适量的RIPA裂解液中加入预混的PMSF(比例为PMSF∶RIPA=1∶100)。使用细胞刮刀仔细地将细胞碎片刮入EP管内,并在冰上进行持续的裂解,时长为30 min,后进行30 s的超声处理,以确保细胞彻底裂解。裂解完成后,提取各组A375细胞的蛋白裂解物,12 000 r/min离心15 min,离心半径16 cm,抽取上清液后按照BCA蛋白定量试剂盒使用操作检测蛋白浓度。电泳后添加5%胎牛血清白蛋白37 ℃封闭1.5 h,洗膜后添加PI3K(1∶1 000)、AKT(1∶1 000)、mTOR(1∶1 000)抗体,一抗4 ℃孵育过夜。二抗37 ℃孵育1.5 h显影,结果运用Image Lab软件进行处理。
1.4" 统计学分析
采用SPSS 26.0统计软件进行数据统计学分析。所有数据结果以“x±s”表示,组间比较采用方差分析,两两样本之间的比较则采用LSD-t检验,以Plt;0.05为差异有统计学意义。
2 结果
2.1" FZJDD有效成分及治疗黑色素瘤潜在靶点
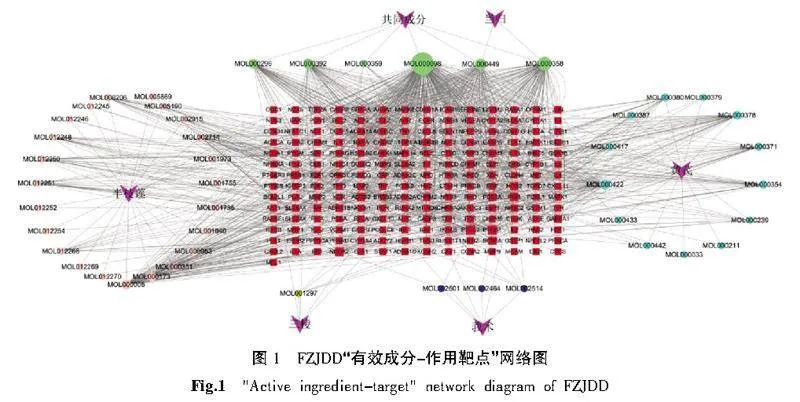
通过TCMSP检索,以OB≥30%,DL≥0.18为筛选条件并剔除无效成分后,共获取FZJDD有效成分47个,成分对应的作用靶点197个,FZJDD的“有效成分-作用靶点”网络图见图1,根据度值(Degree)及相关文献报道筛选活性成分,其中槲皮素(quercetin)、β-谷甾醇(beta-sitosterol)、豆甾醇(stigmasterol)、芒柄花黄素(formononetin)、山柰酚(kaempferol)、木樨草素(luteolin)、常春藤皂苷(hederagenin)、汉黄芩素(wogonin)、黄芪异黄烷苷(7-O-methylisomucronulatol)、黄芩素(baicalein)等药物有效成分与多个作用靶点存在密切联系,这些成分可能是FZJDD防治黑色素瘤的关键化合物。详见表2。
2.2" 药物-疾病交集靶点获取
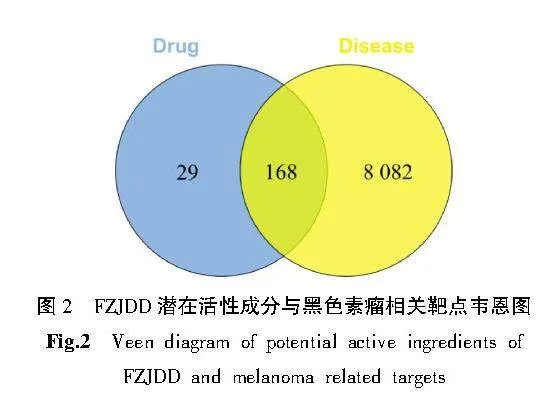
在GeneCards、OMIM及TTD数据库中筛选有关黑色素瘤的疾病靶点,将3个数据库的靶点基因进行合并,去重后共获得8 250个与黑色素瘤相关的靶点,将得到的基因经UniProt数据库校正。通过韦恩图将FZJDD197个作用靶点与黑色素瘤的8 250个靶点进行映射,共获得168个FZJDD-黑色素瘤共同靶点。详见图2。
2.3" PPI网络构建及核心靶点筛选
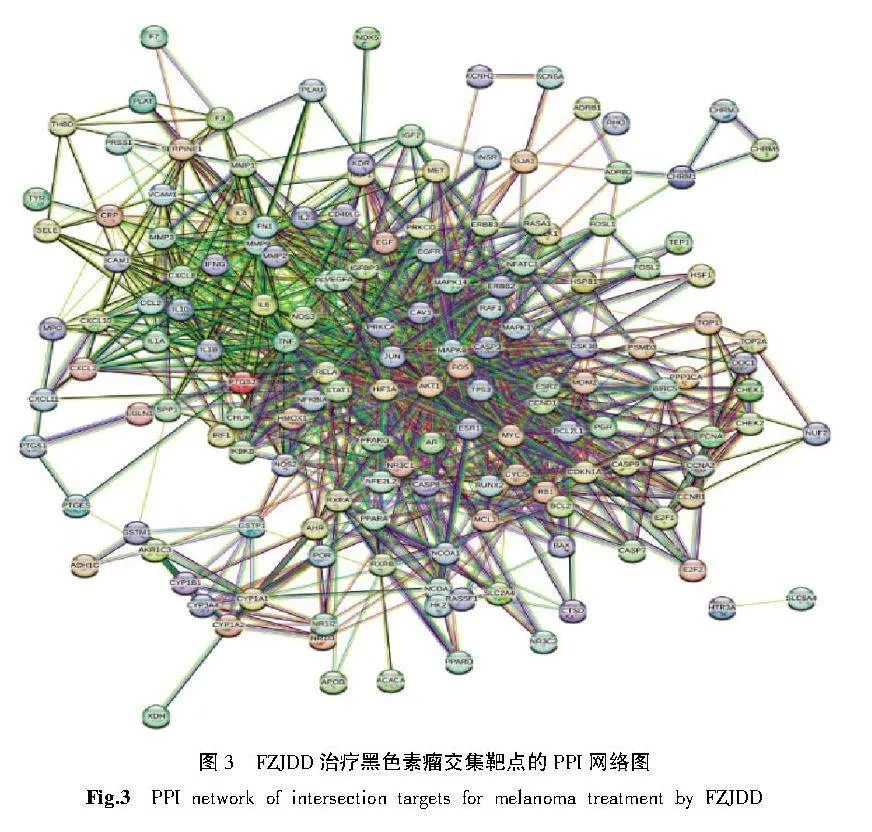
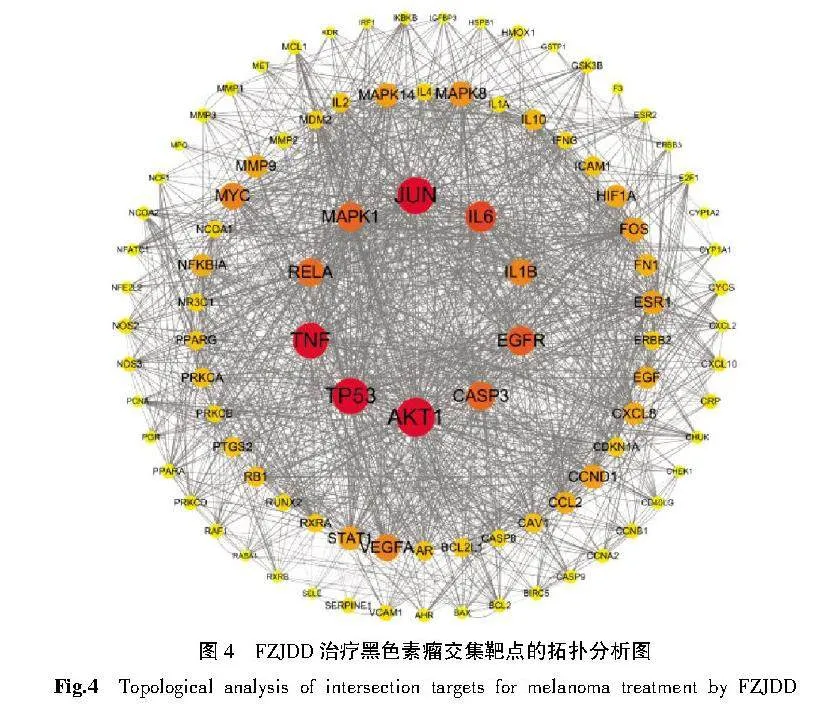
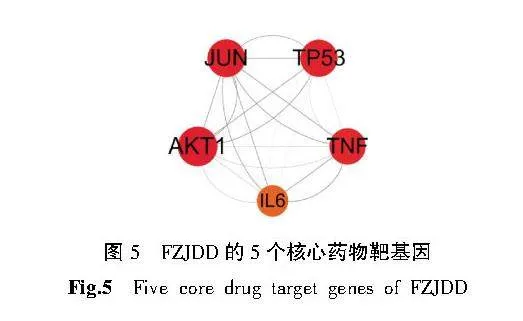
将交集靶点导入STRING数据库进行PPI分析。FZJDD治疗黑色素瘤的PPI预测见图3。将网络文件保存为TSV格式,将TSV文件导入Cytoscape 3.8.1软件绘制PPI网络,对网络进行拓扑分析,以degree值反映靶点大小及颜色,以combined score值反映边的粗细,从而构建PPI网络,如图4和图5所示,其中颜色越深,面积越大表示度值越大,该网络共包括245个结点和1 566 条边,其中AKT1、JUN、TP53、TNF、IL-6为核心靶点。
2.4" GO和KEGG通路富集分析
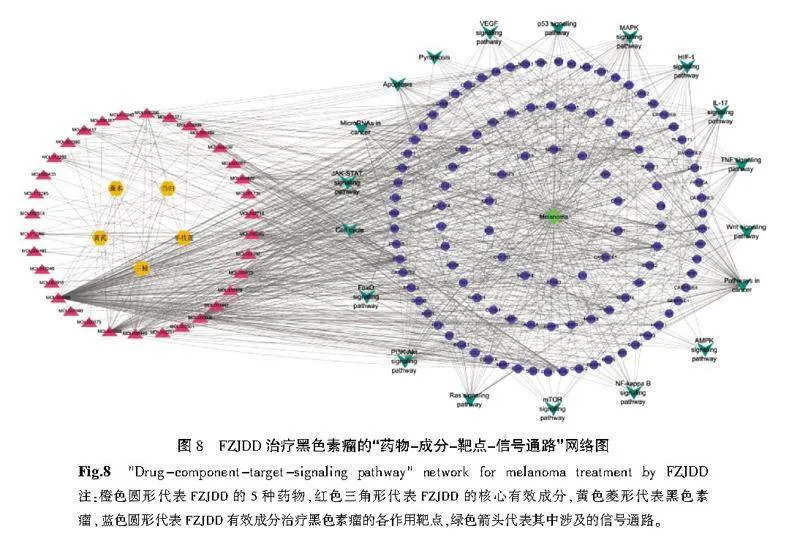
在GO富集分析中,富集到374条生物过程(biological process,BP)、39条细胞组成(cell composition,CC)、85条分子功能(molecular function,MF)条目。以Plt;0.05为筛选条件,取前10个GO条目绘制气泡图,见图6。根据DAVID筛得到 KEGG通路181条,根据Plt;0.05筛选出FZJDD治疗黑色素瘤的通路155条,根据P值排序绘制排名前20位的KEGG气泡图,见图7。可预测FZJDD对黑色素瘤的治疗作用主要涉及癌症通路、PI3K-AKT信号通路、MAPK信号通路、TNF信号通路、IL-17信号通路、VEGF信号通路等。
2.5" “药物-成分-靶点-信号通路”网络构建
根据GO富集分析及KEGG通路富集分析的结果,并查阅相关文献,借Cytoscape 3.8.1软件构建“药物-成分-靶点-信号通路”网络。AKT信号通路的靶点交集数为96。详见图8。
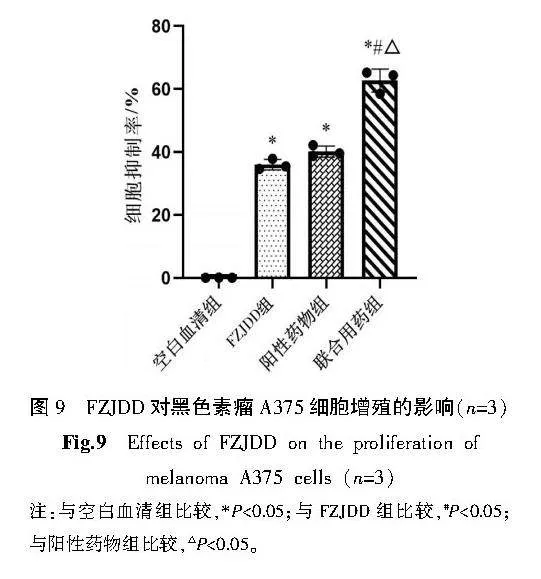
2.6" FZJDD对黑色素瘤A375细胞增殖的影响
与空白血清组比较,FZJDD与阳性药物细胞抑制率显著升高(Plt;0.05);FZJDD与阳性药物细胞抑制率比较差异无统计学意义(Pgt;0.05);与FZJDD组、阳性药物组比较,联合用药组的细胞抑制率显著升高(Plt;0.05)。详见图9。
2.7" qPCR检测PI3K/AKT信号通路相关蛋白mRNA的表达
与空白血清组比较,FZJDD组与阳性药物组的PI3K、AKT、mTOR的mRNA表达水平显著降低(Plt;0.05);FZJDD组与阳性药物组的PI3K、AKT、mTOR的mRNA表达水平比较差异无统计学意义(Pgt;0.05);与FZJDD组、阳性药物组比较,联合用药组的PI3K、AKT、mTOR的mRNA表达水平显著降低(Plt;0.05)。详见图10。
2.8" Western blot法检测PI3K/AKT信号通路相关蛋白水平的表达
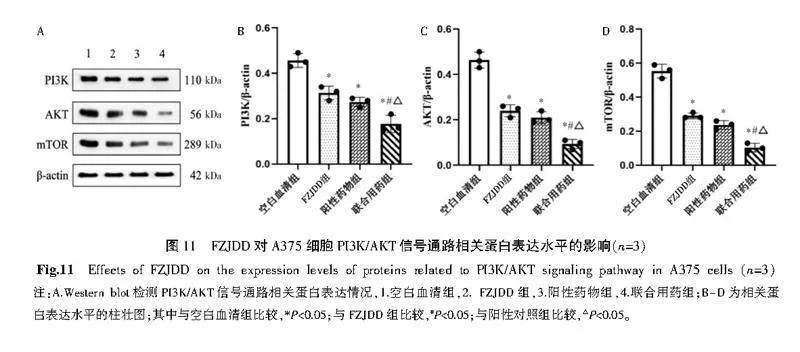
与空白血清组比较,FZJDD组与阳性药物组的PI3K、AKT、mTOR的蛋白表达水平显著降低(Plt;0.05);FZJDD组与阳性药物组的PI3K、AKT、mTOR的蛋白表达水平比较差异无统计学意义(Pgt;0.05);与FZJDD组、阳性药物组比较,联合用药组的PI3K、AKT、mTOR的蛋白表达水平显著降低(Plt;0.05)。详见图11。
3 讨论
PI3K/AKT信号通路在黑色素瘤的发生和发展中起着至关重要的作用[21-22]。PI3K/AKT信号通路的异常激活通常与多种致癌因素有关,在黑色素瘤中PI3K/AKT通路的激活可以通过多种机制实现,如PI3K的基因突变、AKT的过表达或PTEN的失活等[23],最终导致肿瘤的形成和进展。PI3K/AKT信号通路的抑制剂在黑色素瘤的治疗中显示出一定的潜力[24-25]。此通路的激活能够通过增强肿瘤细胞的运动性并降低细胞之间的黏附性来促进肿瘤的侵入与转移[26]。研究表明,PI3K/AKT信号通路能够调控肿瘤细胞的增殖、凋亡、侵袭、迁移及药物耐药等多个生物学过程,该信号通路在多种恶性肿瘤的发生、进展过程中处于持续的异常激活状态[27]。黑色素瘤细胞培养及肿瘤患者活组织检查结果提示约有70%的恶性黑色素瘤患者体内存在PI3K/AKT信号通路异常活动,靶向AKT及其下游基因也被证明可以抑制小鼠黑色素瘤的发展[28]。其中PI3K其表达对恶性肿瘤的发生、进展及预后存在重要影响,其可维持肿瘤细胞的恶性生物学行为并促进肿瘤细胞的增殖;AKT是PI3K下游离子靶向电位调节中的关键分子之一,与恶性肿瘤细胞的生长、凋亡、侵袭密切相关,在药物耐药方面存在关键作用,可维持肿瘤细胞的恶性生物学行为;mTOR是PI3K/AKT的下游激酶,可通过AKT的磷酸化和激活在细胞增殖的调节中发挥作用[29]。激活PI3K/AKT信号通路后,AKT的磷酸化激活NF-κB抑制剂IκB激酶,NF-κB发生核转位,进而激活或抑制下游细胞凋亡相关的靶蛋白,通过一系列的生物信号传递和级联反应,促进了肿瘤细胞的恶性生物学行为[30]。研究显示多数的黑色素瘤病例体内PI3K/AKT信号通路表现为高度激活[31]。陈明等[32]研究证实,半枝莲的提取物半枝莲总黄酮能够抑制荷瘤小鼠体内黑色素瘤的生长,促进黑色素瘤细胞凋亡,并通过明显抑制PI3K、AKT及mTOR蛋白的表达起到抗肿瘤的作用,而p-AKT与AKT的表达量变化趋势一致。
本研究中通过网络药理学分析显示,FZJDD中含槲皮素、β-谷甾醇、豆甾醇等47个有效成分,交集靶点168个,结果表明FZJDD具有多类活性物质、多靶点、多通路及整体调控功能,富集信号通路主要包括癌症通路、PI3K/AKT等信号通路,其中PI3K/AKT信号通路为FZJDD治疗黑色素瘤的主要信号通路之一。此外核心药物靶基因分析显示,AKT、TNF、TP53、IL-6、JUN等靶蛋白为FZJDD治疗黑色素瘤的核心靶点,均受PI3K/AKT信号通路所调控,其中TNF在众多恶性肿瘤中表现出强大的杀灭肿瘤或抑制肿瘤作用,同时表现出较强的免疫调节活性,能够促进人体免疫细胞杀伤癌细胞,此外,TNF还表现出较强的抗炎症作用[33]。TP53基因是人体内的关键抑癌基因,TP53基因突变在黑色素瘤患者中尤为常见,TP53可通过转录合成细胞周期调控相关蛋白,在细胞增殖、凋亡、周期等方面起到极为重要的调控作用[34]。IL-6在激活与调节机体免疫功能及参与炎性反应中扮演着极为重要的角色,其能使炎症损伤程度加剧,同时对机体免疫功能造成影响,从而促进恶性肿瘤的进展[35]。JUN基因的作用主要在调控细胞恶变方面,其对恶性肿瘤的发生、发展及转归均存在重要作用[36]。网络药理学预测PI3K/AKT信号的激活在黑色素瘤中起着重要作用,与黑色素瘤的发生、发展与预后密切相关,PI3K/AKT信号通路可能成为黑色素瘤治疗的重要靶标通路。为了更好地验证网络药理学的结果,本研究采用细胞实验对PI3K/AKT信号通路的关键调控蛋白进行验证。体外细胞验证实验结果表明,FZJDD能够有效抑制PI3K、AKT、mTOR蛋白磷酸化修饰表达,从而抑制PI3K/AKT信号通路关键蛋白PI3K、AKT、mTOR的蛋白及mRNA表达水平,说明FZJDD治疗黑色素瘤的可能机制与下调PI3K/AKT信号通路有关。
本文基于网络药理学研究方法及细胞实验验证对FZJDD治疗黑色素瘤进行初步研究,相对科学可靠地预测FZJDD治疗黑色素瘤的分子作用机制并加以验证,丰富了FZJDD治疗黑色素瘤的机制研究,为中医药治疗黑色素瘤提供了新思路,但中药成分复杂、靶点众多,其药效机制仍需要更进一步的研究探讨。
参考文献
[1] SIEGEL R, GIAQUINTO A N, JEMAL A. Cancer statistics, 2024[J]. CA: A Cancer Journal for Clinicians, 2024, 74: 12-49.
[2] LIU M J, LAN Y N, ZHANG H L, et al. Analysing the causal relationship between potentially protective and risk factors and cutaneous melanoma: A mendelian randomization study[J]. Journal of the European Academy of Dermatology and Venereology, 2024, 38(1): 102-111.
[3] ZHANG J, YE Z W, TOWNSEND D M, et al. Redox pathways in melanoma[M]//Advances in Cancer Research. Amsterdam: Elsevier, 2024: 125-143.
[4] CHERKAS E, KALAFATIS N E, MAROUS M R, et al. Iris melanoma: Review of clinical features, risks, management, and outcomes[J]. Clinics in Dermatology, 2024, 42(1): 62-70.
[5] XU L B, ZHANG L, ZHANG S N, et al. Taxifolin inhibits melanoma proliferation/migration impeding USP18/Rac1/JNK/β-catenin oncogenic signaling[J]. Phytomedicine, 2024, 123: 155199.
[6] SERGI M C, FILONI E, TRIGGIANO G, et al. Mucosal melanoma: Epidemiology, clinical features, and treatment[J]. Current Oncology Reports, 2023, 25(11): 1247-1258.
[7] TRAGER M H, GESKIN L J, SAMIE F H, et al. Biomarkers in melanoma and non-melanoma skin cancer prevention and risk stratification[J]. Experimental Dermatology, 2022, 31(1): 4-12.
[8] PAMPENA R, PICCOLO V, MUSCIANESE M, et al. Melanoma in children: A systematic review and individual patient meta-analysis[J]. Journal of the European Academy of Dermatology and Venereology, 2023, 37(9): 1758-1776.
[9] DAVIS L E, SHALIN S C, TACKETT A J. Current state of melanoma diagnosis and treatment[J]. Cancer Biology amp; Therapy, 2019, 20(11): 1366-1379.
[10] 张琳婧, 梁羽茜, 王媛媛, 等. 黄芪和天花粉配伍治疗黑色素瘤的文献挖掘[J]. 中医药学报, 2019, 47(1): 43-47.
[11] 刘玉昕.治疗恶性黑色素瘤的中西疗法对比[J].现代医学与健康研究电子杂志,2018,2(4):172-173, 181.
[12] 茅婧怡, 周" 洁, 张" 明, 等. 恶性黑色素瘤的中医药治疗及研究进展[J]. 世界临床药物, 2017, 38(6): 428-434.
[13] 刘" 巧, 胡俊媛, 王" 俭, 等. 中医药治疗恶性黑色素瘤临床概况[J]. 河北中医, 2015, 37(6): 934-936, 937.
[14] 李惠菁, 郜然然, 刘" 敏, 等. 基于数据挖掘和网络药理学探讨中医药治疗糖尿病牙周炎的组方规律及作用机制[J]. 中药新药与临床药理, 2024, 35(10): 1600-1610.
[15] 雷" 鸣, 刘" 瑞, 陈" 思, 等. 基于网络药理学的清热止痒汤治疗湿疹的作用机制研究[J]. 新疆中医药, 2024, 42(5): 77-81.
[16] 赵方圆, 李侯希尔, 吴家慧, 等. 基于网络药理学和体外实验探讨瓦草皂苷的抗肿瘤机制[J]. 中南药学, 2024, 22(10): 2663-2669.
[17] 楚欣欣, 潘思雨, 郭" 绅, 等. 网络药理学和分子对接法研究白杨素治疗肺动脉高压的机制[J]. 华西药学杂志, 2024, 39(5): 509-514.
[18] 王" 超, 蔡华俊, 王晨晖, 等. 网络药理学研究筒鞘蛇菰治疗药源性肝损伤的机制[J]. 华西药学杂志, 2024, 39(5): 515-521.
[19] 李仪奎. 中药药理实验方法学[M]. 2版. 上海: 上海科学技术出版社, 2006.
[20] 敖" 丽, 王" 凯, 鲁晓岚, 等. 荧光显微镜联合CCK8法测定原花青素B2对胃癌细胞自噬和凋亡的影响[J]. 中国医疗设备, 2020, 35(S1): 82-84.
[21] LONG G V, SWETTER S M, MENZIES A M, et al. Cutaneous melanoma[J]. Lancet, 2023, 402(10400): 485-502.
[22] CARVAJAL R D, SACCO J J, JAGER M J, et al. Advances in the clinical management of uveal melanoma[J]. Nature Reviews Clinical Oncology, 2023, 20(2): 99-115.
[23] RASHID S, SHAUGHNESSY M, TSAO H. Melanoma classification and management in the era of molecular medicine[J]. Dermatologic Clinics, 2023, 41(1): 49-63.
[24] LAZAROFF J, BOLOTIN D. Targeted therapy and immunotherapy in melanoma[J]. Dermatologic Clinics, 2023, 41(1): 65-77.
[25] BRUNSGAARD E K, WU Y P, GROSSMAN D. Melanoma in skin of color: Part I. Epidemiology and clinical presentation[J]. Journal of the American Academy of Dermatology, 2023, 89(3): 445-456.
[26] 张秋艳, 张琳婧, 樊炜静, 等. 中西医靶向PI3 K/Akt信号通路治疗恶性黑色素瘤的研究进展[J]. 中医药学报, 2019, 47(4): 124-131.
[27] ZAREMBA A, JANSEN P, MURALI R, et al. Genetic and methylation profiles distinguish benign, malignant and spitzoid melanocytic tumors[J]. International Journal of Cancer, 2022, 151(9): 1542-1554.
[28] SAMARKINA A, YOUSSEF M K, OSTANO P, et al. Androgen receptor is a determinant of melanoma targeted drug resistance[J]. Nature Communications, 2023, 14(1): 6498.
[29] LI Y H, ZHOU Y, ZHANG G J, et al. Successful treatment of metastatic vulvar malignant melanoma with toripalimab: A rare case report and review of the literature[J]. Medicine, 2022, 101(36): e30239.
[30] HUNT S V, GARROTT H M, WILLIAMS M E, et al. Bilateral paraneoplastic orbital Myositis associated with malignant melanoma and multiple myeloma[J]. Ophthalmic Plastic and Reconstructive Surgery, 2022, 38(3): e72-e75.
[31] FANG P L, HAN Y K, QU Y H, et al. EIF3B stabilizes PTGS2 expression by counteracting MDM2-mediated ubiquitination to promote the development and progression of malignant melanoma[J]. Cancer Science, 2022, 113(12): 4181-4192.
[32] 陈" 明, 王举涛, 吴珍妮, 等. 半枝莲总黄酮通过PI3K/AKT/mTOR通路诱导肿瘤细胞自噬的体内实验研究[J]. 中国中药杂志, 2017, 42(7): 1358-1364.
[33] DHARANIPRAGADA P, ZHANG X, LIU S X, et al. Blocking genomic instability prevents acquired resistance to MAPK inhibitor therapy in melanoma[J]. Cancer Discovery, 2023, 13(4): 880-909.
[34] CHEN X Y, LI Y D, XIE Y H, et al. Nivolumab and relatlimab for the treatment of melanoma[J]. Drugs of Today, 2023, 59(2): 91-104.
[35] BOJAR P, BURDAN F, WRONECKI L, et al. Melanoma of the gallbladder[J]. Folia Medica Cracoviensia, 2023, 63(2): 77-92.
[36] FLAHERTY K T. A twenty year perspective on melanoma therapy[J]. Pigment Cell amp; Melanoma Research, 2023, 36(6): 563-575.
〔收稿日期〕2024-08-31
〔基金项目〕湖南省研究生科研创新重点项目(CX20210680);湖南省教育厅科学研究重点项目(21A0224);湖南省教育厅科学研究优秀青年项目(23B0377);湖南省中医药管理局中医药科研课题(C2024012);2024年湖南省大学生创新训练计划项目(S202410541030);湖南中医药大学校院联合基金重点项目(2023XYLH002)。
〔通信作者〕*陈其华,男,教授,主任医师,博士研究生导师,E-mail:1105165868@qq.com。

