基于“虚气留滞”理论探讨中药调控线粒体质量控制对肺癌的影响及研究进展

〔摘要〕 肺癌的发病率和死亡率均居于我国癌症首位,线粒体质量控制(MCQ)可通过促进线粒体自噬和动力学改变以及破坏线粒体生物发生,从而促进肺癌的进展。肺癌为本虚标实、虚实夹杂之证,“虚气留滞”是肺癌的关键病机,与MCQ存在直接联系,“虚气”与“留滞”皆可通过MCQ失衡致使肺正常细胞的凋亡,促进肺癌细胞的侵袭与转移,从而影响肺癌的发生发展。从“虚气留滞”理论出发,结合MCQ在肺癌中的发病机制,阐述中医药干预MCQ的进展和思路,以期为中医理论的现代应用及中医药治疗肺癌提供新依据和新靶点。
〔关键词〕 线粒体质量控制;“虚气留滞”理论;肺癌;扶正补虚;祛邪行滞;发病机制;研究进展
〔中图分类号〕R273" " " " "〔文献标志码〕A" " " " " 〔文章编号〕doi:10.3969/j.issn.1674-070X.2025.01.030
Effects and research progress of Chinese medicines on lung cancer through regulation of mitochondrial quality control based on the theory of
\"deficienct-qi stagnation\"
LYU Anqi1, JIANG Cheng3,4, YANG Zhenyu1, ZUO Wanzhao1, LI Yan2, YANG Yi3,4,
HE Cong3,4, TIAN Fanian3,4, KE Jia3,4*
1. School of Chinese Medicine, Hubei University of Chinese Medicine, Wuhan, Hubei 430060, China;
2. The First Clinical College, Hubei University of Chinese Medicine, Wuhan, Hubei 430060, China;
3. Hubei Provincial Hospital of TCM, Affiliated Hospital of Hubei University of Chinese Medicine, Wuhan Hubei,
430074, China; 4. Hubei Shizhen Laboratory, Wuhan Hubei 430060, China
〔Abstract〕 Both the incidence and mortality of lung cancer rank first among all all types of cancers in China, and mitochondrial quality control (MCQ) can promote the progression of lung cancer by facilitating mitophagy, altering mitochondrial dynamics, and disrupting mitochondrial biogenesis. Lung cancer is characterized by root deficiency and tip excess, as well as mixed deficiency and excess, with \"deficienct-qi stagnation\" being the key pathogenesis, which is directly related to MCQ. Both \"deficienct-qi\" and \"stagnation\" can disrupt the balance of MCQ, leading to the apoptosis of normal lung cells and promoting the invasion and metastasis of lung cancer cells, thereby affecting the occurrence and progression of the disease. This article, based on the theory of \"deficienct-qi stagnation\", elaborates on the progress and approaches of Chinese medicine interventions combined with the pathogenic mechanisms of MCQ in lung cancer, providing new evidence and targets for the modern application of Chinese medicine theories and the treatment of lung cancer with Chinese medicine.
〔Keywords〕 mitochondrial quality control; theory of \"deficienct-qi stagnation\"; lung cancer; reinforcing healthy qi and supplementing deficiency; eliminating pathogenic factors and resolving stagnation; pathogenesis; research progress
据最新癌症调查数据显示,全球近1 000万癌症死亡病例中因肺癌死亡约180万例,死亡人数远高于其他癌症,是全球最常见及病死率最高的癌症类型[1-2]。目前肺癌的治疗以经典疗法为主,如手术切除、放射治疗和化学治疗等,取得了显著的临床疗效。但经典疗法带来较多的不良反应,其临床有效性受到诸多因素的限制,严重影响患者的生存期、生存质量及治疗效果,并不适用于所有的肺癌患者[3]。因此,亟待进一步探索更多的肺癌治疗方案及有效药物。
线粒体质量控制(mitochondrial quality control,MCQ)包括线粒体自噬、线粒体动力学和生物发生,对于细胞能量的产生、代谢和信号传导至关重要,其与肺癌的发生发展密切相关[4-5]。同时,肺癌为本虚标实、虚实夹杂之证,“虚气留滞”是肺癌的关键病机,该病机与MCQ存在直接联系,“虚气”与“留滞”皆可致使MCQ失衡,促进肺正常细胞的凋亡、肺癌细胞的侵袭与转移,从而影响肺癌的发生发展[6]。研究表明,中医药可通过调节MCQ从而抑制或延缓肺癌的发生发展;中医药以其辨证论治、扶正祛邪等特点,在改善肺癌病理状态、提高机体免疫力及生存期、改善患者生存质量等方面具有独特优势,同时能弥补目前一线化学治疗药物耐药方面的不足,改善患者临床症状及放化疗的毒副作用,降低肺癌的高转移性和高复发性[7-8]。因此,本文主要从“虚气留滞”与肺癌的关系、MCQ在肺癌中的作用、“虚气留滞”与MCQ失衡的关系以及对中药单体、中药复方基于“虚气留滞”理论调控MCQ干预肺癌进行系统梳理,以期为肺癌在药物治疗研究以及临床新药研发上提供新的思路,同时也为后续更深入的机制研究提供参考和借鉴。
1 “虚气留滞”是肺癌的基本病机变化
“虚气留滞”首见于宋代杨士瀛的《仁斋直指方·胀满方论》:“虚者,时胀时减,虚气留滞,按之则濡,法当以温药和之。”其中,明确提出虚是滞的前提条件,治疗上应当选用温通药物。王永炎院士援引《仁斋直指方·胀满方论》的相关描述首先提出,“虚气留滞”理论是指元气亏虚,失于温煦和推动,所致气血相失,进而气血津液运行失常,最终出现气滞、痰凝、血瘀、经络阻滞的病理过程[9]。“虚气留滞”病机理论对某些疾病发生发展过程中以虚为本、以滞为标、因虚而滞的时空动态性和虚-滞之间的内在因果关系进行了高度概括。
肺癌属于中医学“肺积”“息积”“息贲”等范畴,金代医家张元素指出“壮人无积,虚人则有之”,《医宗必读·积聚》中载:“积之成也,正气不足,而后邪气踞之。”均指出正虚是肺癌发病的先决条件,邪实为标、留滞不通、凝聚成癌是发病的关键环节[10]。肺为娇脏、华盖,在体合皮毛,在窍为鼻,外邪侵袭,首先犯肺,致气机升降失调,肺失于宣发肃降,无力运行气血津液,津液凝聚成痰,血停致瘀,瘀血、痰浊等病理产物相互博结,积聚成块,日久耗伤气血津液,终成癌毒,发为肺癌。在肺癌的发生发展进程中,“虚气”为本,“留滞”为标,本虚标实。肺癌的病因病机演变过程与“虚气留滞”病机理论具有高度相似性,均强调其本在“虚”,其标在“滞”,因虚而滞,滞久而虚的动态病理状态。正衰积损,无力抗邪,邪必干正,诸邪日益增剧,而积亦甚,正气愈虚,邪积愈甚,又致正气愈虚,正所谓“无虚不成积,久积正愈虚”,故可认为“虚气留滞”是肺癌的基本病机。
2 MCQ在肺癌中的作用
MQC是维持线粒体稳态和功能的重要机制,它涉及多个层面的调控,包括线粒体自噬、线粒体动力学和生物发生等,MCQ失衡与肺癌的发生和发展有着密切关系[11-12]。
2.1" 线粒体自噬与肺癌
线粒体在细胞内能量代谢中的高需求对肺癌细胞尤为重要。研究表明,肺癌细胞可以通过减少线粒体自噬和增加线粒体生物发生来响应应激,从而在恶劣的肿瘤微环境中存活[13]。此外,线粒体自噬衔接蛋白B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)/Bcl-2相互作用蛋白3(Bcl-2 interacting protein 3,BNIP3)和Bcl-2/腺病毒E1B 19kDa结合蛋白3样(Bcl-2/adenovirus E1B 19 kDa protein-interacting protein 3-like, BNIP3L)/Nip样蛋白(Nip-like protein X,NIX)通过蛋白激酶PTEN诱导假定激酶1(PTEN induced putative kinase 1,PINK1)/parkin RBR E3泛素蛋白连接酶非依赖性线粒体自噬途径在肺癌发生中发挥重要作用[14]。研究发现,在kirsten大鼠肉瘤病毒癌基因同源物(kirsten rat sarcoma viral oncogene homolog,KRAS)突变的癌细胞中,BNIP3L/NIX通过促进线粒体自噬,增强线粒体氧化还原稳定性,并允许细胞内葡萄糖转移到糖酵解以减少活性氧(reactive oxygen species,ROS)的产生,从而促进癌细胞生长[15-16]。KRAS基因的突变率在非小细胞肺癌中很高,KRAS突变的靶向药物有限且通常表现不佳,导致KRAS突变的肺癌患者5年生存率较低[17]。线粒体自噬与肺癌产生的直接关系尚未被证实,但KRAS和TP53都是肺癌的关键基因,它们的突变会导致肺癌细胞生长和分裂失控,从而促进肺癌的快速发展和恶化。线粒体自噬与肺癌密切相关,其对肺癌的作用是双面的,在早期抑制肺癌发展,在晚期促进肺癌发展,可能与肺癌发展阶段有关[18-19]。
2.2" 线粒体动力学与肺癌
正常情况下,线粒体裂变与融合所形成的动态平衡对于维持线粒体功能至关重要,其参与了肿瘤的发生发展及肿瘤耐药机制的形成;而在肺癌细胞中,线粒体裂变和融合动力学的改变会促使其适应细胞应激和侵袭,从而导致其对化学治疗和靶向药物耐药[20-21]。研究表明,在缺氧条件下,癌细胞会增加线粒体裂变,从而对顺铂产生耐药性;动力蛋白相关蛋白1(dynamin-related protein 1,DRP1)作为控制线粒体裂变的起始蛋白,通过与线粒体外膜结合开始裂变,在癌细胞裂变耐药过程中起关键作用[22];同时,DRP1的高表达会促进肺癌细胞的侵袭性转移[23-24]。然而,也有研究表明,DRP1在肺癌中的表达可能与肺癌发生机制有关,并且DRP1在肺癌进展期间持续下降,DRP1水平的增加和降低都与癌症的发展和进展有关,因此,在线粒体裂变中取得平衡对肺癌的发生发展具有重要意义[25-27]。
此外,癌细胞通常会经历不受控制的细胞周期进程,并且大多数细胞周期检查点需要有缺陷才能使细胞癌变,故大多数癌细胞的发育通常与缺陷的细胞周期检查点和细胞凋亡失调密切相关。研究表明,DRP1参与细胞凋亡,其中Bcl-2相关X蛋白(Bcl-2-associated X,Bax)是调节这一过程的重要细胞凋亡相关蛋白,而DRP1与Bax的N末端区域发生物理相互作用并促进细胞凋亡,线粒体融合相关蛋白线粒体融合素1(recombinant mitofusin 1,MFN1)的表达降低可有效抑制线粒体依赖性细胞凋亡;同时,ROS在缺陷的线粒体中累积,诱导线粒体损伤发生,进而导致线粒体膜电位上的非特异性孔打开,线粒体中凋亡相关因子释放到细胞质中,由此引发细胞受损甚至凋亡,导致肺癌发生发展进程加快[28]。此外,DRP1和肌动蛋白之间的密切关系表明DRP1与肺癌细胞迁移之间存在着密切联系,DRP1的低表达或MFN1的过表达可降低癌细胞的迁移能力[29-30]。此外,细胞糖酵解代谢重编程的发生,与MQC稳态介导线粒体功能调节有关,由线粒体分裂和融合动态过程构成的线粒体动力学,有利于促进肺癌细胞生长[30]。综上,线粒体动力学与肺癌的转移存在密切联系,在肺癌的发生发展中起着重要作用。
2.3" 线粒体生物发生与肺癌
诸多复杂的机制均可损害肺癌线粒体生物发生,其中包括基因突变、表观遗传修饰和代谢重编程等。研究表明,线粒体DNA(mitochondrial DNA,mtDNA)是编码氧化磷酸化和代谢平衡的重要机制,mtDNA突变能影响癌症的复发[31]。线粒体复合物Ⅰ是细胞内最大的膜蛋白复合物之一,相关基因的热点截短突变是多种癌症的共同特征[32]。与编码呼吸复合物Ⅲ、Ⅳ和V3的基因突变相比,复合物Ⅰ的截短突变(尤其是MT-ND5)所占比例较高[33]。由于复合体Ⅰ是还原型辅酶Ⅰ(nicotinamide adenine dinucleotide,NADH)氧化的主要位点,故导致氧化还原失衡,并对细胞代谢产生广泛的下游影响[34]。此外,特别是在肺癌中出现异常激活的致癌途径,如丝裂原激活的蛋白激酶/丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)/细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)和磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶标(mammalian target of rapamycin,mTOR)已被证实参与调节线粒体功能和生物发生[35]。研究表明,肺癌细胞由于端粒酶异常活化等能损害线粒体生物发生而具有永生性,肺癌细胞的永生性依赖于其与正常细胞不同的生理特征,其中代谢重编程能满足肺癌细胞对能量和细胞大分子的旺盛需求,也是肺癌发生的特征之一[36]。此外,代谢重编程是致癌过程早期阶段的标志之一,代谢重编程在诱导细胞恶性转化过程中起关键调节作用,以应对细胞存活和增殖的能量需求[37]。
3 “虚气留滞”与MCQ失衡的联系
肺癌为本虚标实、虚实夹杂之证。本虚主要为肺脾肾亏虚、气血阴阳失和、脏腑精气亏损——“虚气”;标实主要为气、痰、湿、瘀、毒等病理产物阻滞——“留滞”。“虚气”为肺癌发病之本,“留滞”为其发病之标,“虚气”与“留滞”相互胶着,互为因果,呈螺旋式发展,贯穿肺癌发生发展的始终。“虚气”与“留滞”皆可通过MCQ失衡致使肺正常细胞的凋亡,肺癌细胞的侵袭与转移,从而影响肺癌的发生发展。
3.1" “虚气”与MCQ失衡
线粒体可被认为是气的微观表现之一,气与线粒体在物质和功能上具有高度相似性[38]。正常情况下,气具有推动、温煦、防御的功能,机体通过气化完成新陈代谢和脏腑间的信息交流。线粒体是能量代谢的中心,通过氧化磷酸化产生腺苷三磷酸(adenosine-triphosphate,ATP)和热能,为人体提供能量、维持体温,同时线粒体存在抗氧化系统,可阻遏自由基的损害,并通过MQC维持整体稳态,支持肺正常细胞的应激反应,防止肺癌细胞的侵袭与转移,最终预防细胞损伤与死亡的发生,一定程度上与气的防御和维稳功能密切相关。
病理情况下,五脏之气亏虚,气机运行无力,四肢懈惰乏力;而线粒体是机体能量代谢的重要场所,若MCQ失衡,功能受损,生成的能量将不足以支撑机体的各项生命活动。因此,气虚之体可能存在相应的MCQ失衡以及功能紊乱。“虚气”与MCQ失衡存在直接联系。线粒体作为细胞的能量和动力工厂,是机体维持生命活动所需的能量来源,其功能在一定程度上与气的推动作用类似,线粒体自噬是细胞清除功能异常或结构受损线粒体的手段,有利于维持细胞的稳态,这与气的调控作用有一定关联。当机体处于气虚状态时,无力抵御外邪入侵,被迫处于病理状态,线粒体自噬激活增加,但此时气的推动与调控作用不平衡,使得部分线粒体自噬的过程不能完整进行,自噬体不能被溶酶体充分降解而产生堆积,从而影响肺癌的发生发展[39]。
3.2" “留滞”与MCQ失衡
“留滞”是MCQ失衡的直接原因。其病机主要表现在以下两个方面:MCQ需要气有足够的推动作用,痰瘀等有形之邪阻滞之时,机体推动清除有形之邪,这与线粒体受损推动MCQ有一定的相似之处,但痰瘀等病理产物耗伤人体正气,肺、脾、肾消除痰瘀的同时亦需耗损人体正气,随着病程的迁延日久,机体清除痰瘀所耗费的正气越多,肺脾肾亏虚更甚,肺脏失养,痰瘀等病理产物持续增加,持续消耗人体正气,形成恶性循环;再者,当痰瘀等有形之邪累积到一定程度时,血不载气,导致肝气郁滞,肝邪乘脾,木气克土,使得脾气虚弱,而此时机体处于过度应激状态,会引起线粒体自噬的过度激活、裂变以及生物发生失衡,大量耗气后气的推动作用减弱,导致细胞凋亡,从而加速肺癌的发展进程[40]。详见图1。
4 基于“虚气留滞”调控MCQ干预肺癌
4.1" 扶正补虚
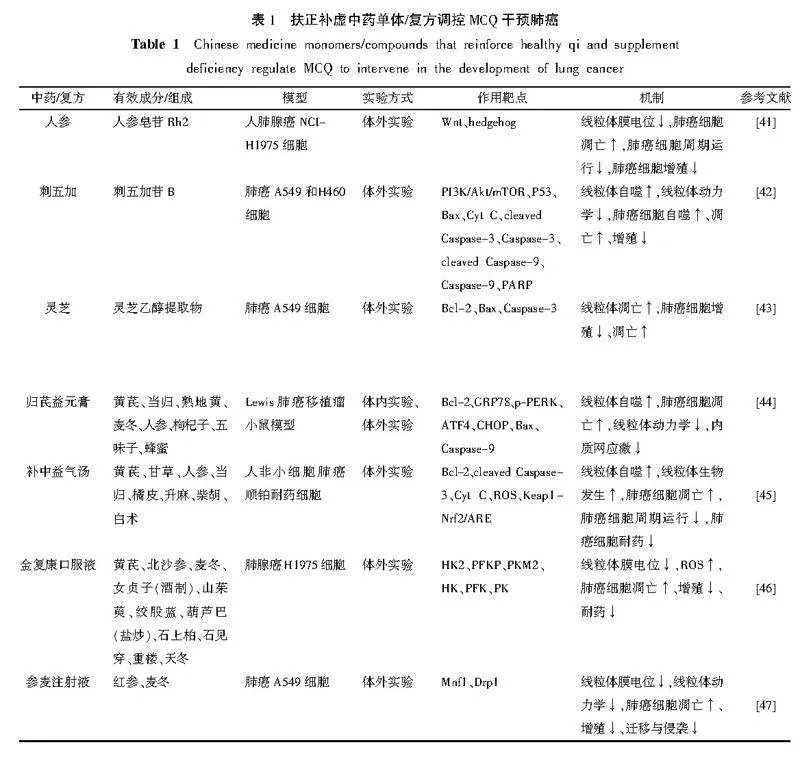
“虚气”为肺癌发病之本,可导致MCQ失衡,故中医药通过扶正补虚,调控线粒体质量,从而延缓甚或抑制肺癌的发生发展进程。人参皂苷Rh2是从红参中提取得到的一种二醇型低糖链皂苷单体,也是人参中主要活性成分之一。丛中一等[41]通过体外实验研究表明,人参皂苷Rh2可通过在S641磷酸化β-连环蛋白(β-catenin)抑制Wnt和hedgehog信号传导,显著降低肺癌细胞线粒体膜电位,抑制肺癌细胞增殖,同时促进细胞凋亡和抑制上皮-间质转化来抑制非小细胞肺癌细胞的增殖和转移,以及通过调节糖酵解过程的关键酶抑制糖酵解,糖链减少可能有利于其抗肿瘤活性,从而抑制肺癌细胞增殖,促进凋亡。刺五加苷B来源于五加科植物刺五加的根及根茎,曹雪婷等[42]通过体外实验研究表明,刺五加苷B可通过线粒体途径增加线粒体自噬和抑制线粒体动力学干预PI3K/Akt/mTOR信号通路,增加肺癌细胞中P53、Bax、细胞色素C(cytochrome C,Cyt C)、活化型胱天蛋白酶-3、胱天氨酸蛋白酶(Caspase)-3、cleaved Caspase-9、Caspase-9以及多聚腺苷二磷酸核糖聚合酶[poly(ADP-ribose)polymerase,PARP]等蛋白表达水平以及Bax与Bcl-2的比值,降低Bcl-2以及生存素蛋白表达,使肺癌A549和H460细胞发生核固缩的数量增加、凋亡小体形成的数量增多,从而诱导肺癌细胞发生凋亡和自噬,抑制其增殖。灵芝是中国传统的药用真菌,具有益气扶正固本之效。陈源等[43]通过体外实验研究发现,灵芝乙醇提取物可通过线粒体途径下调Bcl-2,上调Bax和激活Caspase-3,从而诱导肺癌细胞凋亡,抑制其增殖。
归芪益元膏有益气补血之功,孔思琪等[44]通过体内外实验研究发现,归芪益元膏可通过调控线粒体凋亡、自噬、动力学以及内质网应激途径,降低肺癌组织中Bcl-2蛋白表达水平,显著升高葡萄糖调节蛋白78(glucose regulated protein 78kD,GRP78)、磷酸化的蛋白激酶R样内质网激酶(protein kinase RNA-like endoplasmic reticulum kinase,p-PERK)、活化转录因子4(recombinant activating transcription factor 4,ATF4)、凋亡蛋白C/EBP同源蛋白(C/EBP-homologous protein,CHOP)、Bax、Caspase-9蛋白表达水平,从而对Lewis肺癌小鼠产生抑瘤作用,降低肿瘤质量,提高抑瘤率,诱导肺癌细胞凋亡。补中益气汤具有补中益气、升阳举陷之功。牟琪瑞等[45]通过体外实验研究表明,补中益气汤可通过Nrf2/ROS通路调控线粒体途径细胞凋亡,上调凋亡蛋白cleaved Caspase-3与Cyt C表达水平,抑制Bcl-2和ROS表达水平,调控线粒体自噬、生物发生、肺癌细胞周期以及耐药性,诱导肺癌细胞凋亡,从而延缓肺癌的进程以及改善肺癌A549细胞的顺铂耐药情况。
金复康口服液具有益气养阴、清热解毒之功。张轶等[46]通过体外实验研究表明,金复康口服液可通过降低肺癌细胞葡萄糖摄取能力,降低糖酵解通路关键限速酶己糖激酶(hexokinase,HK)、磷酸果糖激酶(phosphofructokinase,PFK)、丙酮酸激酶(pyruvate kinase,PK)的活性及HK2、P型磷酸果糖激酶(recombinant phosphofructokinase platelet,PFKP)、M2型丙酮酸激酶(recombinant pyruvate kinase isozymes M2,PKM2)蛋白表达,减少乳酸生成,抑制有氧糖酵解过程,损伤线粒体膜电位并促进ROS累积,影响线粒体功能,降低肺癌细胞耐药性。参麦注射液有益气固脱、养阴生津、生脉之功效。王晓芳等[47]通过体外实验研究表明,参麦注射液可有效降低肺癌A549细胞线粒体膜电位,调控肺癌A549细胞线粒体动力学相关蛋白Mnf1和Drp1的表达,调节线粒体动力学,促进肿瘤细胞凋亡,抑制其增殖、迁移与侵袭,从而达到抗肿瘤作用。扶正补虚之中药复方/单体/提取物调控MCQ干预肺癌具体见表1。
4.2" 祛邪行滞
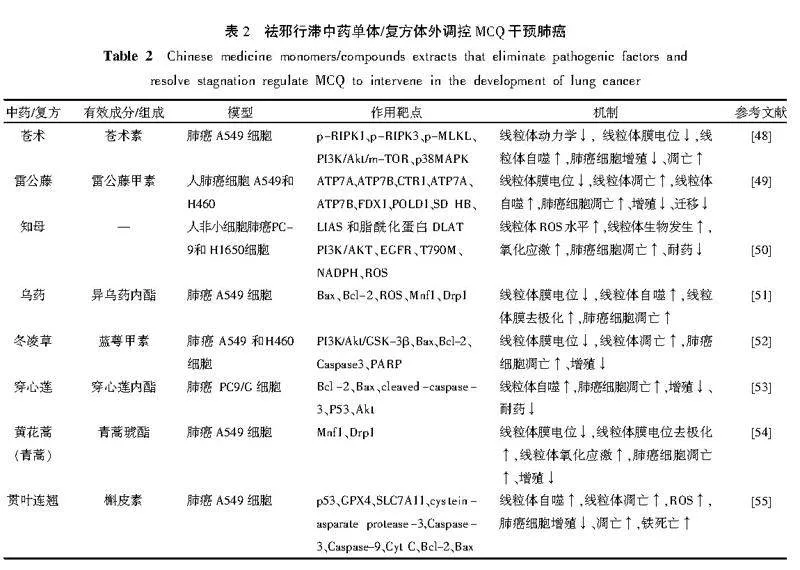
“留滞”为肺癌发病之标,是致使MCQ失衡的直接原因,中医药可通过祛邪行滞,减少或消除机体内病理产物,如痰瘀等,调控线粒体质量,从而干预肺癌的发生发展。苍术素主要来源于菊科植物茅苍术或北苍术的干燥根茎,苍术为辛苦温燥之品,具有燥湿健脾、祛风散寒之效。王乙波等[48]通过体外实验研究发现,苍术素可通过激活丝氨酸苏氨酸激酶1(receptor interacting protein,RIPK1)/受体相互作用RIPK3/混合系激酶域样(mixed lineage kinase dom⁃
ain-like,MLKL)信号通路诱导肺癌A549细胞发生程序性坏死,抑制A549细胞及其裸鼠移植瘤的生长,经苍术素处理过的肺癌A549细胞发生肿胀,线粒体内脊消失呈空泡化,细胞内容物向外泄漏,细胞核聚集,表现为坏死特征,可诱导肺癌A549细胞程序性坏死,提升肺癌A549细胞中ROS水平并抑制线粒体膜点位,诱导线粒体凋亡,同时通过调节PI3K/Akt/mTOR和p38 MAPK信号通路诱导肺癌细胞自噬,抑制其增殖,延缓肺癌的进程。雷公藤甲素是从卫矛科植物雷公藤的根、叶、花及果实中提取的一种环氧二萜内酯化合物。肖艳霞等[49]通过体外实验研究表明,雷公藤甲素可通过下调ATP7A和ATP7B表达,使细胞内线粒体膜电位下降和铜浓度增加,进而下调铁硫簇蛋白表达水平、增加二氢硫辛酸转乙酰基酶(dihydrolipoamide S-acetyltransferase, DLAT)寡聚体表达水平,诱导肺癌细胞铜死亡,抑制肺癌细胞增殖与迁移。
知母为清热抗癌的代表中药,余娅娅等[50]通过体外实验研究表明,知母可能通过上调线粒体ROS水平,促进线粒体生物发生和肺癌细胞凋亡,进而促进氧化应激诱导的肺癌细胞死亡,逆转PI3K/Akt通路异常活化介导的肺癌细胞耐药。异乌药内酯来源于樟科植物乌药的干燥块茎,乌药具有行气止痛、温肾散寒之功效。郑倩等[51]通过体外实验研究表明,异乌药内酯可通过诱导细胞内ROS积累,促进线粒体膜显著去极化,激活线粒体凋亡途径,上调促凋亡蛋白Bax表达水平而下调抗凋亡蛋白Bcl-2表达水平,从而抑制肺癌A549细胞生长并诱导其凋亡。蓝萼甲素来源于冬凌草,冬凌草具有清热解毒、活血止痛之效。张德[52]通过体外实验研究表明蓝萼甲素可呈浓度依赖性方式降低肺癌A549细胞线粒体膜电位,诱导肺癌细胞线粒体凋亡,诱导肺癌细胞凋亡,同时上调Bax蛋白和下调Bcl-2的蛋白表达水平,活化Caspase-3和PARP,抑制PI3K/Akt/糖原合酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)通路,抑制肺癌细胞增殖并诱导其凋亡,从而发挥抗肺癌的作用。穿心莲内酯来源于穿心莲的全草,穿心莲具有清热解毒、凉血、消肿、燥湿之效。王陈晨[53]通过体外实验研究表明,穿心莲内酯可通过激活内源性线粒体细胞凋亡与自噬,明显升高Bax、cleaved-Caspase-3、P53蛋白表达水平,降低Bcl-2蛋白表达水平,有效抑制肺癌PC9/G细胞增殖,诱导肺癌细胞凋亡,协同以降低肺癌PC9/G细胞耐药性。
青蒿琥酯是青蒿素重要衍生物,吴高平等[54]通过体外实验研究发现,青蒿琥酯可诱导线粒体膜电位下降及造成线粒体损伤,增加ROS的生成且抑制线粒体ATP的产生,促使肺癌细胞能量代谢障碍,诱导其凋亡,同时靶向肿瘤细胞糖酵解,抑制细胞的多个能量来源途径,有效降低肺癌A549细胞活力,抑制其增殖,有效延缓肺癌的发生发展。槲皮素是植物中广泛存在的天然黄酮类化合物,是贯叶连翘的主要有效成分。李畅等[55]通过体外实验研究表明,槲皮素能够显著促进线粒体凋亡相关蛋白Caspase-3、Caspase-9、Cyt C和Bax蛋白表达,并抑制抗凋亡因子Bcl-2蛋白表达,显著促进铁死亡相关蛋白p53表达,抑制肺癌A549细胞增殖并诱导铁死亡,同时抑制谷胱甘肽过氧化物酶4(recombinant glutathione peroxidase4,GPX4)及胱氨酸/谷氨酸逆向转运蛋白溶质载体家族7成员11(solute carrier family 7 member 11,SLC7A11)蛋白表达水平,上调细胞内mt ROS及脂质过氧化物水平,诱导肺癌细胞凋亡,延缓肺癌的发生发展。祛邪行滞之中药单体/复方调控MCQ干预肺癌具体见表2。
5 小结
本文主要基于“虚气留滞”理论,从“虚气留滞”与肺癌的关系、MCQ在肺癌中的作用、“虚气留滞”与MCQ失衡的关系以及对中药单体、中药复方基于“虚气留滞”理论调控MCQ干预肺癌进行系统梳理,探讨肺癌的病机变化特点,“虚气”为本,“留滞”为标,二者互为因果,推动疾病进展,肺癌发病过程中正虚与邪滞并存,癌毒侵袭机体,加之正气虚损日久,脏腑功能失调,气血阴阳失和,此种病理状态为“虚气”;病久入深,致气滞、血瘀、痰阻、毒聚,多种病理产物阻滞,此为“留滞”。同时,“虚气”与“留滞”皆可通过MCQ失衡致使肺正常细胞的凋亡,肺癌细胞的侵袭与转移,从而影响肺癌的发生发展,可通过调控MCQ的平衡有效干预肺癌。在防治肺癌中,根据“虚气留滞”病机特点,遵循“扶正补虚、祛邪行滞”的治法,临证时可根据患者临床表现及证候的不同随证变通,不必拘泥于一方一药,在扶正补虚的基础上可配合行气化滞、益气活血、涤痰通络、抗癌解毒等治法。基于“虚气留滞”动态辨证体系,中医药在治疗肺癌方面具有独特优势,值得深入研究。
中医药在延缓肺癌发生发展方面疗效确切,具有标本兼顾、安全性好、不良反应少等优势,但目前其调控MCQ干预肺癌仍具有一定的局限性,例如目前中药基于有效成分的研究较少且多作用于某单一成分,有待挖掘多成分的相互作用。同时,基于MCQ干预肺癌的单味中药、中药复方以及中药化学成分的研究较少,目前主要集中在PINK1/Parkin通路方面的研究,可以开展关于单味中药或中药化学成分在此方面的机制研究,并拓展到其他通路。此外,在动物实验中,动物模型多为西医模型,中医不同证型动物模型研究较少。综上,MCQ与“虚气留滞”理论有着密切联系,二者结合可有助于为中西医结合防治肺癌提供强有力的理论依据,有助于拓展肺癌的治疗思路和发挥中医药防治肺癌的特色。
参考文献
[1] ADAMS S J, STONE E, BALDWIN D R, et al. Lung cancer screening[J]. Lancet, 2023, 401(10374): 390-408.
[2] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA, 2021, 71(3): 209-249.
[3] ABU ROUS F, SINGHI E K, SRIDHAR A, et al. Lung cancer treatment advances in 2022[J]. Cancer Investigation, 2023, 41(1): 12-24.
[4] ZHANG J N, QIAO W L, LUO Y F. Mitochondrial quality control proteases and their modulation for cancer therapy[J]. Medicinal Research Reviews, 2023, 43(2): 399-436.
[5] LIU J L, WANG J Y, XIONG A Y, et al. Mitochondrial quality control in lung diseases: Current research and future directions[J]. Frontiers in Physiology, 2023, 14: 1236651.
[6] 贺佳文, 韩" 冰, 卢佳萱, 等. 基于“虚气留滞”理论探讨肺癌高凝状态的病机与治法[J]. 北京中医药大学学报, 2023, 46(12): 1767-1771.
[7] 田建辉. 中医药扶正调控免疫防治肺癌[J]. 中国肿瘤生物治疗杂志, 2023, 30(11): 943.
[8] 李姝蒙, 陈芋屹, 吴桐桐, 等. 西医一线、中医药联合西医一线治疗广泛期小细胞肺癌的研究进展[J]. 中国医药导报, 2023, 20(30): 43-46.
[9] 高" 维, 郭蓉娟, 王永炎. 论七情致病“虚气留滞”病因病机新认识[J]. 环球中医药, 2019, 12(10): 1490-1494.
[10] 李中梓. 医宗必读[M]. 2版. 顾宏平,校注. 北京: 中国中医药出版社, 2005.
[11] MUSIKA W, KAMSA-ARD S, JIRAPORNKUL C, et al. Lung cancer survival with current therapies and new targeted treatments: A comprehensive update from the srinagarind hospital-based cancer registry from (2013 to 2017)[J]. Asian Pacific Journal of Cancer Prevention: APJCP, 2021, 22(8): 2501-2507.
[12] NAIK P P, BIRBRAIR A, BHUTIA S K. Mitophagy-driven metab⁃olic switch reprograms stem cell fate[J]. Cellular and Molecular Life Sciences, 2019, 76(1): 27-43.
[13] SHARMA A, AHMAD S, AHMAD T, et al. Mitochondrial dynamics and mitophagy in lung disorders[J]. Life Sciences, 2021, 284: 119876.
[14] 李婷婷, 刘学飞. 基于PINK1/Parkin通路探讨川陈皮素诱导非小细胞肺癌A549细胞自噬的机制[J/OL]. 解剖科学进展, 1-7[2024-08-30]. http://kns.cnki.net/kcms/detail/21.1347.Q.20241107.1143.008.html.
[15] LIU K, LEE J, KIM J Y, et al. Mitophagy controls the activities of tumor suppressor p53 to regulate hepatic cancer stem cells[J]. Molecular Cell, 2017, 68(2): 281-292.
[16] HUMPTON T J, ALAGESAN B, DENICOLA G M, et al. Oncogenic KRAS induces NIX-mediated mitophagy to promote pancreatic cancer[J]. Cancer Discovery, 2019, 9(9): 1268-1287.
[17] DRAKE L E, SPRINGER M Z, POOLE L P, et al. Expanding perspectives on the significance of mitophagy in cancer[J]. Seminars in Cancer Biology, 2017, 47: 110-124.
[18] 孙" 肖, 梅" 雪, 徐菁菁, 等. 基于调控线粒体自噬的中药治疗常见呼吸系统疾病的研究进展[J/OL]. 中药药理与临床, 1-19[2024-08-30]. https://doi.org/10.13412/j.cnki.zyyl.20241104.006.
[19] HIRSCH F R, SCAGLIOTTI G V, MULSHINE J L, et al. Lung cancer: Current therapies and new targeted treatments[J]. Lancet, 2017, 389(10066): 299-311.
[20] HAN Y, KIM B, CHO U, et al. Mitochondrial fission causes cisplatin resistance under hypoxic conditions via ROS in ovarian cancer cells[J]. Oncogene, 2019, 38(45): 7089-7105.
[21] RODRIGUES T, FERRAZ L S. Therapeutic potential of targeting mitochondrial dynamics in cancer[J]. Biochemical Pharmacology, 2020, 182: 114282.
[22] GE Y F, BOOPATHY S, SMITH A, et al. A model membrane platform for reconstituting mitochondrial membrane dynamics[J]. Journal of Visualized Experiments, 2020(163): 10.
[23] GIACOMELLO M, PYAKUREL A, GLYTSOU C, et al. The cell biology of mitochondrial membrane dynamics[J]. Nature Reviews Molecular Cell Biology, 2020, 21: 204-224.
[24] LECORDIER L, HEO P, GRAVERSEN J H, et al. Apolipoproteins L1 and L3 control mitochondrial membrane dynamics[J]. Cell Reports, 2023, 42(12): 113528.
[25] KIM Y Y, YUN S H, YUN J. Downregulation of Drp1, a fission regulator, is associated with human lung and colon cancers[J]. Acta Biochimica et Biophysica Sinica, 2018, 50(2): 209-215.
[26] JIN P, JIANG J W, ZHOU L, et al. Mitochondrial adaptation in cancer drug resistance: Prevalence, mechanisms, and management[J]. Journal of Hematology amp; Oncology, 2022, 15(1): 97.
[27] SESSIONS D T, KASHATUS D F. Mitochondrial dynamics in cancer stem cells[J]. Cellular and Molecular Life Sciences, 2021, 78(8): 3803-3816.
[28] JENNER A, PEÑA-BLANCO A, SALVADOR-GALLEGO R, et al. DRP1 interacts directly with BAX to induce its activation and apoptosis[J]. The EMBO Journal, 2022, 41(8): e108587.
[29] YU L L, XIAO Z K, TU H Y, et al. The expression and prognostic significance of Drp1 in lung cancer: A bioinformatics analysis and immunohistochemistry[J]. Medicine, 2019, 98(48): e18228.
[30] LIANG X H, DANG S Q. Mitochondrial dynamics related genes-MFN1, MFN2 and DRP1 polymorphisms are associated with risk of lung cancer[J]. Pharmacogenomics and Personalized Me⁃dicine, 2021, 14: 695-703.
[31] MAHMOOD M, LIU E M, SHERGOLD A L, et al. Mitochondrial DNA mutations drive aerobic glycolysis to enhance checkpoint blockade response in melanoma[J]. Nature Cancer, 2024, 5(4): 659-672.
[32] XU R, LUO X, YE X, et al. SIRT1/PGC-1α/PPAR-γ correlate with hypoxia-induced chemoresistance in non-small cell lung cancer[J]. Frontiers in Oncology, 2021, 11: 682762.
[33] BONNAY F, VELOSO A, STEINMANN V, et al. Oxidative metabolism drives immortalization of neural stem cells during tumorigenesis[J]. Cell, 2020, 182(6): 1490-1507.
[34] 吴发胜, 张" 晖, 谢家童, 等. 线粒体在肺癌发生中的作用机制及治疗研究进展[J]. 肿瘤防治研究, 2024, 51(4): 278-283.
[35] YU D D, LIU C, GUO L. Mitochondrial metabolism and cancer metastasis[J]. Annals of Translational Medicine, 2020, 8(14): 904.
[36] CRUZ-BERM['][U]DEZ A, LAZA-BRIVIESCA R, VICENTE-BLANCO R J, et al. Cisplatin resistance involves a metabolic reprogramming through ROS and PGC-1α in NSCLC which can be overcome by OXPHOS inhibition[J]. Free Radical Biology amp; Medicine, 2019, 135: 167-181.
[37] 史雪艳. RFWD3通过抑制cGAS/STING细胞质DNA感应通路调控非小细胞肺癌免疫重编程/线粒体相关程序性细胞死亡模式在预测非小细胞肺癌预后中的作用[D]. 北京: 北京协和医学院, 2024.
[38] 张茂林, 张六通, 邱幸凡, 等. 论线粒体与中医“气”的关系[J]. 中国中医基础医学杂志, 2001, 7(4): 60-61.
[39] 王苏晋, 蒋鹭莲, 徐晓华, 等. 基于“气火学说”及线粒体能量代谢机制论治肺癌[J]. 中医学报, 2023, 38(5): 932-936.
[40] 俞赟丰, 唐" 佩, 周曼丽, 等. 基于“正虚邪滞”理论探讨肺癌自噬机制及中药干预进展[J]. 中国实验方剂学杂志, 2023, 29(18): 190-197.
[41] 丛中一, 吕泽旗, 刘少薇, 等. 人参皂苷Rh2与吉非替尼联用对人肺腺癌NCI-H1975细胞的作用研究[J]. 长春中医药大学学报, 2023, 39(8): 865-869.
[42] 曹雪婷, 吴博雅, 陈" 静. 刺五加苷B介导PI3K/Akt/mTOR通路诱导肺癌细胞凋亡和自噬[J]. 中国中药杂志, 2023, 48(24): 6693-6701.
[43] 陈" 源, 李晓云, 刘宏壁, 等. 灵芝乙醇提取物对肺癌细胞增殖抑制的作用及分子机制[J]. 华西药学杂志, 2022, 37(4): 376-379.
[44] 孔思琪, 李金田, 李" 娟, 等. 归芪益元膏联合顺铂通过内质网应激途径和线粒体凋亡途径对Lewis肺癌小鼠的影响[J]. 中国实验方剂学杂志, 2024, 30(20): 54-61.
[45] 牟琪瑞, 李" 贺, 刘玥彤, 等. 补中益气汤通过Nrf2/ROS通路调控线粒体途径细胞凋亡改善A549/DDP细胞顺铂耐药的分子机制[J]. 中国实验方剂学杂志, 2024, 30(1): 95-102.
[46] 张" 轶, 贾" 方, 王秋月, 等. 金复康口服液对吉非替尼耐药肺腺癌H1975细胞有氧糖酵解的影响[J]. 现代中西医结合杂志, 2024, 33(2): 155-161.
[47] 王晓芳, 杨雪洁, 舒健峰. 参麦注射液联合盐酸安罗替尼对A549细胞的干预机制[J]. 中国当代医药, 2023, 30(19): 12-16.
[48] 王乙波, 焦" 斌, 王小强, 等. 苍术素通过激活RIPK1/RIPK3/MLKL信号通路诱导非小细胞肺癌A549细胞程序性坏死并抑制裸鼠移植瘤生长[J]. 中国肿瘤生物治疗杂志, 2024, 31(2): 146-153.
[49] 肖艳霞, 刘" 璞, 郭" 君, 等. 雷公藤甲素诱导肺癌细胞铜死亡的机制研究[J]. 中国医药生物技术, 2024, 19(2): 135-143.
[50] 余娅娅, 朱燕娟, 肖真真, 等. 知母、干姜对PI3K/AKT通路异常激活介导的非小细胞肺癌吉非替尼耐药的影响及机制研究[J]. 中药新药与临床药理, 2023, 34(11): 1525-1533.
[51] 郑" 倩, 王晓珊, 林蔓婷, 等. 异乌药内酯通过ROS介导的线粒体凋亡途径诱导A549细胞凋亡的研究[J]. 惠州学院学报, 2023, 43(3): 35-39.
[52] 张" 德. 蓝萼甲素通过抑制PI3K/Akt/GSK3β通路诱导NSCLC细胞凋亡[D]. 赣州: 赣南医学院, 2023.
[53] 王陈晨. 穿心莲内酯协同吉非替尼克服非小细胞肺癌PC9/G细胞耐药的作用研究[D]. 锦州: 锦州医科大学, 2023.
[54] 吴高平, 孟杭锋, 陈燕敏, 等. 青蒿琥酯及其联合2-脱氧-D-葡萄糖对非小细胞肺癌A549细胞的抑制作用[J]. 江苏医药, 2022, 48(11): 1085-1089.
[55] 李" 畅, 王" 浩, 贺千羽, 等. 槲皮素通过诱导铁死亡抑制A549细胞增殖的作用及机制研究[J]. 中草药, 2022, 53(22): 7112-7120.
〔收稿日期〕2024-09-02
〔基金项目〕国家中医药管理局“凃晋文国医大师传承工作室”建设项目(国中医药办人教函〔2022〕245号);国家中医疫病基地项目(湖北)(国中医药医政函〔2020〕244号);湖北省“公共卫生青年拔尖人才培养项目”计划(鄂卫通〔2021〕74号);湖北省自然科学基金项目(2023AFD173)。
〔通信作者〕*柯" 佳,男,硕士,副主任医师,硕士研究生导师,E-mail:kejia@hbhtcm.com。

