基于“虚气留滞”理论探讨益气调腑汤治疗晚期结直肠癌脾虚气滞型患者的回顾性研究
〔摘要〕 目的 基于“虚气留滞”理论探究益气调腑汤对晚期结直肠癌(CRC)脾虚气滞型患者的临床疗效。方法 回顾2020年8月18日至2022年9月1日就诊于湖南省中西医结合医院门诊及住院部的107例晚期CRC脾虚气滞型患者病例资料,将这些患者分为治疗组(n=55)与对照组(n=52),治疗组采用益气调腑汤联合一般西医治疗,对照组采用一般西医治疗。分析比较治疗6周后两组患者的中医证候积分(腹胀肠鸣、神疲乏力、食少纳呆、大便稀溏)、肿瘤标志物[血清癌胚抗原(CEA)、糖类抗原19-9(CA19-9)、糖类抗原50(CA50)]、T细胞亚群[T淋巴细胞(CD3+)、辅助性T细胞(CD4+)、细胞毒性T细胞(CD8+)、CD4+/CD8+]、毒副反应(恶心呕吐、肝肾功能损伤、手足皮肤、腹泻、骨髓抑制)变化,并比较两组患者总生存期(OS)变化。结果 治疗6周后,两组患者中医证候积分和CEA、CA19-9、CA50水平均低于治疗前(Plt;0.05),且治疗组中医证候积分和CEA、CA19-9、CA50水平均低于对照组(Plt;0.05)。治疗6周后,两组患者CD3+、CD4+、CD8+、CD4+/CD8+水平均高于治疗前(Plt;0.05),且治疗组CD3+、CD4+、CD4+/CD8+水平均高于对照组(Plt;0.05),CD8+水平稍高于对照组但差异无统计学意义(Pgt;0.05)。治疗组肝肾功能损伤、手足皮肤、骨髓抑制毒副反应发生率均低于对照组但差异无统计学意义(Pgt;0.05),恶心呕吐、腹泻毒副反应发生率低于对照组(Plt;0.05)。治疗组患者中位OS为21.2个月,对照组患者中位OS为15.6个月,差异无统计学意义(Pgt;0.05),但治疗组患者OS较对照组有升高趋势。结论 益气调腑汤可改善晚期CRC脾虚气滞型患者的临床症状及其生活质量,增强机体抗癌能力,有效缓解恶心呕吐及腹泻毒副反应,具有一定的临床疗效。
〔关键词〕 结直肠癌;益气调腑汤;虚气留滞;总生存期;肿瘤标志物;免疫功能;回顾性研究
〔中图分类号〕R273"""""""" 〔文献标志码〕B""""""""" 〔文章编号〕doi:10.3969/j.issn.1674-070X.2025.02.026
〔收稿日期〕2024-09-21
〔基金项目〕湖南省自然科学基金项目(2022JJ30362);湖南省中医药管理局重点项目(A2023049,A2024019)。
〔通信作者〕*宋" 程,男,博士,主任医师,硕士研究生导师,E-mail:77083182@qq.com。
A retrospective study on the treatment of patients with advanced colorectal cancer of spleen deficiency and qi stagnation pattern using Yiqi Tiaofu Decoction based on the theory of \"deficient qi stagnation\"
YE Ziyu1,2, SONG Cheng2*, TANG Wei3, LIU Huan1,2, LIU Chuanlong1, HUA Yuwei1,2
1. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. Hunan Cancer Hospital, Changsha, Hunan 410013, China; 3. Hunan Provincial Hospital of Integrated Traditional Chinese and Western Medicine (The Affiliated Hospital of Hunan Academy of Traditional Chinese Medicine), Changsha, Hunan 410006, China
〔Abstract〕 Objective To explore the clinical efficacy of Yiqi Tiaofu Decoction in patients with advanced colorectal cancer (CRC) of spleen deficiency and qi stagnation pattern based on the theory of \"deficient qi stagnation\". Methods A retrospective study was conducted on the case data of 107 patients with advanced CRC of spleen deficiency and qi stagnation pattern who were treated at the outpatient and inpatient departments of Hunan Provincial Hospital of Traditional Chinese and Western Medicine from August 18, 2020 to September 1, 2022. These patients were divided into" treatment group (n=55) and control group (n=52). The treatment group was treated with Yiqi Tiaofu Decoction combined with conventional Western medicine, while the control group was only treated with conventional Western medicine. After six weeks of treatment, comparisons were made between the two groups in terms of Chinese medicine pattern scores (abdominal distension, bowel sounds, fatigue, weakness, poor appetite, and loose stool), tumor markers [serum carcinoembryonic antigen (CEA), carbohydrate antigen 19-9 (CA19-9), carbohydrate antigen 50 (CA50)], T-cell subsets [T lymphocytes (CD3+), helper T cells (CD4+), cytotoxic T cells (CD8+), and CD4+/CD8+ ratio], and adverse reactions (nausea, vomiting, liver and kidney function impairment, hand-foot skin reactions, diarrhea, and myelosuppression). Additionally, the overall survival (OS) of patients in both groups was compared. Results After six weeks of treatment, the Chinese medicine pattern scores and levels of CEA, CA19-9, and CA50 were lower in both groups compared to pre-treatment levels (Plt;0.05), with the treatment group exhibiting lower Chinese medicine pattern scores and levels of CEA, CA19-9, and CA50 than the control group (Plt;0.05). After six weeks of treatment, the levels of CD3+, CD4+, CD8+, and CD4+/CD8+ ratio were higher in both groups compared to pre-treatment levels (Plt;0.05), with the treatment group showing higher levels of CD3+, CD4+, and CD4+/CD8+ ratio than the control group (Plt;0.05). The CD8+ level was slightly higher in the treatment group than that in the control group, but the difference was not statistically significant (Pgt;0.05). The incidence of adverse reactions such as liver and kidney function impairment, hand-foot skin reactions, and myelosuppression was lower in the treatment group than in the control group, although the difference was not statistically significant (Pgt;0.05). However, the incidence of nausea and vomiting, and diarrhea was lower in the treatment group compared to the control group (Plt;0.05). The median OS was 21.2 months in the treatment group and 15.6 months in the control group, with no statistically significant difference (Pgt;0.05); however, there was a trend towards longer OS in the treatment group compared to the control group. Conclusion Yiqi Tiaofu Decoction can improve the clinical symptoms and quality of life of patients with advanced CRC of the spleen deficiency and qi stagnation pattern, enhance the body's anti-cancer ability, effectively alleviate
toxic and side effects including nausea, vomiting, and diarrhea, and has certain clinical efficacy.
〔Keywords〕 colorectal cancer; Yiqi Tiaofu Decoction; deficient qi stagnation; overall survival; tumor markers; immune function; retrospective study
本文引用: 叶子玉, 宋" 程, 唐" 蔚, 刘" 欢, 刘传龙, 华雨薇. 基于“虚气留滞”理论探讨益气调腑汤治疗晚期结直肠癌脾虚气滞型患者的回顾性研究[J]. 湖南中医药大学学报, 2025, 45(2): 363-369.
结直肠癌(colorectal cancer, CRC)是我国肿瘤中世界标准人口年龄标准化发病率(age-standardized incidence rate-world standard, ASIRW)及世界标准人口年龄标准化死亡率(age-standardized mortality rate-world standard, ASMRW)排名第四且呈上升趋势的消化道恶性肿瘤,严重损害人类身体健康[1]。受主客观因素制约,CRC患者确诊之际,大多数情况下已处于疾病晚期,进而丧失了最佳的手术时机。研究表明,高达65%的Ⅳ期术后CRC患者会出现复发转移现象[2]。因此,药物治疗成为晚期CRC患者的主要治疗方式。目前,靶向治疗、免疫治疗等新技术突飞猛进,对于减少肿瘤负荷、优化成功切除机会、改善肿瘤学结局具有一定意义,但放化疗仍然是晚期肠癌治疗的主要手段之一[3-5]。然而化疗期间患者机体常出现骨髓抑制或免疫功能下降等情况,药物不良反应也无法避免,由此引发乏力、纳呆、恶心呕吐等症状,成为影响晚期CRC患者的远期疗效及生存质量的重要因素。因此,探求减少化疗药物的毒副反应并提高晚期CRC患者治疗效用乃当时之务。
CRC在中医学属“肠覃”“肠癖”等范畴。“虚气留滞”学说最早出自《仁斋直指方·胀满》,其内涵之一便是走窜善行之气。《王九峰医案·痰饮》言:“虚气上逆,浊饮上升,虚气下坠,肠僻延绵不已。”虚气下行于胃肠,而致肠癖形成。晚期CRC患者常常出现腹胀、疲乏、纳呆等症状[6],此属久病入脏,脾虚无以运气,而致气滞邪聚之证。益气调腑汤是国医大师潘敏求教授治疗CRC患者的经验用方,全方以补脾气、通腑气、祛瘀邪为法[7]。因此,本研究旨在通过回顾性分析,探究益气调腑汤对于晚期CRC患者临床相关结局指标的影响。
1 资料与方法
1.1" 一般资料
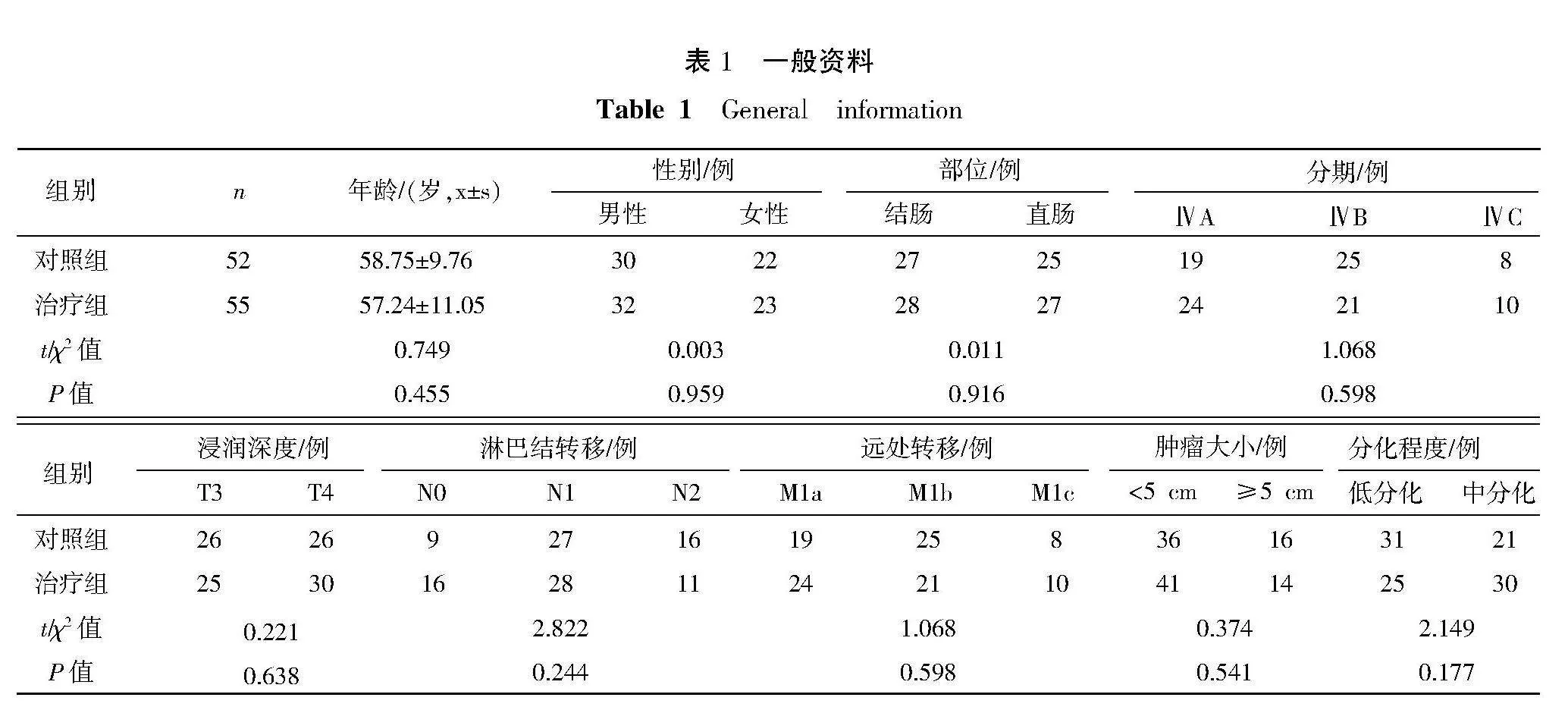
回顾性分析2020年8月18日至2022年9月1日就诊于湖南省中西医结合医院门诊及住院部的107例晚期CRC脾虚气滞型患者病例资料,将患者分为治疗组(益气调腑汤+常规西医治疗,n=55)和对照组(常规西医治疗,n=52)。两组患者一般资料对比,差异无统计学意义(Pgt;0.05),存在可比性,详见表1。本次研究已通过湖南省中西医结合医院伦理委员会批准(伦理审批号:[2023]174号)。
1.2" 病例选择标准
1.2.1" 诊断标准" (1)参照《中国结直肠癌诊疗规范(2023版)》[8]中CRC的诊断标准,经临床症状、实验室检测、内镜检查、影像学及病理学等均诊断为CRC者;(2)参考中国中医药出版社2008版《肿瘤中医诊疗指南》[9]大肠癌脾虚气滞型诊断标准,症状见腹胀肠鸣、腹部窜通、纳呆、神疲乏力、面色萎黄、大便稀溏、舌质淡红、苔薄腻、脉濡滑。
1.2.2" 纳入标准" (1)符合上述诊断标准;(2)年龄25~80岁(含25岁、80岁)者,性别不限;(3)用药疗程≥6周者;(4)卡氏功能状态(Karnofsky performance status, KPS)评分≥50分者;(5)肿瘤-淋巴结-远处转移(tumor node metastasis, TNM)分期初诊为Ⅳ期者;(6)临床资料完整者;(7)患者本人或家属已签署知情同意书。
1.2.3" 排除标准" (1)合并其他部位原发恶性肿瘤者;(2)存在精神病、智力或语言障碍,无法配合研究者;(3)严重心、肝、肾功能不全者;(4)患有凝血功能、免疫功能异常或严重营养不良的患者。
1.2.4" 剔除标准" (1)入组后发现不符合纳入标准或符合排除标准者;(2)病例资料不完整,影响数据分析和结果判断者;(3)治疗期间出现严重不良反应或不良事件,经判断不宜继续接受试验干预者;(4)自行服用可能影响本研究结果的其他药物、保健品或接受其他未经许可的治疗手段者。
1.3" 治疗方法
1.3.1" 对照组" 选取已行奥沙利铂+亚叶酸钙+氟尿嘧啶(FOLFOX方案)或卡培他滨联合奥沙利铂(CapeOx方案)治疗疗程大于6周,联合或未联合贝伐珠单抗或西妥昔单抗者。FOLFOX方案:奥沙利铂[齐鲁制药(海南)有限公司,国药准字:H20203216,规格:10 mL∶50 mg] 85 mg/m2,化疗第1天静脉滴注2 h;亚叶酸钙(扬子江药业集团广州海瑞药业有限公司,国药准字:H20073593,规格:100 mg/瓶)400 mg/m2,化疗第l天静脉滴注2 h;氟尿嘧啶(上海旭东海普药业有限公司,国药准字:H31020593,规格:250 mg∶10 mL)400 mg/m2,化疗第1天静脉推注,之后以1 200 mg/m2持续静脉滴注46 h,总量2 400 mg/m2。每2周为1个周期,治疗3个周期及以上。CapeOx方案:奥沙利铂130 mg/m2,化疗第1天静脉滴注2 h;卡培他滨(江苏恒瑞医药股份有限公司,国药准字:H20133365,规格:0.5 mg/片)1 000 mg/m2,口服,每天2次,连服14 d停7 d。每3周为1个周期,治疗2个周期及以上。靶向药物:贝伐珠单抗[信达生物制药(苏州)有限公司,国药准字:S20200013,规格:4 mL∶100 mg]7.5 mg/kg,化疗第1天静脉滴注,每3周1次;西妥昔单抗(德国Merck公司,批准文号:S20171039,规格:20 mL∶0.1 g)首次400 mg/m2静脉滴注2 h,之后每周250 mg/m2静脉滴注1 h。
1.3.2" 治疗组" 在对照组的基础上,同时服用益气调腑汤[白参(蒸兑)10 g,黄芪20 g,白术10 g,茯苓10 g,枳壳10 g,香附10 g,广木香12 g,砂仁6 g,山楂10 g,大黄5 g,石见穿30 g,败酱草20 g,甘草5 g]。益气调腑汤由湖南省中西医结合医院煎药房统一煎制,每天1剂,每剂水煎至400 mL,早晚分两次温服,每次200 mL。连服3周为1个周期,服用2个周期及以上。
1.4" 观察指标
所有病例由两位研究者同时筛选,共纳入107例晚期CRC患者的病例资料,通过门诊、住院部就诊、复诊情况以及电话回访方式,收集患者中医证候积分、血清肿瘤标志物、T细胞亚群、毒副反应、2年内总生存期(overall survival, OS)指标,建立数据库。两组患者回访时间均为24个月,每2个月回访1次,直至患者失访、死亡或研究终止。
(1)中医证候积分:参考《中药新药临床研究指导原则:试行》[10]标准,对两组患者治疗前后四大主症(腹胀肠鸣、神疲乏力、食少纳呆、大便稀溏)的中医证候积分进行量化评分,通过4级评分法予以评估,将患者的症状分为无症状(0分)、轻度症状(1分)、中度症状(2分)、重度症状(3分),评分越高显示症状的严重程度越高。(2)血清肿瘤标志物:于治疗前后分别采集患者清晨空腹状态下的静脉血6 mL,采取化学发光免疫分析仪检测血清癌胚抗原(carcinoembryonic antigen, CEA)、糖类抗原19-9(carbohydrate antigen 19-9, CA19-9)、糖类抗原50(carbohydrate antigen 50, CA50)肿瘤标志物的水平。(3)免疫指标:于治疗前后采用ELISA法测定两组患者T淋巴细胞(cluster of differentiation 3 positive, CD3+)、辅助性T细胞(cluster of differentiation 4 positive, CD4+)、细胞毒性T细胞(cluster of differentiation 8 positive, CD8+)、CD4+/CD8+的水平。(4)毒副反应:统计两组患者治疗期间恶心呕吐、肝肾功能损伤、手足皮肤、腹泻、骨髓抑制的毒副反应发生情况。(5)OS:是指首次入住湖南省中西医结合医院开始治疗肿瘤的时间点到患者因任何原因死亡的时间间隔,以确定某种治疗方法是否能够提高患者的生存时间。
1.5" 统计学方法
采用SPSS 25.0软件进行数据分析。计数资料以“例(%)”表示,组间比较采用χ2检验。计量资料用“x±s”表示,若满足正态分布,组间比较采用独立样本t检验,组内比较采用配对t检验;若不满足正态分布,则采用非参数秩和检验。采用Kaplan-Meier生存曲线进行生存分析,组间差异采用Log-rank检验。以Plt;0.05为差异有统计学意义。
2 结果
2.1" 两组患者治疗前后中医证候积分比较
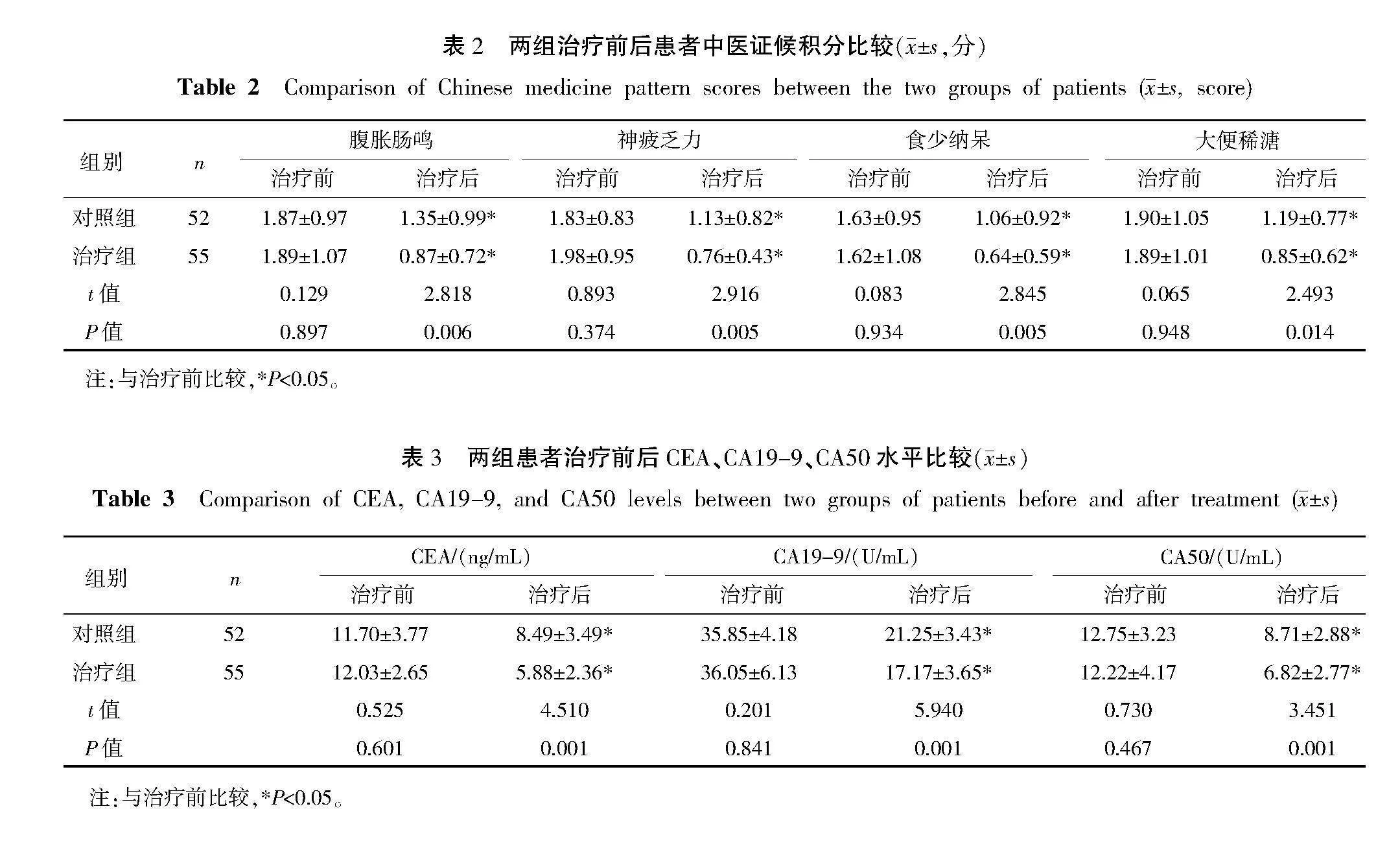
治疗前,两组患者腹胀肠鸣、神疲乏力、食少纳呆、大便稀溏四大主症的中医证候积分比较,差异均无统计学意义(Pgt;0.05)。治疗后,两组患者上述中医证候积分均较治疗前下降(Plt;0.05),且治疗组均低于对照组(Plt;0.05)。详见表2。
2.2" 两组患者治疗前后血清肿瘤标志物表达水平比较
治疗前,两组患者血清肿瘤标志物CEA、CA19-9、CA50表达水平比较,差异均无统计学意义(Pgt;0.05)。治疗后,两组患者CEA、CA19-9、CA50表达水平均较治疗前降低(Plt;0.05),且治疗组CEA、CA19-9、CA50表达水平均低于对照组(Plt;0.05)。详见表3。
2.3" 两组患者治疗前后免疫指标比较
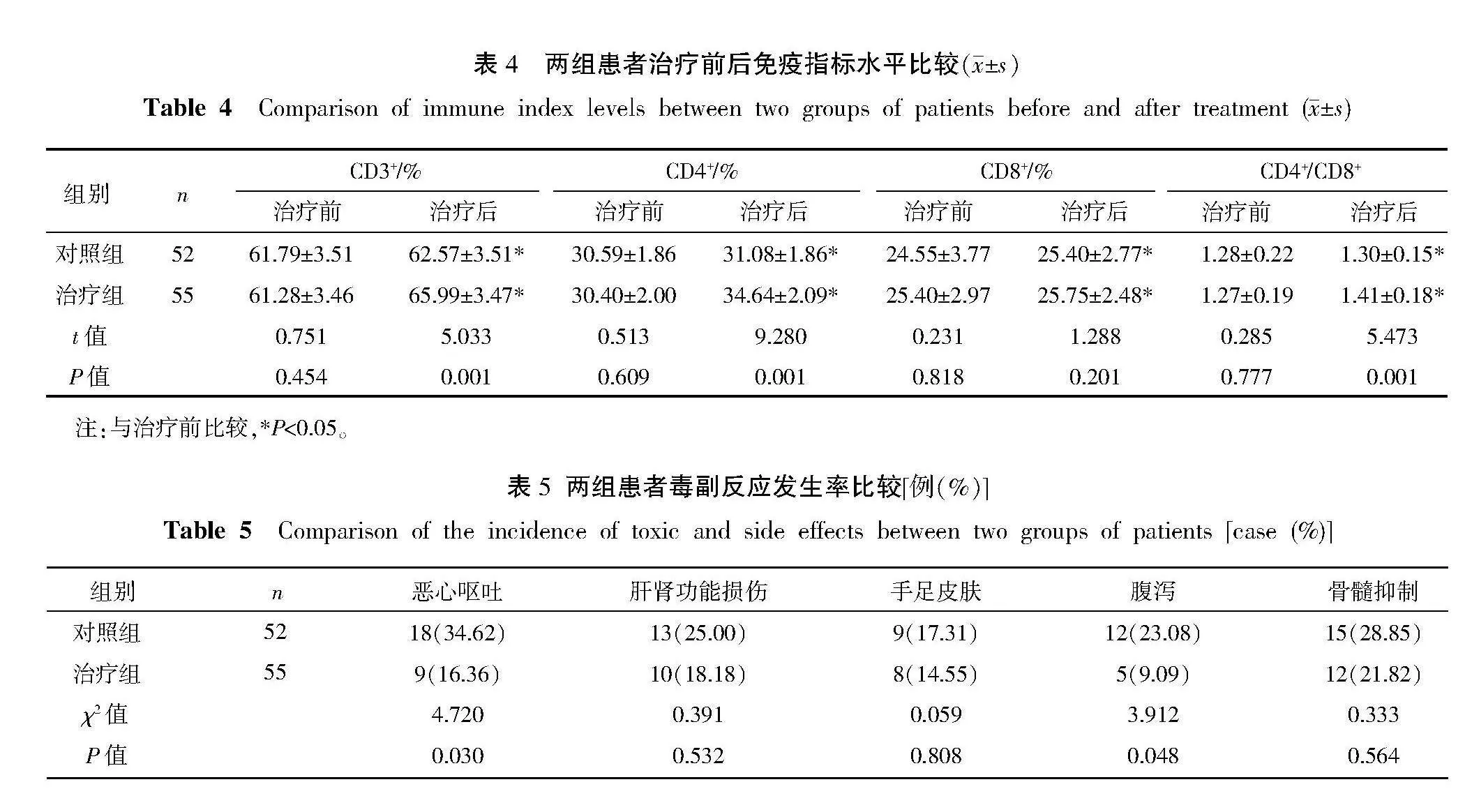
治疗前,两组患者免疫指标CD3+、CD4+、CD8+、CD4+/CD8+表达水平比较,差异均无统计学意义(Pgt;0.05)。治疗后,两组患者CD3+、CD4+、CD8+、CD4+/CD8+表达水平均较治疗前升高(Plt;0.05);治疗组CD3+、CD4+、CD4+/CD8+表达水平均高于对照组(Plt;0.05),CD8+表达水平稍高于对照组但差异无统计学意义(Pgt;0.05)。详见表4。
2.4" 两组患者毒副反应发生情况比较
治疗组肝肾功能损伤、手足皮肤、骨髓抑制毒副反应稍低于对照组但差异无统计学意义(Pgt;0.05);治疗组恶心呕吐、腹泻毒副反应发生率低于对照组(Plt;0.05)。详见表5。
2.5" 两组患者OS比较
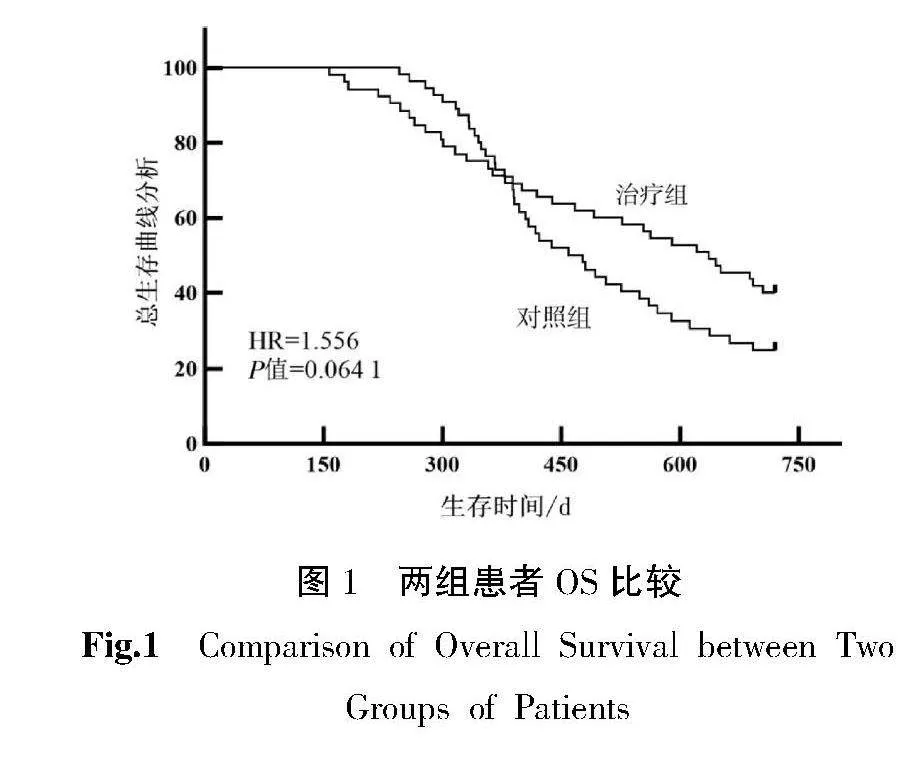
截止回访结束,所有患者均未失访。对照组死亡39例,中位OS为15.6个月;治疗组死亡33例,中位OS为21.2个月。两组患者中位OS比较差异无统计学意义(χ2=3.428,P=0.0641),但治疗组患者OS较对照组呈升高趋势。详见图1。
3 讨论
自2010年以来,癌症一直是中国人口死亡的主要原因之一[11]。其中,CRC在中老年患者中的发病率、致死率居高不下,这对于人口老龄化不断加重的中国而言,无疑造成了巨大的公共卫生负担[12-14]。多项临床研究数据表明,一线化疗方案对于CRC患者的OS可推高至近20个月,已成为晚期CRC患者的治疗支柱[15-17]。然而,化疗存在一定的局限性,例如全身性毒性、有效反应率欠佳、靶向特异性欠佳、耐药性挑战等[18]。中药对症治疗能一定程度抑制肿瘤生物学行为,作用于机体免疫系统并减轻毒副作用,恢复消化系统、骨髓造血系统、免疫系统等多系统的正常功能,提高晚期CRC患者生存时间及生存质量[19-20]。
“虚气留滞”学说最早见于《仁斋直指方论·胀满》言:“虚者,时胀时减,虚气留滞,按之则濡。”可见气滞是由气虚进一步发展而来,阐明因虚致滞两者间的内在关联,而“虚气”泛指气虚、气滞、气逆等气机的改变[21]。《证治准绳·诸痛门》言:“气与血犹水也,盛则流畅,少则壅滞。”气足血旺则少有留滞,气血不足则留滞易成,故停久壅滞成瘀而郁化邪毒。晚期CRC患者多已耗损中焦之气,气虚则脾不健,则癌毒结聚不解更甚,复伤脾胃致使机体气血双亏而致瘀滞,虽行治疗而余毒未净,血瘀与余毒痼结不解而留滞,故而出现脘腹胀满、纳呆食少等腑气不通之症,此乃因虚致实之象。故晚期CRC患者中多以脾虚气滞证为主证,扶正治则在其远期治疗中具有重要作用[22-23]。
国医大师潘敏求教授经验用方益气调腑汤与“虚气留滞”特征相契合,即以正虚、气滞、血瘀、毒聚为核心,围绕人体气机升降出入失常,行补脾益气、调腑祛瘀、解毒抗癌之法。方中以白参、黄芪、白术、茯苓益气扶正健脾,补益脾胃中焦之气,使气血化生有源,意在气旺则血行,瘀去则络通。气虚进而易成气滞,“虚气”之气滞位在胃肠。故予枳壳、广木香疏肠理气、行滞除胀,配合大黄、香附化瘀攻积给邪毒以通,砂仁、山楂醒脾开胃,石见穿、败酱草清热解毒以祛除局部壅滞之郁热,共奏解毒以祛壅、壅散以积除之效。甘草调和诸药。全方补气与理气药相伍,补气而不壅滞,补脾益气以治本,祛瘀调腑以治标,合而用之,则气旺、腑通、瘀消,诸症向愈。
本研究结果显示,治疗后治疗组中医证候积分各项均低于对照组,证实了益气调腑汤可改善晚期CRC患者临床症状。治疗后,治疗组CA19-9、CEA、CA50水平均低于对照组,表明益气调腑汤可降低晚期CRC患者化疗后肿瘤标志物水平。文献证实,扶正治则与“机体抗癌机构”包括抗癌细胞及细胞素系统相对应,可强化细胞免疫活性及固有抗癌能力[24]。同时,本研究数据显示,益气调腑汤治疗后可促进CD3+、CD4+、CD4+/CD8+表达水平,且较常规西医治疗效果显著,表明益气调腑汤在调节免疫微环境上可发挥一定作用。一项临床研究数据显示,FOLFOX化疗后常见毒副反应中淋巴细胞减少、腹泻占比最多[25]。本研究结果显示,益气调腑汤可降低手足皮肤、肝肾功能损伤、骨髓抑制毒副反应,尤其对于减轻恶心呕吐、腹泻症状具有显著意义。本研究结果显示,治疗组中位OS较对照组稍高,但比较差异无统计学意义,不排除研究时间较短等因素影响;治疗组两年内生存曲线较对照组有升高趋势,表明益气调腑汤对于延长晚期CRC患者生存时间具有一定的积极意义。
综上所述,本研究结果证实益气调腑汤可改善晚期CRC患者的临床症状及其生活质量,增强机体抗癌能力及免疫机能,并且可以有效缓解恶心呕吐及腹泻毒副反应,对于改善生命质量具有一定意义。同时,本研究可立足于临床样本数据,进一步改进和完善研究方法,为CRC患者的治疗提供新思路。但是,本研究存在一定的样本局限性,可能会影响研究结果的普遍性和适用性,未来可进一步扩大样本的范围和多样性,以提高研究结论的可靠性。
参考文献
[1] WANG Y A, YAN Q J, FAN C M, et al. Overview and countermeasures of cancer burden in China[J]. Science China Life Sciences, 2023, 66(11): 2515-2526.
[2] DING P Q, AU F, CHEUNG W Y, et al. Cost-effectiveness of surveillance after metastasectomy of stage Ⅳ colorectal cancer[J]. Cancers, 2023, 15(16): 4121.
[3] WEITZ J, KOCH M, DEBUS J, et al. Colorectal cancer[J]. The Lancet, 2005, 365(9454): 153-165.
[4] MAAS M, BEETS-TAN R G H, LAMBREGTS D M J, et al. Wait-and-see policy for clinical complete responders after chemoradiation for rectal cancer[J]. Journal of Clinical Oncology, 2011, 29(35): 4633-4640.
[5] LAMBREGTS D M J, VANDECAVEYE V, BARBARO B, et al. Diffusion-weighted MRI for selection of complete responders after chemoradiation for locally advanced rectal cancer: A multicenter study[J]. Annals of Surgical Oncology, 2011, 18(8): 2224-2231.
[6] 陈叶青, 李晓琳, 陈子睿, 等. 基于数据挖掘的结直肠癌中医证型与中药应用规律研究[J]. 中国中医基础医学杂志, 2022, 28(3): 412-416.
[7] 潘敏求, 潘" 博, 黎月恒. 益气调腑汤配合化疗治疗大肠癌43例临床观察[J]. 湖南中医药导报, 2003, 9(11): 12-14.
[8] 国家卫生健康委员会医政司, 中华医学会肿瘤学分会. 中国结直肠癌诊疗规范(2023版)[J]. 消化肿瘤杂志(电子版), 2023, 15(3): 177-206.
[9] 中华中医药学会. 肿瘤中医诊疗指南: ZYYXH/T136~156—2008[S]. 北京: 中国中医药出版社, 2008: 11.
[10] 郑筱萸. 中药新药临床研究指导原则: 试行[M]. 北京: 中国医药科技出版社, 2002: 216-221.
[11] PHD H S, JACQUES FERLAY MSC M, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. Ca, 2021, 71(3): 209-249.
[12] CAO W, CHEN H D, YU Y W, et al. Changing profiles of cancer burden worldwide and in China: A secondary analysis of the global cancer statistics 2020[J]. Chinese Medical Journal, 2021, 134(7): 783-791.
[13] WANQING CHEN PHD M, MPH R Z, et al. Cancer statistics in China, 2015[J]. Ca, 2016, 66(2): 115-132.
[14] QI J L, LI M L, WANG L J, et al. National and subnational trends in cancer burden in China, 2005-20: An analysis of national mortality surveillance data[J]. The Lancet Public Health, 2023, 8(12): e943-e955.
[15] COLUCCI G, GEBBIA V, PAOLETTI G, et al. Phase III randomized trial of FOLFIRI versus FOLFOX4 in the treatment of advanced colorectal cancer: A multicenter study of the Gruppo Oncologico Dell'Italia Meridionale[J]. Journal of Clinical Oncology, 2005, 23(22): 4866-4875.
[16] CASSIDY J, TABERNERO J, TWELVES C, et al. XELOX (capecitabine plus oxaliplatin): Active first-line therapy for patients with metastatic colorectal cancer[J]. Journal of Clinical Oncology, 2004, 22(11): 2084-2091.
[17] TOURNIGAND C, ANDRÉ T, ACHILLE E, et al. FOLFIRI followed by FOLFOX6 or the reverse sequence in advanced colorectal cancer: A randomized GERCOR study[J]. Journal of Clinical Oncology, 2004, 22(2): 229-237.
[18] XIE Y H, CHEN Y X, FANG J Y. Comprehensive review of targeted therapy for colorectal cancer[J]. Signal Transduction and Targeted Therapy, 2020, 5(1): 22.
[19] 彭永焕, 黄学宽, 周德奇, 等. 中医药治疗结直肠癌术后复发转移的相关作用机制研究进展[J]. 中国医药科学, 2024, 14(5): 50-53.
[20] 李山晨, 屈景辉, 陈殿超, 等. 中西医结合治疗对中晚期结直肠癌生存期影响的荟萃分析[J]. 临床医药文献电子杂志, 2017, 4(A3): 20403.
[21] 李" 奕, 刘福栋, 姜晓晨, 等. 基于“虚气留滞”探析调气解毒法在恶性肿瘤防治中的作用[J]. 中医学报, 2024, 39(11): 2326-2330.
[22] 崔可新, 张宁苏, 朱" 颖. 结直肠癌的证型分布特点及证型判别分析[J]. 中医临床研究, 2022, 14(4): 26-29.
[23] 孙凌云, 张" 达, 郝" 洁, 等. 晚期结直肠癌患者中医证型、中医体质与生存结局相关性分析[J]. 中国中西医结合杂志, 2017, 37(9): 1059-1062.
[24] 史" 勤, 刘" 静. 健脾益气法应用于大肠癌的临床研究进展[J]. 辽宁中医杂志, 2010, 37(6): 1179-1181.
[25] SCHRAG D, SHI Q, WEISER M R, et al. Preoperative treatment of locally advanced rectal cancer[J]. The New England Journal of Medicine, 2023, 389(4): 322-334.
(本文编辑" 匡静之)

