质谱流式成像技术及其在肿瘤研究中的应用进展
【摘 要】多重单细胞蛋白组技术已成为生物医学研究的热点,其中质谱流式成像(imaging mass cytometry,IMC)彻底解决了荧光基团间严重的串色问题,并弥补了单细胞测序技术缺失的组织空间信息。该技术能够在单张组织切片上同时标记数十种靶标,并在单细胞层面获得它们的表达水平及细胞定位,进行深度的细胞表型原位分析并从时间和空间水平直观描绘出单细胞蛋白组图谱,因其独特的技术优势逐渐成为肿瘤研究领域新兴的强有力工具。本文将详细介绍IMC的技术原理,并通过分析近期应用案例阐述其在细胞表型鉴定、生物标志物检测、肿瘤免疫调节判定、肿瘤异质性区分、临床预后指导及反应预测等肿瘤研究方面的应用进展,推动肿瘤空间组学与现有技术的进一步结合。
【关键词】质谱流式成像;空间蛋白组;单细胞分析;肿瘤微环境;肿瘤标志物
【中图分类号】R73【文献标志码】A【收稿日期】2024-01-15
基金项目:国家自然科学基金资助项目(编号:82172619);重庆市科卫联合医学科研资助项目(编号:2024MSXM136);重庆市沙坪坝区决策咨询与管理创新资助项目(编号:2023122)。
Imaging mass cytometry technology and its application in tumor research
Huang Yiwei1,Xiang Tingxiu1,Liu Xinghe2,Ran Jing1,Zhao Yi1
(1.Oncology Laboratory,Chongqing Key Laboratory of Translational Research for Cancer Metastasis and Individualized Treatment,Chongqing University Cancer Hospital;2.School of Medicine,Chongqing University,Chongqing University Cancer Hospital)
【Abstract】Multiplex single-cell proteomics technology has become a hot topic in biomedical research,among which imaging mass cy‐tometry(IMC) completely solves the serious problem of cross-color between fluorophores and makes up for the lack of tissue spatial in‐formation in single-cell sequencing technology. This technique can label dozens of targets simultaneously on a single tissue section,ob‐tain their expression levels and cell localization at the single-cell level,perform in-depth cell phenotypic in situ analysis,and visually depict single-cell proteome maps from the temporal and spatial levels,and due to its unique technical advantages,it has become a pow‐erful tool in the field of tumor research. This article elaborates on the technical principle of IMC and summarizes the advances in the ap‐plication of IMC in cell phenotype identification,biomarker detection,tumor immunomodulatory determination,tumor heterogeneity dif‐ferentiation,clinical prognosis guidance,and response prediction by analyzing recent cases,so as to promote the further integration of tumor spatial omics with existing technologies.
【Key words】imaging mass cytometry;spatial proteome;single-cell analysis;tumor microenvironment;tumor markers
全面探究肿瘤微环境(Tumor microenvironment,TME)是了解肿瘤发病机制并探索新治疗方案的重要途径,其中各种类型细胞不断相互作用,多种异质成分的丰度、定位和功能方向随着时间和对治疗的反应而变化,动态且复杂的生态系统影响着肿瘤的病程及其对治疗的敏感性。深度挖掘并解析TME的高维信息变得愈发重要,而诸如scRNA-seq或多光谱荧光成像等高维细胞分析技术仍面临着组织背景丢失,同步可视化的靶标数量有限或方案繁琐等限制。在空间分辨率下精确分析单细胞组学将有助于解读肿瘤内表型信息、异质性、细胞相互作用及分子机制[1-2],构建TME中重要组份的“空间图谱”成为一种热点思路和发展方向。
目前已有多种技术被开发并应用于解析肿瘤组织空间数据,尤其是细胞相互作用的原位空间信息[3-4]。其中,质谱流式成像(imaging mass cytometry,IMC)在原位免疫组织化学(immunohistochemistry,IHC)基础上,结合了质谱流式细胞技术(CyTOF)和激光消融技术,能在亚细胞分辨率下同时检测组织样本中多达50余种靶标的丰度变化及空间分布,极大地提高了绘制TME空间图谱的潜力[5],对开展个性化诊疗有独特优势。近年来,IMC已在肿瘤研究领域广泛应用并不断扩展,一系列研究表明该技术是破译肿瘤复杂性的强大工具。
1 IMC技术原理
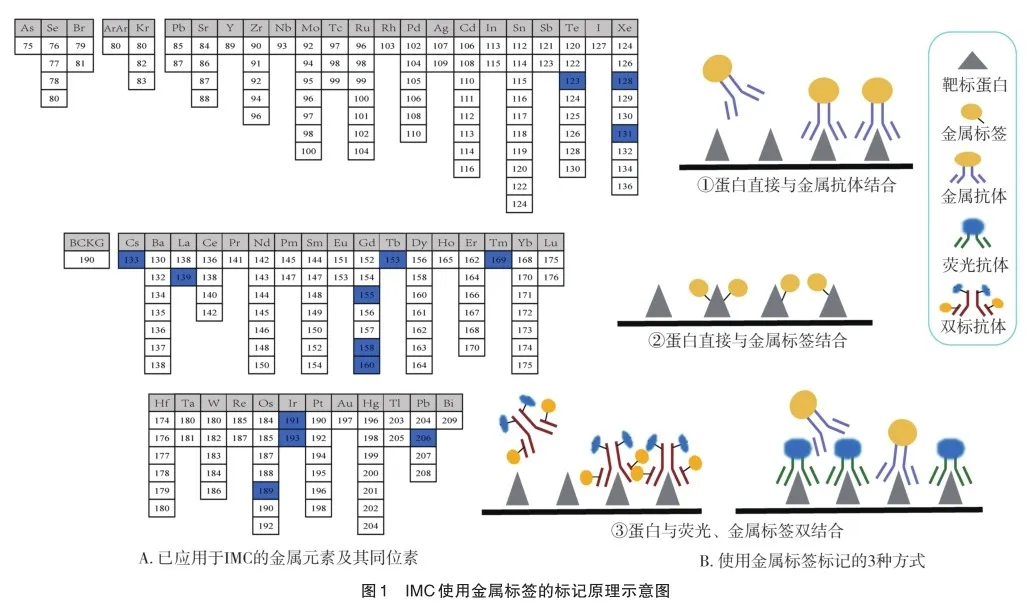
1.1 金属标签
传统荧光标记成像技术以荧光基团作为标签修饰抗体,标记对应的标志物。不同于此,IMC利用重金属同位素作为标签修饰抗体,通过检测同位素丰度,推测在对应空间位点上被标记的靶标物含量[6]。例如,一般约定利用带有金属铱(Ir)标签的抗体标记细胞核,定位细胞或识别单个细胞区域并进行分割,再结合单个或多个标志物在不同细胞中的表达丰度,可对细胞进行表型分析。为了减少背景信号,通常会避开钠、钾、钙、铁、锌等细胞内源性元素,主要选择过渡金属、稀土金属等作为标签金属。目前已有100余种同位素作为金属标签成功应用于IMC(图1A),包括成熟的同位素标签钇(Y),铟(In),镧系元素系列(Pm除外)等,及近年新开发的106至116 Da镉系同位素[7]。
利用金属标签检测标志物一般有3种方式(图1B):①大多数蛋白(或标志物)需要通过抗体来结合金属标签,标记后进行检测;②部分可不经过抗体直接与金属标签结合,它们可直接进行检测[8];③可制备带有金属标签和荧光基团的双标记抗体[9],某些荧光抗体结合标志物后也可再结合金属标签[10],2种方式都可实现免疫荧光与进一步的质谱定量分析。当金属标签与一抗偶联信号较弱时,还可引入带有金属标记的二抗来放大弱信号。应当注意,在临床诊断或治疗中可能引入金属污染,如铂盐治疗(顺铂、奥沙利铂等)或使用钆造影剂,从而导致患者样本存在干扰信号。因此,需要避开污染的元素选择金属标签,但也可直接将这些已知的治疗性/诊断性金属视作标签进行IMC检测[11]。此外,利用钌能与细胞质均匀结合的特性,再与铱染色搭配,可以模拟苏木精和伊红染色[12]。
1.2 常规实验流程
标志物的选择:实验设计时除了依据研究目的,还应确保标志物拥有能稳定结合的抗体,才能进行IMC检测。适用的抗体可使用商业化产品,也可自主合成,一般以标志物能在预实验(免疫组化)中获得良好染色为前提。
抗体设计与选择:金属标签在数量和类型上都远超过荧光标签,抗体可根据需要自主搭配可结合的金属标签,丰富的选择性使检测方案设计更加灵活。利用金属标签抗体标记时,应注意保持与预实验条件相同,金属标签与抗体结合的稳定性可能受到抗体孵育pH、时间、温度等前处理条件的影响。标志物表达量高低不同,孵育条件的差异直接会影响检测信号的强弱[13-15]。另外,考虑到金属偶联可能会改变抗体对其表位的亲和力[10],还需通过IMC分析金属标记的性能来优化操作方案。
样本的前处理:IMC检测可直接选择常规石蜡包埋组织(formalin-fixed and paraffin-embedded,FFPE)切片或冷冻切片作为样本,但不同于传统免疫荧光染色,IMC能对单张切片一次性孵育多个金属标签抗体完成标记。最后以一次高浓度的铱染色结束,达到强化细胞核染色并终止所有免疫反应的目的。
上机操作:上机前需预先对感兴趣的区域(region of interest,ROI)进行定位,一般而言,预实验中完成的免疫组化切片可以帮助定位。若使用商业化金属标签抗体,因试剂盒提供了成熟的实验条件而无需免疫组化步骤,则另需1张组织样本的连续切片,通过HE染色辅助ROI定位。对已完成显微识别的免疫荧光标记样本,也可直接在玻片上选定ROI,再次引入金属标签并进行IMC检测,但前提是其前期处理方法没有损害IMC必需的抗体固定和后期质谱获取。上机检测时,激光以固定速率对样本组织进行微米精度的烧蚀消融,并对单位面积内的消融产物逐点进行质谱分析[16-17]。扫描组织位点中的同位素丰度对应了原始坐标中的标志物含量,并以此为依据整合出空间水平上的多通道多参数图像[6]。
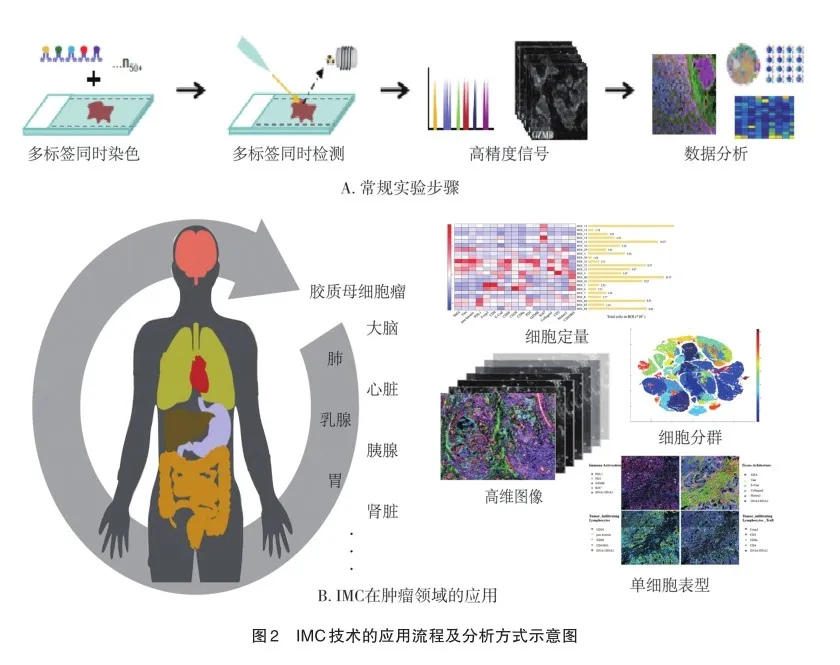
数据分析:扫描并采集的ROI面积和数量决定了获得数据所需的分析算力,包括可视化、质量控制检查和大量的预处理(图2A)。因此IMC数据的分析处理需要使用多种软件、操作系统和生物信息学知识,其主要步骤可概括为:①导出原始数据;②完成人工/自动细胞分割,生成掩码;③将掩码导入分析软件,进一步分析数据。目前有多种开源性软件可供选择,如,MCDViewer对原始数据进行查看或预处理,Cell Profiler进行图像去噪和细胞分割,并导出单细胞数据支撑后续分析[18]。Histocat能以单细胞分辨率量化所有通道的分割数据,并通过热图、散点图、降维分析[T分布和随机近邻嵌入(T-distributed stochastic neighbor embedding,T-SNE);主成分分析(principal components analysis,PCA)]和其他聚类工具进行数据可视化,识别细胞表型和定量,邻域分析以及细胞空间相互作用[19]。也有团队总结并提供了一套可供参考的通用操作方法Github(https://bodenmillergroup. github.io/ IMCDataAnalysis/)。
2 IMC在肿瘤领域的应用
IMC技术的主要优势体现对样本空间信息的解析,以及检测广度、精度和深度的提升。金属标签的使用带来了优秀的多通道标记能力,使得研究者能在单次实验中同步获取大量靶标的全景信息,而不必通过多次重复细胞流式或免疫组化来综合(图2B)。相较于病理医师的经验性判读,质谱仪精准地量化了生物标志物的表达,有助于疾病分类与分级,高精度的多靶标数据也成为了肿瘤细胞表型研究的主要依据,对重新定义细胞亚群特征和TME成分有重要作用。近期一系列研究应用IMC表征肿瘤患者或样本间的生物学差异,在一定程度上实现了精准的患者分层和预后。同时,结合检测标志物对应的空间微观信息,研究者能跟踪和定位不同细胞亚群并分析其相互作用,识别细胞表型差异及演进过程,进而解析肿瘤免疫微环境(immune tumor microenviron‐ment,iTME)和肿瘤异质性。
2.1 细胞表型
大多数临床诊疗依赖于肿瘤亚型的组织病理学分层,而单细胞表型的精准分析对鉴定和定义亚型至关重要。近期有团队利用IMC对352例乳腺癌样本进行了35个抗体指标的检测,分析细胞表型和相互作用鉴定出23个细胞亚群,并重新定义18个与不同临床结果相关的新亚群。鉴于乳腺癌临床诊断常基于对原发肿瘤和淋巴结转移的分析,所以作者还通过比对205例原发性乳腺癌及匹配的淋巴结转移单细胞表型,观察到转移部位存在弥散性细胞表型,其与原发部位表型差异明显,且经常偏离临床疾病亚型,据此确定与患者生存相关弥散性肿瘤细胞的单细胞表型和空间组织特征,并指出表征弥散性肿瘤细胞的分子信息用于乳腺癌临床预后的价值尚未开发[20-21]。在构建的胰腺癌肝转移(pancre‐atic cancer with liver metastasis,PCLM)小鼠模型中,研究者利用单细胞RNA-seq从正常肝脏和治疗前后PCLM样本的免疫细胞集群中鉴定出12个亚群后,进一步结合IMC表征其空间分布,从解析的iTME中发现了激活的iNKT细胞(invariant natural killer T cells)通过调节NK细胞,T细胞及肿瘤相关巨噬细胞对PCLM起重要保护作用[22]。
除了用于定义功能亚群,空间信息的表征还使细胞表型分析反映出不同亚群间的空间关系及相互作用。例如,有研究借助CyTOF检测细胞悬液样本生成了全血免疫组,并结合RNA-seq、免疫组化和IMC数据进行Meta分析,表征了化脓性汗腺炎患者皮肤病变的空间免疫图谱,发现在病变皮肤中CD38+经典型单核细胞及其衍生的巨噬细胞量尤为丰富,提出靶向CD38在临床试验中的价值[23]。肿瘤长期作为独立实体被研究而忽略了局部微环境的作用,空间信息使研究者能够破译原位生态系统。有团队采用IMC研究神经胶质瘤的空间蛋白质组学,辅助发现了胶质母细胞瘤(glioblastoma,GBM)基本特征,并阐述了局部区域中肿瘤-宿主的相互依存关系,为探索其复发和治疗抗性提供支撑[24]。
2.2 肿瘤标志物
目前临床肿瘤标志物的来源、种类和检测方法都已多种多样,相较于开发新标志物,IMC更有助于对现有标志物进行精细分类,指标分级或组合联用,被认为是多模式生物标志物开发的重要渠道,有助于进一步优化并提升临床实用价值[25]。慢性组织细胞间绒毛炎(chronic histiocytic intervillosi‐tis,CHI)是胎盘中罕见的组织病理特征,由于能从少量样本中挖掘出丰富的信息,当利用IMC对CHI胎盘和匹配(双胞胎)对照的组织切片样本进行深度可视化后,研究者在绒毛间隙中发现了5种不同表型的CD68+细胞群,且其中3种是CHI明显存在并独有的,空间共定位将它们与邻近细胞的免疫抑制酶CD39表达降低建立起关联,这些特异性细胞亚群的鉴定有望成为疾病诊断的标志物[26]。借助多通道标记能力,有团队对来自不同炎性疾病的结直肠和胃肿瘤组织进行了39项标志物综合分析,发现了肿瘤组织与周围淋巴之间多层次的密切相互作用,仅以CD20、CD21和CD23 3个标志物的组合特征实现对三级淋巴组织进行精细分类,进而辅助区分不同疾病,新的分类标准对这些疾病的诊断、预警和预后都极具价值[27]。
通过在空间分辨率下剖析肿瘤的发生发展进程,能识别并追踪蛋白和免疫学信号在不同发展阶段的演进。有研究联合靶向空间组学和单细胞RNA-seq分析结直肠癌样本,检测到巨噬细胞亚群从促炎功能转变为免疫抑制表型,提供了从正常组织逐步进展到结直肠癌期间巨噬细胞群发生变化的证据,确定了与疾病进展密切相关的生物标志物,以及可在临床中利用的靶向免疫过程[28]。在空间背景下识别由微环境变化导致的多种转录自调控,帮助构建了GBM与其局部微环境相互作用的图谱,也为诊疗早期GBM提供可能的标志物靶点[24]。此外,对TME变化的解析还能帮助研究者识别药物或治疗手段的效能。最近研究利用IMC表征了非小细胞肺癌对免疫治疗反应的免疫微环境,证明了CXCL13的表达与患者的免疫检查点抑制剂(immune check‐point inhibitors,ICI)疗效相关,且重组CXCL13增强了体内抗PD-1反应,增加了T细胞亚群并减少了CCR2+单核细胞[29]。通过IMC绘制三阴性乳腺癌原位中的多细胞肿瘤生态系统图,研究人员还发现了关键的免疫检查点阻断反应预测因素[30]。这些特征与肿瘤临床数据结合,有望发现能预测患者对ICI反应的潜在生物标志物,还可以提高理解iTME在ICI反应中起到的作用。研究者还能利用IMC同步分析微环境中的胞外蛋白、核酸等生物成分,以肿瘤进展中因细胞异常或宿主受肿瘤刺激产生的一系列物质,来定义TME特征或靶向免疫过程,探索有临床意义的标志物组合[31-33]。这些研究进一步强调了利用空间分析揭示肿瘤发生发展中分子和免疫学景观的必要性,有助于绘制肿瘤进展过程中持续失调的基因、通路和TME,并识别临床相关的生物标志物。
2.3 肿瘤免疫
越来越多的证据表明,空间组织上的免疫生态对于理解肿瘤免疫机制至关重要,了解iTME与肿瘤生物学的相关性,以及利用特定免疫细胞亚群来改善预后的可能性,对优化免疫治疗具有开发和转化价值。有团队利用IMC对139例高级别神经胶质瘤和46例脑转移瘤的免疫微环境进行表征,得到脑部TME的高维空间图,通过对比原发性脑肿瘤和源自不同实体瘤的脑转移瘤之间的免疫微环境,确定了一种与长期生存相关的独特中性粒细胞样巨噬细胞亚群(髓过氧化物酶阳性)[34]。将GBM的空间特征与患者生存率相关联,提示了在特定TME中对巨噬细胞采用特定特征编程可能更有利于患者治疗,重新定义的跨病程和跨区域中的多细胞结构,对于预测患者生存上也更具优势。CD8+ T细胞反应是抗肿瘤免疫的关键,而近期有研究在小鼠中发现淋巴结的反应也必不可少,进一步通过IMC与多技术联用证明了淋巴结内的抗肿瘤T细胞也能被激活,可能在人类抗肿瘤免疫反应中同样起着重要作用[35]。虽然目前只有小部分实体瘤对免疫疗法有反应,但激活淋巴结的免疫反应或许会引发在治疗期间是否要将淋巴结留在体内的重要思考。
用IMC检测细胞免疫应答状态,对探讨肿瘤免疫调节能力也十分有利,一系列应用表明,完整测绘肿瘤生态使得精确的免疫肿瘤学成为可能。鉴于免疫检查点阻断(immune checkpoint blockade,ICB)是针对细胞间的相互作用,研究者通过IMC精确描绘了多细胞空间组织对免疫治疗反应的影响[30],发现细胞表型、激活状态和空间组织共同决定了ICB效应,表明ICB独特地重塑了肿瘤的结构,并发现了关键的ICB反应预测因素。在研究弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)时,研究者利用IMC考察患者淋巴结,发现不同微环境中CD8+ TIL-FRC的亚群组成和空间分布存在差异,并与患者生存相关[36]。此外,TME中基质和免疫细胞的全景分析在一定程度上揭示了成纤维网状细胞(fibroblast reticular cells,FRC)在DLBCL中存在的免疫抑制作用,验证了恰当的处理能增强肿瘤浸润淋巴细胞(tu‐mor infiltrates lymphocytes,TIL)毒性,为进一步了解它们的激活状态和不同免疫功能提供了新的信息。此外,免疫细胞的功能状态也是判断预后、考核疗效和开发新药的指标。例如,利用IMC证明了脂质体纳米颗粒(liposome nanoparticles,LNPs)在创伤后骨关节炎(post-traumatic osteoarthritis,PTOA)小鼠模型中具有很好的免疫调节能力,并且同时发现了LNPs具有减少浸润关节的免疫细胞数量及调节表型的能力[37],证明使用的仿生脂质体治疗对先天免疫系统细胞的浸润能产生非凡的影响。
2.4 肿瘤异质性
单细胞分析技术进步取得的众多发现改变了对肿瘤异质性和可塑性以及潜在治疗选择的理解,IMC技术的发展丰富了单细胞空间层面上评估肿瘤异质性的能力。其通过检测同一区域的表达性差异,或同一类细胞是否突变后致癌,来判断肿瘤空间异质性(相同肿瘤不同区域的差异)与时间异质性(原发性与继发性肿瘤的区别)。目前,已有研究对GBM进行单细胞分辨率水平的空间维度表征,通过解析TME中细胞状态和空间关系的动态适应,发现TME的改变与特定肿瘤亚群存在密切关系,证明了微环境干扰能决定GBM的时间异质性[38]。当研究者基于scRNA-seq构建出GBM的空间转录组图谱后,再整合代谢组学(如matrixas‐sisted laser desorption ionization-imaging mass spectrometetry,MALDI-IMS)和蛋白组学(如IMC)数据能揭示局部区域肿瘤-宿主的相互依赖性,并进一步解析其空间异质性[24]。类似的,IMC与单细胞测序相结合也应用于从转录组角度研究鼻咽癌恶性细胞的单细胞异质性,以及单细胞分辨率下恶性细胞的空间分布特征,由此揭示了鼻咽癌免疫逃逸行为的多种模式,并首次鉴定出一种针对鼻咽癌TME的CD8+ NK细胞簇,具有增强的抗病毒功能[39]。2项技术联用还用于检测横纹肌肉瘤(rhabdomyosarcoma,RMS)患者原代培养物的瘤内异质性,分析了侵袭性肺泡RMS亚型的侵袭性、化疗耐药性和进展背后的发育状态,并将RAS通路确定为有前途的治疗靶点,对化疗耐药和肿瘤复发具有治疗意义[40]。肿瘤异质性的评估还可针对蛋白相关的翻译后修饰,有研究利用IMC分析了7种磷酸化蛋白和14种组蛋白的翻译后修饰情况,发现了心肌缺血及再灌注损伤(myocardial ischemiareperfusion injury,MIRI)中激酶信号的空间差异和多种组蛋白修饰模式,揭示了IRI发病进展过程中的关键信号传导和表观遗传变化[41]。
2.5 肿瘤发生、发展
探讨肿瘤发生、发展机制需要深度解读其涉及的多种复杂过程,从空间水平追踪同源样本的肿瘤演进过程并破译肿瘤发展的复杂机制已逐渐成为研究热点。在研究食管鳞状细胞癌时,IMC提取的空间信息帮助揭示了TME中的基质特征,肿瘤组织前沿区形成的纤维性屏障为侵袭前的微环境提供了准备,并为阻碍免疫效应细胞浸润提供了便利,也为免疫细胞分布及其空间上的排他性提供了成因证据[42]。可见,TME的各种成分会被编排成特定的空间顺序,以协调癌症进展过程中的各种功能。1项报道应用高分辨率成像来研究免疫介导的炎症性疾病的发病机制,因其从单个组织切片中捕获了有关巨细胞动脉炎发病机制的主要信息,并对患者颞动脉中免疫和非免疫细胞进行了深度分析,IMC被认为是分析炎症性疾病中免疫细胞的复杂组成、相互作用和解剖位置的关键工具[43]。IMC技术弥补了scRNA-seq在细胞复杂时空异质性上的信息不足,以及常规转录组在单细胞层面的分析局限,对IRI后各解剖区域和时间点进行了全面的单细胞分析[41]。通过探究疾病过程中细胞群落、信号通路和表观遗传学的时空调控图谱,绘制了IRI成人心脏细胞表型的时空异质性,阐明了单细胞互作网络及引起IRI病理重塑的重要机制,提供了细胞特异的新潜在治疗靶点。针对高级别浆液性卵巢癌(high-grade serous ovarian cancer,HGSOC)的研究表明,基于转录组学的大量结果显示iTME在卡铂反应中发挥作用,而在受治疗的患者中确切机制尚不清楚,应用IMC则有助于阐明细胞对卡铂的自主反应与其iTME之间的相互作用,进而探讨卡铂耐药性机制[25]。此外,有团队充分挖掘了CyTOF的技术优势,针对4种常用肝细胞癌(hepato‐cellular carcinoma,HCC)细胞系小鼠原位模型,应用IMC深入分析其原位iTME,提供了不同模型的TME特征和抗PD-1反应的综合视图,可用于研究不同的免疫抑制途径或指导临床前模型选择[44]。
2.6 预后管理
组织的空间分析进一步阐明了肿瘤与微环境的相互作用,有助于开发空间水平的生物标志物来预测患者对疗法的反应以及预后情况,但以往的空间生物标志物通常源自单个患者队列或传统成像技术,受限于患者数量和不同成像平台间的数据壁垒,往往难以重复和应用。而IMC的应用拓展了分析的数据量并实现了跨平台的互通,充足的统计能力和丰富的分析方法还能避免成像数据的过度拟合。有研究者对乳腺癌患者的临床数据进行了3种不同的多重成像技术分析并比较,基于IMC的结果与其他方法的一致性证实了其在肿瘤预后方面的价值[45]。同时,IMC参与的多技术联用不仅发现了乳腺癌患者预后的新标志物,还在测试以往空间生物标志物的再现性中,验证或质疑了它们的预后价值。针对肝内胆管癌的治疗选择有限且预后不佳,且抗PD-L1免疫疗法联合吉西他滨/顺铂化疗仅在少数胆道癌患者中出现反应这一情况,有研究通过多技术联用分析了治疗方法在原位小鼠模型中的治疗获益机制,并提出了改进的联合治疗方案,有助于克服肝内胆管癌患者治疗耐药性和改善预后[46]。
大数据分析的普及也促进了IMC技术的发展,对于多标记定量的IMC图像,人工智能处理系统将有利于挖掘出新的生物信息。将大量患者的IMC数据进行整合后,基于更精确的多标志物组合来构建预测模型可为肿瘤准确分层或评估提供一个有潜力的工具,在预测肿瘤复发方面表现出卓越的能力,有助于临床医生进一步制定预后管理计划。例如,有研究通过IMC表征了416例非小细胞肺癌样本的免疫微环境特征,深入解析了160万个细胞,分析了患者临床结局和细胞免疫谱系及激活状态的相关性,确定了与患者生存相关的分子特征及空间特征,并以此为基础构建了可预测非小细胞肺癌术后疾病进展的模型[47]。该研究将样本以1 mm2为单位制成组织芯片后利用IMC扫描了35个标志物,结合人工智能分析每个细胞与其相邻细胞并划分为邻域,通过提取邻域类别和生存时间特征证实了特定细胞间相互作用与患者生存率的关系,再次证明了免疫微环境中细胞的组织关系中蕴含独特的预后价值。还有团队开发了1种免疫突触分析算法来研究TME中的免疫突触作用,并在2例黑色素瘤患者样本中发现巨噬细胞突触的形成与T细胞增殖有关,当扩展到乳腺癌IMC图像时则发现通过B细胞突触可预测患者生存率[48]。
2.7 其他
基于金属标签的检测原理,IMC能够直接检测组织样品中的化疗药物(如铂),因此可用于分析铂基化疗患者的肿瘤与非肿瘤组织中的铂水平。有团队研究了局部晚期胃癌患者术前化疗后的肿瘤铂水平与病理反应之间的关系,发现术前化疗72 d后的手术标本中仍可检测到铂,而较高的肿瘤铂浓度又能体现病理上的改善程度[49]。该团队还证明了奥沙利铂治疗后皮肤中的铂沉积会持续数年,这将有助于解释铂相关周围感觉神经病变这类治疗不良反应的机制[50]。铂类抗癌药物虽然广泛应用于临床,但其耐药及不良反应严重影响了疗效并限制了使用,研究者们已把目光投向铂类及其衍生物,或与铂同主族/同周期的一些过渡金属上(如锇、铜等),以研发更高效安全的抗癌金属配合物[51-53]。IMC技术与这些新药物具有良好的适配性,可应用于开发到验证的各个环节,为进一步开发靶向性强、毒性低的药物提供参考依据,对抗癌金属药物的更新迭代发挥重要作用。
3 技术小结
3.1 相较于其他免疫标记技术
多重免疫标记是当前抗原检测的常用方法,其中多重荧光标记的操作相对简单,但随着标志物个数的增加不可避免地带来串色重叠和光损伤等实际问题,虽然通过识别荧光寿命能在一个光谱通道中拆分出多个标志物进而实现单通道多色成像[54],但其技术要求随之增高,并可能导致更快的光漂白[55]。而IMC采用的金属同位素标记法,在基于经典免疫组化流程的同时,通过质谱测定金属标签的方式避免了荧光信号的衰落和串色等问题,不仅提高了可同时检测标志物的个数还扩展了抗体的可选择性[56]。
MIBIscope技术基于多重离子束成像(multiplexed ion beam imaging,MIBI)并结合质谱仪定量检测,也实现了高精度空间蛋白质组成像[57]。MIBIscope可以使用与IMC相同的抗体和染色方案,但样本需要使用镀金载玻片,且信号采集方式与IMC不同。因其主离子束不会破坏样本组织,MIBI‐scope可选择不同速率和分辨率多次重复采样。IMC是基于金属标签检测开发,而MIBIscope能检测并定量从氢到铀的所有元素,因此还能检测细胞内源性元素。有报道利用12C和31P作为反染剂,定量了脾脏组织石蜡切片中的56Fe,并将其与巨噬细胞中血红素加氧酶-1的数量关联起来,重现了细胞间相互作用的轨迹[58]。
3.2 相较于其他空间质谱成像技术
目前质谱成像(imaging mass spectrometry,IMS)的本质都是把样本像素化分割,逐一离子化后利用质谱检测生成质量峰图,再经软件重构形成空间图像。结合不同的方法可发展出具有特定优势的分支技术,比如利用电喷雾电离原理分析小分子代谢物的DESI-IMS,或利用基质喷涂辅助样本电离检测蛋白、多肽和脂质的MALDI-IMS[59]。虽然能将检测对象映射到原始样品的2D或3D坐标上,但由于质量峰图的非靶性,需要通过比对数据库分析物质分子量才能定性、定量和定位地获取空间组织中的分子水平信息。而与流式技术相结合的IMC采用了另一种思路,金属标签使其能靶向地检测生物标志物,更精确地描述空间组织结构,定量和定位地提取细胞表型和相互作用网络的数据。然而,数据广度的增加使得IMC需要更加繁杂的样本前处理时间和更多的成本投入。1张FFPE切片需要经过脱蜡、抗原修复、抗体过夜孵育等操作才能进行IMC检测,而IMS前处理只需要脱蜡或基质喷涂即可上机检测。其操作会更便捷、耗时短、易上手。金属标签的使用是IMC成本增加的主要原因,虽然多标记的一次性检测可以节省珍贵样本和缩短检测周期,但越多的标记抗体将产生越大的成本。
4 结语
IMC较之传统成像技术有更高的灵敏度,更强的分子特异性,能同时从组织样本中原位检测多种生物分子,1次数据采集即可获得多种分子的空间分布信息和定量数据。因其高水平的多通道分析能力,样本利用率和数据深度,已被广泛应用于癌症研究的各个层面。通过挖掘和分析细胞间的相互作用,IMC能够从细胞亚群功能鉴定到癌症治疗效果等多方面对肿瘤生态系统进行深入全面的探究,在免疫肿瘤学领域具有独特的潜在应用价值。IMC可从细胞和癌组织样本中同时获取多靶标数据,并能保留空间组织结构,量化细胞亚群和相互作用信息,在面对TME的复杂性和异质性时,有助于更好的理解癌症进展机制。另外,通过比对治疗前后以及反应者和无反应者之间的TME,IMC及其空间分析方法可在发现特异性差异方面发挥关键作用。然而,由于IMC的数据采集速率目前一般在1 mm2/100 min,即使最新技术已提升至约5倍(Hyperion XTi,Standard BioTools,USA),但仍然难以用较少时间和成本获得更大乃至整个切片区域的数据信息,只能划分并选择较小的ROI。另外,除了检测仪器的投入,若要分析大量的患者组织样本,其分析成本与组织切片中金属标记抗体的数量和切片表面积成正比。这些因素导致IMC目前仍是一种昂贵的检测技术,实际上很难广泛应用于常规临床诊断,仍需进一步优化工作流程,降低时间和成本。在癌症精准诊疗时代,随着空间转录组学的发展,分子病理学将与反映癌症组织结构的空间数据进一步结合,IMC能在破译癌症组织内细胞表型、功能和相互作用,发现耐药机制,探索诊疗标志物等方面发挥关键作用,有助于开发精准医学新策略,并推动临床应用转化。
参考文献
[1] Schreiber RD,Old LJ,Smyth MJ. Cancer immunoediting:integrat‐ing immunity’s roles in cancer suppression and promotion[J]. Science,2011,331(6024):1565-1570.
[2] Topalian SL,Hodi FS,Brahmer JR,et al. Safety,activity,and im‐mune correlates of anti-PD-1 antibody in cancer[J]. N Engl J Med,2012,366(26):2443-2454.
[3] Chang Q,Ornatsky OI,Siddiqui I,et al. Imaging mass cytometry[J]. Cytometry A,2017,91(2):160-169.
[4] Gohil SH,Iorgulescu JB,Braun DA,et al. Applying highdimensional single-cell technologies to the analysis of cancer immuno‐therapy[J]. Nat Rev Clin Oncol,2021,18(4):244-256.
[5] Cotechini T,Jones O,Hindmarch CCT. Imaging mass cytometry in immuno-oncology[M]// The Tumor Microenvironment. New York:Hu‐mana,2023:1-15.
[6] Giesen C,Wang HA,Schapiro D,et al. Highly multiplexed imag‐ing of tumor tissues with subcellular resolution by mass cytometry[J]. Nat Methods,2014,11(4):417-422.
[7] Glasson Y,Chépeaux LA,Dumé AS,et al. Single-cell highdimensional imaging mass cytometry:one step beyond in oncology[J]. Semin Immunopathol,2023,45(1):17-28.
[8] Han GJ,Chen SY,Gonzalez VD,et al. Atomic mass tag of bis‐muth-209 for increasing the immunoassay multiplexing capacity of mass cytometry[J]. Cytometry A,2017,91(12):1150-1163.
[9] Gerdtsson E,Pore M,Thiele JA,et al. Multiplex protein detection on circulating tumor cells from liquid biopsies using imaging mass cytometry[J]. Converg Sci Phys Oncol,2018,4(1):015002.
[10] Allo B,Lou XD,Bouzekri A,et al. Clickable and high-sensitivity metal-containing tags for mass cytometry[J]. Bioconjug Chem,2018,29(6):2028-2038.
[11] Rovira-Clavé X,Jiang SZ,Bai YH,et al. Subcellular localization of biomolecules and drug distribution by high-definition ion beam imag‐ing[J]. Nat Commun,2021,12(1):4628.
[12] Catena R,Montuenga LM,Bodenmiller B. Ruthenium counter‐staining for imaging mass cytometry[J]. J Pathol,2018,244(4):479-484.
[13] Ijsselsteijn ME,van der Breggen R,Farina Sarasqueta A,et al. A 40-marker panel for high dimensional characterization of cancer im‐mune microenvironments by imaging mass cytometry[J]. Front Immunol, 2019,10:2534.
[14] Baars MJD,Sinha N,Amini M,et al. MATISSE:a method for im‐proved single cell segmentation in imaging mass cytometry[J]. BMC Biol,2021,19(1):99.
[15] Hoch T,Schulz D,Eling N,et al. Multiplexed imaging mass cy‐tometry of the chemokine milieus in melanoma characterizes features of the response to immunotherapy[J]. Sci Immunol,2022,7(70):eabk1692.
[16] Baharlou H,Canete NP,Cunningham AL,et al. Mass cytometry imaging for the study of human diseases-applications and data analysis strategies[J]. Front Immunol,2019,10:2657.
[17] Chang Q,Ornatsky OI,Siddiqui I,et al. Biodistribution of cispla‐tin revealed by imaging mass cytometry identifies extensive collagen binding in tumor and normal tissues[J]. Sci Rep,2016,6:36641.
[18] Carpenter AE,Jones TR,Lamprecht MR,et al. CellProfiler:im‐age analysis software for identifying and quantifying cell phenotypes[J]. Genome Biol,2006,7(10):R100.
[19] Schapiro D,Jackson HW,Raghuraman S,et al. histoCAT:analy‐sis of cell phenotypes and interactions in multiplex image cytometry data[J]. Nat Methods,2017,14(9):873-876.
[20] Fischer JR,Jackson HW,de Souza N,et al. Multiplex imaging of breast cancer lymph node metastases identifies prognostic single-cell populations independent of clinical classifiers[J]. Cell Rep Med,2023,4(3):100977.
[21] Jackson HW,Fischer JR,Zanotelli VRT,et al. The single-cell pathology landscape of breast cancer[J]. Nature,2020,578(7796):615-620.
[22] Yi QJ,Wang J,Liu TT,et al. scRNA-Seq and imaging mass cy‐tometry analyses unveil iNKT cells-mediated anti-tumor immunity in pancreatic cancer liver metastasis[J]. Cancer Lett,2023,561:216149.
[23] Mi QS,Dimitrion P,Hamzavi I,et al. Dysregulated CD38 expres‐sion in blood and skin immune cells of patients with hidradenitis suppu‐rativa[J/OL]. Res Sq,2023[epub ahead of print].doi: 10.21203/rs.3.rs-2609421/v1.
[24] Ravi VM,Will P,Kueckelhaus J,et al. Spatially resolved multiomics deciphers bidirectional tumor-host interdependence in glioblas‐toma[J]. Cancer Cell,2022,40(6):639-655.
[25] Funingana IG,Bedia JS,Huang YW,et al. Multiparameter singlecell proteomic technologies give new insights into the biology of ovarian tumors[J]. Semin Immunopathol,2023,45(1):43-59.
[26] Krop J,van der Meeren LE,van der Hoorn MP,et al. Identifica‐tion of a unique intervillous cellular signature in chronic histiocytic in‐tervillositis[J]. Placenta,2023,139:34-42.
[27] Le Rochais M,Hémon P,Ben-Guigui D,et al. Deciphering the maturation of tertiary lymphoid structures in cancer and inflammatory diseases of the digestive tract using imaging mass cytometry[J]. Front Im‐munol,2023,14:1147480.
[28] Roelands J,van der Ploeg M,Ijsselsteijn ME,et al. Transcrip‐tomic and immunophenotypic profiling reveals molecular and immuno‐logical hallmarks of colorectal cancer tumourigenesis[J]. Gut,2023,72(7):1326-1339.
[29] Sorin M,Karimi E,Rezanejad M,et al. Single-cell spatial land‐scape of immunotherapy response reveals mechanisms of CXCL13 en‐hanced antitumor immunity[J]. J Immunother Cancer,2023,11(2):e005545.
[30] Wang XQ,Danenberg E,Huang CS,et al. Spatial predictors of im‐munotherapy response in triple-negative breast cancer[J]. Nature,2023,621(7980):868-876.
[31] Sanmamed MF,Nie XX,Desai SS,et al. A burned-out CD8+ Tcell subset expands in the tumor microenvironment and curbs cancer im‐munotherapy[J]. Cancer Discov,2021,11(7):1700-1715.
[32] Xiang HD,Ramil CP,Hai J,et al. Cancer-associated fibroblasts promote immunosuppression by inducing ROS-generating monocytic MDSCs in lung squamous cell carcinoma[J]. Cancer Immunol Res,2020,8(4):436-450.
[33] van Dam S,Baars MJD,Vercoulen Y. Multiplex tissue imaging:spatial Revelations in the tumor microenvironment[J]. Cancers,2022,14(13):3170.
[34] Karimi E,Yu MW,Maritan SM,et al. Single-cell spatial immune landscapes of primary and metastatic brain tumours[J]. Nature,2023,614(7948):555-563.
[35] Rahim MK,Okholm TLH,Jones KB,et al. Dynamic CD8+ Tcell responses to cancer immunotherapy in human regional lymph nodes are disrupted in metastatic lymph nodes[J]. Cell,2023,186(6):1127-1143.
[36] Apollonio B,Spada F,Petrov N,et al. Tumor-activated lymph node fibroblasts suppress T cell function in diffuse large B cell lym‐phoma[J]. J Clin Invest,2023,133(13):e166070.
[37] Mancino C,Pasto A,de Rosa E,et al. Immunomodulatory biomi‐metic nanoparticles target articular cartilage trauma after systemic ad‐ministration[J]. Heliyon,2023,9(6):e16640.
[38] Heiland DH,Ravi VM,Will P,et al. Spatiotemporal heterogeneity of glioblastoma is dictated by microenvironmental interference[J]. Brain Spine,2021,1:100550.
[39] Lin QY,Zhou YQ,Ma J,et al. Single-cell analysis reveals the multiple patterns of immune escape in the nasopharyngeal carcinoma microenvironment[J]. Clin Transl Med,2023,13(6):e1315.
[40] Danielli SG,Porpiglia E,De Micheli AJ,et al. Single-cell profil‐ing of alveolar rhabdomyosarcoma reveals RAS pathway inhibitors as cell-fate hijackers with therapeutic relevance[J]. Sci Adv,2023,9(6):eade9238.
[41] Yao LY,He FN,Zhao QY,et al. Spatial multiplexed protein pro‐filing of cardiac ischemia-reperfusion injury[J]. Circ Res,2023,133(1):86-103.
[42] He JZ,Chen Y,Zeng FM,et al. Spatial analysis of stromal signa‐tures identifies invasive front carcinoma-associated fibroblasts as sup‐pressors of anti-tumor immune response in esophageal cancer[J]. J Exp Clin Cancer Res,2023,42(1):136.
[43] Robert M,Chépeaux LA,Glasson Y,et al. Comprehensive analy‐sis of cell lineages involved in giant cell arteritis pathogenesis using highly multiplexed imaging mass cytometry[J]. Autoimmun Rev,2023,22(1):103216.
[44] Zabransky DJ,Danilova L,Leatherman JM,et al. Profiling of syn‐geneic mouse HCC tumor models as a framework to understand antiPD-1 sensitive tumor microenvironments[J]. Hepatology,2023,77(5):1566-1579.
[45] Eng J,Bucher E,Hu Z,et al. Robust biomarker discovery through multiplatform multiplex image analysis of breast cancer clinical cohorts[J/OL]. bioRxiv,2023[epub ahead of print]. doi: 10.1101/2023.01.31. 525753.
[46] Chen J,Amoozgar Z,Liu X,et al. Reprogramming intrahepatic cholangiocarcinoma immune microenvironment by chemotherapy and CTLA-4 blockade enhances anti-PD1 therapy[J/OL]. bioRxiv,2023[epub ahead of print].doi: 10.1101/2023.01.26.525680.
[47] Sorin M,Rezanejad M,Karimi E,et al. Single-cell spatial land‐scapes of the lung tumour immune microenvironment[J]. Nature,2023,614(7948):548-554.
[48] Wang V,Liu ZC,Martinek J,et al. Computational immune syn‐apse analysis reveals T-cell interactions in distinct tumor microenviron‐ments[J/OL]. Res Sq,2023[epub ahead of print].doi: 10.21203/rs.3.rs-2968528/v1.
[49] Cao YS,Chang Q,Cabanero M,et al. Tumor platinum concentra‐tions and pathological responses following cisplatin-containing chemo‐therapy in gastric cancer patients[J]. J Gastrointest Cancer,2019,50(4):801-807.
[50] Cao YS,Chang Q,Zhang WJ,et al. Skin platinum deposition in colorectal cancer patients following oxaliplatin-based therapy[J]. Can‐cer Chemother Pharmacol,2019,84(6):1195-1200.
[51] Sayin K,üng?rdü A. Investigation of anticancer properties of caf‐feinated complexes via computational chemistry methods[J]. Spectro‐chim Acta A Mol Biomol Spectrosc,2018,193:147-155.
[52] Lau JKC,Deubel DV. Hydrolysis of the anticancer drug cisplatin:pitfalls in the interpretation of quantum chemical calculations[J]. J Chem Theory Comput,2006,2(1):103-106.
[53] Alvarado-Soto L,Ramirez-Tagle R. A theoretical study of the binding of[Re?Se?(OH)?(H?O)?]rhenium clusters to DNA purine base guanine[J]. Materials,2015,8(7):3938-3944.
[54] Deo C,Abdelfattah AS,Bhargava HK,et al. The HaloTag as a general scaffold for far-red tunable chemigenetic indicators[J]. Nat Chem Biol,2021,17(6):718-723.
[55] Duncan RR,Bergmann A,Cousin MA,et al. Multi-dimensional time-correlated single photon counting(TCSPC) fluorescence lifetime imaging microscopy(FLIM) to detect FRET in cells[J]. J Microsc,2004,215(Pt 1):1-12.
[56] Dang JQ,Li HX,Zhang LL,et al. New Structure Mass Tag based on Zr-NMOF for Multiparameter and Sensitive Single-Cell Interrogat‐ing in Mass Cytometry[J]. Adv Mater,2021,33(35):e2008297.
[57] Ptacek J,Locke D,Finck R,et al. Multiplexed ion beam imaging(MIBI) for characterization of the tumor microenvironment across tumor types[J]. Lab Invest,2020,100(8):1111-1123.
[58] Keren L,Bosse M,Thompson S,et al. MIBI-TOF:a multiplexed imaging platform relates cellular phenotypes and tissue structure[J]. Sci Adv,2019,5(10):eaax5851.
[59] Parrot D,Papazian S,Foil D,et al. Imaging the unimaginable:de‐sorption electrospray ionization-imaging mass spectrometry(DESI-IMS)in natural product research[J]. Planta Med,2018,84(9/10):584-593.
(责任编辑:曾 玲)
本文引用格式:
黄一薇,向廷秀,刘星河,等. 质谱流式成像技术及其在肿瘤研究中的应用进展[J]. 重庆医科大学学报,2025,50(1):6-13.

