基于多维指标对不同来源蜂蜜的比较分析

摘要:蜂蜜是一种成分复杂的天然食品,其成分组成和营养价值因蜜源植物、产地、蜂种等不同而异。为实现对不同来源蜂蜜的评价和区别,采用常规理化指标检测和高效液相色谱−四极杆飞行时间质谱联用(highperformance liquid chromatography-quadrupole-time of flight/mass spectrometer,HPLC-Q-TOF/MS)分析等多维指标对其进行比较分析。结果表明,不同蜂蜜样品的淀粉酶值、果糖、葡萄糖、总酚酸和总黄酮含量等有明显差异;其中,油菜蜜淀粉酶值最低,为(3.42±0.70)mL·g-1·h-1;洋槐蜜(沁水)淀粉酶值最高,为(12.66±2.44) mL·g-1·h-1;中蜂蜜的总酚酸和总黄酮含量均高于其他蜂蜜样品。脯氨酸−组氨酸−半胱氨酸和羟基酪醇1-O-葡萄糖苷可能有助于区分蜂蜜的蜜源植物种类,倍半萜化合物在洋槐蜜的产地区分中起到重要作用。研究结果为蜂蜜的特征性评价提供了一定的方法性指导,即借助多维指标可实现不同来源蜂蜜的区分与鉴别。
关键词:蜂蜜;多维指标;HPLC-Q-TOF/MS;特征性鉴别doi:10.13304/j.nykjdb.2023.0522
中图分类号:TS207.3 文献标志码:A 文章编号:1008‐0864(2025)02‐0170‐10
蜂蜜是蜜蜂采集植物的花蜜或蜜露,并辅以自身的分泌物,经充分转化、酿造而成的天然甜味物质[1]。蜂蜜具有极高的营养和保健价值,除糖分之外,蜂蜜含有的微量物质大多是维持人体健康的必需成分,在能量代谢、免疫调节等生理过程中发挥重要作用[2]。植物的花蜜是这些微量物质的重要来源,不同植物来源、不同产地的蜂蜜中微量物质种类和含量存在较大差异[3]。因此,开展各类蜂蜜中微量物质的特征分析,可以为蜂蜜营养品质的评价提供依据,对地方特色蜂蜜产业的发展具有重要意义。
蜂蜜的成分相当复杂,含有80%~85% 的糖分、15%~17% 的水、0.3% 的蛋白质及少量氨基酸、酚类、色素和维生素等[4‐5]。某些特定蜜源蜂蜜中的典型特征成分,即特征标记物质被广泛鉴别出来,进而被应用于鉴别特定产地、蜜源、加工方式的蜂蜜样品中,如1-戊烯-3-醇可作为英国地区蜂蜜的特征挥发性成分[6]。一般情况下,极致追求利用某种单一成分区别不同来源的蜂蜜不太现实,大多需要借助某类或某组特征成分。例如,糠硫醇、苯甲醇、δ-辛醇内酯、γ-癸内酯、丁香油酚、苯甲酸、异戊酸、苯乙醇和4-甲氧基苯酚均对巴西的腰果(Anacardium occidentale)蜂蜜风味具有重要影响[7]。Qiao等[8]报道了丁香酸甲酯、相思酸、椴树素[4- (2-hydroxypropan-2-yl) cyclohexa-1,3-diene-1-carboxylic acid]可分别作为油菜、洋槐、椴树蜂蜜中特殊或独特的植物化学成分,其中丁香酸甲酯和椴树素是油菜和椴树蜂蜜中含量最高的成分,此外,还建立了以上3种单花蜂蜜的高效液相(high performance liquid chromatography,HPLC)指纹图谱,并提供了评估标准,将特征成分与标准指纹相结合,可实现商品油菜、洋槐和椴树蜂蜜真实性的评价。研究报道,Zantaz蜂蜜是单花蜂蜜品种,是蜜蜂采自摩洛哥阿特拉斯山脉的灌木Bupleurum spinosum(Apiaceae),多酚成分测定显示,丁香酸甲酯占多酚总量的50%以上,代表了该单花蜜特征的非常有价值的参数[9]。
液相色谱-质谱法适配性广泛、灵敏度高,因而成为检测手段的首选。但三重四级杆串联质谱多采用多反应检测扫描模式(multiple reactionmonitoring, MRM),其分辨率和扫描速率受到限制,在样品分析时会受到基质干扰成分的影响,易出现假阳性和假阴性结果[10‐11]。近些年,高分辨质谱技术在蔬菜、水果、茶叶、酒等领域应用广泛[12‐13],而在蜂蜜基质的报道中,利用高分辨质谱的分析检测报道相对较少。高效液相色谱-四级杆飞行时间质谱联用技术(high performanceliquid chromatography-quadrupole-time of flight/mass spectrometer,HPLC-Q-TOF/MS)是一种常用的分析方法,其基本原理是在高效液相层析仪和四级杆飞行时间质谱之间进行联用,以获得更准确和可靠的化合物分析结果。该技术被广泛应用于药物分析、天然产物分析、蛋白质分析和环境分析等领域。HPLC-Q-TOF/MS 联用技术在食品成分分析和品质评价,包括食品中营养成分和香味成分的分析等方面大有用途[14-16]。但HPLC-QTOF/MS联用技术仍然存在一些挑战和局限性,例如,分离HPLC和四级杆飞行时间质谱之间的界面和2种技术之间的校准问题。此外,在操作和数据处理方面也需要掌握一定的技巧和经验,以确保准确性和精度。飞行时间质谱(time of flight/mass spectrometer,TOF/MS)鉴定过程中,根据一级质谱得到化合物精确的分子式,然后再根据其二级质谱结合数据库和相关文献对化学成分进行定性,精确质量数与理论质量数相差不超过±2×10-6 [17‐18]。
本研究拟借助多维指标对我国主要的大宗蜜源蜂蜜样品进行评价,并加以区分鉴别。首先,根据国家标准方法对样品的常规指标和成分进行分析,然后采用当前精确性较高的HPLC-Q-TOF/MS方法对样品的蜜源种类、产地等进行区分和鉴别,以期探索多技术角度评价不同来源蜂蜜的可行性,为蜂蜜的特征性和真实性评价提供一定理论基础。
1 材料与方法
1.1 蜂蜜样品及蜜源信息
本研究中的蜂蜜样品采自我国各蜜源主产区的意大利蜜蜂(Apis mellifera)和中华蜜蜂(Apiscerana cerana)蜂场,包括5个省(直辖市)的5种蜜源蜂蜜(表1)。所有样品均是在蜜源植物的开花流蜜季节采集,采样时间为2022年3—8月。每个采样地点一般聚集有10个以上的养蜂户,且各采样点之间的距离超过5 km,养殖规模一般为100群左右。每种蜂蜜样品平行采集5~10次,共计37个样品,各样品采样量为500 g,密封保存于6~8 ℃。蜂蜜样品蜜源信息的确认,主要依靠采访养蜂户、调查采样点蜜源植物种类及专业人员的感官鉴别等。
1.2 常规理化指标分析
参照GB 5009.8—2016[19]采用高效液相色谱法检测果糖和葡萄糖含量;参照GB/T 18932.16—2003[20]采用分光光度法检测淀粉酶活性。
1.3 总酚酸和总黄酮含量的测定
蜂蜜中总多酚含量的测定采用Folinol-Ciocalteu 法[21]。2.5 g 蜂蜜样品加蒸馏水定容到10 mL 容量瓶中,取1 mL 蜂蜜水溶液与1 mL 的Folinol-Ciocalteu 混匀,再加入5 mL 的1 mol·L-1Na2CO3 溶液,用蒸馏水定容至10 mL,充分混匀。于黑暗环境孵化1 h,8 000 r·min-1离心5 min后取上清液于比色皿中,在760 nm处测定其吸光度值。用没食子酸来绘制标准曲线,多酚含量以每千克蜂蜜提取的没食子酸当量(gallic acid equivalents,GAEs)的毫克数表示。
总黄酮含量测定[21]:将5 g 蜂蜜样品加入10 mL 的去离子水中,在60 kHz 超声下处理10 min,在8 000 r·min-1 下离心5 min。收集上清液并将其加入到5 mL 甲醇和5 mL 水预处理的SPE滤芯中。上清液样品以1 mL·min-1的流速通过色谱柱,然后用8 mL甲醇洗脱被分析物。所得的洗脱液用氮气流进行干燥,得到蜂蜜提取物。加入1 mL 的甲醇复溶,并于-20 ℃保存。取500 μL溶液进行总黄酮测定,取500 μL溶液进行后续HPLC-Q-TOF/MS分析。
500 μL蜂蜜提取物与3 mL无水乙醇、1 mL硝酸铝溶液(100 g·L-1)和1 mL醋酸钾溶液(9.8 g·L-1)混合后加水定容到10 mL容量瓶。于黑暗环境孵化1 h,在415 nm处测定混合物的吸光度值。用槲皮素来绘制标准曲线,结果以每kg蜂蜜提取的槲皮素当量(quercetin equivalents,QEs)的毫克数表示。
1.4 蜂蜜HPLC-Q-TOF/MS 分析
用0.22 μm的尼龙膜对500 μL蜂蜜提取物溶液进行过滤,并将其放入棕色小瓶中。采用高效液相色谱结合四极杆飞行时间质谱(HPLC-QTOF/MS,6545)系统,在负/正电离模式下进行色谱分析。使用安捷伦Zorbax Poroshell EC-C18柱(2.1 mm×100 mm,2.7 μm)分离提取的化合物,用含有0.1%甲酸(体积比)的超纯水(A)和甲醇(B)以0.3 mL·min−1 的流速进行线性梯度洗脱,分离分析物。线性梯度洗脱程序为:0~1 min,5% B;1~6 min,55% B;6~20 min,95% B;20~26 min,95% B;26~27 min,5% B;柱温设定为30 ℃,进样量为2 μL。ESI 源的参数如下:雾化器压力为40 psi,毛细管电压为3 500 V,碎裂器电压为120 V,干燥气体(N2)流速为8 L·min−1,干燥气体温度为320 °C,m/z范围为 100~1 700[21]。
1.5 数据分析
1.5.1 一般分析 数据来自5~10个独立样品的重复试验,并以平均值±标准差显示。统计学差异采用单因素方差分析(one-way ANOVA)检验,然后进行Bonferroni post hoc analysis 和Student’sunpaired t-test,Plt;0.05表示有统计学意义。
1.5.2 HPLC-Q-TOF/MS 数据统计分析 对HPLC-Q-TOF/MS 系统获得的原始数据进行初步处理,以适当的格式提供结构化数据,供后续数据分析使用。所得数据由MassHunter 定性分析软件(Agilent Technologies)中的Profinder 软件工具提取,并转换为CEF 文件。用Mass ProfinderProfessional(MPP)(Agilent Technologies)软件进行数据筛选,只有频率大于70% 的物质被选作进一步分析,最后用ID Browser(AgilentTechnologies)对未知物进行鉴定。采用单因素方差分析法对样品的差异进行统计分析,然后进行Bonferroni post hoc analysis 和Student’sunpaired t-test,Plt;0.05 表示有统计学意义。利用偏最小二乘回归分析(partial least squaresdiscriminant analysis, PLS-DA)分析样品之间的差异,并绘制得分图[21]。
2 结果与分析
2.1 蜂蜜淀粉酶值比较分析
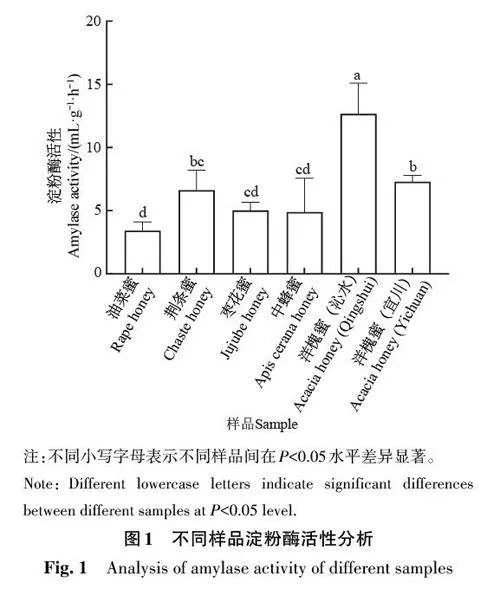
蜂蜜的淀粉酶活性是检验其新鲜度的重要指标,在生产、加工和贮存过程中,温度过高可导致蜂蜜的淀粉酶活性下降。本研究中,所有样品中80%的蜂蜜淀粉酶活性高于国家行业标准(不低于4 mL·g−1·h−1)[22],淀粉酶活性均值为6.65 mL·g−1·h−1。由图1可知,油菜蜜的淀粉酶活性显著低于荆条蜜和洋槐蜜(沁水和宜川)(Plt;0.05),平均值为(3.42±0.70 )mL·g−1·h−1;洋槐蜜(沁水)的淀粉酶活性显著高于其他蜂蜜样品(Plt;0.05),平均值为(12.66±2.44) mL·g−1·h−1。
2.2 蜂蜜中主要成分分析
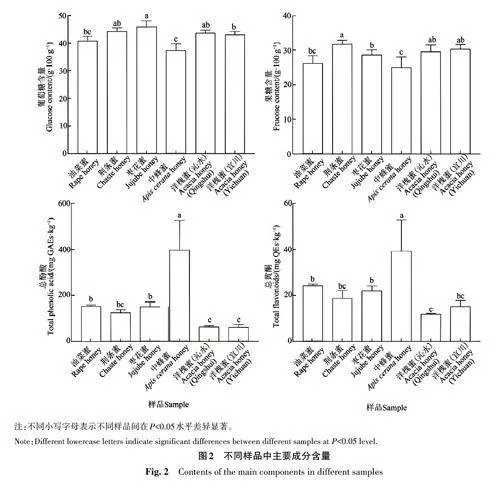
由图2可知,所有蜂蜜样品的葡萄糖和果糖含量均高于国家行业标准(二者总含量不低于60%)[23],最高的为荆条蜜,约是国家行业标准的1.27倍,6组蜂蜜样品平均葡萄糖和果糖含量为国家行业标准的1.18倍。蜂蜜中还原糖(葡萄糖和果糖)含量较高,易被人体吸收利用。枣花蜜的葡萄糖含量显著高于油菜蜜、中蜂蜜和洋槐蜜(宜川)(Plt;0.05),中蜂蜜的葡萄糖含量显著低于荆条蜜、枣花蜜和洋槐蜜(沁水和宜川)(Plt;0.05)。荆条蜜的果糖含量显著高于油菜蜜、枣花蜜和中蜂蜜(Plt;0.05),中蜂蜜的果糖含量显著低于荆条蜜、枣花蜜和洋槐蜜(沁水和宜川)(Plt;0.05)。沁水洋槐蜜(62.33±5.37)mg GAEs·kg−1 和宜川洋槐蜜(60.21±12.49)mg GAEs·kg−1的总酚酸含量显著低于油菜蜜、枣花蜜和中蜂蜜(Plt;0.05)。中蜂蜜的总酚酸含量为(369.68±130.57) mg GAEs·kg−1,显著高于其他蜂蜜(Plt;0.05)。油菜蜜、枣花蜜和荆条蜜的总酚酸含量分别为(153.53±5.61)(149.67±21.88)和(125.34±12.15) mg GAEs·kg−1。此外,洋槐蜜(沁水)的总黄酮含量为(11.7±0.32) mg QEs·kg−1,显著低于油菜蜜、枣花蜜和中蜂蜜(Plt;0.05)。中蜂蜜的总黄酮含量为(39.17±13.75) mg QEs·kg−1,显著高于其他蜂蜜(Plt;0.05)。油菜蜜、枣花蜜、荆条蜜和洋槐蜜(宜川)的总黄酮含量分别为(24.23±0.71)(21.97±2.17)(18.76±3.43)和(15.12±2.62)mg QEs·kg−1。与Truchado等[24]测定的意大利和斯洛伐克洋槐蜜的结果基本一致,2个产地洋槐蜜样品中的总酚酸和总黄酮含量均较低。本研究中枣花蜜中酚酸类化合物含量较高,与杨二林等[25]研究结果类似。但不同研究中,相同蜜源蜂蜜中酚酸和黄酮类化合物含量之间存在一定差异,说明蜂蜜中酚酸和黄酮的含量也受地区、地理条件的影响。
2.3 基于HPLC-Q-TOF/MS 的样品蜜源鉴别
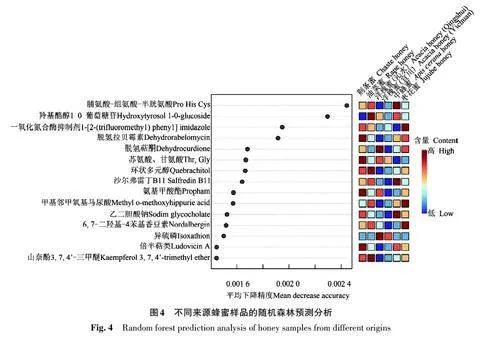
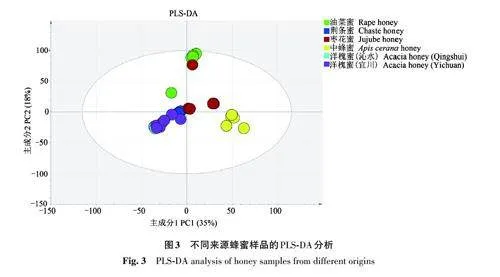
通过富集各蜂蜜样品提取物中的活性成分,并利用安捷伦MPP软件分析其在各样品中的差异。为评估6组蜂蜜样品之间活性成分的变化并简化数据管理,在MPP软件中对原始数据进行偏最小二乘回归分析(PLS-DA)算法。图3 显示的二维PLS-DA代表了53%的总变异,其中第1主成分(principal component 1,PC1)占总数据变异的35%,第2 主成分(principal component 2,PC2)占总数据变异18%。除2种洋槐蜂蜜高度重合外,其余4 种蜂蜜样品分布区域均具有明显的分离度。
图4显示的是随机森林预测分析,以期寻找区分蜂蜜样品的特征标志物。随着平均下降精度(mean decrease accuracy)的变大,目标化合物作为生物标志物在图中右侧显示的排名越好。例如,脯氨酸(Pro)、组氨酸(His)、半胱氨酸(Cys)在中蜂蜜样品中具有较高的相对丰度,而在洋槐蜜(沁水)样品中具有较低的丰度,显然是这些样品组很好的预测者。同样,羟基酪醇 1-O-葡萄糖苷(hydroxytyrosol 1-O-glucoside)在中蜂蜜样品中具有较高的相对丰度,而在荆条蜜样品中具有较低的丰度,说明其对于区分2 种蜂蜜具有较高价值。另外,洋槐蜜(沁水)和洋槐蜜(宜川)在随机森林预测分析中,区分度较小,无法明显区别开。
2.4 基于HPLC-Q-TOF/MS 的样品产地鉴别
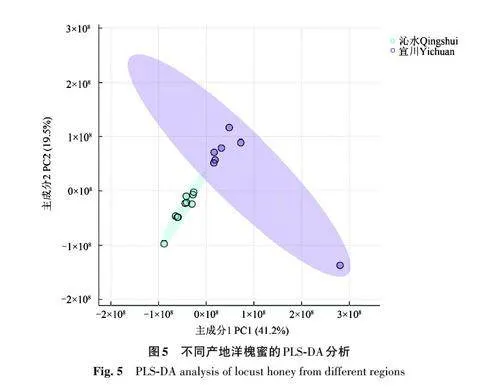
通过以上PLS-DA 分析、蜜源鉴别结果可以发现,洋槐蜜(沁水)和洋槐蜜(宜川)放在所有样品中进行分析,区分度很小,无法做到明确区分。因此,进一步将2种洋槐蜜取出进行PLS-DA分析和随机森林预测分析。图5显示的二维PLS-DA代表了60.7%的总变异,其中第1主成分(PC1)占总数据变异的41.2%,第2主成分(PC2)占19.5%,说明对2种洋槐蜂蜜进行单独分析,依然可以区分开,即不同产地洋槐蜂蜜之间存在一定差异。
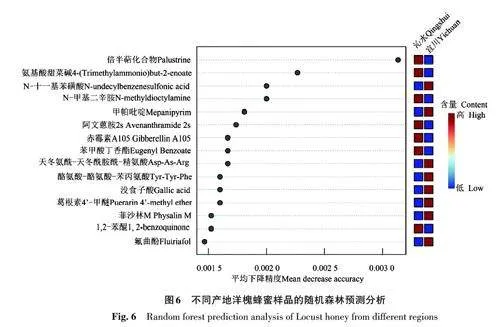
进一步对洋槐蜜(沁水)和洋槐蜜(宜川)进行随机森林预测分析(图6),以寻找区分蜂蜜样品的特征标志物。随着平均下降精度的变大,目标化合物作为生物标志物在图中右侧显示的排名越好。倍半萜化合物(palustrine)在沁水洋槐蜜样品中具有较高的相对丰度,而在洋槐蜜(宜川)样品中具有较低的丰度,显然倍半萜化合物是2种蜂蜜样品的很好的特征标志物。因洋槐蜜(沁水)和洋槐蜜(宜川)只是产地不同,说明倍半萜化合物在不同产地洋槐蜂蜜的区分中,可能具有重要应用价值。
3 讨论
蜂蜜的各项理化指标是表征蜂蜜品质最简单、最基本的指标。由于蜜源、气候、产地、贮藏条件等的不同,蜂蜜中的理化指标存在一定差异,但都保持在一定范围内[3]。糖是蜂蜜中含量最高的物质,含量高达70%~80%,因收获时间、蜜源、产地的不同,蜂蜜中的糖含量也不同[26‐27]。蜂蜜中主要的糖类是葡萄糖和果糖,其含量分别为15.5%~49.3% 和18.2%~48.0%[28],其中果糖是表征蜂蜜营养价值的糖,本研究中荆条蜜和洋槐蜜中果糖含量相对较高,具有较高的营养价值。淀粉酶是表征蜂蜜酿造程度及新鲜程度的指标,其一部分来源于花蜜,另一部分来源于蜜蜂分泌物,且蜜源植物对淀粉酶含量有一定影响。蜂蜜中的淀粉酶随着储存时间的延长和温度的升高而降解[29]。本研究样品没有经过高温加热,检测前储存于冰箱内,蜂蜜的成分未受到降解。本研究揭示了蜜源对蜂蜜淀粉酶活性影响较大,洋槐蜜和荆条蜜中淀粉酶值较高。淀粉酶可促进人体消化吸收,具有一定的营养价值,是表征蜂蜜品质的常见指标[30‐31]。
酚酸和黄酮类物质是蜂蜜中重要的生物活性成分,其中的对羟基苯甲酸、咖啡酸苯乙酯、木犀草素、槲皮素、山奈酚、芹菜素和柯因等已被证实具有抗氧化、抗炎和抗肿瘤等功效[32]。蜂蜜中已发现的酚酸和黄酮类物质达几十种,且在不同蜜源蜂蜜中含量差异较大,可作为鉴别蜂蜜蜜源的生物标记物[33]。本研究中,6组蜂蜜样品的总酚酸和总黄酮含量结果类似,均表现为中蜂蜜的含量最高,而洋槐蜜含量较低。6组蜂蜜样品中总酚酸含量一般维持在60.21~396.68 mg·kg-1,含量较高,该结果与Bertoncel等[34]的研究相近,其发现斯洛文尼亚7种最常见蜂蜜样品的总酚含量范围为44.8~241.4 μg·g-1,且蜂蜜中总酚含量的高低与其抗氧化能力的强弱有很大联系。
经HPLC-Q-TOF/MS 对蜂蜜活性富集物进行非靶标代谢物质分析,所有进入色谱柱被采集到的物质都被保留下来,经MPP软件分析不同组蜂蜜间的物质差异,并通过PLS-DA 分析对不同组蜂蜜进行判别分析,可以实现对不同蜜源蜂蜜样品的明显区分,而同一蜜源的蜂蜜样品不能被分离。当单独分析不同产地的同一蜜源蜂蜜时,可以实现产地的区分,其中倍半萜化合物(palustrine)发挥了重要作用,可作为洋槐蜂蜜产地区分的标志物质。倍半萜化合物主要来源为多年生草本植物犬问荆(Equisetum palustre L.),可用于治疗风湿性关节炎、痛风、动脉粥样硬化等[35]。山西沁水产的洋槐蜂蜜中Palustrine 含量较高,说明当地洋槐花期,犬问荆植物生长面积大,蜜蜂在采集洋槐花蜜的过程中,混入了倍半萜化合物成分,增加了其特殊性。另一方面,本研究利用HPLC-Q-TOF/MS分析了来自5个蜜源的6组蜂蜜样品,对采集到的化合物进行全局性分析,并实施多变量统计分析以进行分类和预测,结果表明,6组蜂蜜样品分布存在明显差异,通过PLS-DA判别分析可以明显区分蜂蜜的蜜源和产地信息,说明不同来源蜂蜜中化学成分差异明显,预示着通过HPLC-Q-TOF/MS区分不同来源蜂蜜的方法切实可行。
参 考 文 献
[1] 王琪琦,杜欣玥,高西贝,等.蜂蜜功能活性及药用价值研究
进展[J].食品安全质量检测学报,2022,13(18):5849-5854.
WANG Q Q,DU X Y,GAO X B,et al ..Research progress on
functional activities and medicinal value of honey [J].J.Food
Saf. Qual., 2022,13(18):5849-5854.
[2] DE-MELO A A M,DE ALMEIDA-MURADIAN L B,SANCHO
M T,et al ..Composition and properties of Apis mellifera honey:a
review [J]. J. Apic. Res., 2017,57(13):1-33.
[3] 任佳淼,赵亚周,田文礼,等.不同蜜源蜂蜜的挥发性成分分
析[J].中国食品学报,2016,16(3):225-236.
REN J M, ZHAO Y Z, TIAN W L,et al .. Analysis of volatile
components in honeys from different nectar sources [J]. J.
Chin. Inst. Food Sci. Technol., 2016,16(3):225-236.
[4] AL M L, DANIEL D, MOISE A,et al .. Physico-chemical and
bioactive properties of different floral origin honeys from
Romania [J]. Food Chem., 2009,112(4):863-867.
[5] PASCUAL-MATE A, OSES S M, FERNANDEZ-MUINO M A,
et al .. Methods of analysis of honey [J]. J Apic. Res., 2018,
57(1): 38-74.
[6] BOI M, LLORENS L, CORTÉS L,et al .. Palynological and
chemical volatile components of typically autumnal honeys of
the western Mediterranean [J]. Grana, 2013,52(2):93-105.
[7] LUZ C F P D, BARTH O M. Pollen analysis of honey and
beebread derived from Brazilian mangroves [J]. Braz. J. Bot.,
2012, 35(1): 79-85.
[8] QIAO J T, CHEN L H, KONG L J,et al .. Characteristic
components and authenticity evaluation of rape, Acacia, and
linden honey [J]. J. Agric. Food Chem., 2020, 68(36): 9776-
9788.
[9] ELAMINE Y, LYOUSSI B, MIGUEL M G, et al ..
Physicochemical characteristics and antiproliferative and
antioxidant activities of Moroccan Zantaz honey rich in methyl
syringate [J/OL]. Food Chem.,2021,339:128098 [2023-06-06].
https://doi.org/10.1016/j.foodchem.2020.128098.
[10] LOWE C N, ISAACS K K, MCEACHRAN A, et al .. Predicting
compound amenability with liquid chromatography-mass
spectrometry to improve non-targeted analysis [J]. Anal.
Bioanal. Chem., 2021,413(30):7495-7508.
[11] CHAPELA M J, REBOREDA A, VIEITES J M, et al ..
Lipophilic toxins analyzed by liquid chromatography-mass
spectrometry and comparison with mouse bioassay in fresh,
frozen,and processed molluscs [J]. J. Agric. Food Chem., 2008,
56(19):8979-8986.
[12] YAN X T, ZHANG Y, ZHOU Y, et al .. Technical overview of
orbitrap high resolution mass spectrometry and its application
to the detection of small molecules in food (update since 2012) [J].
Crit. Rev. Anal. Chem., 2022,52(3):593-626.
[13] KALOGIOURI N P,AALIZADEH R,DASENAKI M E,et al ..
Application of high resolution mass spectrometric methods
coupled with chemometric techniques in olive oil authenticity
studies—a review[J]. Anal. Chim. Acta, 2020,1134:150-173.
[14] LING Y, ZHANG Y P, ZHOU Y, et al .. Rapid detection and
characterization of the major chemical constituents in Akebia
quinata by high performance liquid chromatography coupled to
electrospray ionization and quadrupole time-of-flight mass
spectrometry [J]. Anal. Methods, 2016,8(12):2634-2644.
[15] LIU J H, ZHONG X H, JIANG Y Y, et al .. Systematic
identification metabolites of Hemerocallis citrina Borani by
high-performance liquid chromatography/quadrupole-time-offlight
mass spectrometry combined with a screening method [J/OL].
J.Pharm.Biomed.Anal.,2020,186:113314 [2023-06-06].https://
doi.org/10.1016/j.jpba.2020.113314.
[16] YE L H, YANG J, LIU F M, et al .. Ultrahigh-performance
liquid chromatography coupled with ion mobility quadrupole
time-of-flight mass spectrometry for separation and identification of
hawthorn fruits by multivariate analysis [J/OL]. Microchem. J.,
2021, 171: 103832 [2023-06-06]. https://doi.org/10.1016/j.microc.
2021.106832.
[17] 郭崇婷. 不同干制疏桃多酚体外代谢转运和免疫调节机制
研究[D].沈阳:沈阳农业大学,2022.
GUO C T. Research on the mechanism of metabolic transport
and immunomodulation of different dried thinned peach
polyphenols [D]. Shenyang : Shenyang Agricultural University,
2022.
[18] 崔岩. 中药旋覆花和南山楂质量评价方法研究 [D].天津:天
津中医药大学, 2022.
GUI Y. Study on quality evaluation method of Inulae Flos and
Hawthorn (Crataegus cuneata) fruits [D]. Tianjin: Tianjin
University of Traditional Chinese Medicine, 2022.
[19] 中华人民共和国国家卫生和计划生育委员会,国家食品药
品监督管理总局.食品安全国家标准 食品中果糖、葡萄
糖、蔗糖、麦芽糖、乳糖的测定:GB 5009.8—2016[S].北京:
中国标准出版社,2016.
[20] 庞国芳,付宝莲,李子健,等.蜂蜜中淀粉酶值的测定方法分
光光度法:GB/T 18932.16—2003[S].北京:中国标准出版社,
2003.
[21] GUO N,ZHAO L,ZHAO Y,et al ..Comparison of the chemical
composition and biological activity of mature and immature
honey:an HPLC/QTOF/MS-based metabolomic approach [J]. J.
Agric. Food Chem.,2020,68(13):4062-4071.
[22] 杨寒冰,殷客卿,谭丽蕊. 中华人民共和国供销合作行业标
准 蜂蜜:GH/T 18796—2012[S]. 北京:中国标准出版社, 2016.
[23] 中华人民共和国卫生部. 食品安全国家标准 蜂蜜:
GB 14963—2011[S].北京:中国标准出版社,2011.
[24] TRUCHADO P, LÓPEZ-GÁLVEZ F, GIL M I,et al .. Quorum
sensing inhibitory and antimicrobial activities of honeys and
the relationship with individual phenolics [J].Food Chem.,2009,
115(4):1337-1344.
[25] 杨二林,赵浩安,徐元元,等.枣花蜜酚类化合物组成及其抗
氧化活性分析[J].食品科学,2021,42(3):150-157.
YANG E L, ZHAO H A, XU Y Y, et al .. Phenolic compounds
and antioxidant activity of jujube honey [J].Food Sci.,2021,42
(3):150-157.
[26] EYER M, NEUMANN P, DIETEMANN V. A look into the cell:
honey storage in honey bees,Apis mellifera [J/OL].PLoS One,
2016, 11(8): e0161059 [2023-06-06]. https://doi.org/10.1371/
journal.pone.0161059.
[27] 张晓华.蜂蜜中糖类的高效液相色谱测定及其在蜂蜜品质
控制中的应用研究[J].食品研究与开发,2019,40(16):74-79.
ZHANG X H. Determination of sugars in honey by high
performance liquid chromatography and its application in
honey quality control [J]. Food Res. Dev., 2019,40(16):74-79.
[28] WOOD P, SIDDIQUI I, WEISZ J. Determination of glucose
and fructose in honey [J]. J. Apic. Res.,1975,14(1):41-45.
[29] CHUTTONG B, CHANBANG Y, SRINGARM K, et al ..
Physicochemical profiles of stingless bee (Apidae:Meliponini)
honey from South East Asia (Thailand) [J]. Food Chem., 2016,
192:149-155.
[30] 张冯斌,方冲伟,李斌,等.基于代谢组学对延安五倍子蜂蜜
特征物筛选的研究[J].中国蜂业,2023,74(1):60-63.
ZHANG F B, FANG C W, LI B, et al .. Research on screening
characteristic compounds of gallnut honey from Yan’an of China
based on metabonomics [J]. Apic. China, 2023,74(1):60-63.
[31] 张国志,李珊珊,郑火青,等.6种蜂蜜的抗氧化和抑菌活性研
究[J].中国蜂业,2022,73(11):66-70.
ZHANG G Z, LI S S, ZHENG H Q, et al .. Study on the
antioxidant and antibacterial properties of six kinds of honeys [J].
Apic. China,2022,73(11):66-70.
[32] 张敏,黄京平,赵文,等.超高效液相色谱−串联质谱法测定蜂
蜜中24 种酚酸和黄酮类化合物[J]. 分析测试学报,2022,
41(11):1636-1643.
ZHANG M, HUANG J P, ZHAO W, et al .. Determination of 24
kinds of phenolic acids and flavonoids in honey by ultra-high
performance liquid chromatography-tandem mass spectrometry [J].
J. Instrum. Anal., 2022,41(11):1636-1643.
[33] CHEUNG Y, MEENU M, YU X M, et al .. Phenolic acids and
flavonoids profiles of commercial honey from different floral
sources and geographic sources [J]. Int. J. Food Prop., 2019,
22(1):290-308.
[34] BERTONCEL J J, DOBERSEK U, JAMNIK M, et al.. Evaluation
of the phenolic content, antioxidant activity and colour of Slovenian
honey [J]. Food Chem., 2007, 105(2): 822-828.
[35] 魏作富,鲍文瑶,付玉杰,等.犬问荆化学成分研究[J].中药材,
2021,44(2):334-338.
WEI Z F, BAO W Y, FU Y J, et al .. Chemical constituents
from the acrial parts of Equisetum palustre [J]. J. Chin. Med.
Mater.,2021,44(2):334-338.

