外源钙对盐胁迫下火麻生理特性及次生代谢产物的影响



摘要:为探究外源CaCl2对盐胁迫下火麻生理特性和次生代谢产物的影响,以火麻幼苗为试验材料,通过盆栽土培法,设置300 mmol·L-1 NaCl(C0)胁迫处理及300 mmol·L-1NaCl 胁迫+5(C1)、10(C2)和20 mmol·L-1CaCl2( C3)4个处理,以正常生长火麻为对照(CK),测定不同处理下火麻的光合与荧光参数、各生理指标和次生代谢产物(总黄酮和大麻二酚)含量。结果表明,随着盐胁迫时间延长,火麻净光合速率(net photosyntheticrate,Pn)、气孔导度(stomatal conductance,Gs)、蒸腾速率(transpiration rate,Tr)、光合色素、最大光化学效率(Fv/Fm)显著下降,抗氧化酶活性及可溶性蛋白、总黄酮和大麻二酚含量降低,丙二醛、可溶性糖、脯氨酸含量升高,膜脂过氧化程度加剧。外源施加CaCl2后,火麻的Pn、Gs、Tr、光合色素、Fv/Fm、抗氧化酶活性及可溶性糖、可溶性蛋白、游离脯氨酸、次生代谢产物含量均随CaCl2用量的增加呈先升后降趋势,而丙二醛含量呈先降低后升高的趋势。与CK和C0处理相比,外源CaCl2处理后火麻各指标的变幅均减小,并存在明显剂量效应,即施用低剂量外源钙可在一定程度上缓解盐胁迫对火麻幼苗的损伤程度,但高水平反而会加重损伤,其中10 mmol·L-1 CaCl2处理对增强火麻幼苗的抗盐性效果最佳。以上研究结果为火麻在盐渍土地区栽培与应用提供技术支持。
关键词:火麻;盐胁迫;外源CaCl2;生理特性;次生代谢产物doi:10.13304/j.nykjdb.2023.0332
中图分类号:S563.3;Q945.78 文献标志码:A 文章编号:1008‐0864(2025)02‐0080‐09
我国盐渍土总面积为 3 690 万 hm²,占全国可利用土地面积的5.01%,主要分布在东北、西部、中部等地区[1]。我国盐渍化土地面积还在逐年增加,形势十分严峻。在盐渍环境中,植物种子的萌发会受到阻碍,体内的离子稳态失衡,从而使光合作用减弱,细胞膜结构受损[2-4]。因此,如何增强植物的耐盐性,减轻盐胁迫对作物的危害,已成为当前研究热点。研究显示,通过施加适量的外源调节物质,可以减轻盐胁迫对植物的伤害,提高植物耐盐性[5]。通过施加外源物质减轻盐胁迫对农作物造成的损伤是解决土壤盐渍化的有效途径之一。钙是植物生长所必需的营养元素,在很早之前就与氮、磷、钾一起被称为“肥料的四要素”。研究表明,钙离子参与盐胁迫、氧胁迫、高温和低温胁迫等逆境过程,它能够增强植物的抗逆能力[6]。钙对于信号传导、离子运输、调节酶活性以及细胞膜透性的保持等发挥着关键作用,也是偶联胞外信号与胞内生理反应的第二信使,可以保证钙信号系统的正常发生和传递[7]。为了应对外界环境变化,钙能够抑制细胞内产生更多的活性氧,减少叶绿素降解,使渗透压平衡并保持细胞膜的稳定性,从而使植株正常生长[8]。钙在稳固细胞壁、细胞膜及细胞膜结合蛋白,调控胞内稳态和多种酶活性方面都发挥着重要作用[9]。钙涉及植物种子从萌发到成熟的全部生活史,在维持植物细胞生长及平衡代谢中发挥重要作用,可以很好地增强植物抵御逆境胁迫的抗性。但钙对植物逆境胁迫的缓解效果因钙盐用量、种类以及植物种类等不同而存在差异。
火麻(Cannabis sativa L.)被称为工业大麻,为大麻科(Cannabaceae)大麻属(Cannabis)一年生草本植物[10],也是最古老的栽培作物之一。由于其对环境的适应能力强和出色的抗逆能力,已被推广为盐碱地种植的主要作物之一[11]。火麻具有较高的药用价值,其种子去壳后被称为火麻仁,有行气止痛、温肾散寒的功效[12]。此外,火麻中含有多种萜酚类次生代谢产物被称为大麻素,其中四氢大麻酚(tetrahydrocannabinol,THC)和大麻二酚(cannabidiol,CBD)是2 种重要的大麻素成分。THC是一种精神活性物质,具有成瘾性,而CBD与THC有拮抗作用,CBD在止痛、抗炎、抗癫痫、舒缓压力和抗焦虑、退行性病变(帕金森病、阿尔茨海默病)、癌症等疾病防治方面有巨大潜力[13]。此外,火麻纤维还是一种天然的高强度纤维,其强度比棉、麻等纤维都高,还有抑菌、止痒、防臭、透气性好等特性,可用于制作各种纺织品。火麻的合法种植在我国已经有18年的历史,目前,我国只有云南和黑龙江具有大面积种植大麻的资格[14],而黑龙江省有大面积的盐渍土地。为使火麻的种植不与粮争地,充分利用盐渍土地,可选择在盐渍土地种植火麻。研究表明,火麻具有较好的盐碱耐受性,但生长也会受到一定限制[15]。目前,外源物质缓解盐胁迫对火麻损伤的研究尚未见报道。因此,本研究在前期对火麻盐胁迫研究的基础上,选择CaCl2 为外源物质,研究不同CaCl2 用量对盐胁迫下火麻生理特性及次生代谢产物含量的影响,寻找缓解盐胁迫下火麻的最适CaCl2 用量,并探索其作用机理,为火麻在盐渍地区的栽培和耐盐适应性发现提供理论性依据。
1 材料与方法
1.1 试验设计
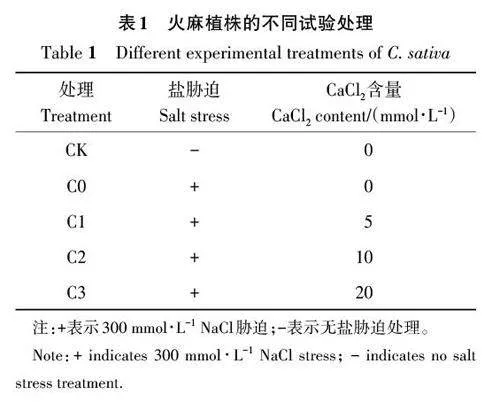
选取长势一致的火麻植株作为试验材料,使用盆栽土培法,根据预试验耐盐性测定,确定火麻苗期的半致死盐胁迫水平。在此基础上,施用CaCl2 处理,参照高彦龙等[16] 关于CaCl2 缓解NaCl 胁迫的研究,以正常生长的火麻为对照(CK),设置300 mmol·L-1 NaCl(C0)胁迫处理及在300 mmol·L-1 NaCl 胁迫下同时施用5(C1)、10(C2)和20 mmol·L-1 CaCl2( C3),共计5个处理(表1),每个处理3 次重复。其中,C0~C3 处理浇灌200 mL NaCl溶液;CK和C0处理叶面喷施去离子水200 mL;C1~C3 处理喷施相同量(请补充具体的施用量体积)的CaCl2溶液。喷施时间均选择晴天的上午9:00 进行。盐胁迫处理当日记作第0天,分别于处理的第1、5、10、15天上午9:00左右取生长一致的火麻幼苗相同节位叶片用于测定光合指标;另随机选取各处理下的其他叶片,将其快速置于液氮中,冷冻后放入-80 ℃冰箱低温冷藏,用于测定各项生理指标和大麻二酚、总黄酮次生代谢产物含量。
1.2 测定指标及方法
1.2.1 光合指标及荧光参数的测定 盐胁迫处理当日记作第0天,分别于处理的第1、5、10、15天上午9:30—11:30,取生长一致的火麻幼苗相同节位叶片测定净光合速率(net photosynthetic rate,Pn)、蒸腾速率(transpiration rate,Tr)、气孔导度(stomatal conductance,Gs);采用便携式脉冲调制叶绿素荧光仪(OS-5P+,美国Opti Sciences公司)测定相同功能叶片的最大光化学效率(Fv/Fm);重复3次。
1.2.2 生理指标测定 使用分光光度法测定叶绿素a(chlorophyll a,Chl a)、叶绿素b(chlorophyll b,Chl b)和总叶绿素含量;采用硫代巴比妥酸比色法测定丙二醛(malondialdehyde,MDA)含量;采用氮蓝四唑光化还原法测定超氧化物歧化酶(superoxide dismutase,SOD)活性;采用愈创木酚法测定过氧化物酶(peroxidase,POD)活性;采用紫外吸收法测定过氧化氢酶(catalase,CAT)活性;参考紫外分光光度法测定抗坏血酸过氧化物酶(ascorbic acid peroxidase,APX)活性;采用考马斯亮蓝G-250染色法测定可溶性蛋白含量;采用蒽酮比色法测定可溶性糖含量;采用酸性茚三酮染色法测定游离脯氨酸含量[17]。
1.2.3 次生代谢产物含量的测定 采用氯化铝比色法[18]测定总黄酮含量;采用高效液相色谱(highperformance liquid chromatography,HPLC)法[19] 测定大麻二酚(CBD)含量。
1.3 数据分析
采用 Excel 2020 和SPSS 26.0 软件进行数据统计分析,采用Origin 2018 软件绘图。
2 结果与分析
2.1 外源CaCl2对盐胁迫下火麻叶片光合特性的影响
由图1可知,C0处理火麻的净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)均较CK显著下降,且随着处理时间的延长呈持续下降趋势,具有明显剂量效应。外源施加CaCl2后,Pn、Gs、Tr的下降速度明显变缓,且不同CaCl2处理对Pn下降速度的缓解程度不同。其中以C2 处理(10 mmol·L-1CaCl2)效果最佳。
2.2 外源CaCl2对盐胁迫下火麻叶片最大光化学效率和叶绿素含量的影响
由图2可知,随着盐胁迫时间的持续,火麻叶片最大光化学效率(Fv/Fm)、叶绿素a、叶绿素b和总叶绿素含量均呈下降的趋势。施加CaCl2处理后,各指标虽然也随着胁迫时间的延长呈下降趋势,但均高于没有喷施CaCl2的C0处理,其中以C2处理(10 mmol·L-1 CaCl2)效果最佳。
2.3 外源CaCl2对盐胁迫下火麻中丙二醛含量的影响
由图3可知,C0处理的丙二醛(MDA)含量最高,且随着胁迫时间的延长持续升高,表明盐胁迫对火麻细胞膜的伤害程度在持续增加。施加CaCl2处理的MDA的含量虽然高于CK,但较C0处理均有不同程度的降低,表明施加外源Ca2+能够不同程度地缓解盐胁迫对火麻的伤害,其中以10 mmol·L-1 CaCl2 (C2)处理效果最优。
2.4 外源CaCl2对盐胁迫下火麻渗透调节物质的影响
由图4 可知,C0 处理的可溶性蛋白含量低于CK,而可溶性糖和脯氨酸含量均高于CK。施加外源Ca2+后,3 种渗透调节物质的含量均高于C0和CK处理。在不同胁迫时间下,火麻中的可溶性蛋白、可溶性糖和脯氨酸含量均随着CaCl2用量的增加先升高后降低,其中C2 处理(10 mmol·L-1 CaCl2)下这3种渗透调节物质含量均最高。
2.5 外源CaCl2对盐胁迫下火麻幼苗抗氧化酶活性的影响
由图5可知,C0处理不同程度地提高了火麻超氧化物歧化酶(SOD)、过氧化物酶(POD,胁迫第15 天除外)和抗坏血酸过氧化物酶(APX)活性,而降低了过氧化氢酶(CAT)活性。施加外源CaCl2后,4种酶的活性均随CaCl2用量的增加呈先升高而后降低趋势。其中SOD、POD和APX活性均在C2处理(10 mmol·L-1 CaCl2)最高;APX活性在C1处理(5 mmol·L-1 CaCl2)最高。
2.6 外源CaCl2对盐胁迫下火麻叶中总黄酮和大麻二酚含量的影响
由图6可知,C0处理火麻叶中的总黄酮和大麻二酚含量均低于CK。施加外源CaCl2后,火麻叶中的总黄酮和大麻二酚含量均随着CaCl2用量的增大逐渐升高,其中在C2 处理(10 mmol·L-1CaCl2)下,这2 种次生代谢物含量均在胁迫第10天最高,与CK相比,火麻叶片总黄酮、大麻二酚含量均显著升高(Plt;0.05)。
3 讨论
当植物受到逆境胁迫时,会根据其自身的生理生化特性快速地进行调节,以应对外界环境变化对其产生的不良影响。盐胁迫对植物造成的危害包括渗透胁迫、离子失衡、水分和养分缺乏等,最后会导致氧化胁迫,对植物的生理代谢产生抑制作用[20]。许多植物都是靠调整其生理机能来适应盐胁迫,主要包括植物形态和结构特征、离子区域化、耐盐基因、渗透调节和活性氧清除等途径[21]。盐胁迫会引起植物线粒体以及叶绿体的电子传递泄漏程度增加[22],造成活性氧(reactiveoxygen species,ROS)的大量积累,对脂质、蛋白质、核酸造成氧化损伤[23]。植物会快速地合成多种渗透调节物质来响应渗透变化,其中可溶性蛋白、可溶性糖和脯氨酸是3种主要的渗透调节物质,对细胞渗透势的维持发挥着关键作用。多数植物都具备的应激响应机制,即通过渗透调节物质来减轻盐胁迫对植物的损害[24]。面临环境胁迫时,由超氧化物歧化酶、过氧化物酶、过氧化氢酶和抗坏血酸过氧化物酶等构成的抗氧化酶系统,是植物最主要的防御体系之一,在ROS清除中起重要作用[25]。除抗氧化酶外,可清除ROS的物质还包括总黄酮、总皂苷等,它们在植物中也可发挥较强的抗氧化性,在一定程度上缓解ROS胁迫。光合作用对于环境胁迫尤为敏感,它为植物生长发育提供物质和能量[26]。钙作为促进植物代谢、生长发育不可或缺的营养元素和矿质元素,Ca2+信号参与植物对各种非生物胁迫的响应。当植物遭受盐害时,会通过Ca2+提高细胞中K+/Na+,从而提高植物的耐盐性,因此,Ca2+在植物发育生长中起重要作用[27]。研究显示,在盐胁迫下,适量外源钙既能改善钙缺乏所引起的矿质营养缺乏,又能提高生物膜结构的稳定性,降低质膜透性,以控制离子的选择吸收[28];适量Ca2+可以有效地降低质膜透性,提高质膜稳定性以及钙信号系统在植物中的生成和传输,从而调节Na+、K+在胞内及胞外的占比,保护细胞结构和功能,继而增强植物抗逆性,并促进其正常生长发育[27]。本研究表明,盐胁迫显著抑制火麻的光合特性,使光合荧光参数(Pn、Gs、Tr)、光合色素、最大光化学效率(Fv/Fm)显著下降,可溶性蛋白含量、抗氧化酶(SOD、POD、CAT、APX)活性及总黄酮和大麻二酚含量降低,MDA、可溶性糖、脯氨酸含量升高,膜脂过氧化程度加剧;且随胁迫时间的延长各指标均加剧变化。这说明持续盐胁迫会导致火麻叶绿素的降解,加速叶片的衰老,由于火麻细胞膜的渗透性下降,其吸水能力减弱,导致细胞膜遭到破坏,同时细胞内氧自由基含量也随之增加,从而进一步加剧了膜脂的过氧化反应[29]。SOD、POD、CAT和APX等植物内源活性氧清除剂及植物自身渗透调节物质对细胞内部渗透势进行调控,使植物细胞膜处于稳定状态,进而将植物体内自由基、活性氧控制在较低水平,避免膜脂过氧化并保护细胞膜,增强植物对逆境的抵抗能力[30]。本研究结果与与朱营营等[31]研究结果一致。本研究还发现,经外源CaCl2处理后,火麻幼苗的Pn、Gs、Tr、最大光化学效率以及光合色素的降幅均减缓,且均随CaCl2用量的增加呈先升后降趋势,以10 mmol·L-1 CaCl2 处理效果最佳。这表明CaCl2能够维持较高的光合效率,通过改善气孔开张程度来提高植株光合性能,这与高彦龙等[16]对苹果研究的观点相同。MDA 含量指示脂质过氧化程度,间接反映了植物细胞膜的状态和完整性。施加CaCl2 后,火麻叶片的MDA含量显著降低,可能是Ca2+减轻了细胞膜脂过氧化程度,这与Wang等[32]对黄瓜幼苗的研究结果一致。游离脯氨酸作为渗透调节物质,其含量变化是对逆境的适应性反应。在本研究中,施加外源CaCl2后,火麻叶片的脯氨酸含量升高,表明Ca2+可能是通过促进精氨酸和鸟氨酸的合成[33]加速脯氨酸的积累。施加外源CaCl2后,火麻叶片的可溶性蛋白和可溶性糖含量显著增加,以10 mmol·L-1 CaCl2处理下火麻叶片的可溶性蛋白和可溶性糖含量最高,表明适量的外源CaCl2 处理能够有效地增加火麻叶片中的可溶性蛋白与可溶性糖含量,从而增强火麻幼苗抵抗盐胁迫对其造成的伤害。当植物遭受逆境胁迫时,细胞内抗氧化酶活性迅速升高。在本研究中, 施加外源CaCl2后,火麻幼苗中的POD、SOD、CAT和APX活性均显著升高,这可能是由于Ca2+减轻了自由基对细胞膜的损伤,因此,Ca2+通过和钙调蛋白相结合,提高过抗氧化酶活性,与吴华鑫等[34]关于盐胁迫降低西伯利亚白刺体内抗氧化酶活性,而外源钙可提高抗氧化酶活性的研究结论相一致。但本研究发现,施用过量的外源CaCl2 (20mmol·L-1)对火麻幼苗盐胁迫的缓解作用减弱,甚至会产生新的离子毒害。总黄酮是一大类天然黄酮类化合物的总称,因其具有极强的抗氧化作用而备受重视;大麻二酚是一种主要的植物大麻素,主要来源于火麻,是火麻主要的非成瘾性活性成分[35]。施加外源CaCl2后,火麻植株的总黄酮和大麻二酚含量均随着外源CaCl2用量的增加和胁迫时间的延长,呈先增加后减少的趋势,10 mmol·L-1 CaCl2处理的效果较好。由此表明,在盐胁迫下施加适宜用量的CaCl2有利于火麻幼苗中总黄酮和大麻二酚的积累,然而其作用机制仍不明确,亟需进一步深入研究。
综上所述,适宜量的CaCl2处理能够提高盐胁迫下火麻的叶绿素含量,促进光合作用,提高最大光化学效率、渗透调节物质含量、抗氧化酶活性及次生代谢产物总黄酮和大麻二酚含量,降低丙二醛含量,减轻脂膜过氧化程度,缓解盐胁迫对火麻的伤害。
参考文献
[1] 杨真,王宝山.中国盐渍土资源现状及改良利用对策[J].山
东农业科学,2015,47(4):125-130.
YANG Z, WANG B S. Present status of saline soil resources and
countermeasures for improvement and utilization in China [J].
Shandong Agric. Sci., 2015, 47(4):125-130.
[2] RAHNAMA A, JAMES RA, POUSTINI K, et al .. Stomatal
conductance as a screen for osmotic stress tolerance in durum
wheat growing in saline soil [J]. Funct. Plant Biol., 2010, 37(3):
255-263.
[3] 杨怡帆,吕新民,鲁晓燕,等.CaCl2对NaCl胁迫下酸枣幼苗抗
逆生理指标的影响[J].石河子大学学报(自然科学版),2016,
34(4):415-423.
YANG Y F, LYU X M, LU X Y, et al .. Effects of CaCl2 on
physiological indexes of sour jujube seedlings under NaCl
stress [J]. J. Shihezi Univ. (Nat. Sci.), 2016, 34(4):415-423.
[4] CHEN Y Y, WANG J C, YAO L R, et al .. Combined proteomic
and metabolomic analysis of the molecular mechanism
underlying the response to salt stress during seed germination
in barley [J/OL]. Int. J. Mol. Sci., 2022, 23(18):10515 [2023-
03-14]. https://doi.org/10.3390/ijms231810515.
[5] 苏文欣,许凌欣,姜宛彤,等.不同外源物质对盐碱胁迫下紫
苏种子萌发、幼苗生长及生理的影响[J].草地学报,2022,
30(9):2415-2422.
SU W X, XU L X, JIANG W T, et al .. Effects of different
exogenous substances on seed germination and seedling growth
and physiology of Perilla frutescens under saline-alkali stress [J].
Acta. Agrestia Sin., 2022, 30(9):2415-2422.
[6] HU W J, LIU J Y, LIU T W, et al .. Exogenous calcium
regulates the growth and development of Pinus massoniana
detecting by physiological, proteomic and calcium-related
genes expression analysis [J]. Plant Physiol. Biochem., 2023,
196:1122-1136.
[7] VERMA S, NEGI N P, NARWAL P, et al .. Calcium signaling
in coordinating plant development, circadian oscillations and
environmental stress responses in plants [J/OL]. Environ. Exp.
Bot., 2022, 201:104935 [2023-03-14]. https://doi.org/10.1016/
j.envexpbot.2022.104935.
[8] ZHANG Z H, SUN H, SHAO C, et al .. Calcium affects growth
and physiological indices of Panax quinquefolium L. [J].
Hortscience, 2022, 57(1):112-117.
[9] 尹大川,祁金玉,邓勋,等.施用外源钙对干旱胁迫下樟子松
苗木生理特性的影响[J]. 沈阳农业大学学报,2018,49(5):
559-565.
YIN D C, QI J Y, DENG X, et al .. Effects of exogenous calcium
on the metabolic system of Pinus sylvestris var. Mongolica
under drought stress [J]. J. Shenyang Agric. Univ., 2018, 49(5):
559-565.
[10] 中国科学院中国植物志编辑委员会.中国植物志[M].北京:
科学出版社,1998:223-225.
[11] HU H, LIU H, LIU F. Seed germination of hemp (Cannabis
sativa L.) cultivars responds differently to the stress of salt type
and concentration [J]. Ind. Crop. Prod., 2018, 123:254-261.
[12] 国家药典委员会.中华人民共和国药典:一部[M].北京:中国
医药科技出版社,2020:81-82.
[13] BRITCH S C, BABALONIS S, WALSH S L. Cannabidiol:
pharmacology and therapeutic targets [J]. Psychopharmacology,
2020, 238(1):9-28.
[14] 于宛彤,侯康鑫,苏新堯,等.药用大麻活性成分、产品开发
及育种研究进展[J]. 中国实验方剂学杂志,2023,29(3):
213-222.
YU W T, HOU K X, SU X Y, et al .. Active ingredients, product
development and breeding of medicinal cannabis: a review [J].
Chin. J. Exp. Tradit. Med. Form., 2023, 29(3):213-222.
[15] 曹焜,孙宇峰,张晓艳,等.盐碱胁迫对工业大麻生长发育的
影响[J].种子,2022,41(11):37-46.
CAO K, SUN Y F, ZHANG X Y, et al .. Effects of salt-alkali
stress on growth and development of industrial hemp [J]. Seed,
2022, 41(11):37-46.
[16] 高彦龙,张德,张瑞,等.外源CaCl2对盐胁迫下苹果砧木T337
生理特性的影响[J].华北农学报,2021,36(5):118-126.
GAO Y L, ZHANG D, ZHANG R, et al .. Effect of exogenous
CaCl2 on physiological characteristics of apple rootstock T337
under salt stress [J]. Acta. Agric. Boreali-Sin., 2021, 36(5):
118-126.
[17] 王学奎,黄见良.植物生理生化实验原理和技术[M].第3版.
北京:高等教育出版社,2015:1-324.
[18] 付立忠,赵利梅,刘骞,等.氮素形态对三叶青块根主要化学
成分含量及抗氧化活性的影响[J]. 中国药学杂志,2021,
56(8):633-639.
FU L Z, ZHAO L M, LIU Q, et al .. Effects of nitrogen forms on
main phytochemical content and antioxidant activity in root
tubers of Tetrastigma hemsleyanum [J]. Chin. Pharm. J., 2021,
56(8):633-639.
[19] 刘胜贵,马海悦,李智高,等.HPLC法测定工业大麻花叶中的
CBD和THC的含量[J].云南化工,2020,47(5):62-64.
LIU S G, MA H Y, LI Z G, et al .. Determination of CBD and
THC in industrial hemp flowers and leaves by HPLC [J].
Yunnan Chem. Technol., 2020, 47(5):62-64.
[20] REHMAN S, ABBAS G, SHAHID M, et al .. Effect of salinity
on cadmium tolerance, ionic homeostasis and oxidative stress
responses in conocarpus exposed to cadmium stress:
implications for phytoremediation [J]. Ecotoxicol. Environ.
Safety, 2019, 171:146-153.
[21] 秦楚.SOS 基因在紫花苜蓿中的表达及其抗逆性研究[D].银
川:宁夏大学,2017.
QIN C. Research on the expression and stress resistance of
SOS gene in alfalfa [D]. Yinchuan: Ningxia University., 2017.
[22] YANG Z, LI J L, LIU L N, et al .. Photosynthetic regulation
under salt stress and salt-tolerance mechanism of sweet
sorghum [J/OL]. Front. Plant Sci., 2020, 10: 1722 [2023-03-
14]. https://doi.org/10.3389/fpls.2019.01722.
[23] KESAWAT M S, SATHEESH N, KHERAWAT B S, et al ..
Regulation of reactive oxygen species during salt stress in plants
and their crosstalk with other signaling molecules-current
perspectives and future directions [J/OL]. Plants Basel, 2023, 12(4):
864 [2023-03-14]. https://doi.org/10.3390/plants12040864.
[24] ZHAO S S, ZHANG Q K, LIU M Y, et al .. Regulation of plant
responses to salt stress [J/OL]. Int. J. Mol. Sci., 2021, 22(9):
4609 [2023-03-14]. https://doi.org/10.3390/ijms22094609.
[25] 杨舒贻,陈晓阳,惠文凯,等.逆境胁迫下植物抗氧化酶系统
响应研究进展[J].福建农林大学学报(自然科学版),2016,45
(5):481-489.
YANG S Y, CHEN X Y, HUI W K, et al .. Progress in
responses of antioxidant enzyme systems in plant to
environmental stresses [J]. J. Fujian Agric. For. Univ. (Nat.
Sci.), 2016, 45(5):481-489.
[26] ZAHRA N, HINAIMSA L, HAFEEZ M B, et al .. Regulation of
photosynthesis under salt stress and associated tolerance
mechanisms [J]. Plant Physiol. Bioch., 2022, 178:55-69.
[27] BACHANI J, MAHANTY A, AFTAB T, et al .. Insight into
calcium signalling in salt stress response [J]. South African J.
Bot., 2022, 151:1-8.
[28] 苏江硕,陈素梅,管志勇,等.外源钙离子对NaCl胁迫下菊花
幼苗生理特性的影响[J].江苏农业科学,2016,44(9):199-203.
SU J S, CHEN S M, GUAN Z Y, et al .. Effects of exogenous
calcium ions on physiological characteristics of Chrysanthemum
morifolium seedlings under NaCl stress [J]. Jiangsu Agric. Sci.,
2016, 44(9):199-203.
[29] MOMENI M M, KALANTAR M, DEHGHANI-ZAHEDANI M.
Physiological, biochemical and molecular responses of durum
wheat under salt stress [J]. Plant Genet. Resour., 2021, 19(2):
93-103.
[30] MIJITI M, ZHANG YM, ZHANG CR, et al .. Physiological and
molecular responses of Betula platyphylla Suk to salt stress [J].
Trees Struct Funct., 2017, 31(5):1653-1665.
[31] 朱营营,张倩,董元杰.外源NO缓解花生盐胁迫的效果及机
理[J].中国农业大学学报,2020,25(12):30-39.
ZHU Y Y, ZHANG Q, DONG Y J. Effects of exogenous nitric
oxide on the physiological characteristics of peanut seedlings
under salt stress [J]. J. Chin. Agric. Univ., 2020, 25(12):30-39.
[32] WANG X D, LAN Z Q, TIAN L, et al .. Change of physiological
properties and ion distribution by synergistic effect of Ca2+ and
grafting under salt stress on cucumber seedlings [J/OL].
Agronomy, 2021, 11(5): 848 [2023-03-14]. https://doi.org/
10.3390/agronomy11050848.
[33] KETEHOULI T, QUOC V H N, DONG J Y, et al .. Overview of
the roles of calcium sensors in plants’ response to osmotic
stress signaling [J]. Funct. Plant Biol., 2022, 49(7):589-599.
[34] 吴华鑫,赵野,王浩宇,等.外源Ca2+对西伯利亚白刺盐胁迫伤
害的缓解效应[J].山东农业科学,2022,54(8):73-78.
WU H X, ZHAO Y, WANG H Y, et al .. Relieving effect of
exogenous Ca2+ on salt stress injury to Nitraria sibirica [J].
Shandong Agric. Sci., 2022, 54(8):73-78.
[35] CERINO P, BUONERBA C, CANNAZZA G, et al .. A review of
hemp as food and nutritional supplement [J]. Cannabis
Cannabinoid Res., 2021, 6(1):19-27.

