AM 真菌−小麦共生体系对不同氮源的吸收转运效率及对磷水平的响应




摘要: 【目的】研究随着时间的变化以及不同磷(P) 浓度下,氮(N) 素在丛枝菌根(AM) 真菌根外菌丝中的转运对小麦生长状况的影响。【方法】试验在三室栽培盒中构建AM 真菌−小麦共生根系系统。在小麦生长约60 天后,进行7 天饥饿处理,然后在菌丝室分别施加30 mL 4 mmol/L 硝酸钾、硫酸铵、谷氨酰胺、精氨酸、尿素溶液,以纯水为对照(CK)。在供氮后第3、5、7 天收获小麦植株,分析菌根和根外菌丝中精氨酸含量、叶片中游离氨基酸和叶绿素含量。同样饥饿处理小麦−菌根共生体系,在菌丝室分别加入磷水平0、35、700 μmol/L 的溶液,每个磷水平下分别施加4 mmol/L 15N 标记的硝酸钾、硫酸铵、尿素,以加纯水为对照,氮源和不同磷水平每7 天各加10 mL,42 天后收样,测定菌根中15N 丰度、叶片中关键酶活性及植株氮、磷含量。【结果】1) 随着供氮培养时间的增加,各处理根外菌丝中精氨酸含量不断下降,在第7 天降至最低。相较于CK,各氮源处理在培养第3 天显著增加了根外菌丝中精氨酸含量,尤以硝酸钾和精氨酸处理的含量最高。相较于CK,除精氨酸组外,各氮源处理在不同培养天数均显著提高了小麦叶片游离氨基酸含量,以施加硝酸钾处理第5 天的游离氨基酸含量最高(1.26 mg/g)。小麦叶片叶绿素含量也随供氮时间的延长整体呈上升趋势。2) 供磷水平与氮素形态均显著影响菌根中15N 丰度,硝酸钾处理配合P 700 μmol/L 处理菌根中的15N 丰度最高,而硫酸铵则在P 35 μmol/L处理下最高。除尿素处理配合P 700 μmol/L 外,氮源的施加显著提高了小麦叶片中硝酸还原酶和谷氨酰胺合成酶活性,施加不同氮源后,小麦叶片硝酸还原酶活性随着磷水平的升高而有所降低。在各磷水平下,各氮源处理下植株地上部、地下部氮、磷含量较不施氮处理均有不同程度的提高。【结论】AM 真菌根外菌丝吸收转运硝态氮和铵态氮的效率高于有机态氮,吸收的氮素以精氨酸的形式转移到根内菌丝,进一步运转到菌根中供小麦生长所需,整个运转过程约为7 天。高磷水平有利于AM 真菌对硝态氮的吸收转运,而低磷水平有利于对铵态氮的吸收转运。
关键词: AM 真菌;小麦;15N 同位素示踪;氮、磷转运
丛枝菌根(arbuscular mycorrhiza,AM) 真菌可以与地球上大多数植物的根形成共生关系[1],AM 真菌吸收氮(N)、磷(P) 等元素并转运到宿主植物体内[2]。Jin 等[3]和Govindarajulu 等[4]证明当AM 真菌根外菌丝(extraradical mycelium,ERM) 吸收NO3−或NH4+后,往往通过硝酸还原酶(NR) 以及谷氨酰氨合成酶/谷氨酸合成酶(GS/GOGAT) 途径转化为精氨酸(Arg),再转运到根内菌丝(intraradical mycelium,IRM),Arg 通过尿素循环分解为NH4+供植物吸收和利用。而宿主植物给AM 真菌提供碳源以供AM 真菌的生长。小麦(Triticum aestivum L.) 是世界三大粮食作物之一,我国有35% 的人口以小麦为主食[ 5 ]。小麦也是菌根作物,其根系能够被AM 真菌侵染[6],接种AM 真菌可以促进小麦生长,提高小麦籽粒产量。如马放等[7]通过人工施加AM 真菌菌剂后,发现小麦侵染率提高了24.54%,小麦地上部生物量提高了24.05%。Li 等[8]在接种AM 真菌的同时联合施用48.76 mg/kg 磷肥,不仅获得小麦高产,还充分发挥了小麦吸收硒的生物学潜力。
氮(N) 是植物中最重要的矿物质营养元素之一,是核苷酸、氨基酸和蛋白质的重要组成成分[9],小麦高产严重依赖氮肥[10]。长期以来,人们一直认为AM真菌共生在植物养分积累中只起着次要作用。但Govindarajulu 等[4]在离体培养试验中发现根系蛋白氨基酸中的氮至少有1/3 来自AM 真菌。Mäder 等[11]发现,通过菌根途径吸收转运给寄主番茄的氮素可达植物体总氮吸收量的42%。Tanaka 等[12]报道菌根化玉米地上部氮吸收量的74% 来自于与其共生的AM真菌ERM。然而,Johansen 等[13]研究发现AM 真菌菌丝体吸收转运给黄瓜的氮素仅占植物总吸收氮量的0.6%~10%。这些差异可能是由于宿主植物的不同等因素造成的。植物对氮的形态也有偏好,一些植物偏向吸收铵态氮,如茶树、水稻等[14],对大部分旱生植物来说则更喜欢硝态氮,如玉米,蔬菜等[15]。所以不同形态氮源的添加可能会影响AM 真菌对氮素的吸收。
磷(P) 是核酸、膜磷脂、还原型辅酶II (NADPH)和ATP 的重要组成部分,在植物的光合、呼吸、蒸腾作用和生长中起着重要作用,往往限制植物的生长和产量[16],土壤中的磷分为有机磷和无机磷,然而磷的流动性较差,难以被植物根系直接吸收利用。中国耕地的土壤磷平均盈余每年达到51.4 kg/hm2,远高于全球平均水平,真正被田间作物吸收利用的磷只占施肥的10%~15%[17−18]。AM 真菌能够通过扩大土壤中磷的吸收范围,将从土壤中吸收的多聚磷酸盐通过多聚磷酸酶转化为植物可利用的正磷酸盐[19]。同时有研究表明,当磷浓度一定时,菌根植物对磷的吸收速率是非菌根植物的6 倍[20]。Qin 等[21]通过32P 示踪技术,在不同磷浓度下接种AM 真菌后发现相较于低磷,高磷条件显著降低了AM 真菌对小麦根部的侵染和小麦茎部的磷含量,表明充足的磷供应会降低AM 真菌对宿主植物的侵染,故而影响AM 真菌吸收的磷素对宿主磷的贡献率。
无机氮形态,通常指硝酸盐和铵盐,在植物对氮的吸收中占主导地位,因此,有关AM 菌根化小麦对其他形式氮的吸收转运研究较少,也缺乏不同磷供应水平、不同形态氮下,ERM 对小麦共生体氮素营养吸收的研究。因此本研究对以下两个问题进行探究:1) 随着时间的变化,不同氮素形态在AM真菌ERM 中的转运以及对小麦生长状况的影响;2) 在不同磷水平下施加不同形态氮素时,ERM 对氮的转运量以及转运的氮、磷对小麦生长状况的影响。
1 材料与方法
1.1 试验材料
寄主植物为小麦,品种为石4366,购自金华市种子公司;供试AM 真菌为异形根孢囊霉(Rhizophagusirregularis),由本课题组培养(本试验接种物为含有Ri T-DNA 转基因胡萝卜根、真菌孢子、菌丝的AM真菌菌剂)。
培养容器为三室培养盒,盒体通过两层0.0385mm 的尼龙过滤布被分隔成三室(菌根室、隔离室和菌丝室)。为了避免营养元素的流动,设计菌根室高于菌丝室。三室在0.1% 的高锰酸钾溶液中浸泡消毒50~60 min 后晾干待用。供试基质材料为清洗后的河沙与草木灰,二者均经121℃、0.1 MPa 高温蒸汽灭菌120 min。菌根室基质为河沙与草木灰按19∶1(v/v) 均匀混合,以保证前期生长的基本营养。隔离室和菌丝室基质为河沙。
1.2 试验设计
选取大小相近、籽粒完整且饱满的小麦种子,用流水冲洗后浸泡在70% 的无水乙醇溶液中消毒3 min,立即用蒸馏水冲洗。将小麦种子放入铺有灭菌滤纸的玻璃培养皿,置于25℃ 生化培养箱暗条件培养并保持湿润。待种子发芽后将种子播入培养基质均一的育苗盘,成长到两叶一心期后,选取长势一致的幼苗移栽至菌根室,每个三室培养盒种植4株。接种处理组在小麦根系分别接种2 mL 菌剂(约400 个孢子)。生长阶段每隔7 天在菌根室添加30 mLHoagland 营养液,向菌丝室定期补水。待菌丝室基质在显微镜下可以看到许多蛛网状结构的根外菌丝后(60 天),饥饿处理7 天(在菌丝室和菌根室只加水),之后进行两组试验处理。
1.2.1 不同氮供应试验 在菌丝室分别施加硝酸钾(KNO3)、硫酸铵[(NH4)2SO4]、尿素(Urea)、精氨酸(Arg)、谷氨酰胺(Gln),各形态氮素的浓度均为N 4mmol/L,添加量为30 mL,以加30 mL 纯水为对照。在菌根室施加30 mL 不含氮、磷的Hoagland 营养液。于处理第3 天、第5 天和第7 天分别收获1次,共计18 个处理,每个处理3 个重复。
1.2.2 不同磷浓度下15N 示踪试验 在菌丝室中分别添加P 水平为0、35、700 μmol/L 的KH2PO4 溶液,分别记作P0、P35、P700,每个磷浓度处理下,分别加入 4 mmol/L 15N 同位素标记的15N-KNO3、15N-(NH4)2SO4、15N-Urea,以加纯水为对照。不同磷水平、各形态氮素、不含氮、磷的Hoagland 营养液每隔7 天各加10 mL,共计12 个处理组合,每个处理3 个重复,42 天后收样。
1.3 测定方法
1.3.1 菌根和菌丝中精氨酸(Arg) 含量测定 取300 g 菌丝室河沙倒入烧杯,加入1000 mL 水,玻璃棒搅拌后立即使用孔径分别为0.45 和0.0385 mm 的试验筛进行叠筛,重复多次直至烧杯中水变清澈。将下层孔径为0.0385 mm 的试验筛网上的残留物全部洗入10 mL 离心管中,加入60% 的蔗糖溶液,4000 r/min 离心10 min,去上清,用蒸馏水洗去菌丝上残留的蔗糖后收集筛离的菌丝(ERM)。小麦收样后将根部用自来水冲洗干净,用滤纸吸去表面的水分即为菌根。将提取的ERM 和菌根使用真空冷冻干燥仪干燥(−50℃,8.0 Pa,48 h)。采用甲萘酚−双乙酰胺法[22]测定Arg 含量。
1.3.2 植株总氮、磷含量测定 将小麦植株收获后分为地上部和地下部,在超低温冷冻干燥机内干燥(−50℃,8.0 Pa,48 h),分别采用凯氏定氮法[23]和钼锑抗比色法[24]测定小麦植株地上部和地下部的氮、磷含量。
1.3.3 叶绿素含量测定 采用丙酮−乙醇法[25]测定小麦叶片叶绿素含量。
1.3.4 核磁共振(NMR) 分析同位素15N 丰度 参照孙颖盈等[26]的方法对菌根中15N 丰度进行测定。
1.3.5 游离氨基酸含量测定 将新鲜小麦叶片冲洗后用吸水纸擦拭干净,剪碎、混匀,采用茚三酮溶液显色法[27]测定小麦组织中游离氨基酸含量。
1.3.6 硝酸还原酶(NR) 和谷氨酰胺合成酶(GS) 的测定 参考陈薇等[28]的方法进行NR 活性测定;参考董召娣等[29]的方法进行GS 活性测定。
1.4 数据处理
数据处理、统计分析与图表制作分别采用MicrosoftExcel 2021、SPSS 26.0、Origin 2021 软件完成。采用Duncan 法进行数据比较,结果用平均值±标准差(SD) 表示。
2 结果与分析
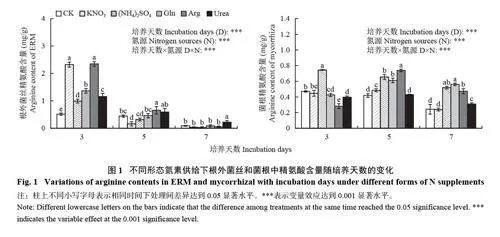
2.1 不同形态氮素供给下ERM 和菌根Arg 含量的变化
图1 为不同取样时间ERM 和菌根中的Arg 含量。培养第3 天,各氮素处理组ERM 中Arg 的含量显著高于对照,增幅为94.52%~360.24%,而在第5 天和第7 天,ERM 中的Arg 含量急剧降低,培养5 和7 天 的ERM 中Arg 含量较第3 天分别下降了13.79%~93.13% 和77.78%~97.89%,且大部分氮处理的Arg 含量与CK 处理无显著差异。
随培养时间的增加,菌根中Arg 含量在KNO3、Arg、Urea 处理下先增加后减少,在(NH4)2SO4 处理下呈下降趋势,在Gln 处理下呈升高趋势。培养至第3 天,菌根Arg 含量KNO3 组与对照无显著差异,Gln、Arg 和Urea 处理组显著降低,而(NH4)2SO4 处理组显著增加。培养至第5 天时,Urea 处理组菌根Arg 含量与对照无显著差异,而KNO3、(NH4)2SO4、Gln、Arg 处理组比对照显著提高了16.83%~151.15%。培养至第7 天时,KNO3 处理与对照无显著差异,(NH4)2SO4、Gln、Arg 和Urea 处理菌根Arg 含量比对照显著提高了28.43%~133.98%。
2.2 AM 真菌氮素转运对小麦叶片游离氨基酸和叶绿素含量的影响
由图2 所示,随着恢复供氮后培养时间的延长,不同氮源处理小麦叶片中的游离氨基酸含量3 个取样时间均以KNO3、(NH4)2SO4 处理最高,且显著高于其他处理;KNO3 处理的叶片游离氨基酸含量第5 天(1.26±0.06 mg/g) 也显著高于(NH4)2SO4 处理;而Arg 处理的游离氨基酸含量在5 个氮源处理中最低,第7 天时甚至显著低于对照。随着培养时间的增加,叶绿素含量整体上呈上升的变化趋势。在培养3 天时,仅有Gln 和Arg 处理叶绿素含量高于对照组,培养7 天时,各氮素处理叶绿素含量均高于对照组。其中,Gln 处理对叶绿素含量的积累最为显著,在培养至7 天时叶绿素含量达到了(1.51±0.05) mg/g。
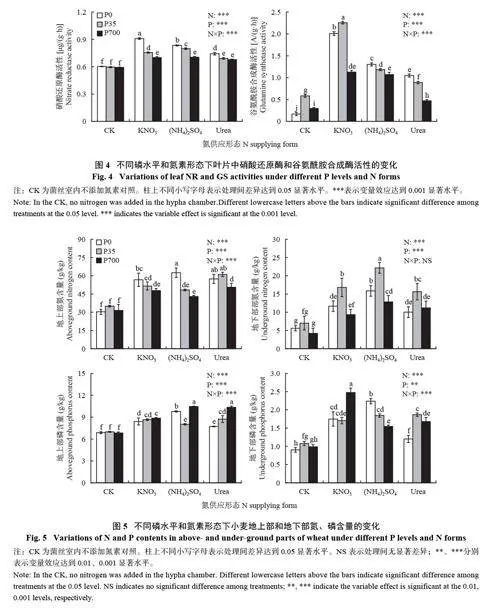
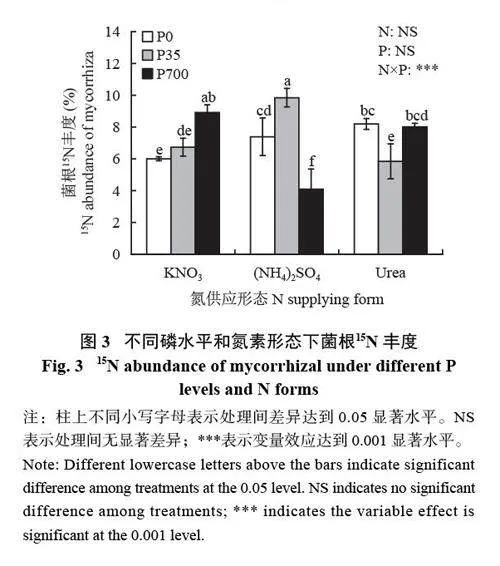
2.3 不同磷水平和氮素形态下菌根15N 丰度
由图3 所示,磷水平与氮素形态对小麦菌根组织15N 丰度影响显著。当施加KNO3 时,小麦菌根组织15N 丰度随着磷水平的增加而增加,P 700 μmol/L处理显著高于0 μmol/L 处理。当施加(NH4 )2SO4时,菌根组织15N 丰度随着磷水平的增加呈先升高后降低的趋势,在P 35 μmol/L 处理最高,为9.84%,且高于其他所有处理组,在P 700 μmol/L 处理下最低,仅为4.09%,显著低于其他所有处理组。当施加Urea 时,菌根组织15N 丰度随着磷水平的增加先降低后升高,在P 0 和700 μmol/L 处理间无显著差异;P 0 μmol/L条件下,(NH4)2SO4 和Urea 处理菌根组织15N 丰度显著高于KNO3 处理。在P 35 μmol/L条件下,(NH4)2SO4处理菌根组织15N 丰度显著高于KNO3 和Urea 处理。在P 700 μmol/L 条件下,KNO3和Urea 处理菌根组织15N 丰度显著高于(NH4)2SO4 处理,但这两处理间无显著差异。
2.4 不同磷水平和氮素形态下叶片中NR 和GS活性的变化
由图4 所示,各施氮处理组NR 活性均显著高于不施氮处理。在不施氮 (CK) 时,磷水平对小麦NR 活性无显著影响。施加氮源后,随着磷水平的增加,各氮素处理下NR 活性随着磷水平的升高呈降低趋势;除磷水平为700 μmol/L、氮源为Urea 处理外,其余施氮处理GS 活性均显著高于不施氮处理。随着磷水平的增加,小麦GS 活性在( N H 4 ) 2 S O 4和Urea 处理下降低,在不施氮和KNO3 处理下先升高后降低。施KNO3 时,磷水平在35 μmol/L 处理下小麦GS 活性最高,为2.26 A/(g·h),显著高于其他处理组。
2.5 不同磷水平和氮素形态下小麦植株中氮、磷含量的变化
如图5 所示,在不同磷水平下,相较于不施氮处理,各氮素处理均不同程度提高了小麦地上部、地下部的氮含量。对于地上部来说,在不施加氮素时,磷水平对小麦氮含量无显著影响。施加KNO3和(NH4)2SO4 时,在P 0 μmol/L 处理下氮含量高于P35 和700 μmol/L 处理。施加Urea 时,在P 0 和35μmol/L 处理下氮含量无显著差异,但均显著高于P700 μmol/L 处理;对于地下部来说,在不施加氮素时,磷水平对小麦氮含量无显著影响。在施加氮素时,氮含量随着磷水平的提高呈先增加后减少的趋势,在P 35 μmol/L 处理下氮含量达到最大。
在不同磷水平下,相较于不施氮处理,各氮素处理下植株地上部、地下部的磷含量均得到不同程度的提高。对于地上部来说,在不施加氮素时,供磷水平对小麦磷含量无显著影响。施加KNO3 和Urea 时,磷含量随着施磷水平的增加而增加。施加(NH4)2SO4时,P 0 和700 μmol/L 处理下磷含量均显著高于P 35μmol/L 处理,分别增加了21.96%、31.44%;对于地下部来说,施加KNO3 时,P 700 μmol/L 处理磷含量最高,达(2.48±0.12) g/kg,高于其他所有处理组。施加(NH4)2SO4 时磷含量随着施磷水平的增加而减少。施加尿素时,磷含量随着施磷水平的增加先增加后减少,在P 35 μmol/L 处理下达到最大。
3 讨论
3.1 随时间变化氮素在AM 真菌ERM 中的转运状况以及对小麦生长状况的影响
本试验通过在菌丝室中一次性加入不同形态的氮源后发现,相较于对照,施加氮源显著提高了ERM中Arg 含量,且随着培养时间的增加,ERM 中的Arg 含量呈下降趋势(图1),说明ERM 吸收氮源后可以促进Arg 的合成,同时,Arg 逐渐被易位到IRM。在培养至第7 天时,几乎全部被转运到IRM,说明氮源被ERM 吸收后再转运到IRM 大约需要7 天。而菌根中Arg 含量并没有随着培养时间的延长而增加,说明Arg 分子转运到IRM 后迅速通过尿素循环途径分解,最终以NH4+的形式供给寄主植物[4];氨基酸在植物氮代谢和发育中起着重要作用[30]。Svietlova等[31]发现有益真菌能够向氮饥饿的植物提供氮,恢复因缺氮而失衡的氨基酸稳态。本研究结果表明除施加Arg 外,施加其他形式的氮均显著促进了小麦叶片中游离氨基酸含量的积累。其中,施加KNO3、(NH4)2SO4 后游离氨基酸含量均显著高于其他氮源,说明在短时间内(7 天) AM 真菌对无机氮的吸收利用进而被菌根化小麦吸收利用效率大于对有机氮的吸收利用。
3.2 不同磷浓度下15N 在AM 真菌ERM 中的转运状况以及对小麦生长状况的影响
虽然AM 真菌已被证明可以吸收氮和磷,并将其从土壤转移到植物中,但磷水平与氮形态之间的相互影响较少报道。在本试验采用同位素15N 示踪技术的研究结果中,(NH4 )2SO4 处理下小麦菌根组织15N 丰度在磷水平为 35 μmol/L 条件下最高,显著高于除磷水平为700 μmol/L 硝态氮处理外的其他所有处理。而在磷水平为 700 μmol/L 条件显著低于其他处理;KNO3 处理下小麦菌根组织15N 丰度随供磷水平的增加而显著增加,在磷水平700 μmol/L 达到最大值(图3)。说明在小麦通过菌丝途径吸收利用铵态氮的过程中,AM 真菌对周围环境中磷含量的多少比较敏感,这与孙颖盈等[26]在AM 真菌−丹参共生体中的研究结果一致,可能是因为高水平的磷抑制了AM 真菌菌丝的形成和ERM 的延长,从而降低了对外源氮的吸收能力[ 3 2 ]。当供应的氮素为NO3−时,菌根共生会强烈诱导硝酸盐转运基因OsNPF4.5、ZmNPF4.5、SbNPF4.5 的表达,促进菌根对硝态氮的获取[33]。本研究发现磷水平在700 μmol/L 条件下,KNO3 处理下菌根组织15N 丰度显著高于(NH4)2SO4 处理,这可能是当磷浓度过高时,大部分NO3−则沿着禾本科植物特殊的AM 真菌氮吸收途径传递给寄主植物,进一步减弱AM 真菌借助氮载体Arg 的氮转运效应[34],其有待进一步验证。
氮代谢是植物中最重要和最基本的代谢活动之一。硝酸还原酶(NR) 和谷氨酰胺合成酶(GS) 对植物氮代谢发挥重要调节作用。GS 是氮代谢的中心酶,参与各种氮代谢的调节,可同化氮和参与谷氨酰胺的生物合成[35]。任开明等[36]研究指出,施加尿素可以使小麦GS、NR 活性分别提高7.65%~46.46%、0.48%~28.26%。本研究发现相较于纯水对照,不同磷水平下,施加KNO3、(NH4)2SO4、尿素均显著提高菌根化小麦NR、GS 活性,且在 P 0、35 μmol/L处理下,硝态氮对GS 活性的增幅显著高于铵态氮,而磷水平为700 μmol/L 下,两个氮形态处理之间无显著差异(图4),因而不同磷水平下施加KNO3、(NH4)2SO4、尿素均显著提高了菌根化小麦地上部、地下部的氮、磷含量(图5),证明AM 真菌吸收的氮素通过调控根系氮代谢关键酶基因和氮转运基因的表达,增强根系的活性,从而提高对氮的吸收同化效率。
4 结论
AM 真菌根外菌丝可吸收不同形态的氮源,合成Arg 后转移到根内菌丝,以供菌根化小麦生长所需。AM 真菌对硝态氮和铵态氮的吸收利用效率高于有机氮。磷供应水平影响着根外菌丝对不同形态氮的吸收利用,低磷条件下促进了AM 真菌对铵态氮的吸收,高磷抑制对铵态氮的吸收,但有利于硝态氮的吸收。不同磷水平下,AM 真菌对氮素吸收和转运增强了小麦中氮代谢关键酶活性,增加了小麦中的氮、磷含量。

