低磷胁迫下不同耐受型谷子的代谢组学差异






摘要: 【目的】谷子具有较强的耐瘠薄特性,探索谷子响应低磷胁迫的根系形态与生理代谢变化,对于了解谷子耐低磷机制具有重要意义。【方法】以耐低磷型种质B254 和低磷敏感型种质B171 为试材进行水培试验,设置正常和低磷Hoagland 营养液两个处理,KH2PO4 浓度分别为0.25、0.0025 mmol/L。幼苗在营养液中处理7、14 天时,取样分析农艺性状、根系形态、磷含量、生理酸性磷酸酶(ACP) 活性,利用LC-MS/MS 技术分析叶片和根系的代谢物,以VIPgt;1、|log2(FC)|≥1 和Plt;0.05 为条件筛选差异代谢物,并利用KEGG 代谢通路数据库分析差异代谢物主要存在的代谢途径。【结果】在低磷条件下,谷子株高显著降低了32.8%,根系磷含量降低可达75.84%,但耐受型B254 总根长、根表面积分别显著增加了33.7%、59.5%,表现出较强的耐低磷特性。同时,叶绿素、花青素和酸性磷酸酶(ACP) 活性在低磷条件下也显著增加,其中B254 的叶片与根系ACP 活性分别显著增加了91.83% 与22.91%。相关性分析结果表明,在低磷条件下株高、根系发育与生理适应性状之间的相关性显著增强。代谢组学差异分析结果显示,低磷胁迫下不同低磷耐受型谷子代谢产物类型存在较大差异,其中B171 在叶片和根系中积累了大量的黄酮、萜类和脂质,而B254 的差异代谢物主要为氨基酸和脂质,尤其是特殊酯类磷脂合成前体溶血磷脂酸积累。KEGG 代谢通路分析发现,低磷胁迫显著富集了谷子叶片的嘌呤代谢和根系苯丙氨酸代谢。【结论】低磷胁迫诱导谷子耐低磷种质提高了酸性磷酸酶活性,提升了花青素含量,并促进了黄酮、氨基酸、脂类等代谢物的合成,尤其是对类磷脂合成前体如溶血磷脂酸的累积起到极为关键的作用,产生的差异代谢物主要出现在嘌呤代谢和苯丙氨酸代谢途径。
关键词: 谷子;低磷胁迫;根系形态;生理响应;差异代谢物
磷(P) 作为植物生命活动中不可或缺的关键营养元素之一,影响着植物体内的生物分子结构(如磷脂、ATP 及核酸) 与细胞功能调控(如蛋白质合成与调节)[1−2]。尽管土壤中磷元素储量丰沛,但多以不溶性形态存在,易与Fe、Al、Ca 等离子结合,形成难以被植物直接吸收的化合物,导致土壤中有效磷(Pi) 含量有限,从而难以满足植物生长发育的旺盛需求[3]。为应对这一环境压力,植物在漫长的进化历程中演化出一套精密的信号传导网络,能够敏锐感知内外磷水平波动,并触发一系列适应性反应,包括根系构型的重塑、养分利用效率的提升及代谢物谱的调整,以增强对低磷环境的耐受性[4]。植物体内的磷素增加在一定程度上会缓解干旱、盐、高温等非生物胁迫对植物的伤害,提高植物对非生物胁迫的抗性[5]。谷子(Setaria italica),被誉为“五谷之尊”,源自中国北方的野生狗尾草驯化,是一种兼具强抗旱性与耐瘠薄特性的C4 作物,展现出较强的生态适应性[6]。尤其是我国北方广泛存在的土壤盐碱化问题,严重抑制着植物营养的吸收均衡性,显著地降低了土壤磷素的有效性,严重影响作物产量[7]。磷素缺乏会导致谷子叶色发红(紫)、根系发育不良、生长速度减缓等症状形成,同时增加秕谷比例,并进一步降低谷子的抗病能力和品质[ 8 − 9 ]。这启示我们深入探究低磷胁迫对谷子根系形态与生理代谢的影响,对于揭示其耐瘠薄特性的内在机制至关重要。
植物界中广泛存在着针对低磷胁迫的适应性策略,从植株形态、生理及分子层面均有体现,旨在确保植物在磷匮乏条件下能正常生长和发育[10]。例如,拟南芥(Arabidopsis thaliana) 通过增加根毛数量、侧根密度,减少主根长度,从而提高根系对土壤磷的捕获能力[11−12]。植物体内糖代谢与脂类代谢也会发生适应性调整,如甘蓝型油菜(Brassica napus)在低磷时增强根毛发育与质子、酸性磷酸酶(ACP)及羧酸盐的分泌,以促进磷的吸收与利用[13−14]。根系分泌物作为植物与环境交流的关键媒介,其成分变化可直接反映植物对逆境的响应机制[15],例如在磷饥饿条件下,拟南芥通过分泌紫色酸性磷酸酶(PAP)开辟了将无机磷转化为有机磷的有效途径[16−17]。相比之下,玉米(Zea mays)、小麦(Triticum aestivum) 等作物根系的羧酸盐分泌则对磷供应变化不敏感[18−19],但耐低磷玉米根系中脂质代谢物的积累加速了Pi 信号传递,增强了其环境适应性[20]。通过增加有机酸的积累与分泌,植物能够有效释放土壤中的可溶性磷酸盐,这一策略在苜蓿(Medicago sativa)、菜豆(Phaseolus vulgaris)、水稻(Oryza sativa)、玉米等多种作物中均有报道[21−22]。例如,油菜在低磷时显著增加根系分泌的丁二酸、苹果酸及柠檬酸含量,而木豆则分泌大量番石榴酸以应对磷饥饿[23]。同一物种中不同品种的耐低磷特性也存在较大差异,如不同小麦品种间磷素利用效率相差10 倍以上,低磷敏感品种和耐低磷品种生物量、根长和根体积均存在显著差异[24]。低磷条件下,不同基因型谷子的产量相关性状和根系构型表现也存在显著差异[25],不同品种的根长增长范围从11.43% 到28.57%,生物量降低幅度由6.29% 到高达18.55%[26]。因此,分析不同品种的耐低磷特性,筛选低磷耐受型和高磷应答型种质,可为耐低磷作物的育种和分子机制的研究,改良作物磷利用效率奠定研究基础。
代谢组学作为解析植物非生物胁迫耐受性的强大工具,正逐步揭示出植物体内代谢物变化与逆境响应之间的复杂联系。通过利用液相/气相色谱质谱联用(LC/GC-MS),研究人员已在大麦等作物中发现了低磷条件下代谢物谱的显著变化,涉及三羧酸循环及胺代谢等多个关键途径[27]。近年来,针对谷子磷素养分高效利用机制的研究虽已取得一定进展,如谷子豫谷1 号(Yugu1) 在低磷胁迫下表现出冠根长度、侧根数量和冠根密度(侧根数量与冠根长度之比) 显著增加[28],但不同谷子种质在低磷条件下根系形态构型、生物量变化均存在显著差异。相对于低磷敏感型种质,耐低磷种质根毛数量有显著提高,且生长受限和生物量减少的幅度相对较低[25]。在耐低磷分子机制方面,低磷胁迫促使谷子改变磷信号调控因子或磷酸盐转运蛋白等的表达,可提高植物对低磷胁迫的耐受性[29],例如低磷会显著诱导根系中磷酸盐转运体基因SiPHT1.1、SiPHT1.2 和SiPHT1.4表达上调[28]。此外,谷子磷酸盐饥饿响应基因SiPHR1可通过增加主根长度、侧根和根毛数量来增强植株的耐低磷特性[30]。在农业生产上,深入挖掘和开发谷子磷高效吸收与利用的关键代谢物及其调控基因,对实现作物养分利用率、抗逆性和产量同时提高的目标具有重要的基础意义。因此,本研究基于前期筛选出的耐低磷与磷敏感谷子种质,通过对比分析其在低磷与正常磷条件下的根系形态、ACP 活性,并利用UPLC-MS/MS 技术鉴定低磷条件下的叶片和根系的差异代谢物,旨在揭示谷子耐低磷代谢信号途径的关键要素,为谷子磷高效代谢机理的深入阐释提供理论基础。
1 材料与方法
1.1 试验设计
本研究以前期筛选的谷子低磷敏感型种质B171(河北广宗县) 和低磷耐受型种质B254 糯粟(江西省上饶市) 为试验材料,首先使用15% 双氧水对籽粒表面消毒30 min,再用蒸馏水重复冲洗5 次后,在带有滤纸的培养皿内黑暗萌发48 h。然后将培养皿转移到14 h 光照/10 h 黑暗、光强30000 Lux,温度22℃~28℃,相对湿度45% 的气候室中培养。第7 天时,从两种材料中分别挑选出长势均匀的幼苗移栽至水培盒(31 cm×29 cm×18 cm) 中,加入霍格兰营养液进行培养。继续培养7 天后进行低磷条件处理,低磷浓度设置为(KH2PO4) 0.0025 mmol/L,同时设置正常磷浓度(0.25 mmol/L) 为对照,每3 天更换1 次营养液。每个处理重复6 次。
1.2 植物表型和生理指标测定
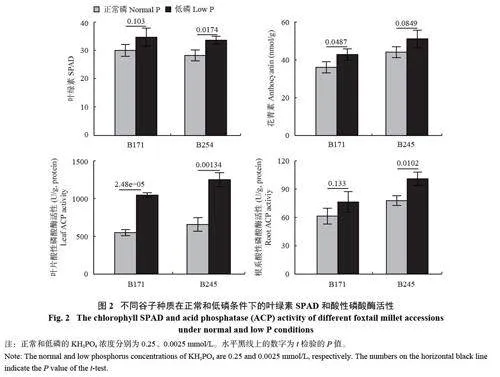
在培养7 和14 天后,取幼苗样测定植株形态、生理表型、磷含量,每组设置3 次生物学重复。其中使用钢尺测定株高和根长,使用千分之一天平称量鲜重后,分别将根、叶片样品装入牛皮纸袋中,放入烘箱105℃ 2 h 后,60℃ 48 h 烘干至恒重,最后称其干重。将烘干的根系和叶片组织进行研磨,通过H2SO4−H2O2 法消解后,采用钼蓝比色法测定磷含量。使用根系扫描仪(Epson Perfection V850 Pro) 测量总根长( T R L )、根表面积( R S A ) 和根分支数(RBN);便携式叶绿素仪(SPAD-502 ChlorophyllMeter Model) 测定倒二叶的叶绿素相对含量(SPAD);采用南京建成生物工程研究所酸性磷酸酶(ACP) 试剂盒测定低磷胁迫14 天后的叶片ACP 活性,ACP活性以1 g 组织蛋白在37℃ 与基质作用30 min 产生1 mg 酚为1 个活力单位,即U/(g·protein);采用盐酸−甲醇法测定花青素含量,使用1% 盐酸−甲醇浸提样品12 h,用酶标仪测定535 nm 处的吸光值。
花青素含量(nmol/g) = (A535/0.0462)×(V/m)
式中:A535 表示样品在535 nm 处的吸光值,V 为溶液总体积(mL),m 为样品质量(g)。
1.3 样品代谢组测定
分别取上述根和叶样品0.1 g,置于冻干机中真空冷冻干燥后,采用研磨仪(MM400) 研磨至粉末状,之后将样品放入2 mL 离心管中并加入1.0 mL 70%甲醇,然后采用多次涡旋混合(每次10 s,共3 次,间隔10 min) 方式进行提取。提取液在4℃ 冰箱中静置过夜后,以12000 r/min 的转速离心10 min,取上清液并通过0.22 μm 微孔滤膜过滤,保存于进样瓶中,以备代谢物的定性定量分析。检测仪器为QExactiveTM plus 组合型四级杆OrbitrapTM 质谱仪(Thermo Fisher)。采用Full Mass 和dd Mass2 分别对一、二级质谱进行扫描,其中二级质谱检测时的碎裂能量(cataclastic energy, CE) 分别设置20、40 和60 V,扫描窗口±1.6 m/z。最后,使用MassLynx V4.2 采集的原始数据通过Progenesis QI 软件做峰提取、峰对齐等数据处理操作,并基于Progenesis QI 软件在线METLIN 数据库、公共数据库识别代谢物。最后将原始数据上传至MetaboAnalyst 5.0 (http://www.metaboanalyst.ca) 在线软件,根据所有代谢物峰面积的中位数对其进行归一化处理。
1.4 差异代谢物筛选及调控基因表达分析
在代谢物分析中,综合运用单元和多元统计分析方法,以及正交偏最小二乘法判别分析VIP 值,通过设置VIPgt;1、差异倍数对数值|log2(FC)|≥1 且T 检验Plt;0.05 为条件筛选差异代谢物,并使用本地数据库进行差异代谢物质谱定性分析。最后利用KEGG PATHWAY 数据库(https://www.kegg.jp/kegg/pathway.html/) 进行差异代谢物的通路富集分析,以超几何检验的Plt;0.05 定其代谢物富集的显著性。利用前期在低磷条件下,低磷敏感型谷子根系低磷胁迫处理0.5、2、12 h 获得的转录组数据,鉴定并分析富集到重要代谢通路表达的基因[30],获得响应低磷胁迫过程的具体基因的作用机制。
1.5 统计分析
在R 软件环境中使用rstatix 和ggplot 2 软件包进行统计分析和数据可视化,并使用t 检验比较不同磷水平下生长表型和生理表型的统计差异,图形数据以平均值±标准误差表示。
2 结果与分析
2.1 低磷胁迫对谷子苗期生长表型和磷含量的影响
从图1 可以看出,相比正常磷条件下,低磷条件下谷子种质B171 (低磷敏感型) 和B254 (低磷耐受型) 的幼苗株高分别降低了49.3% 和16.3% (Plt;0.01),平均降低了32.8%,地上部干重分别降低了68.3% 和54.8% (Plt;0.01),根系总分支数分别增加了10.5%、31.3%,B171 根系表面积降低了46.3%(Plt;0.001),而B254 根系表面积和总根长分别显著增加了59.5% 和33.7% (Plt;0.01),B171 总根长变化不显著。在低磷条件下耐低磷种质B254 的根冠比增加了10.7%,而低磷敏感种质B171 根冠比反而降低了9.9%。同一磷条件下,B254 根系和叶片的磷含量明显高于B171。而在低磷条件下,B254 根系和叶片磷含量分别显著下降了36.06% 和43.86%,相比之下,B171 的根系磷含量下降幅度更为显著(Plt;0.01),叶片和根系分别达到18.89% 和75.84%。由此可见,低磷条件显著抑制了谷子幼苗的生长,而低磷耐受型B254 通过调整总根长、根表面积和根分支数等,减少根系和叶片中磷含量降低幅度,从而减少了低磷对幼苗生长的影响,表现出更强的低磷适应性。
2.2 低磷胁迫对谷子生理性状的影响及相关性分析
相比正常磷处理,在低磷条件下谷子叶绿素和花青素含量均增加。其中,低磷耐受型种质B254叶片的叶绿素和花青素含量分别增加了17.2% 和17.4%,但低磷敏感种质B171 叶绿素含量增加不显著。此外,B254 叶片与根系中ACP 活性分别增加了91.83%、22.91%,而B171 根系的ACP 活性增加不显著(图2)。由此表明,低磷条件促进了叶片中叶绿素和花青素的积累,并显著提高了叶片ACP 的活性,但ACP 活性提升在低磷敏感种质根系中表现不显著。
在低磷和正常磷条件下,不同种质的谷子幼苗农艺性状和生理性状之间相关性存在较大差异(图3)。正常磷条件下,株高与地上部干重、根表面积、根分支数均存在显著正相关,相关系数(r) 分别为0.86、1.00 和0.97;而株高与根分支数均存在显著负相关,相关系数r 为−0.82。在低磷条件下,株高、根系发育与生理适应性状之间存在显著正相关,且相关系数更高,其中株高与地上部干重、根干重和总根长存在显著相关,相关系数r 分别为0.84、0.91和0.85。花青素和根系ACP 活性与株高、根干重等农艺性状的相关性均达到显著性水平,如根系ACP活性与株高、根干重、根表面积、根分支数相关系数分别为0.90、0.88、0.96 和0.90。由此可见,谷子在不同磷水平下,其农艺性状与生理性状之间的相关性表现出显著差异,低磷条件根表面积、总根长、根分支数的显著增加,并伴随有花青素和ACP活性的提升,从而更好地适应磷胁迫。
2.3 谷子苗期对磷饥饿代谢响应的差异代谢物分析及归类
经过低磷和正常磷条件处理7 和14 天,幼苗叶片和根样品中共获得447 个代谢产物谱。经|log2FC|≥1和Plt;0.05 两个条件筛选,低磷胁迫7 天后,敏感种质B171 叶片中鉴定出96 个差异代谢物,其中44 个呈现上调趋势(图4A),主要包括氨基酸及其衍生物、萜类和脂质(图4B),胁迫14 天后,叶片中差异代谢物数量增至111 个,其中84 个上调。耐低磷种质B254 叶片在低磷胁迫7 和14 天下分别鉴定到54个和31 个差异代谢物(图4A)。在谷子幼苗根系中,低磷胁迫7 天后在敏感种质B171 中鉴定到43 个差异代谢物,其中13 个呈现上调,主要为氨基酸及其衍生物和黄酮类;在14 天后,鉴定到的差异代谢物数量大幅增加至89 个,其中60 个呈现上调,涵盖了更广泛的代谢物类别,如氨基酸、黄酮类、萜类以及植物激素等(图4B)。在耐受型种质B254根中,胁迫7 天后,鉴定到28 个差异代谢物,其中17 个上调,主要涉及黄酮类;胁迫14 天后,差异代谢物数量增至81 个,上调代谢物以黄酮类和氨基酸及其衍生物为主。由此可见,低磷胁迫引起低磷敏感种质B171 代谢物的变化明显多于耐低磷种质B254,差异代谢物叶片中主要包括氨基酸及其衍生物、萜类和脂质,根系中主要为黄酮类和氨基酸等。
2.4 不同磷耐受型谷子共有的响应低磷胁迫差异代谢物及其KEGG 富集分析
在低磷胁迫7、14 天后,28 个差异代谢物在低磷敏感种质B171 叶片均被鉴定到,其中有11 个黄酮类和4 个脂质(图5A),而在耐低磷种质B254 叶片中鉴定11 个,其中有2 个氨基酸及其衍生物和4 个脂质。D-天冬酰胺、α-亚油酸乙醇酰胺和溶血卵磷脂LPC (18:3) 在2 个耐受型种质叶片中均被鉴定到,血磷脂酸 (LPA 18:1 和LPC 18:3) 以及1 种溶血磷脂胆碱均显著提高了1.6 倍。在B171根系中共有差异代谢物13 个,包括3 个黄酮类、2 个萜类、2 个吲哚衍生物以及芳香族(图5B),在B254 根系共有差异代谢物7 个,包括3 个黄酮类、2 个脂质和1 个萜类。其中茉莉酸在种质B254 叶片和根系中分别显著增加1.2 和1.8 倍。小白菊内酯是唯一在两个品种根系中均被鉴定到的差异代谢物。
将所有叶片和根系差异代谢产物在KEGG Pathway数据库中进行代谢途径比对,在氨基酸代谢、核苷酸代谢、脂质代谢、能量代谢和碳水化合物代谢等途径中发现了差异代谢物(图5C、5D)。B171 和B254 叶片中共有的代谢途径有5 条,分别参与丙氨酸、天冬氨酸和谷氨酸代谢、氨酰基tRNA 生物合成、核酸代谢、甘氨酸、丝氨酸和苏氨酸代谢、嘌呤代谢,尤其参与氨酰基tRNA 生物合成和嘌呤代谢途径。此外,B254 叶片还特有半胱氨酸和蛋氨酸代谢、乙醛酸和二羧酸代谢及鞘脂代谢3 个代谢途径。B171 和B254 根系中共有的代谢途径有9 条,主要参与氨基酸代谢(精氨酸、丝氨酸和苏氨酸等)、氨酰基tRNA 生物合成、嘌呤代谢和苯丙氨酸代谢途径,且B254 根系还特有α-亚麻酸代谢、不饱和脂肪酸生物合成及黄醇代谢3 个途径。值得注意的是,在低磷胁迫7 和14 天后B171 和B254 的叶片差异代谢物均参与嘌呤代谢途径,而根系中主要参与苯丙氨酸代谢途径。由此可见,磷耐受型谷子品种B254 和磷敏感品种B171 在磷胁迫下的代谢响应差异显著,这些差异不仅体现在代谢物的数量和种类上,还体现在其参与的代谢途径上,这为理解和改良谷子的磷胁迫耐受性提供了重要线索。
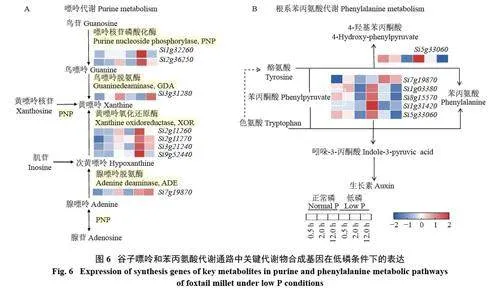
2.5 低磷诱导谷子嘌呤和苯丙氨酸代谢通路的基因表达分析
为了进一步探索低磷诱导差异代谢物参与嘌呤和苯丙氨酸代谢途径的调控基因,本研究结合低磷敏感型材料和低磷敏感型谷子的转录组数据,系统分析了此代谢通路中代谢物及关键基因的表达变化。图6 表明,相比正常磷条件下,Si1g32260 和Si2g36250 调控嘌呤核苷磷酸化酶(PNP) 合成在低磷胁迫2 h 表达量达到最高。腺嘌呤和鸟嘌呤在脱氨酶(ADE、GDA) 作用下转化为黄嘌呤和次黄嘌呤,此过程调控脱氨酶基因中Si3g31280、Si7g19870 在低磷胁迫的12 h 表达量达到最高;黄嘌呤氧化酶进一步氧化次黄嘌呤形成黄嘌呤,Si2g11260、Si2g11270、Si3g21240、Si9g52440 具有相同的功能,均属于黄嘌呤氧化还原酶(XOR),在低磷胁迫的2 h 开始高表达,积极参与低磷响应。在谷子根系低磷胁迫后,共有6 个谷子基因参与苯丙酮酸到苯丙氨酸的转变。其中基因Si1g03380、Si8g15570、Si1g31420、Si5g33060 表达在低磷胁迫30 min 后显著上调,Si7g19870 表达在低磷胁迫2 和12 h 后均显著上调,生长素作为苯丙氨酸的下游合成物质,苯丙氨酸的积累可能是通过促进根系生长素的合成来帮助植物生长,从而抵御低磷胁迫。
3 讨论
磷作为植物生长发育不可或缺的营养元素,在土壤中其有效性常受限于磷的固化作用,导致植物可吸收的有效磷含量有限,进而严重影响植物的生长与发育。为了应对磷饥饿,植物进化出了一系列发育、生理和生化反应机制,包括重塑根系的形态构型促进根系吸收更多的有效磷及体内有机磷的高效利用[31]。其中,根系形态的重塑尤为关键,它不仅优化了植物对土壤水分及矿质养分的获取能力,更在磷素匮乏时展现出显著的优势。在缺磷条件下,许多物种根系所占的总干物质比例更大[32]。前期研究已比较了16 种作物的根系形态对磷获取的策略,发现不同物种之间根系功能性状存在显著的种间差异。在玉米中,低磷条件下根长显著增加,根平均直径显著降低,两种玉米的总根长、根表面积、比根长和根平均直径无显著差异[33]。而在本研究中低磷胁迫能显著抑制谷子幼苗的生长,但是两种不同耐受型品种的根系形态变化存在差异。耐低磷种质B254 在低磷胁迫下可通过显著增加总根长、根表面积及分支数,进而提升根冠比达10.7%,显著优于磷敏感品种B171 的负向变化(根冠比降低9.9%),从而减弱低磷胁迫对其生长的影响。植物可以通过增加根毛和侧根的数量和长度,增加根冠比,产生分枝来扩大与土壤磷的接触面积,从而增加植物对磷的吸收[34−35]。由此表明,在磷贫瘠土壤中,谷子耐低磷种质在资源分配上的策略性调整,即将更多养分用于根系形态重塑,从而表现出更强的低磷适应性。
酸性磷酸酶(ACP) 作为植物体内关键的水解酶,在低磷条件下其活性显著增强,通过催化有机磷化合物水解,为植物提供额外的磷源,从而增强了植物对低磷环境的适应能力。缺磷诱导玉米叶片、根组织和根系分泌ACP 活性升高[36]。水稻OsACP1 可从内质网和高尔基体中的非必需磷酸酯中回收无机磷酸盐Pi,以维持水稻Pi 稳态,细胞内磷酸酯类释放的Pi 会缓解Pi 胁迫反应[37]。本研究中,两种不同基因型谷子的ACP 活性在低磷条件下均显著增加,特别在耐低磷品种B254 叶片中增幅高达91.83%,进一步印证了ACP 在磷高效利用中的重要性。此外,低磷条件下和正常磷条件下生长表型与生理表型之间相关性存在较大差异。例如,在正常磷条件下,株高与花青素含量及叶片和根系ACP 活性存在负相关,相关系数r 分别为0.73、0.54 和0.68,而在低磷条件下,株高、根系发育与生理适应性状之间存在明显正相关,且相关系数均较高,其中株高与根干重、根分支数、根系ACP 活性的相关系数分别为0.91、0.85 和0.90。由此表明,在低磷条件下,谷子农艺性状与生理性状间的联系更加紧密,特别是低磷条件不仅促进了根系重塑形态构型,而且伴随有花青素和ACP 活性的提升,反映了谷子在低磷条件下通过精细调控生长策略和生理机能,展现出一种高效、灵活的主动适应机制。这一发现对于深入理解植物逆境生理、优化农业管理措施以及培育耐低磷作物品种具有重要的理论和实践价值。
在植物应对低磷胁迫的过程中,代谢适应是至关重要的策略之一。这种适应不仅涉及初级代谢途径的调整,还深刻影响着次级代谢产物的生成。在低磷条件下,玉米根系的核酸、有机酸和糖的浓度显著增加,但磷酸化代谢物、特异氨基酸、脂质代谢物和含氮化合物的浓度降低[38]。低磷条件下,丛枝菌根植物通过调控碳水化合物和脂质平衡增加库强[39]。本研究聚焦不同耐低磷能力种质间的代谢物差异,结果发现发现磷敏感与耐低磷种质在代谢物种类上存在显著差异。其中低磷敏感种质的差异代谢物主要包括黄酮、酯类,而耐低磷种质中差异代谢物主要是氨基酸、酯类。在耐低磷种质B254 中,2 种溶血磷脂酸(LPA 18:1 和LPC 18:3) 以及1 种溶血磷脂胆碱显著提高了1.6 倍。溶血磷脂酸是一种最小、结构最简单的植物磷脂,是真核细胞磷脂生物合成早期阶段的关键前体,可结合生长素输出载体蛋白PIN1,共同调控生长素转运和植株生长的分子机制[40]。此外,我们还发现茉莉酸在种质B254 叶片和根系中分别显著增加1.2 和1.8 倍。进一步通过KEGG 富集分析发现,低磷诱导的B171 和 B254 差异代谢物主要参与嘌呤和苯丙氨酸途径。其中,嘌呤作为多种生物分子的前体,不仅参与核酸、蔗糖、多糖及磷脂的合成,还在植物抗逆性中扮演重要角色。例如大豆分泌的嘌呤类物质招募有益微生物假单胞菌,从而增强盐胁迫下植物的生长能力[41]。在低磷条件下,独脚金内酯(SLs) 作为植物反应的调节器,也可促进与植物磷限制反应相关的代谢物水平,包括与羧酸、脂肪酸和嘌呤代谢有关的信号。另一方面,苯丙氨酸是木质素、花青素、黄酮类化合物的重要前体物质,可以通过调节植物体内的抗氧化酶活性和多酚物质含量,从而提高植物的抗逆性[42]。在耐瘠薄野生大豆根系的研究中也证实了苯丙氨酸在逆境适应中的积极作用,其在低磷条件下根系中显著增加了1.76 倍[43]。此外,通过外源苯丙氨酸能促进植物激素的生物合成,抑制潜在有害细菌类群,从而促进了氮循环和植物生长[44]。这与本研究结果类似,在根系代谢通路中,耐低磷种质B254 根系中主要参与了苯丙氨酸代谢途径,可能通过促进黄酮类化合物的转化来增强抗氧化能力和抗逆性,从而帮助植物更好地应对低磷环境。然而,关于谷子关键代谢物嘌呤和苯丙氨酸在耐低磷机制中的具体作用机制和相互作用关系仍需进一步研究。
4 结论
低磷胁迫诱导耐低磷谷子品种产生的差异代谢物主要出现在嘌呤代谢和苯丙氨酸代谢途径,耐低磷品种磷胁迫下提高酸性磷酸酶活性,提升花青素含量,促进了黄酮、氨基酸和脂类等代谢物的合成,尤其是对类磷脂合成前体如溶血磷脂酸的累积起到了极为关键的作用。

