白林2号杨组织培养幼化技术的研究


摘要:本研究以白林2号杨断根处新萌发的嫩枝作为外植体,通过探究不同激素浓度配比对其各培养阶段的影响,筛选出适合白林2号杨生长的培养基,总结出一套白林2号杨的组培幼化技术,为其母株保幼提供技术支持。试验结果表明,白林2号杨嫩枝茎段最适合萌芽的培养基为MS+6-BA 0.08 mg L-1+NAA 0.30 mg L-1+蔗糖30 g L-1+琼脂6 g L-1,萌发率最高可达90.56%;最适合增殖的培养基为MS+6-BA 0.08 mg L-1+NAA 0.30 mg L-1+IBA 0.30 mg L-1+蔗糖30 g L-1+琼脂6 g L-1,增殖倍数可达14.45;最适合生根的培养基为MS+NAA 0.30 mg L-1+IBA 0.30 mg L-1+蔗糖20 g L-1+琼脂6 g L-1,生根率达94.5%。
关键词:白林2号杨;组织培养;幼化;茎段
Study on tissue culture rejuvenation technology of Populus ‘Bailin-2’
Cai Qun1,Wei Linyan2,Gu Meiying2,Wang Guozhu2,Su Lin2,Fu Zhixiang2
(1.Jilin Provincial Forest Seedling Management Station,Changchun 130000,China;Baicheng Academy of Forestry,Baicheng 137000,China)
Abstract:In this study,the stem segments of shoots germinating from the broken roots of Populus ‘Bailin-2’were used as explants,by exploring the effects of different hormone concentrations on each culture stage,the medium suitable for growth of" Populus ‘Bailin-2’ was screened, and a set of tissue culture and juvenile technology of" Populus ‘Bailin-2’ was summarized to provide technical support for the preservation of its mother plant.The results showed that the most suitable medium for germination was MS+6-BA 0.08 mg L-1+NAA 0.30 mg L-1+ sucrose 30 g L-1+ agar 6 g L-1, and the highest germination rate was up to 90.56%;The most suitable medium for proliferation was MS+6-BA 0.08 mg L-1+NAA 0.30 mg L-1+IBA 0.30 mg L-1+ sucrose 30 g L-1+ agar 6 g L-1, and the proliferation multiple was 14.45;The most suitable medium for rooting was MS+NAA 0.30 mg L-1+IBA 0.30 mg L-1+ sucrose 20 g L-1+ agar 6 g L-1, and the rooting rate was 94.5%.
Key words:Populus ‘Bailin-2’;Tissue culture;rejuvenation;stem segment
白林2号杨是白城市林业科学研究所以新疆阿勒泰的欧洲黑杨为母本、龙井镇的钻天杨为父本(P.nigra×P.pyramidalis)进行人工杂交选育而成,具有耐寒、耐干早、抗烂皮病、速生和适应性强等特点[1]。杨树在成熟后许多幼年时期的优良性状会逐渐消失(即成熟效应)会影响其繁育苗木质量,通过幼化技术可以保障杨树较强的生长能力[2],而组织培养是对杨树幼化的有效途径[3],也是目前最常用的复幼方法。为了保护白林2号杨采穗圃母株幼龄状态,提高其繁育速度及繁育苗木质量,可以通过建立白林2号杨高效稳定的组织培养体系来解决此问题,也可称之为白林2号杨组培幼化技术。因此,总结出白林2号杨组培幼化技术具有重要意义。
1.试验材料
试验材料取自于吉林省白城市林业科学研究院生态试验林场,选取生长良好,无病虫害的白林2号杨断根处新萌发的嫩枝(根萌苗)作为试验材料。
2.试验方法
2.1外植体消毒
用清水冲洗掉嫩枝表面污物,放到洗衣粉水中浸泡30 s,再用流动的自来水冲洗30 min左右。然后移至超净台内用75%的酒精浸泡45 s,用无菌水冲洗3-5次,以外植体上完全没有酒精味道为准。置于无菌滤纸上,吸干水分备用[4]。
2.2培养条件
培养室内的温度控制在22~24 ℃左右,光照强度1500~2000lx,光照时间14 h/d。各阶段培养基均用高压灭菌锅高温高压(121℃,101KPa)灭菌20 min[5]。
2.3不定芽的诱导培养
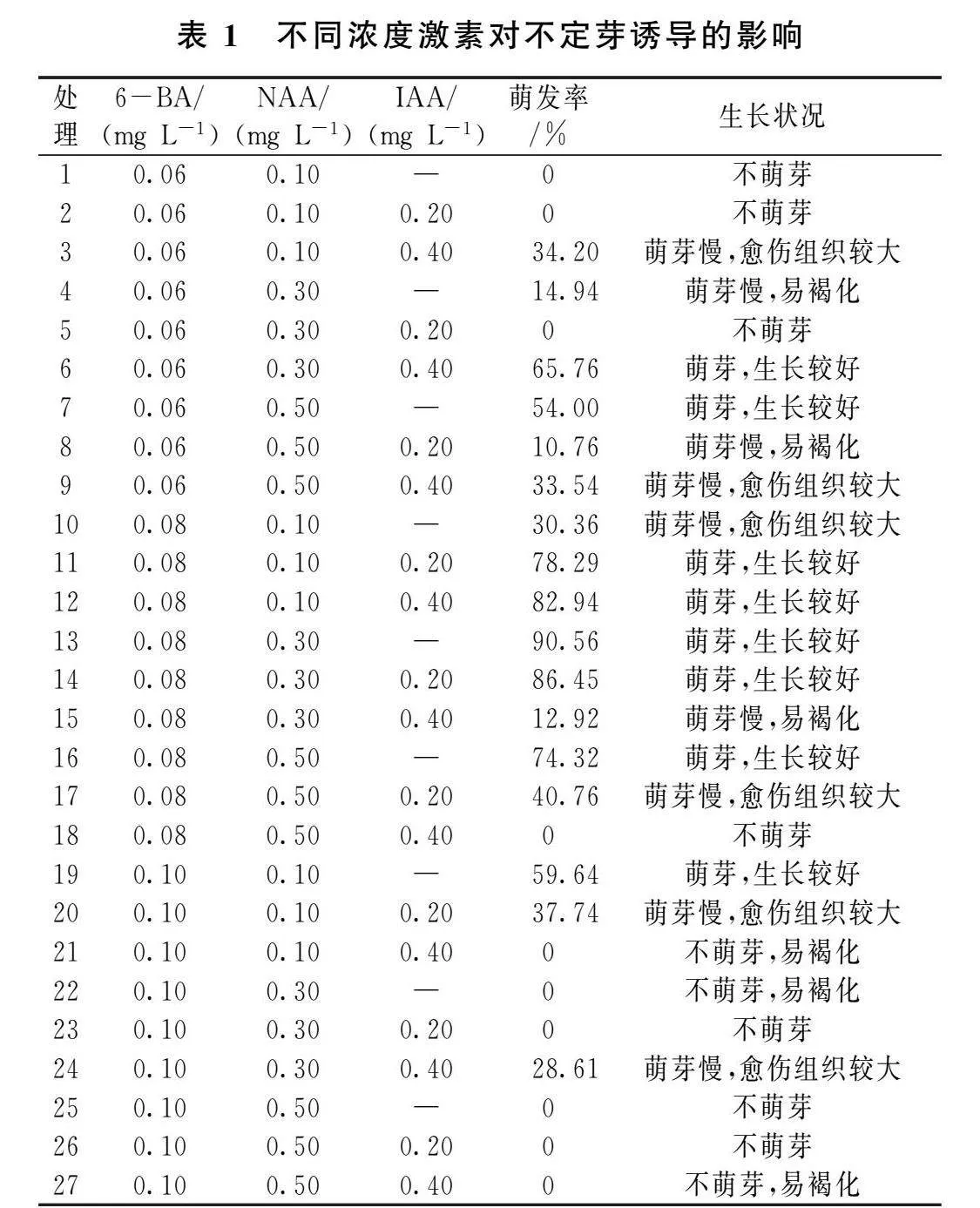
将植株根萌苗的嫩枝剪成1.5~2.0 cm左右的茎尖,保证每个茎段上都带有一个茎节,接种在添加不同浓度(0.06、0.08和0.10 mg L-1)的6-BA、不同浓度(0.10、0.30和0.50 mg L-1)的NAA和不同浓度(0.00、0.20和0.40 mg L-1)的IAA、蔗糖浓度为30 g L-1,琼脂粉浓度为6 g L-1,pH为5.8~6.2的MS培养基上,每个处理接种15瓶,每瓶接种3个外植体。置于培养室内30 d,观察不定芽的萌发情况,筛选出适合不定芽萌发的培养基。
2.4增殖培养
将获得的不定芽,接种于0.08 mg L-1的6-BA、0.30 mg L-1的NAA和不同浓度(0.30、0.20和0.10mg L-1)的ZT、IBA、蔗糖浓度为30 g L-1,琼脂粉浓度为6 g L-1,pH为5.8~6.2的MS培养基中,每个处理接种15瓶,每瓶接种3个。接种后放置于培养室内,培养30 d后统计增殖情况。
2.5生根培养
选取约3.0 cm的不定芽接种于添加不同浓度(0.10、0.30和0.50 mg L-1)的NAA、IBA、蔗糖浓度为20 g L-1,琼脂粉浓度为6 g L-1,pH为5.8~6.2的MS培养基中,每个处理接种15瓶,每瓶接种3株。接种后放置于培养室内,15 d后观察生根情况,统计生根率。
2.6数据处理
采用Excel 2016软件进行数据统计和表格制作。
萌发率=萌发株数/接种株数×100%;
增殖倍数=增殖株数/接种株数;
生根率=生根株数/接种株数×100%。
3.结果与分析
3.1不同激素浓度对不定芽诱导的影响
由表1可以看出,在6-BA浓度为0.08 mg L-1时,大部分不定芽的萌发率相较于其他浓度高,萌发率可达到70%以上,进一步观察发现在6-BA浓度为0.08 mg L-1时,同时添加适宜浓度NAA和IAA后,不定芽的萌发率会显著提升,但是均不高于单独添加浓度为0.30 mg L-1的NAA,说明单独使用NAA就可以达到较高萌发率,达到90.56%。
结合不定芽生长情况来看,在6-BA的浓度为0.08 mg L-1时,大部分处理的不定芽生长状况良好,其他6-BA浓度会出现不萌芽、萌芽较慢、有愈伤以及褐化现象,虽处理6、处理7和处理19的不定芽生长状况良好,但是其萌发率均低于70%;需选择不定芽的生长良好和萌发率高的培养基作为最适培养基。综上,最适合白林2号杨不定芽萌发的培养基为处理13:MS+6-BA 0.08 mg L-1+NAA 0.30 mg L-1+蔗糖30 g L-1+琼脂6 g L-1。
3.2不同浓度激素对增殖培养的影响
根据不定芽诱导培养时不定芽萌发的情况发现,在6-BA浓度为0.08 mg L-1、NAA浓度为0.30 mg L-1时,不定芽的生长情况良好,在增殖阶段对这两种激素的浓度不进行调整,观察其他激素变化对白林2号杨不定芽增殖情况的影响。由表2可以看出,分别添加不同浓度的ZT和IBA均可以对不定芽进行增殖诱导,在添加ZT时,不定芽的增值倍数随着其浓度的降低,发生不规则变化,增殖倍数最高为12.50;而在添加IBA时,不定芽增殖倍数会随着其浓度的增加而增大,最高可达14.45。因此,白林2号杨最适增值的培养基为处理4:MS+6-BA 0.08 mg L-1+NAA 0.30 mg L-1+IBA 0.30 mg L-1+蔗糖30 g L-1+琼脂6 g L-1。
3.3生根培养基筛选
将长至约3.0 cm高的不定芽接种于生根培养基中,由表3可知,在NAA和IBA共同作用时,添加IBA浓度为0.50 mg L-1,白林2号杨均不生根,即此浓度配比不适合其生根。在IBA浓度为0.10 mg L-1时,白林2号杨的生根率会随着NAA浓度的增加而升高,最高可达65.3%,每株生根数在7根左右,根长在2.0~3.0 cm之间;在IBA浓度为0.30 mg L-1时,白林2号杨的生根率随着NAA浓度的增加发生不规则变化,生根率最高可达94.5%,每株生根数在23根左右,根长在1.5~2.0 cm之间,综合生根效果最好。因此,白林2号杨最适生根的培养基为处理5:MS+NAA 0.30 mg L-1+IBA 0.30 mg L-1+蔗糖20 g L-1+琼脂6 g L-1。
3.4炼苗移栽
将生根的组培苗移至温室大棚炼苗,选择1:1的细河沙和草甸土的混合物作为炼苗基质,将带有培养基的组培苗移栽到基质中,使用微喷系统定时浇水以保证育苗盘处于湿润状态。除此之外,需在早9点至下午3点半在大棚外设置遮阴网,避免烧苗。在炼苗10-15 d后就有新芽萌发,且幼苗生长健壮,炼苗45 d后,移至大田栽植。
4.讨论
植物组织培养体系的建立对杨树种质资源的保护、优质种苗的繁育以及恢复杨树采穗圃母株的幼龄状态以维持较强的生长状态,具有重要意义[6]。一般来说建立植株的组织培养体系主要通过调整植物生长调节剂之间的配比来实现,细胞分裂素和生长激素发挥主要作用,其可以分别促进细胞的分裂和细胞的生长[7]。在不定芽诱导阶段,较低浓度的6-BA和相对较高浓度的NAA,对白林2号杨的不定芽诱导较为明显,且不定芽生长状况较好。
有研究表明,虽然细胞分裂素是植物组织培养的增殖激素,但是当浓度过高时也会抑制植物的增殖[8]。因此,在白林2号杨增殖培养过程中,细胞分裂素6-BA与生长素NAA浓度不变时,与生长素IBA组合增殖效果显著高于细胞分裂素ZT,增殖倍数最高达14.45。
在植物生根培养过程中,NAA和IBA是植物诱导不定根常用的植物生长调节剂[9],本试验通过两种激素不同浓度配比发现,最佳生根培养基为MS+NAA 0.30 mg L-1+IBA 0.30 mg L-1+蔗糖20 g L-1+琼脂6 g L-1,生根数多,生根率可达94.5%。
综上所述,白林2号杨初代培养最适培养基为MS+6-BA 0.08 mg L-1+NAA 0.30 mg L-1+蔗糖30 g L-1+琼脂6 g L-1;最适增殖培养基为MS+6-BA 0.08 mg L-1+NAA 0.30 mg L-1+IBA 0.30 mg L-1+蔗糖30 g L-1+琼脂6 g L-1;最适生根培养基为MS+NAA 0.30 mg L-1+IBA 0.30 mg L-1+蔗糖20 g L-1+琼脂6 g L-1。
参考文献:
[1]金志明,金培林,金晓红等.白林二号杨[J].吉林林业科技,2001,(03):10-13.
[2]伍孝贤,熊忠华,朱忠荣.响叶杨群落结构与改良技术研究[J].浙江林学院学报,1998,(02):37-42.
[3]徐佳.杨树高效扩繁技术的初步研究[D].北京林业大学,2009.
[4]任菲宏,李晓松,王姣等.沙子空心李组织培养技术研究[J].安徽农学通报,2023,29(20):78-82.
[5]付雪宁,高洪治,申耀荣等.红桦组织培养体系的建立[J].林业科学研究,2021,34(03):194-200.
[6]谢纯刚,刘哲,章书声等.手指柠檬茎段离体再生体系建立[J].植物学报,2023,58(06):926-934.
[7]刘海涛,刘玲,吕沙妹.小叶栀子再生体系的建立研究[J].河南科技学院学报(自然科学版),2024,52(01):16-24+32.
[8]刘燕,王济红,陈训等.大白杜鹃种子胚组织培养研究[J].贵州农业科学,2010,38(12):30-33.
[9]张佳奇.紫花槭茎段组织培养体系的建立及优化[D].延边大学,2022.

