利用冷冻电子断层扫描技术探究超声对红细胞膜的影响



关键词 红细胞膜;超声;冷冻电子断层扫描
超声波技术已成为现代生物医学的强大工具,为临床诊断和治疗提供了一种非侵入性方法,能够深入组织并与细胞结构相互作用,在成像、靶向药物输送、基因治疗甚至组织工程领域广泛应用[1-3]。超声波对生物组织的影响主要通过机械力介导,例如剪切应力和空化效应[4-6],这些影响取决于超声处理的参数,包括频率、功率和持续时间,因此,了解超声波对细胞膜的具体影响至关重要[7-8]。
人红细胞因其简单的结构与高度专业化的功能,是研究最多的细胞类型之一。红细胞膜由磷脂双分子层及膜蛋白组成,并由细胞骨架蛋白网络支撑,这对于维持细胞的灵活性和结构完整性至关重要[9-12]。超声治疗过程中引起的细胞膜结构破坏会导致细胞膜严重的功能障碍,包括变形能力下降和膜通透性改变等[13-16]。因此,研究超声波对红细胞膜的影响不仅有助于了解治疗性超声波应用中的潜在风险,而且对于探索操纵细胞膜用于治疗目的的新方法非常重要[13]。
除了红细胞外,脂质体也是超声研究中的重要模型体系。脂质体作为一种模仿生物膜结构的纳米载体,被广泛用作药物输送载体,如作为封装治疗剂的人工囊泡[17-18]。在脂质体表面修饰特定蛋白,可以增强靶向能力。超声波作用于脂质体会改变其结构和表面特性,特别是脂质体表面蛋白的分布和功能[19-20],这种作用可被利用以增强脂质体的靶向能力,从而提高药物输送的有效性和特异性[21-23]。
近年来,关于超声技术对细胞和脂质体结构影响的研究取得了一系列进展。已有研究表明,超声处理可以引发细胞膜结构变化和通透性增加等现象[24-26]。然而,超声处理对膜蛋白和磷脂双分子层间的相互作用及细胞膜-骨架的影响机制仍需进一步的探究,这些分子水平的变化对基于超声的肿瘤疗法的探索和诊断工具的开发具有重要影响[27-30]。
对细胞膜及脂质体结构的研究通常使用多种高分辨率成像技术,如荧光显微镜、共聚焦显微镜、原子力显微镜和冷冻电子断层扫描(Cryo-ET)等。近年来, Cryo-ET 技术在生物膜结构研究中展现出独特优势,能够在接近天然状态下观察生物膜的高分辨结构,捕捉超声作用下的细微结构变化。本研究采用Cryo-ET 技术,旨在提供超声波影响细胞膜精细结构的直接证据,为深入理解膜结构在超声作用下的变化提供支持[20,31-32]。考察了不同的超声功率水平和处理持续时间如何影响细胞骨架从红细胞膜上的分离以及细胞膜蛋白在磷脂双分子层上的脱落和重组,通过分析这些变化,有助于增强对超声诱导的膜和细胞骨架结构改变的机制的理解以及优化超声在基础研究和临床实践中的进一步应用。
1 实验部分
1.1 仪器与试剂
Tecnai G2 F20 200 kV 冷冻透射电子显微镜(美国FEI 公司);K2 直接电子探测相机(美国Gatan 公司);Vitrobot Mark Ⅳ 快速投入式冷冻制样仪(美国赛默飞世尔科技公司);SOLARUS-950 等离子体清洗系统(美国Gatan 公司);TGL-21M 高速冷冻离心机(上海卢湘仪离心机仪器有限公司);KQ-2200DE型台式数字超声波清洗机(昆山舒美超声仪器有限公司);R1.2/1.3 300 目多孔碳膜铜网(德国Quantifoil公司)。
NaCl、KCl、KH2PO4 和Na2HPO4·12H2O(分析纯,北京化工厂);多聚L-赖氨酸溶液(质量浓度1 g/L,美国Sigma-Aldrich 公司);5nm 胶体金颗粒(西安瑞禧生物科技有限公司)。
1.2 人红细胞膜的获取
取健康成年志愿者的末梢血10 μL,在磷酸盐缓冲液(137 mmol/L NaCl, 2.7 mmol/L KCl, 1.8 mmol/LKH2PO4, 10 mmol/L Na2HPO4, pH 7.4)中离心(1000 r/min, 2 min)、清洗5次,弃去上清液,在管底收集干净的人红细胞,加入1 mL 低渗磷酸盐缓冲液,诱导人红细胞完全溶血10 min,然后在23000 r/min 下离心10 min,用低渗磷酸盐缓冲液清洗,反复离心、清洗5 次,弃去上清液,收集人红细胞膜,加入1mL 磷酸盐缓冲液,备用。整个实验流程均在4 ℃下进行。
1.3 超声波处理红细胞膜
使用泡沫浮漂将包含膜悬浮液的离心管固定在装满冰水混合物的烧杯中,放置在超声波清洗机内。固定超声频率为40kHz,设置超声功率在40~100 W 之间,处理时间在1~5 min 之间。对照组同样放置在装满冰水混合物的烧杯中,未进行超声处理。
1.4 冷冻样品的制备
通过等离子清洗系统对载网进行亲水化处理,通入H2 和O2 辉光放电10 s,然后将清洗过的载网浸入多聚L-赖氨酸溶液(1 mg/mL)中4 h 后放入去离子水中清洗。将制备好的红细胞膜样品沉降在载网上30 min,然后加入蛋白A 包被的胶体金颗粒(3 μL)以作为后续数据处理的对齐标记。准备好的载网在湿度为100%、温度为8 ℃的冷冻制样仪腔室中吸干表面多余水分,然后投入液态乙烷中形成无定形冰。将制备好的载网储存在液氮中直至使用。
1.5 冷冻透射电子显微镜进行样品检查及数据收集
利用冷冻传输架将冷冻好的低温样品送入电镜中。通过Seria EM 软件在Low dose 功能下检查样品,将样品台通过角度对称的旋转方式以3°的间隔从–60°到+60°的倾斜度获取目标区域的Cryo-ET 倾斜序列,显微镜在200 kV 下运行,目标欠焦值为–4 μm ~ –6 μm。通过K2直接电子探测器收集数据,数据图像像素大小为0.2668 nm(放大倍数为19000×)。整个倾斜序列的总累积电子剂量约为140 e–/Å2。
1.6 电子断层扫描图的三维重构
在冷冻电镜成像过程中,样品会受到辐射和其它环境因素的影响,导致图像出现运动模糊。因此对于收集的倾斜序列,首先通过运动校正软件MotionCorr 2对每个倾斜序列的每个角度的电子投影图进行漂移校正,再通过软件IMOD中的加权反投影算法对倾斜序列进行对齐和三维重建,而后通过同步迭代重建技术进行断层图的重建,迭代次数为5或15次[33-34]。
2 结果与讨论
2.1 不同超声功率对人红细胞膜形态的影响
完整的实验流程如图1。红细胞的完整结构(如双凹形状和细胞内部的内容物)可能在超声作用下产生复杂的响应,从而影响细胞膜单独的响应行为。先提取出细胞膜可以排除红细胞内部结构的干扰,确保观察到的是超声波直接作用于膜结构的效果,使实验结果更聚焦于细胞膜的物理和结构变化。因此,首先通过低渗溶血和离心制备纯净的人红细胞膜,进行超声处理后沉降在电镜载网上,利用Vitrobot冷冻制样仪将样品快速冷冻,然后将样品转移到冷冻透射电子显微镜中进行观察及数据收集。
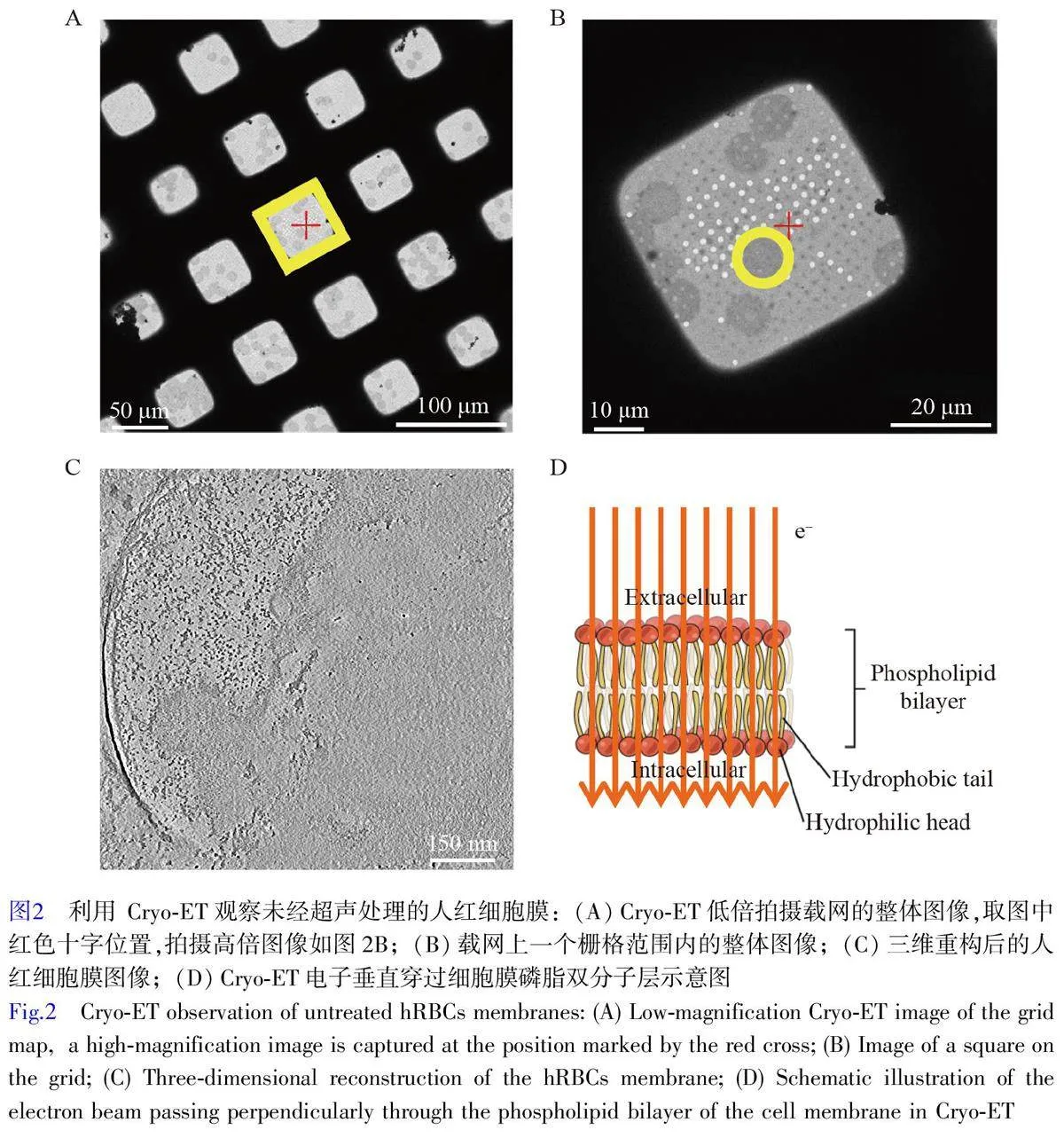
首先观察未经过超声处理的对照组,通过对样品的低倍成像,可见样品冰层厚度适中,透光性良好(图2A)。人红细胞膜边界清晰,结构完整,尺寸约为8~10 μm(图2B)。对细胞膜区域进行高倍数的数据采集,三维重构后的细胞膜光滑且连续,膜蛋白致密(图2C)。这些膜蛋白通常包括各种重要的功能蛋白如离子通道等,在维持细胞功能和结构完整性方面发挥了关键作用。在Cryo-ET 图像中难以清晰地观察到磷脂双分子层,这可能是由于红细胞膜平铺在载网上,电子垂直穿过磷脂双分子层,其吸收程度很低(图2D)。这些结果与预期一致,表明未经超声处理的人红细胞膜保持了其原始结构和功能。
接下来,在40W和60W功率下对红细胞膜进行超声处理,每次处理时间为5 min。通过Cryo-ET 观察发现,经过40W功率超声处理后的红细胞膜形态变化不大,膜结构保持相对完整,膜表面仅出现少量的波状变形(图3A)。这种波状变形可能是由于超声波引起的轻微机械应力所致,但尚不足以破坏膜的整体结构。以60W功率超声处理后,红细胞膜结构开始显示出更明显的变化,虽然大部分膜仍然保持完整,但在某些区域可以观察到较大的变形和孔洞(图3B)。这些孔洞的形成可能是由于超声波引起的空化效应,导致膜局部结构的破坏。尽管如此,总体而言, 60W功率下超声处理后的红细胞膜仍然保持了大部分的结构完整性。当超声功率提高到80W时,红细胞膜的结构破坏明显加剧,膜表面出现了不规则的破裂和较大的孔洞,膜结构的整体完整性受到了严重破坏,并出现了光滑的脂质体(图3C)。这是由于超声波产生强大空化效应和机械应力,这些力直接作用于膜的磷脂双分子层和膜蛋白,导致其分离和破裂。在100W功率下,红细胞膜完全破裂,形成大量的膜碎片及脂质体,膜的连续性完全消失(图3D)。这种完全破裂的现象表明, 100W功率下的超声波产生的机械力和空化效应已经超过了膜结构的承受能力,导致其彻底解体。
2.2 超声持续时间对人红细胞膜的影响
进一步探讨了超声时间对红细胞膜形态的影响。固定超声功率为100W,分别考察了超声1 min、5 min 和间断超声处理对红细胞膜结构的影响。
在超声处理1 min 后, Cryo-ET 图像显示红细胞膜的形态变化较小,尽管膜表面出现了一些微小的孔洞和波状变形,但整体结构仍保持相对完整(图4A)。这些微小孔洞可能是超声波产生的局部剪切力形成的。这种现象表明,在短时间的超声处理时,红细胞膜具有一定的机械稳定性和修复能力,能够抵抗超声波的轻微损伤。随着超声时间延长至5 min,红细胞膜的破坏程度显著增加。在Cryo-ET 图像中可以观察到细胞膜出现大面积的破裂和脱落,膜的连续性被严重破坏(图4B)。为探究更好的保护红细胞膜的方式,考察了采取超声1 min、停止1 min 共进行5 min 的间断超声处理方式的影响。间断超声处理下,虽然膜表面出现了一些孔洞和破裂现象,但膜的整体结构较连续超声处理下保持更为完整(图4C)。这可能是由于间断处理方式给细胞膜留出了缓冲时间,使得膜在受到机械应力后能够部分恢复,从而减少了持续超声对膜结构的累积破坏。此外,发现在这些细胞膜的边缘处,膜卷曲时可以看到边界清晰的磷脂双分子层,这可能是因为当电子横向穿过磷脂双分子层时,其疏水尾部对电子的吸收率更高(图4D)。
2.3 超声导致人红细胞膜骨架的脱落
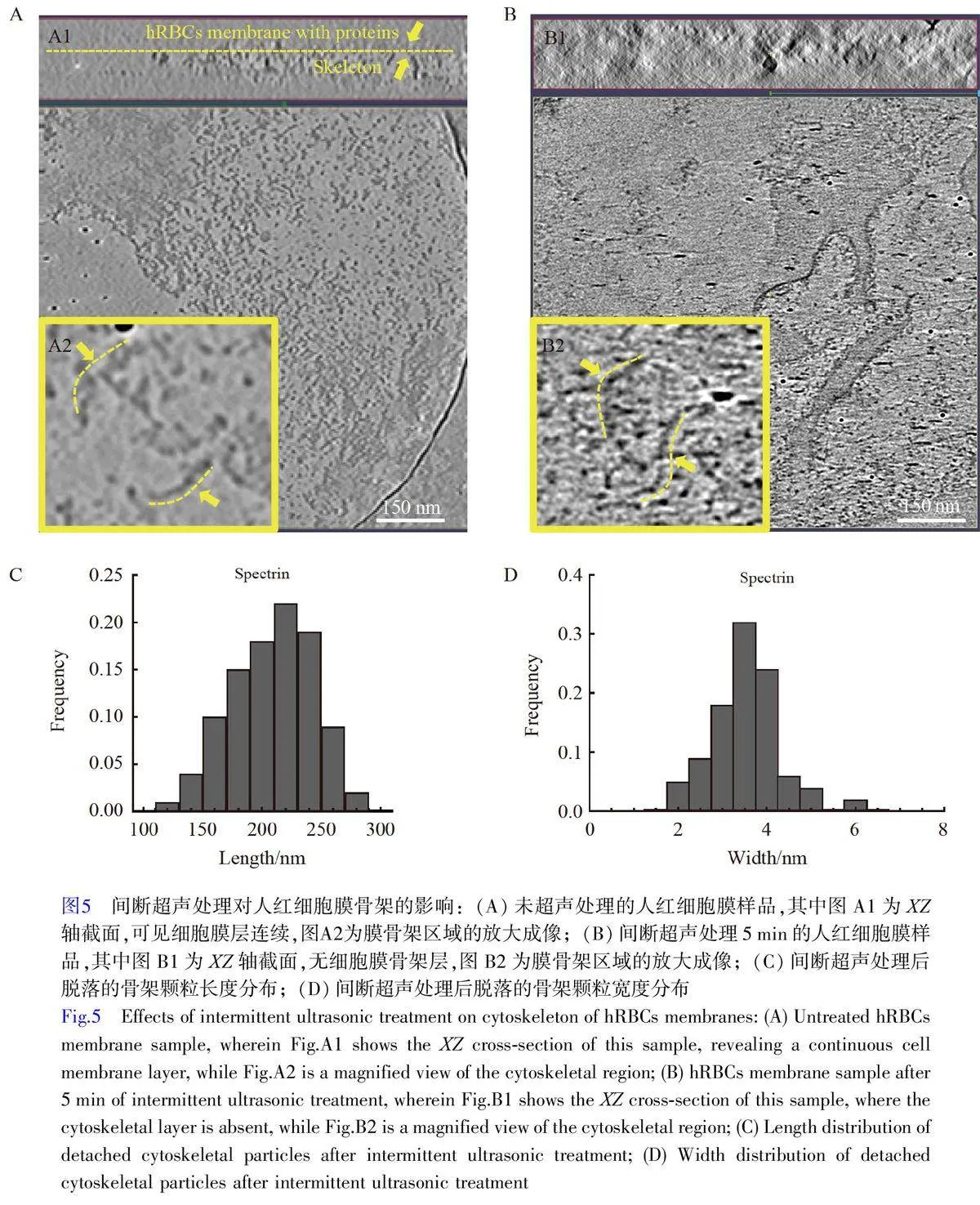
在对照组中, Cryo-ET 图像显示细胞膜与细胞骨架关系紧密。在Z 轴截面图中可以清楚地看到细胞膜磷脂层与骨架层相隔约12 nm(图5A)。经过超声处理后,尤其是在高功率和长时间处理条件下,细胞膜骨架明显脱落。随着超声功率和时间的增加,膜骨架蛋白从膜上解离,形成散落的蛋白质颗粒。这些散落的骨架蛋白颗粒呈现细长的丝状结构(图5B)。进一步统计这些散落的细丝状骨架蛋白质颗粒的尺寸,发现长度分布在200~260 nm 间,宽度约2~5 nm(图5C 和5D)。这表明细胞骨架虽然脱落,但其尺寸大小得到了较好的保持,未发生明显的断裂或变性。这可能是由于细胞骨架通过连接蛋白与细胞膜磷脂双分子层相互作用,在机械应力作用下,细胞骨架与连接蛋白在细胞膜上的分布状态发生改变,超声处理作用于细胞膜与膜骨架连接处的蛋白,破坏了细胞骨架与膜的连接,从而导致其脱落[35-37]。
2.4 细胞膜形成表面覆盖膜蛋白的脂质体
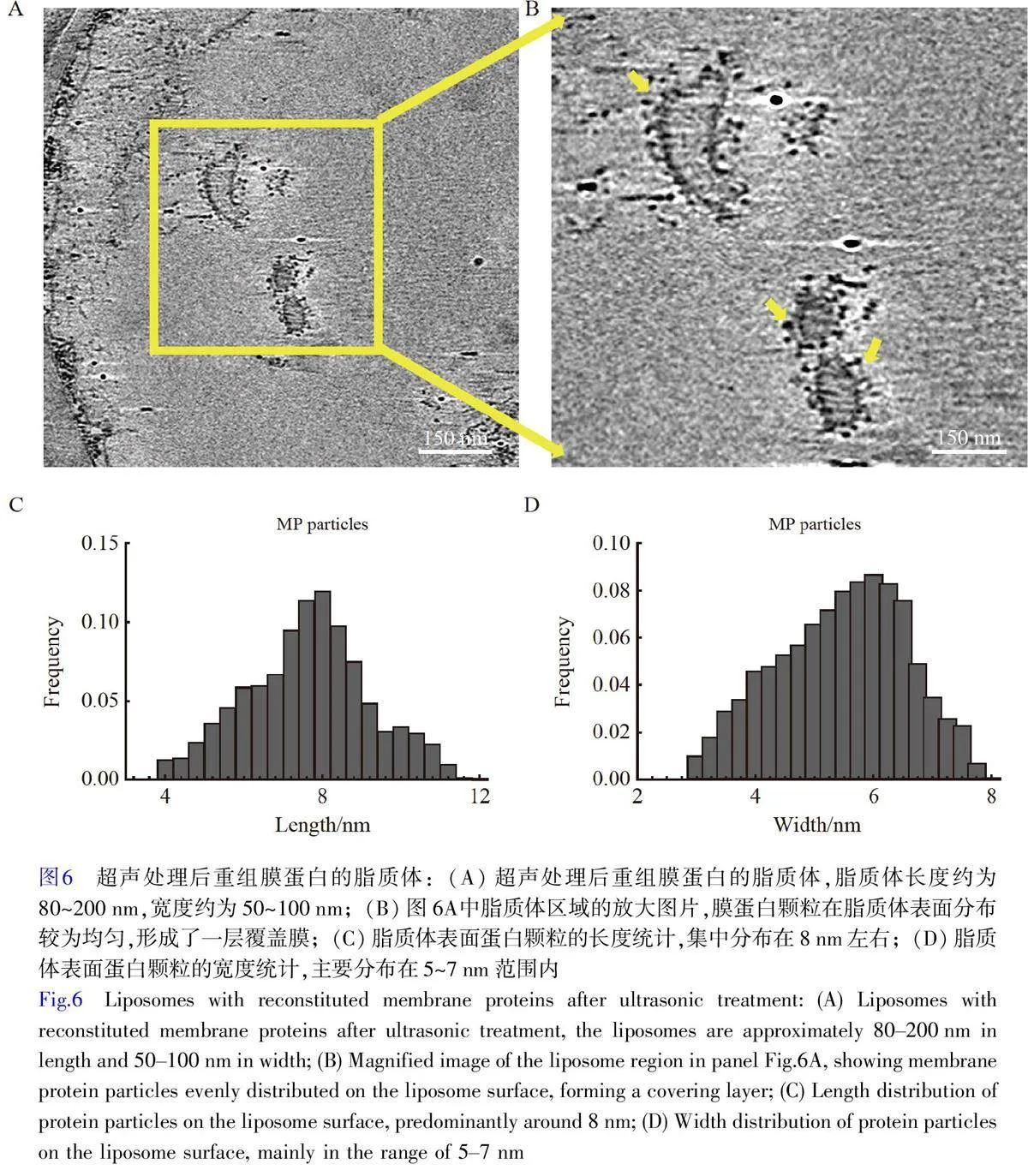
经高强度的连续超声处理(100W, 5 min)后,观察到细胞膜形成的脂质体表面存在膜蛋白(图6A)。这些膜蛋白颗粒在脂质体表面分布较为均匀,形成了一层覆盖膜,呈现出不同于原始细胞膜的分布模式(图6B)。进一步统计这些膜蛋白颗粒的直径,发现其尺寸与未超声处理的细胞膜蛋白颗粒相似,长度集中在8 nm 左右,宽度主要分布在5~7 nm(图6C 和6D),这表明超声处理过程中膜蛋白较好地保持了其整体结构。然而,这些蛋白颗粒显示出明显的突出结构,表明它们从脂质双层中伸出很远。这可能是由于在超声过程中,膜蛋白与细胞膜的连接受到了破坏,导致膜蛋白从磷脂双分子层中脱落。超声的剪切力和空化效应会在细胞膜上产生局部高压和微小气泡,这些气泡的形成与破裂会进一步扰动膜结构,从而促使膜蛋白分离。超声处理后,当脂质体重新形成时,脱落的膜蛋白因其疏水区域的亲脂性倾向,自发地嵌入脂质体的磷脂双分子层,并重新附着在脂质体表面。这种自发附着可能受到疏水相互作用和静电吸引的驱动,使得膜蛋白在脂质体表面均匀分布,形成类似于原始细胞膜的覆盖层[27,38-39]。在图3C 中出现的光滑的脂质体也验证了这一推测。这种重新附着现象表明,超声波处理不仅影响细胞膜的磷脂双层结构,还可能改变膜蛋白的分布和功能。
3 结论
超声波对红细胞膜的影响主要源于其产生的机械力和空化效应。本研究结果显示,功率较低或处理时间较短时,这些效应较为温和,仅会导致膜的轻微变形和局部孔洞的形成。随着超声功率的增加和处理时间的延长,超声波的空化效应和剪切力显著增强,导致膜结构的严重破坏。而间断超声处理可以有效减少细胞膜的损伤,使膜结构保存更加完整。这一规律在药物递送、细胞工程及超声治疗等领域具有重要意义。在药物递送方面,通过优化超声处理的方式,可以在保持细胞活性的同时增加膜的通透性,为药物分子的有效递送提供新的途径。在细胞工程方面,通过精确控制超声处理条件,可以研究细胞膜的机械性质和其对外界应力的响应机制。超声处理引起的人红细胞骨架脱离现象凸显了进一步探究超声对细胞稳定性影响的必要性。膜蛋白在脂质体上重新附着的现象不仅为设计更有效的药物递送系统提供了更多的可能性,也为膜蛋白功能的研究提供了新的手段。例如,通过调整超声处理条件,可以研究膜蛋白的重新分布规律及其对细胞功能的影响。在超声治疗领域,通过超声波处理模拟细胞在生理和病理条件下的膜损伤,可以研究膜损伤对细胞功能的影响和细胞膜的修复机制。在后续实验中,将深入研究超声对细胞膜结构和功能的长期影响,并开发更加灵活的超声调控技术,以进一步提升其在医学应用中的安全性和有效性。

