不同砧木对‘克瑞森无核’葡萄酚类物质含量及其合成相关酶活性的影响


摘 要 以不同砧木嫁接的‘克瑞森无核’葡萄为试材,自根苗为对照,研究其果皮色泽、酚类物质含量以及其合成相关酶活性,以期通过砧木嫁接提高‘克瑞森无核’酚类物质含量,改善着色不均,进而提高果实品质。研究结果表明,砧木嫁接的成熟‘克瑞森无核’葡萄呈红色,砧木101-14、110R嫁接及自嫁接均降低L*、b*,增加a*,而砧木SO4降低L*、b*,同时砧木101-14、110R嫁接显著促进葡萄果实可溶性固形物的积累,降低其可滴定酸含量。砧木嫁接在不同程度上能促进‘克瑞森无核’葡萄的酚类物质的积累,成熟时砧木101-14、110R、SO4嫁接和自嫁接均能提高总酚、类黄酮和花色苷含量,其中砧木101-14嫁接的‘克瑞森无核’的总酚、类黄酮和花色苷分别较对照显著提高50.88%、52.00%和74.13%,促进效果最为明显。与对照相比,砧木101-14嫁接最有利于提高‘克瑞森无核’葡萄的酚类物质各合成相关酶活性,而砧木SO4嫁接对提高DFR和UFGT活性不明显。相关性分析表明,砧木嫁接苗果皮中酚类物质与DGR和UFGT活性相关性较高,其共同作用影响酚类物质的变化。研究发现,砧木嫁接促进‘克瑞森无核’葡萄果皮着色,砧木101-14、110R、SO4嫁接和自嫁接均能通过促进DFR和UFGT的活性,提高果皮中酚类物质含量,并以砧木101-14表现最好。
关键词 砧木;‘克瑞森无核’;酚类物质;酶活性;相关性分析
‘克瑞森无核’(‘Crimson Seedless’)葡萄属欧亚种,又名‘淑女红’‘克伦生无核’等。果皮颜色鲜亮,果肉硬脆,成熟时果实脆甜爽口,是目前性状较好的优质晚熟无核品种[1-2],也是新疆最具发展潜力的鲜食主栽品种之一[3]。但该品种在新疆存在着色不良等问题,又因其成熟晚,易受早霜危害,限制了其经济效益的发展[4]。
酚类物质是葡萄中一类重要的次生代谢物质,主要包括花色苷、黄酮醇及黄烷醇等类黄酮物质,以及酚酸和芪类等[5-6],它们对葡萄果实品质具有重要影响。酚类物质主要经过苯丙烷类代谢途径和类黄酮途径[7],其中苯丙氨酸解氨酶(PAL)是参与合成的第一个酶[8],查尔酮合成酶(CHS)、二氢黄酮醇还原酶(DFR)和类黄酮葡萄糖基转移酶(UFGT)是合成的限速酶和关键酶[9-10]。近年来,关于‘克瑞森无核’葡萄的着色和成熟研究主要集中在外源生长调节剂[11]和施肥[12]等,但关于砧木嫁接对改善‘克瑞森无核’着色不均,提高酚类物质含量、促进果实成熟的研究鲜见报道。
砧木嫁接最早是用于抵御根瘤蚜,随后发现砧木可以提高嫁接苗抗逆性[13-14],同时还可以影响葡萄的生长发育和果实品质[15-16]。不同砧木由于遗传特性的差异,对接穗的酚类物质的含量也产生不同的影响。Wang等[17]研究表明,砧木5A、Harmony和Riparia Gloire提高‘赤霞珠’葡萄果皮类黄酮的含量;砧木5BB、3309M和101-14能提高‘赤霞珠’花色苷含量,但砧木SO4降低果皮花色苷含量[18];砧木5BB使‘藤稔’葡萄在转色初期果实PAL、CHI和UFGT活性增加,促进其果皮酚类物质的积累[19]。由此可见,不同砧木对葡萄果实酚类物质含量的影响不同,因此,研究砧木嫁接提高其果实酚类物质含量,有助于葡萄果实关键品质的提升。因此,本试验以自根苗为对照,比较不同砧木嫁接的‘克瑞森无核’葡萄果实不同生长发育时期果皮中酚类物质含量和相关性酶活性差异,并进行相关性分析,探讨砧木调控葡萄果实酚类物质的积累机制,以期通过砧木嫁接提高‘克瑞森无核’果实酚类物质含量,并为筛选优良砧木提供参考依据。
1 材料与方法
1.1 试验材料
试验场地处于新疆农业科学院安宁渠试验场园艺所葡萄基地,该基地(87°28′E,45°56′N)位于天山北坡,属于温带干旱半干旱大陆性气候,早霜9月下旬至10月中旬,晚霜4月底至5月中旬,全年无霜期155 ~ 177 d,冬季平均最低气温为-22.0 ℃,是典型的西北葡萄埋土防寒区。试验材料为‘克瑞森无核/101-14’(CS/101-14)、‘克瑞森无核/110R’(CS/110R)、‘克瑞森无核/SO4’(CS/SO4)及‘克瑞森无核/克瑞森无核’(CS/CS),以‘克瑞森无核’自根苗(CS)为对照,各砧穗组合于2012年嫁接,2014年开始结果,立地条件和栽培模式相同,均为顺沟倾斜龙干树形,株行距1 m×3.5 m,土、肥、水正常管理,修剪、抹芽定梢、修果穗、灌水、控产和病虫害防治措施均保持一致。
1.2 试验方法
试验从7月15日(花后45 d)开始采样,每隔15 d采样1次,至葡萄成熟期9月15日(花后105 d)结束,共采5次。各选择树势均一、无病虫害的15株,5株为1小区,重复3次。花期挂牌标注生长势相同的花穗。每次取样时,选择上、中、下结果部位,随机采集60粒果实,取果皮部分,液氮速冻,-80 ℃低温冰箱保存待测。
1.2.1 果实色差的测定 采用日本CR-10色差仪测定新鲜葡萄果皮色泽指标L*(亮度)、a*(红绿色差)、b*(黄蓝色差),并计算出色泽饱和度(Chroma,C*)、色调角(hue angle,h°)及色泽指数(color index of red grape,CIRG)。其中,C*=[a*+b*]1/2,h°=arctan(b*/a*),CIRG=" (180-h°)/(L*+C*)。果实外观色泽标准为:CIRGlt;2为黄绿色,2lt;CIRGlt;4为粉红色," 4lt;CIRGlt;5为红色,5lt;CIRGlt;6为深红色,CIRGgt;6为蓝黑色[20]。
1.2.2 果实可溶性固形物和可滴定酸的测定 将新鲜葡萄榨汁,采用日本PAL-1数显折光糖度仪测定可溶性固形物(TSS);可滴定酸(TA)采用氢氧化钠滴定法测定[20]。
1.2.3 类黄酮和总酚的提取与测定 将果皮样品烘干至恒量,粉碎,过40目筛之后,称取0.05 g,加入1" mL提取液(60%乙醇),60 ℃震荡提取2 h,后在10 000 g、25 ℃下离心10 min,取上清液待测。采用亚硝酸—氯化铝法测定类黄酮含量,结果以芦丁计[5],采用福林—肖卡法测定总酚含量,结果以没食子酸计[5]。
1.2.4 花色苷的提取与测定 取烘干后果皮样品0.05 g,加入1 mL提取液(60%乙醇),充分匀浆后转移至EP管,提取液定容至1 mL,盖紧后" 4 ℃浸提24 h,浸提后8 000 g、常温下离心10 min,取上清液待测。采用pH示差法测定花色苷含量,结果以矢车菊素-3-葡萄糖苷计[5]。
1.2.5 酶活性测定 取各处理果皮0.5 g液氮研磨后,加入5" mL pH 7.0缓冲液(0.018 mol·L-1巯基乙醇,0.05 mol·L-1抗坏血酸),4 ℃,10 000r·min-1离心20 min,上清液为苯丙氨酸解氨酶(PAL)和查尔酮合酶(CHS)提取液;取各处理果皮1 g液氮研磨后,加入5 mL丙酮(-20 ℃预冷)混匀离心,弃上清,用4 mL丙酮(-20 ℃预冷)再次提取,沉淀用4 mL pH" 8.8提取液(0.1 mol·L-1硼酸缓冲液,5 mmol·L-1抗坏血酸)提取,4 ℃,10 000 r·min-1离心20 min,上清液为二氢黄酮醇-4-还原酶(DFR)和类黄酮-3-O-糖基转移酶(UFGT)提取液。
PAL、CHS、DFR及UFGT活性均采用ELISA试剂盒(苏州科铭生物技术有限公司)测定,计算每克蛋白的酶活性,单位为U·g-1。
1.3 数据处理
数据使用Excel 2019进行整理和计算;采用SPSS 25.0进行差异显著性分析(Duncan’s新复极差法),对测定指标进行皮尔逊相关性分析;使用Origin 2019软件绘图。
2 结果与分析
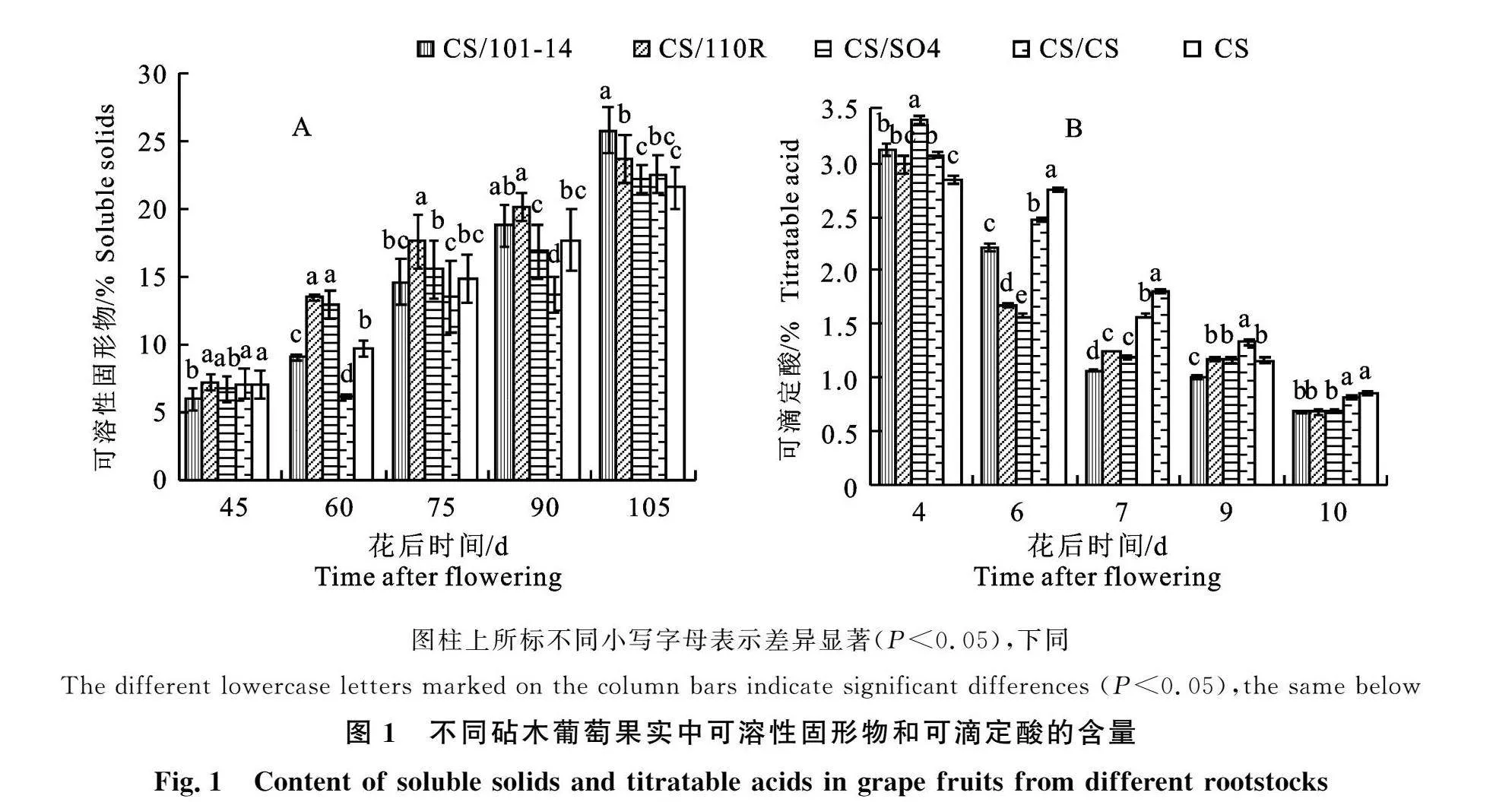
2.1 砧木对‘克瑞森无核’葡萄果实成熟度的影响
4种砧木嫁接的‘克瑞森无核’葡萄及对照的可溶性固形物含量随果实生长发育均在升高(图1-A),可滴定酸含量呈下降趋势(图1-B)。CS/110R和CS/101-14成熟速度较快,而CS/CS和CS/SO4成熟速度较慢;在花后75 d以后,CS/110R和CS/101-14均有较高的可溶性固形物含量和较低的可滴定酸含量。成熟期时,4种砧穗组合及对照果实的可溶性固形物含量表现为CS/101-14 gt; CS/110R gt; CS/CS gt; CS/SO4 gt; CS,各砧穗组合含量均高于对照,其中,砧木101-14和砧木110R嫁接的葡萄果实显著高于对照19.73%和9.87%;成熟期时可滴定酸含量最高的为对照(0.86%),砧木101-14和砧木110R嫁接的果实可滴定酸含量显著低于对照,砧木SO4和自嫁接处理对降低可滴定酸含量几乎无影响。可见,砧木101-14和砧木110R的嫁接有效促进‘克瑞森无核’葡萄果实可溶性固形物的积累,降低可滴定酸含量,促进葡萄的成熟。
2.2 砧木对‘克瑞森无核’葡萄成熟期果皮着色及色泽的影响
着色及色泽是影响葡萄成熟期及品质的关键指标[21]。由表1可知,L*表示颜色的亮度,CS/101-14、CS/110R、CS/SO4和CS/CS均使亮度不同程度降低,其中CS/101-14的亮度极显著低于对照29.39%;a*值为红绿色差指标,正值为红色,负值为绿色,4种砧穗组合及对照的a*值在成熟期时均为正值,CS/101-14极显著高于对照25.06%,CS/110R显著高于对照,CS/101-14和CS/110R使‘克瑞森无核’的红色调增加;b*值表示黄蓝色差指标,数值越小表示蓝色越深,葡萄着色越深,CS/101-14、CS/110R和CS/CS的b*值均极显著低于对照,CS/SO4显著低于对照,其中CS/101-14值最低,低于对照81.95%,表明其果实着色最深;C*表示色泽饱和度,CS/SO4的饱和度最小,表明着色不均匀,其次是CS/CS,而CS/101-14和CS/110R饱和度最高,其中CS/101-14显著高于对照16.42%,说明其果实颜色更加鲜艳;4种砧穗组合及对照的CIRG值为" 4~5,表示葡萄果实颜色为红色,并以CS/101-14的值最高,果实颜色相对较深。可见,从果实色泽指标上看,CS/101-14和CS/110R砧穗组合着色" 最好。
2.3 砧木对‘克瑞森无核’葡萄果皮酚类物质积累的影响
首先,在不同砧木‘克瑞森无核’葡萄生长发育过程中,其果皮总酚含量均呈现下降趋势(图2-A),在花后45 d(果实发育前期)时,各砧穗组合果皮中总酚含量均最高,随后开始迅速下降;花后75 d时,所有砧穗组合总酚含量均显著高于对照,CS/110R和CS/101-14含量分别比对照高出36.99%和32.49%;但花后90 d时略有回升,相比于花后75 d回升1.09% ~ 17.95%;后又继续下降,在成熟期(花后105 d)达到最低值,此时总酚含量以CS/101-14最高,其次是CS/CS,两者均显著高于对照(CS/101-14高于对照50.88%),随后依次为CS/110R和CS/SO4,自根苗总酚含量最低(10.20 mg·g-1)。
其次,4种砧穗组合及对照果皮中类黄酮含量随生育期的变化趋势与总酚相似,总体为下降趋势(图2-B)。其中,在果实发育前期(花后45 d),砧木对类黄酮含量影响差异不大,其含量为1.91 ~ 2.17 mg·g-1;在花后60 d,果皮中类黄酮含量快速下降,此时CS/101-14、CS/110R和CS/SO4含量均显著高于对照;在花后75 d时,除CS/110R和CS/CS含量略有上升外,其他处理均呈现继续下降趋势,但下降速率开始减慢;于成熟前期(花后90 d),CS/101-14、CS/110R和CS/SO4的含量与对照差异达到最大,分别相比对照显著提高59.00%、51.89%和35.80%;在成熟期(花后105 d),果皮类黄酮含量降到最低值,各砧穗组合均高于对照,其中CS/101-14、CS/110R和CS/SO4分别显著高于对照52.00%、40.26%和36.98%。
另外,在果实发育进程中,4种砧穗组合及对照果皮中花色苷含量呈现上升趋势(图2-C)。其中,在花后45 d,果皮中花色苷含量在各材料间差异不大,含量为7.61 ~ 10.52 μg·g-1;从花后60 d开始CS/101-14和CS/110R果皮中花色苷含量快速积累,于成熟期(花后105 d)含量达到最高值,并以CS/101-14和CS/110R组合增加最快、增幅最大。成熟时各砧穗组合花色苷含量均显著高于对照,其中CS/101-14花色苷含量最高,显著高于对照74.13%,其次为CS/110R、CS/SO4及自嫁接,分别显著高于对照61.16%、" 47.62%和41.60%。
可见,砧木嫁接均促进‘克瑞森无核’葡萄果皮中总酚、类黄酮和花色苷的合成,砧木101-14的促进效果更为显著。
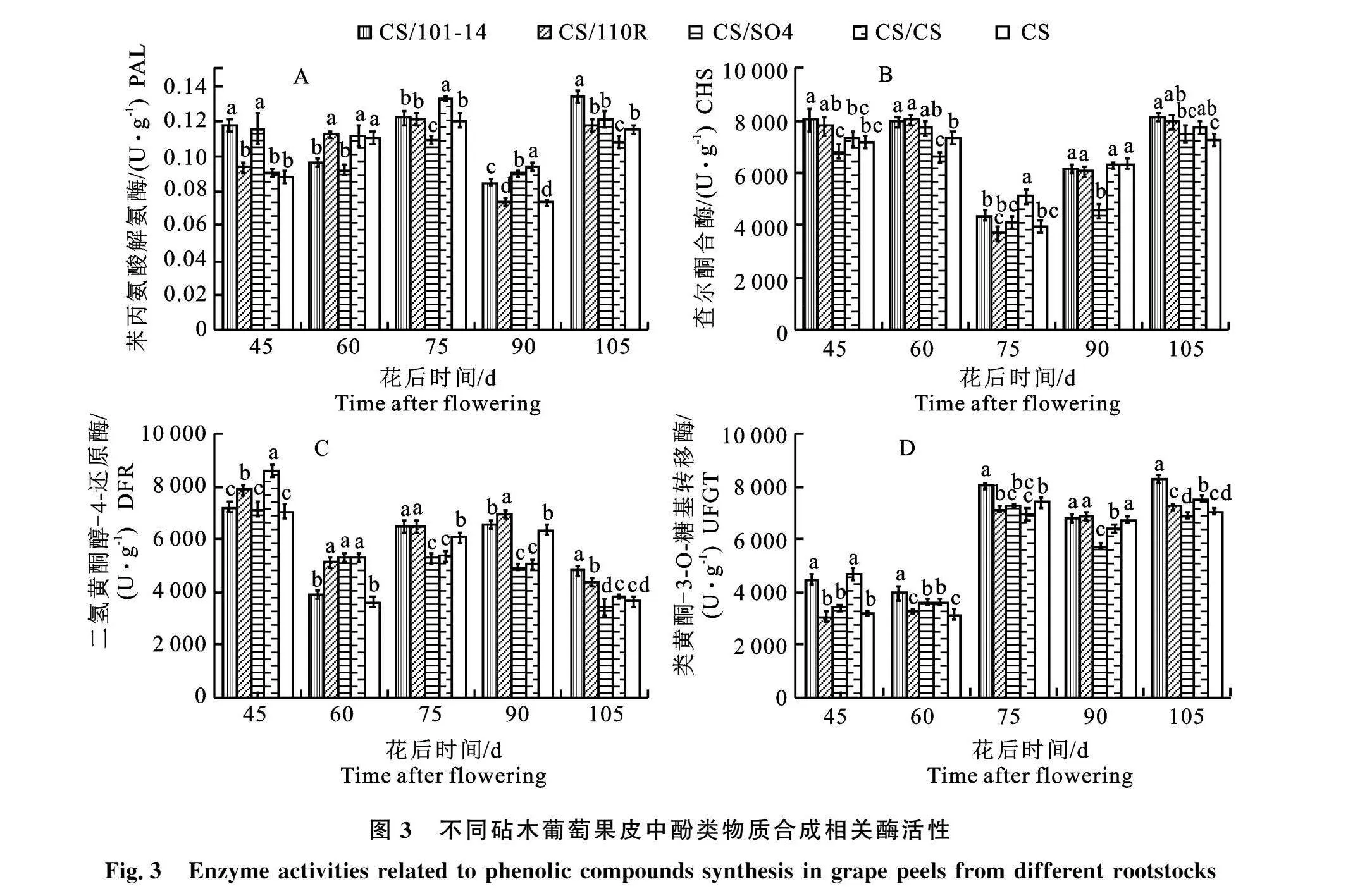
2.4 砧木对‘克瑞森无核’葡萄果皮中酚类物质合成相关酶活性的影响
葡萄果皮中酚类物质合成途径酶活性在不同砧木作用下发生不同程度的变化(图3)。首先,4种砧穗组合及对照‘克瑞森无核’果皮PAL活性在花后45 d时差异较大(图3-A),CS/101-14和CS/SO4活性较高,分别显著性高于对照24.97%和23.58%,随后于花后60 d呈现下降趋势,而其余3个处理在发育前期(花后45 d)活性较低,但在花后60 d呈上升趋势;从花后60~90 d所有砧穗组合的PAL活性均为先上升后下降,于花后75 d存在峰值,花后90 d下降到最低值,在成熟期(花后105 d)时再次上升,且达到最高值;在成熟期时,果皮中PAL活性以CS/101-14最高,显著高于对照14.53%,其次是CS/SO4和CS/110R,但与对照差异不显著,活性最低的是CS/CS处理,显著低于对照。
其次,‘克瑞森无核’的砧木嫁接苗及自根苗果皮CHS活性在果实发育前期(花后45~60 d)变化不明显,于花后75 d下降到最低值,此时CS/CS活性最高,显著高于其他砧穗组合;随后呈现上升趋势,在成熟期(花后105 d)达到最高值,并以CS/101-14活性最高(8 104.85U·g-1),且显著高于对照,其次为CS/110R、CS/CS和CS/SO4,所有砧穗组合CHS活性均高于对照(图3-B)。
再次,随着果实的生长发育,‘克瑞森无核’嫁接苗及自根苗果皮DFR活性呈现先下降后上升再下降的趋势(图3-C)。其中,在果实发育前期(花后45 d)时,CS/CS的DFR活性最高" (8 593.90 U·g-1),其次为CS/110R,均显著高于对照;各材料的DFR活性在花后60 d时均下降,在花后75 d均快速上升;随后CS/SO4和CS/CS的DFR活性从成熟前期(花后90 d)开始下降,其余异嫁接及对照在成熟前期(花后90 d)继续呈现上升趋势;各砧穗组合及对照DFR活性均于成熟期(花后105 d)下降至最低值,且活性均低于果实发育前期;在成熟期时,果皮中DFR活性以CS/101-14最高,显著高于其他处理,并比对照高出24.00%,其次为CS/110R和CS/CS,而CS/SO4活性低于对照,但与对照差异不显著。
另外,4种砧穗组合及对照果皮中UFGT活性呈现先上升后下降再上升的趋势,总体为上升趋势(图3-D)。其中,果皮中UFGT活性在果实发育前期(花后45~60 d)变化较小,于花后75 d快速上升,成熟前期(花后90 d)略有下降,成熟期(花后105 d)活性再次上升,并达到最高值。在果实发育过程中,CS/101-14处理的UFGT活性一直保持较高水平,在成熟期时同样为最高处理" (8 314.33 U·g-1),显著高于对照14.98%;CS/CS和CS/110R处理的UFGT活性次之;CS/SO4处理的活性较低,在成熟期时低于对照,但差异不显著。
以上结果表明,砧木嫁接可以影响‘克瑞森无核’果皮中酚类物质相关合成酶的活性,其中砧木101-14对‘克瑞森无核’PAL、CHS、DFR和" UFGT的活性均有显著促进作用。
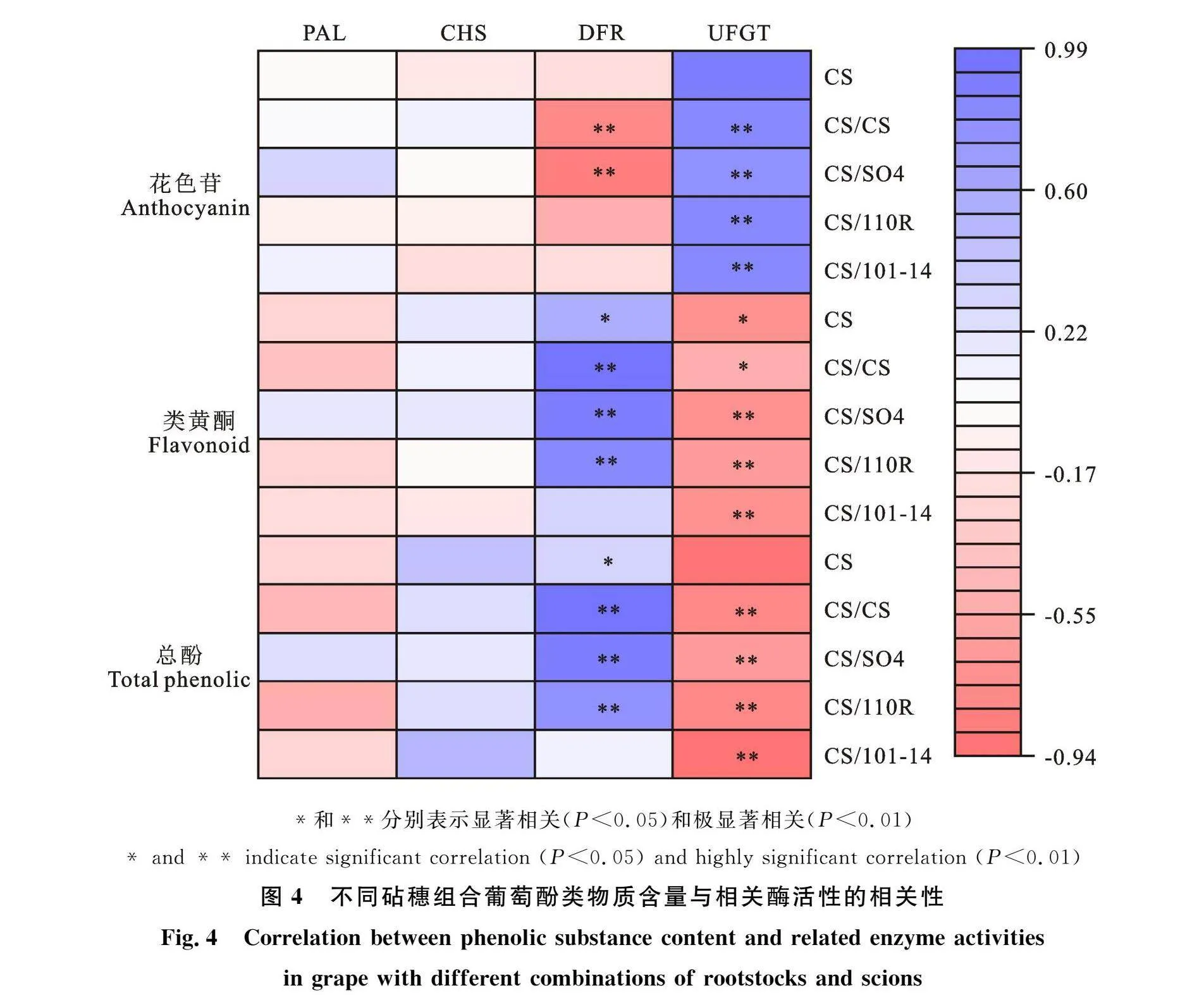
2.5 酚类物质含量与其相关酶活性间的关系
葡萄果皮中总酚、类黄酮、花色苷含量与其合成相关酶活性的相关性分析结果(图4)显示,花色苷含量与DFR活性呈负相关,其中砧木SO4及自嫁接均呈现极显著负相关,相关性系数分别为0.874和0.763;所有处理的花色苷含量与UFGT活性呈现极显著正相关。DFR活性与总酚、类黄酮含量均呈现显著或极显著正相关,其中砧木110R、SO4及自嫁接都为极显著正相关,与总酚含量的相关系数分别达到0.795、0.886和0.927,与类黄酮含量的相关系数分别达到" 0.825、0.906和0.985;所有处理的UFGT活性与总酚及类黄酮含量均呈现显著或极显著负相关,其中砧木101-14与总酚含量的相关系数最高" (0.937),砧木SO4与类黄酮含量相关系数最高(0.727)。而花色苷、类黄酮及总酚含量与PAL、CHS活性均无显著相关性。可见,在葡萄果实发育过程中DFR和UFGT是砧木嫁接影响‘克瑞森无核’酚类物质合成的关键酶。
3 讨论与结论
砧木嫁接对‘克瑞森无核’葡萄的影响首先体现在可溶性固形物和可滴定酸含量的变化。与自根苗相比较,砧木101-14和110R在加速可溶性固形物积累的同时,也加速可滴定酸的分解,表明这2种砧木嫁接加速‘克瑞森无核’果实的成熟,在‘丹娜’[22]和‘赤霞珠’[23]中也有类似发现,说明可以通过砧木嫁接来提高葡萄成熟度。
其次,酚类物质是决定葡萄果实品质的重要成分,是植物重要的次生代谢物质[24],其合成受多种因素的影响,如品种、土壤气候条件、栽培管理等[25]。前人研究表明,砧木嫁接显著影响了多酚、花色苷等酚类物质的含量[26],本研究结果与之一致。未成熟的葡萄果皮中含有大量叶绿素,而成熟果皮颜色主要由花色苷含量决定[27],本研究中各砧穗组合的花色苷含量随着果实的生长发育快速积累,呈现上升趋势,而葡萄果实成熟期的色泽指数同样表明,砧木嫁接使葡萄果实着色加深,进一步验证了砧木嫁接促进‘克瑞森无核’果实的着色。而类黄酮含量呈现下降趋势,这与前人研究结果相同,即花色苷与类黄酮同时存在又相互制约[27]。有文献报道,砧木101-14显著提高‘赤霞珠’花色苷含量[23],这与本研究结果一致,但砧木SO4降低花色苷含量[17],这与本研究结果相反,但也有文献报道砧木SO4、140R有利于‘美乐’葡萄果实花色苷的积累,而砧木101-14和1103P不利于其积累[28],这种差异有可能是由于接穗葡萄品种或气候条件不同所引起的。
另外,本研究发现4种砧穗组合均能够促进‘克瑞森无核’葡萄果皮中总酚的积累,白世践等[29]研究结果同样显示砧木101-14嫁接有助于葡萄果实中总酚的积累,但同样有结果显示砧木SO4嫁接不利于其积累[22],这与本研究结果相反,可能是因接穗品种不同所致,也有可能是不同砧木之间差异较大所引起的。另外,本研究与Giovanelli等[30]研究发现相同,在葡萄果实转色期之前总酚积累,之后含量呈现下降趋势。
酚类物质的合成是通过苯丙烷代谢途径进行的,本研究中砧木嫁接对该途径的PAL、CHS、DFR和UFGT这4种酶均有所影响,砧木101-14、110R和自嫁接使其活性增加。PAL为该途径的第一个酶,其与酚类物质积累存在一定的争议性,有研究发现PAL与猕猴桃花色苷合成呈极显著正相关[31],在受光诱导后为花色苷合成关键酶[32],但也有研究发现PAL活性与荔枝果皮花色苷合成无关[33]。本研究发现,砧木对‘克瑞森无核’酚类物质合成与PAL无显著相关性,说明PAL可能不是砧木嫁接调控‘克瑞森无核’酚类物质合成的关键酶。CHS处于该途径第二阶段,将香豆辅酶A转化为黄烷酮[34],在本研究中花后75 d是一个转折点,CHS活性降到最低值、PAL活性出现峰值,但酚类物质与CHS活性同样无显著相关性,但前人研究发现‘夏黑’的CHS活性与花色苷的积累呈正相关[35],这与本研究结果不同,可能是品种不同引起的,也有可能是因本试验为砧木嫁接葡萄而引起不一致的结果。DFR和UFGT是该途径第三阶段的酶,与花色苷的合成及其稳定性关系紧密[34],在其催化下由无色花青素转化为稳定的有色花色苷,均与酚类物质存在显著或极显著相关关系,DFR促进总酚和类黄酮积累,UFGT则相反;成熟期DFR活性低于果实发育前期,与花色苷呈极显著负相关,这与Gu等[36]结果不一致,可能是因嫁接而导致的不同;UFGT在有色成熟葡萄果皮中活性较强[37],本研究与其结果相同,UFGT活性随着果实发育升高,在所有酶活力中处于最高水平,活性与花色苷的含量模式基本一致,表明其促进花色苷的合成,进而影响果皮颜色[36],意味着UFGT是砧木嫁接对‘克瑞森无核’酚类物质合成途径中的关键合成酶。
综上,砧木101-14和110R有利于可溶性固形物的积累,并通过DFR和UFGT协同作用,促进‘克瑞森无核’酚类物质的积累及葡萄的着色,建议作为砧木使用。
参考文献 Reference:
[1] 张梦燕,孙军利,赵宝龙.外源ALA对克瑞森无核葡萄叶片光合特性及果实品质的影响[J].西北植物学报,2018," 38(3):493-500.
[2]董华芳,安珍珠,许延波,等.不同施肥配方对克瑞森葡萄园艺性状的影响[J].安徽农业科学,2022,50(13):153-157.
[3]杨 湘,苏学德,李鹏程,等.不同土壤水势对克瑞森葡萄光合生理及果实品质的影响[J].西南农业学报,2020,33(7):1429-1434.
[4]刘大章,毛丽萍,李志超,等.不同株行距、枝间距密度对克瑞森葡萄品质和产量的影响[J].热带农业科学,2022," 42(3):11-15.
[5]秦晨亮,丁 玲,代红军.赤霞珠葡萄果实发育过程中酚类物质含量与相关酶活性的关系[J].浙江农业学报,2015," 27(11):1922-1926.
[6]RUIZ-GARCíA Y,GóMEA-PLAZA E.Elicitors:A tool for improving fruit phenolic content[J].Agriculture,2013," 3(1):33-52.
[7]NAING A H,KIM C K.Roles of R2R3-MYB transcription factors in transcriptional regulation of anthocyanin biosynthesis in horticultural plants[J].Plant Mol Biol,2018,98(1):1-18.
[8]AZUMA A,KOBAYASHIS,GOTO-YAMAMOTO N,et al.Color recovery in berries of grape (Vitis vinifera L.) ‘Benitaka’,a bud sport of ‘Italia’,is cause by a novel allele at theVvmybA1" locus[J].Plant Science,2009,176(4):470-478.
[9]ZHANG K K,LIU Z J,GUAN L,et al.Changes of anthocyanin component biosynthesis in ‘Summer Black’ grape" berries after the" red" flesh" mutation" occurred[J].Journal of Agriculture and Food Chemistry,2018,66(35):9209-9218.
[10] GU Z Y,CHEN H,YANG R N,et al.Identification of DFR as a promoter of anthocyanin accumulation in poinsettia (Euphorbia pulcherrima,Wild.ex Klotzsch) bracts under short-day conditions[J].Scientia Horticulturae,2018,236(16):158-165.
[11]白世践,户金鸽,王 勇,等.茉莉酸甲酯对‘克瑞森无核’葡萄果实着色及品质的影响[J].农学学报,2022,12(6):44-49.
[12]郭西智,闫威娇,程大伟,等.不同有机水溶肥对‘克瑞森无核’葡萄生长及果实品质的影响[J].江西农业科学,2022,34(6):1-6.
[13]OKI L R,LIETH J H.Effect of changes in substrate salinity on the elongation of Rosah" ybrida" L.‘Kardinal’ stems[J].Scientia Horticulturae,2004,101(1-2):103-119.
[14]刘竞择,曹 柠,张艳霞.葡萄砧木冬季抗抽干能力及抗旱性综合评价研究[J].果树学报,2020,37(3):339-349.
[15]魏灵珠,沈碧薇,程建徽,等.砧木对‘新雅’葡萄生长及果实品质的影响[J].果树学报,2020,37(9):1346-1357.
[16]郝 燕,马麒龙,张 坤,等.河西走廊不同砧木对‘贵人香’葡萄生长与果实品质的影响[J].果树学报,2017," 34(10):1286-1293.
[17]WANG Y,CHEN W K,GAO X T,et al.Rootstock-mediated effects on Cabernet Sauvignon performance:vine growth,berry ripening,flavonoids,and aromatic profiles[J].International Journal of Molecular Sciences,2019,20(2):2-16.
[18]徐 伟,陈 光,白世践,等.不同砧木对‘赤霞珠’酿酒葡萄果实品质的影响[J].北方果树,2022,29(4):8-10,22.
[19]HABRAN A,COMMISSO M,HELWI P,et al.Rootstocks/scion/nitrogen interactions affect secondary metabolism in the grape berry[J].Frontiers in Plant Science,2016,382(7):1-11.
[20]白世践,户金鸽 ,赵荣华,等.不同颜色果袋对‘新郁’葡萄着色及品质的影响[J].果树学报,2023,40(5):932-945.
[21]田梦瑶,周宏胜,唐婷婷,等.外源蔗糖处理对采后桃果皮色泽形成的影响[J].食品科学,2022,43(1):177-183.
[22]韩 晓,杨航宇,陈为凯,等.不同砧木对欧亚种葡萄‘丹娜’果实类黄酮物质的影响[J].中国农业科学,2022,55(10):2013-2025.
[23]李敏敏,袁军伟,刘长江,等.砧木对河北昌黎产区赤霞珠葡萄生长和果实品质的影响[J].应用生态学报,2016,27(1):59-63.
[24]王 燕,李德美,孙智文,等.赤霞珠干红葡萄酒酚类物质及其与苦涩感的关联性分析[J].食品与发酵工业,2022,48(7):91-96.
[25]郑秋玲,刘万好,刘笑宏,等.4种砧木对‘赤霞珠’葡萄果实品质及抗氧化活性的影响[J].中国果树,202 63(9):36-41.
[26]CHENG J H,WEI L Z,MEI J X,et al.Effect of rootstock on phenolic compounds and antioxidant properties in berries of grape (Vitis vinifera L.) ‘Red Alexandria’[J].Scientia Horticulturae,2017,217(1):137-144.
[27]朱 峰,冯立娟,尹燕雷.‘泰山红’石榴果实花色苷和类黄酮含量变化[J].山东农业科学,2019,51(4):44-50.
[28]GUTIéRREZ-GAMBOA G,GóMEZ-PLAZA E,BAUTISTA-ORTíN A B,et al.Rootstock effects on grape anthocyanins,skin and seed proanthocyanidins and wine color and phenolic compounds from Vitis vinifera L.Merlot grapevine[J].J Agri Food Chem,2019,99(6):2846-2854.
[29]白世践,户金鸽,蔡军社,等.砧木对极端干旱区马瑟兰葡萄光合及酿酒特性的影响[J].西北农林科技大学学报(自然科学版),202 49(3):129-137.
[30]GIOVANELLI G,BRENNA O V.Evolution of some phenolic components,carotenoids and chlorophylls during ripening of three Italian grape varieties[J].Eur Food Res Technol,2007,225(1):145-150.
[31]邱 雪.‘红阳’猕猴桃果实花色苷合成降解相关酶的研究[D].四川雅安:四川农业大学,2016.
[32]ARAKAWA O.Photoregulation of anthocyanin synthesis in apple fruit under U-VB and red light[J].Plant Cell Physiol,1988,29(8):1385-1389.
[33]王惠聪,黄旭明,胡桂兵,等.荔枝果皮花青苷合成与相关酶的关系研究[J].中国农业科学,2004(12):2028-2032.
[34]池 铭,孙丽娟,马立杰,等.不同光质处理对采后桃果皮色泽及花色苷代谢的影响[J].食品科学,2023,44(3):209-217.
[35]ZHANG K K,LIU Z J,GUAN L,et al.Changes of anthocyanin component biosynthesis in ‘Summer Black’ grape berries after the red flesh mutation occurred[J].Journal of Agriculture and Food Chemistry,2018,66(35):9209-9218.
[36]GU Z Y,CHEN H,YANG R N,et al.Identification of DFR as a promoter of anthocyanin accumulation in poinsettia (Euphorbia pulcherrima,Wild.ex Klotzsch) bracts under short-day conditions[J].Scientia Horticulturae,2018,236(16):158-165.
[37]BOGS J,EBADI A,MCDAVID D,et al.Identification of flavonoid hydroxylases from grapevine and their regulation during fruit development[J].Plant Physiol,2006," 140(1):279-291.
Effect of Different Rootstocks on Phenolic" Content and Synthesis-related
Enzyme Activities in ‘Crimson Seedless’ Grapes
QIN Huanxue 2,ZHONG Haixia2,ZHANG Fuchun2,WU Jiuyun3,
ZHOU Xiaoming2,ZHANG Wen2,HAN Shou’an2,WANG Min2,
QIAO Jiangxia 2,PAN Mingqi2,WU Xinyu2 and" ZENG Bin1
(1.College of Horticulture,Xinjiang Agricultural University,Urumqi 830052,China; 2.Research Institute of Horticultural
Crops,Xinjiang Academy of Agricultural Sciences,Urumqi 83009 China;3.Turpan Research Institute of Agricultural
Sciences,Xinjiang Academy of Agricultural Sciences,Turpan" Xinjiang 83800 China)
Abstract Using different rootstocks grafted ‘Crimson Seedless’ grapes asexperimental material,with self-rooted seedlings as the control,this study investigates the effects of skin color,phenolics content,and enzyme activity related to its synthesis.The objective is to enhance the phenolics content,uneven coloring,thereby improving fruit quality of ‘Crimson Seedless’ grapes through rootstock grafting.The results showed that the mature ‘Crimson Seedless’ grapes grafted onto specific rootstocks exhibited a red coloration.Both grafting and self-grafting with rootstocks 101-14 and 110R resulted in reductions of" L*,b* values,and increased a*,while SO4 with rootstocks decreased L* and b*.Furthermore,grafting with rootstocks 101-14 and 110R significantly promoted the accumulation of soluble solids in grape fruits and reduced their titratable acid content.Grafting with rootstocks promoted the accumulation of phenolics in ‘Crimson Seedless’ grapes to varying extends.At maturity,grafting with rootstocks 101-14,110R,SO4,and self-grafting led to significant increase in total phenols,flavonoids,and anthocyanins.Among them,the total phenols,flavonoids,and anthocyanins of ‘Crimson Seedless’ grafted onto rootstocks 101-14 were significantly increased by 50.88%,52.00% and74.13% compared to the control,respectively,demonstrating the most pronounced enhancing effect.Compared with the control,grafting on rootstock 101-14 was most effective in improving the activity of phenolics compound synthesis-related enzymes in ‘Crimson Seedless’ grapes.In contrast,grafting onto rootstock SO4 did not significantly enhance the activities of DFR and UFGT enzymes.Correlation analysis shows a strongcorrelation between phenolics in the fruit peel of rootstock-grafted seedlings and DGR and UFGT activities,and their combined effects affect the changes in phenolics.The results demontrate that rootstock grafting promotes the coloration of the grape peel of ‘Crimson Seedless’ grapes.Rootstock 101-14,110R,SO4 grafting,and self-grafting can promote the activity of DFR and UFGT,increase the content of phenolics in the peel.Among these,rootstock 101-14 performs best.
Key words Rootstocks; ‘Crimson Seedless’; Phenolic; Enzyme activity; Correlation analysis
Received" 2023-08-07 Returned 2023-10-05
Foundation item The National Natural Science Foundation of China (No.32160682, No. 32460722); Xinjiang Autonomous Region Tianshan Talent Program for Young Top Talents Project (No. 20243124233); Stabilization Support from the Xinjiang Academy of Agricultural Sciences (No.xjnkywdzc-2024003-09);Key Ramp;D in the Autonomous Region (No.2023B02029-1-1); Autonomous Region Science and Technology Aid Program (No.2022E02063); Hunan Innovative Province Construction Special Project (No.2023WK4008).
First author QIN Huanxue,female,master" student.Research area:grape cultivation physiology and quality control.E-mail:qinhuanxue1226@163.com
Correspondingauthor ZHONG Haixia,female,associate research fellow.Research area:grape cultivation physiology and quality control.E-mail:zhonghaixia1@sina.cn
ZENG Bin,male,professor.Research area:fruit tree germplasm resources and fruit tree cultivation physiology.E-mail:zbxnd@163.com
(责任编辑:郭柏寿 Responsible editor:GUO Baishou)

