威氏绿绒蒿叶斑病病原鉴定及药剂筛选

摘 要 确定威氏绿绒蒿病原菌及其寄主范围,并筛选对病原菌具有抑制作用的杀菌剂,为威氏绿绒蒿病害的科学防控提供理论基础。以采自西南林业大学苗木基地的威氏绿绒蒿表现叶斑病的病害叶片为试验材料,运用组织分离法分离获得纯化菌株。使用柯赫氏法则验证菌株的致病性,通过形态观察结合分子生物学特性,对病原菌进行种类鉴定。采用离体叶片接种法测定病原菌的寄主范围,并利用带毒平板法测定50%多菌灵、50%嘧菌酯、38%唑醚啶酰菌胺、50%咪鲜胺锰盐、75%百菌清和80%代森锰锌对病原菌的室内毒力。从威氏绿绒蒿叶斑病病叶分离得到病原菌LRH-2,其菌落为圆形具轮纹,菌丝白色,分生孢子纺锤形,2~3根附属丝。结合rDNA-ITS序列分析,构建系统发育树,发现菌株与小孢拟盘多毛孢(Pestalotiopsis microspora)(菌株号:KT459349)聚在同一个分支。结合形态特征和ITS序列分析,鉴定LRH-2为小孢拟盘多毛孢" (P.microspora)。通过离体叶片接种法对21科24种植物的致病性进行测定,其中12科13种供试植物在试验观察期内出现不同程度的发病症状。6种低毒杀菌剂对LRH-2均有一定抑制作用,其中50%多菌灵WP和38%唑醚啶酰菌胺WG对病原菌生长的抑制效果较好,其质量浓度(EC50)为0.447和0.497 mg·L-1。明确了威氏绿绒蒿叶斑病病原菌为小孢拟盘多毛孢(P.microspora),并通过对病原菌寄主范围测定,证实了该病原菌的环境适应性较强,筛选出抑制作用较强的药剂50%多菌灵WP和38%唑醚啶酰菌胺WG。
关键词 威氏绿绒蒿;叶斑病;病原鉴定;小孢拟盘多毛孢;寄主范围;杀菌剂;防治效果
绿绒蒿被誉为“高山牡丹”,一年生或多年生的草本,属于“云南八大名花”之一。该属常生长于海拔2 800~5 000 m的林下、高山草地和流石滩地带,主要分布于亚洲中南部,集中于四川、云南、西藏等地区[1]。其品种众多,分为2个亚属、5个组和9个系,Grey Wilson曾记录该属植物有79种,其中我国58种[2]。绿绒蒿有极高的观赏价值,艳丽优美,花色丰富。另外它还具有独特的民族文化内涵,其园林艺术价值可以弥补园林绿化的景观同质化等问题,同时丰富地域文化特色[2]。除此之外,绿绒蒿具有极高的药用价值和经济价值,是著名的藏药材料。藏医药典籍《月王药诊》、《四部医典》和《晶珠本草》等均对绿绒蒿有详细记载,现代药理也表明该属植物具有止泻、镇痛、保肝护肝、抗炎、抗氧化、抗疲劳、抗心肌缺血等作用[3]。
由于该属植物特有的生长环境,病虫害难以发生。所以在实际栽植中,对病虫害的抵御能力不强。近年来不少学者致力于其绿绒蒿的育种研究,但在培育的过程中病害发生严重,时常造成叶片脱落,大大影响其生长存活。关于绿绒蒿病害病原菌的分离鉴定鲜有报道,因此对病原菌进行系统分离鉴定,并明确其寄主范围,对生产上防治该病害具有重要意义。
笔者于2021年末在西南林业大学苗圃基地中的威氏绿绒蒿(Meconopsis wilsonii)植株上,发现了疑似叶斑病病症,表现为褐色斑点,感病后期叶片干枯死亡。本研究主要针对种植威氏绿绒蒿面临的这种病害,通过鉴定威氏绿绒蒿病害病原,测定病原菌对不同种类植物的致病性,确定病原菌的潜在寄主范围,并研究多菌灵、嘧菌酯、唑醚啶酰菌、咪鲜胺锰盐、百菌清、代森锰锌6种常用广谱低毒杀菌剂对它的防治效果,为治理威氏绿绒蒿病害提供理论依据。
1 材料与方法
1.1 供试材料
供试样品采自云南省昆明市西南林业大学苗木基地,随机从3株威氏绿绒蒿 (M.wilsonii),分别采取3片发病病叶,放置冰盒带回实验室,备用。绿绒蒿健康叶片采自同植株新鲜、无机械伤、大小一致的健康叶片。寄主范围供试植物采自西南林业大学不同植物的健康叶片。
供试杀菌剂为50%多菌灵WP(江苏三山农药有限公司)、50%嘧菌酯WG(河北冠龙农化有限公司)、38%唑醚啶酰菌胺WG(江西正邦作物保护有限公司)、50%咪鲜胺锰盐WP(美国富美实公司)、75%百菌清WP(利民化学有限公司)、80%代森锰锌WP(山东省济南一农化工有限公司)。
1.2 病原菌分离纯化
采用组织分离法,从叶片病健交界处获取" 6 mm×6 mm左右的组织,接种到PDA平板中。倒置在25 ℃左右的培养箱内培养,3 d后挑取病叶附近的菌丝纯化,纯化3~5次后获得纯菌株并进行编号。将纯化后的菌株甘油冻存,于-20 "℃冰箱保存,备用。
1.3 病原菌致病性测定
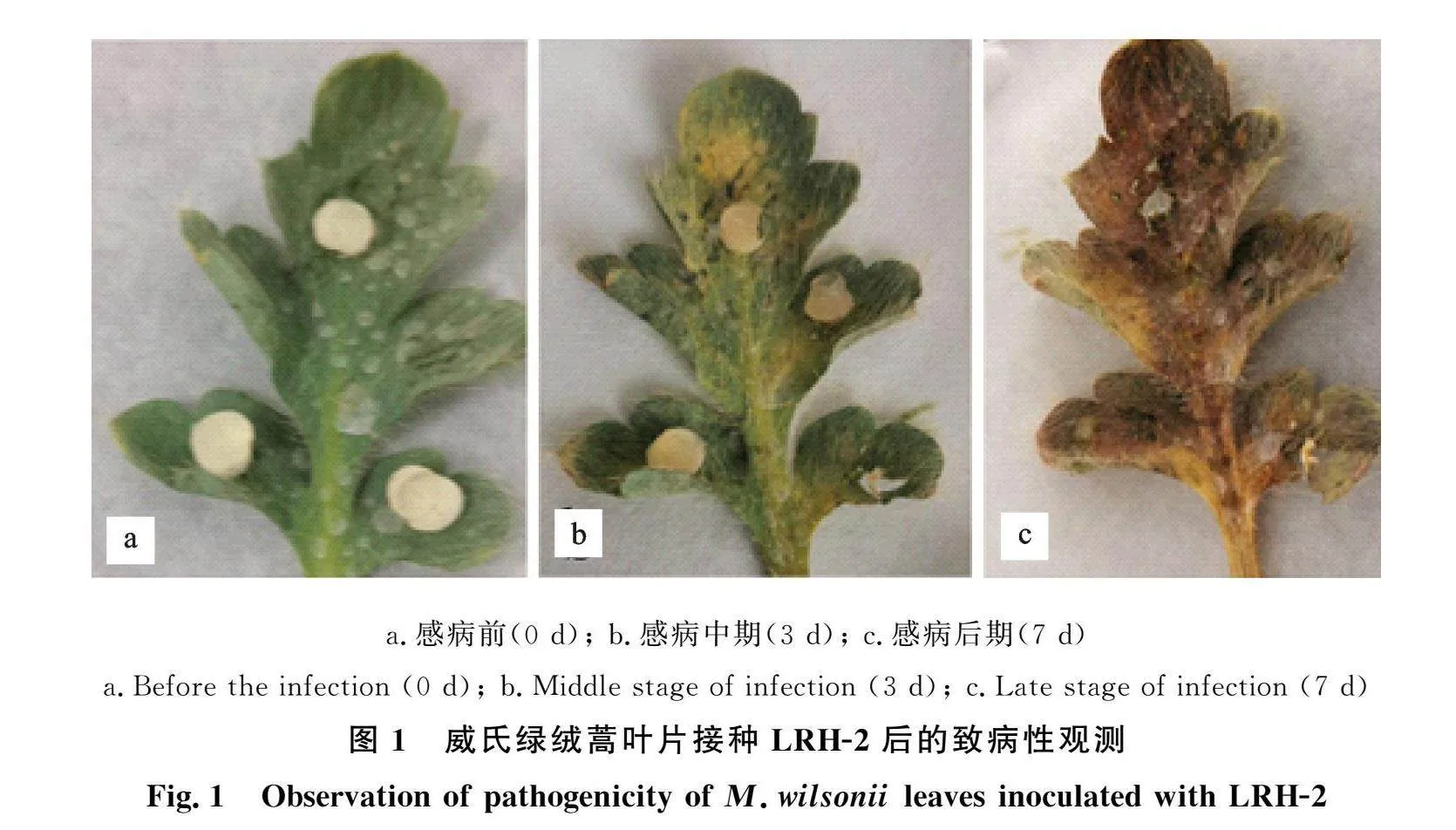
参考离体接种法对菌株进行致病性测定:采取同一植株采取健康无病、生长良好的绿绒蒿叶片,叶片表面消毒后晾干,备用。将培养7 d 的菌丝块(直径5 mm)覆盖于用灭菌针刺破的叶片伤口处,放置保湿培养皿,并设置3组重复,以空白PDA为对照[4]。观察记录接种情况,7 d后从发病的叶片用组织分离法分离病原菌。
1.4 病原菌鉴定
1.4.1 形态鉴定 采用玻片培养法进行培养观察:将察氏培养基倒入培养皿,厚度为1 mm左右,用解剖刀在凝固好的培养基划1.5 cm×1.5 cm的方块,并放置在载玻片上,挑取病原菌菌丝接种在方块边缘,盖上盖玻片,放置在保湿培养皿中[5]。25 ℃培养4~7 d,长出菌丝后,在显微镜下观察并拍照记录分生孢子形态大小和着生方式等特征。比较观察结果与已报道的病原菌,进行形态学鉴定。
1.4.2 分子生物学鉴定 采用真菌DNA抽提试剂盒提取病菌DNA,使用通用引物ITS1和ITS4扩增,PCR扩增体系为MIX 12.5 μL,DDW 9.5 μL,ITS1 1 μL,ITS4 1 μL,DNA 1 μL。PCR反应程序:95 ℃ 5 min;94 ℃ 30 s,52 ℃ 45 s," 72 ℃ 50 s,这3个阶段重复循环35次;72 ℃10 min;4 ℃保存[5]。把扩增后序列送至擎科生物科技有限公司测序,获得的测序结果在NCBI官网进行BLAST比对,参考文献并筛选出相关菌株的ITS序列,用MEGA构建系统进化树,并在NCBI官网上传菌株序列以获取登录号。
1.5 寄主范围测定
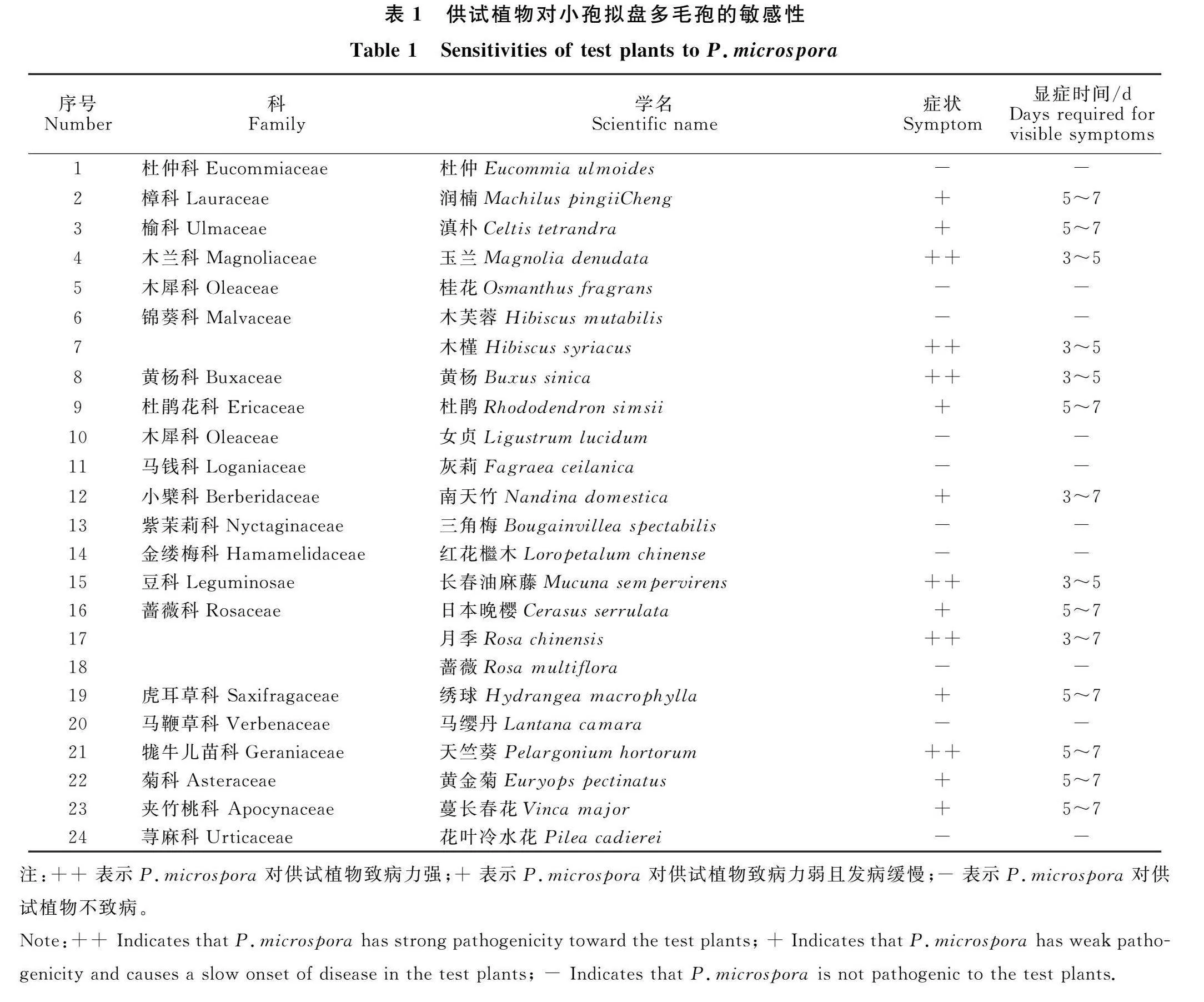
参考杨迪等[6]的方法,采用离体针刺接种法进行致病性测定。供试寄主植物包括:杜仲(Eucommia ulmoides)、滇朴(Celtis tetrandra)、润楠(Machilus pingii" Cheng)、玉兰(Magnolia denudata)、桂花(Osmanthus fragrans)、木芙蓉(Hibiscus mutabilis)、日本晚樱(Cerasus serrulata)、木槿(Hibiscus syriacus)、黄杨(Buxus sinica)、杜鹃(Rhododendron simsii)、女贞(Ligustrum lucidum)、灰莉(Fagraea ceilanica)、南天竹(Nandina domestica)、三角梅(Bougainvillea spectabilis) 、红花檵木(Loropetalum chinense)、长春油麻藤(Mucuna sempervirens)、月季(Rosa chinensis)、蔷薇(Rosa multiflora)、绣球(Hydrangea macrophylla)、马缨丹(Lantana camara)、天竺葵(Pelargonium hortorum)、黄金(Euryops pectinatus)、蔓长春花(Vinca major)、花叶冷水花(Pilea cadierei)。
1.6 药剂敏感性测定
采用菌丝生长速率法测定病原菌对6种供试杀菌剂的敏感性,50%多菌灵和38%唑醚啶酰菌胺参考吴玉珠等[7]设置的质量浓度,80%代森锰锌、75%百菌清及50%醚菌酯参考于静亚等[8]设置的质量浓度,50%咪鲜胺锰盐参考熊朝伟等[9]。制成上述6种杀菌剂的含药平板,药剂与培养基体积比1∶10。以无菌水为对照,每个浓度梯度重复3次,25 ℃倒置暗培养7" d。采用十字交叉法测定菌落生长直径,记录数据并计算不同浓度梯度下杀菌剂的抑菌率。
抑菌率(抑制生长率)=[(对照菌落直径平均值-处理菌落直径平均值)/(对照菌落直径平均值-菌饼直径)]×100%
通过SPSS 26和DPS处理数据,以质量浓度的常用对数值为横坐标,抑制率的机率值为纵坐标,计算毒力回归方程并求出半最大效应浓度(EC50 )的值,比较不同防治药剂的相对抑制效果。
2 结果与分析
2.1 致病性测定
分离得到3株纯菌株LRH-1、LRH-2和LRH-3,通过刺伤将菌饼接种于健康、无病虫害的绿绒蒿叶片上,7 d后观察,结果如图1所示。LRH-2接种处理叶片发病,症状与田间发病叶片症状一致,对照处理叶片均健康未发病。
2.2 病原菌鉴定
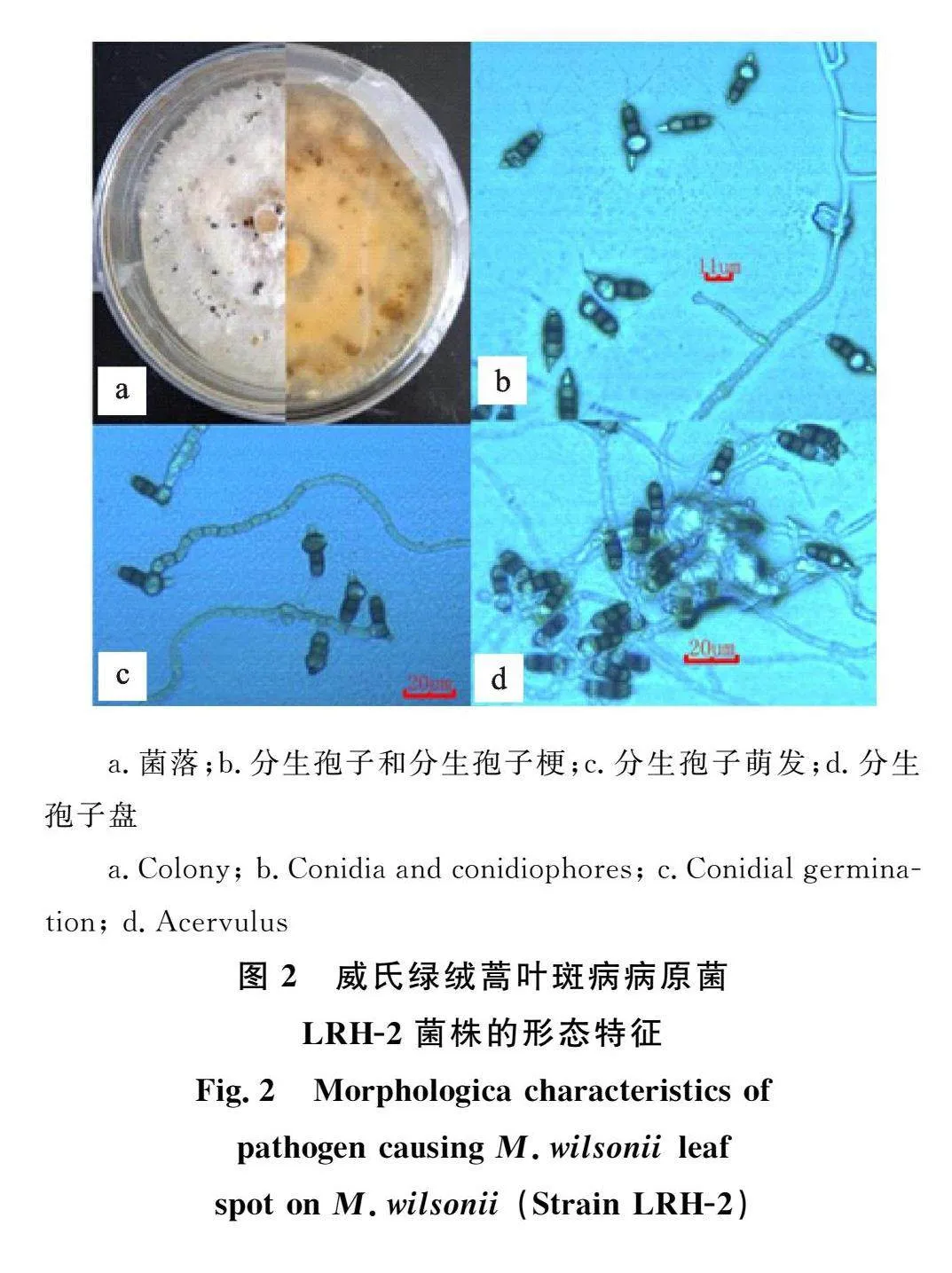
2.2.1 形态鉴定 LRH-2号:菌丝白色,菌落圆形具轮纹,后期产生黑色油滴状分生孢子团(图2-a)。将玻片培养6" d左右的菌丝置于显微镜下观察,发现其分生孢子为纺锤形,20 μm 左右,具有4个隔膜5个细胞,中间3个细胞为褐色,两端细胞无色三角状,顶端附属丝2~3根(图2-b);其分生孢子梗短、无色(图2-b),分生孢子萌发如图2-c,分子孢子盘初期埋生,后期突出基物外露(图2-d)。从该菌形态特征,查阅文献可初步鉴定为小孢拟盘多毛孢(P.microspora)[6]。
2.2.2 分子鉴定 利用ITS1/ITS4引物对LRH-2的ITS进行PCR扩增,测序得知其序列长度为585 bp,进行BLAST比对,下载并选择序列长度接近和同源性高的近缘种序列,使用MEGA7软件用邻近法构建系统发育树(图3),结果表明,菌株LRH2(登录号:OR086089)与小孢拟盘多毛孢(登录号:KT459349)聚类于同一分枝,亲缘关系密切。结合形态学特征将LRH2鉴定为小孢拟盘多毛孢(P.microspora),隶属于腔孢纲(Coelomycetes)黑盘孢目(Melanconiales)黑盘孢科(Melanconiaceae)拟盘多毛孢属(Pestalotiopsis)。
2.3 病原菌的潜在寄主范围
对21科22属24种植物叶片进行离体接种,其中12科13种植物叶片接种部分出现不同程度的发病症状。LRH-2号对天竺葵、玉兰、木槿、黄杨和月季等植物的致病力强,接种后3" d左右就显示不同程度的病症。病原菌对绣球、黄金菊、蔓长春花、南天竹、润楠、滇朴和日本晚樱等植物致病力弱且发病缓慢,约在5~7 d显示不同程度的病症,具体发病时间、病斑大小如表1所示。但对蔷薇、木芙蓉、马缨丹、女贞、灰莉、三角梅、桂花、杜仲、红花檵木和花叶冷水花不致病,暗示这些植物体内可能含有对该病原菌有抑制作用的化合物。
2.4 杀菌剂对病原菌的药剂敏感性
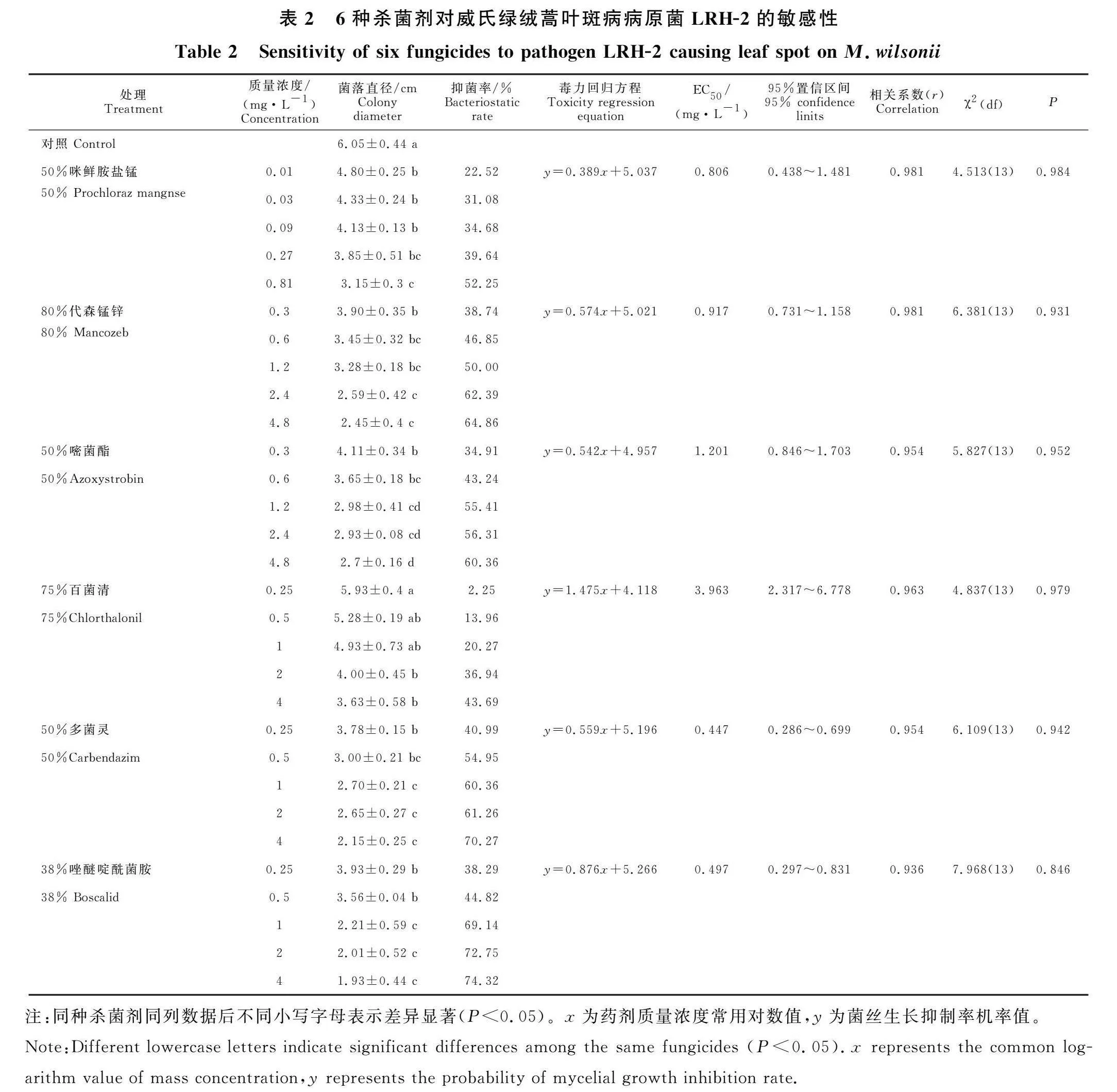
采用生长速率法测定6种供试杀菌剂对病原菌的药剂敏感性,结果表明LRH-2在不同浓度含药平板上均能生长,但与对照组相比,菌丝生长缓慢,且抑制率与杀菌剂浓度呈正相关,表明6种供试杀菌剂对其菌丝的生长均有较好的抑制效果。通过对数据进行拟合,得到6种杀菌剂的毒力回归方程(表2),其相关系数(r)分别为0.987、" 0.983、0.945、0.928、0.933和0926,表明毒力回归方程的拟合度较好。其中多菌灵的毒力最高,对病原菌生长的抑制效果最好,EC50值为0.447" mg·L-1。由EC50值可知病原真菌对6种杀菌剂的敏感性50%多菌灵>38%唑醚啶酰菌胺>50%咪鲜胺盐锰>80%代森锰锌>50%嘧菌酯>75%百菌灵。
3 讨" 论
绿绒蒿叶斑病是绿绒蒿栽培上重要的病害之一,国内外关于绿绒蒿叶斑病病原菌鲜有报道。本研究对威氏绿绒蒿(M.wilsonii)感病叶片分离纯化,通过科赫氏法则对其致病性进行验证,得到病原真菌LRH-2。经形态特征及序列分析等,证明供试病原菌与小孢拟盘多毛孢的特征基本一致,系统发育树中与小孢拟盘多毛孢的同源性达100%。因此将威氏绿绒蒿病害的病原菌鉴定为小孢拟盘多毛孢(P.microspora)。小孢拟盘多毛孢可引起威氏绿绒蒿叶斑病,目前在国内外尚属首次报道。拟盘多毛孢属(Pestalotiopsis)最初被盘多毛孢属(Pestalotia)包含,后于1949年被Steyaert划分出来,认为其属拥有5细胞分生孢子,Sutton和Nag Raj在此基础上,对拟盘多毛孢属的特征作不同的界定。韦继光等[10-11]的研究证实Sutton界定的属间特征具合理性,并发现其分生孢子有色胞分为暗色和淡色。一直以来,该属是一类重要的植物致病菌,症状表现为叶斑、叶枯、腐烂、溃疡等,主要分布在全球热带和亚热带地区,在我国大多分布于南方[12-13]。据文献报道,拟盘多毛孢属(Pestalotiopsis)的寄主范围十分广泛,可寄生超过50多个科的植物,如芒果[14]、杨梅[15]、番石榴[16]等生态作物和经济作物为害比较严重。
近年来,陆续有小孢拟盘多毛孢引起植物病害的报道。小孢拟盘多毛孢可对油棕、石楠、闽楠、红叶石楠、岗梅、核桃、油茶、蓝莓、橄榄等经济作物致病[8,17-23],主要表现为叶斑、溃疡和腐烂等病症。由此可见其寄主范围较为广泛,本研究中小孢拟盘多毛孢对24种植物的致病性测定中,发现有14种植物呈现不同病症,其中不致病的大部分植物为木本植物,在此之前韦继光等[24]认为拟盘多毛孢是木本植物内生真菌的重要类群之一。另外,刘韩等[25]从松树上分离得到11种内生拟盘多毛孢,其中包含小孢拟盘多毛孢。谢津[26]在前人的研究下,总结了小孢拟盘多毛孢在一些植物的内生情况,如茶、樟树、丛花厚壳桂、香叶树、香桄榔、软叶针葵和某些青冈、栎树、杉树与松树品种等。根据前人研究,可以推测小孢拟盘多毛孢在有些植物上为病原,而在其他植物上可能呈内生状态。
目前,关于小孢拟盘多毛孢的防治主要依靠化学杀菌剂。管斌等[27]在10种杀菌剂中发现发现咪鲜胺EC(25%)、代森锰锌WP(80%)、嘧菌酯SC(250 g·L-1)对小孢拟盘多毛孢的防治效果均较佳。于静亚等使用与管斌等相同的6种杀菌剂,采用不同的质量浓度,发现效果较好的是咪鲜胺AS(450 g·L-1)、甲基托布津WP(70%)和苯醚甲环唑WG(10%)[8];同时熊朝伟等[9]增加了杀菌剂对孢子萌发的抑制作用,发现苯醚甲环唑和咪鲜胺效果也比较好。吴玉珠等[7]使用了一些复合型杀菌剂,在12种杀菌剂中唑醚·代森联WG(60%)的抑菌效果最好。在田间试验中,廖道林[28]证实吡唑醚菌酯效果较好,与矿物质油(99%)混合使用可以提高药效。这与阳廷密等[29]对小孢拟盘多毛孢引起柑桔黄斑落叶病的防治结论基本一致。另外,廖道林[28]还建议在病害不严重的情况下,选用600倍液的代森锰锌WP。
本试验对引起威氏绿绒蒿的小孢拟盘多毛孢进行了杀菌剂的抑菌效果测定,6种供试药剂都有抑菌效果,其中多菌灵WP(50%)、嘧菌酯WG(50%)、唑醚啶酰菌WG(38%)、咪鲜胺锰盐WP(50%)、百菌清WP(75%)和代森锰锌WP(80%)的EC50分别为0.447、1.201、0.497、" 0.806、3.963和0.917" mg·L-1。相比较而言,多菌灵和唑醚啶酰菌胺对病原菌的抑制效果较好。这些结果与管斌等[27]的研究存在差异,管斌等得出的EC50分别为4.867 7、4.628 3、4.499 7 mg·L-1;另外,于静亚等[8]和熊朝伟等[9]的咪鲜胺EC50也存在出入,前者采用的是咪鲜胺AS(250 g·L-1),EC50为0.099mg·L-1;后者采用的是咪鲜胺EW(450 g·L-1),EC50为0.013mg·L-1。除此之外,参考于静亚等[8]浓度的代森锰锌、嘧菌酯及百菌清WP,参考吴玉珠等[7]浓度的多菌灵和唑醚啶酰菌胺,EC50也略有不同。本研究中咪鲜胺、多菌灵、代森锰锌和嘧菌酯其有效中浓置信限与吴玉珠等[7]的结果出现一定重叠,说明其结果有一定可取性,而EC50出现的这些差异可能是病原菌生境和杀菌剂的剂型、复合成分以及生产厂家不同导致。
小孢拟盘多毛孢(P.microspora)主要为害威氏绿绒蒿成株期的叶部,引起黄化褐斑等病症,从而降低光合、影响生长发育,严重时造成叶片脱落。在绿绒蒿培育和种植等方面,应当适当避开小孢拟盘多毛孢潜在寄主范围的植物,减少病原侵染的途径。在面对小孢拟盘多毛孢的防治中,可根据实际情况选择杀菌剂。此外,还应注意在冬、春季做好彻底清园,在5-6月物候期重点关注病害发生情况,避免病害传播。
参考文献 Reference:
[1] 屈 燕,区 智.绿绒蒿属植物国内外研究进展 [J].北方园艺,2012(2):191-194.
[2]喻舞阳,杨紫玲,李佶芸,等.绿绒蒿属植物的园林应用及研究进展 [J].四川林业科技,2020,41(1):115-121.
[3]龚 宇,周蕙祯,陈胡兰.近十年绿绒蒿属药用植物的研究进展 [J].中药材,2020,43(3):758-763.
[4]朱轶慧,刘玉军,毕飞虎,等.红叶石楠叶斑病病原鉴定及其生物学特性研究 [J].植物保护,202 47(5):210-215,235.
[5]石建龙,李玉权,胡琨敏,等.贵州半夏块茎腐烂病病原菌的分离与鉴定 [J].微生物学通报,2015,42(2):289-299.
[6]杨 迪,郑雪玲,黎 鹏,等.女贞褐斑病病原菌的生物学特性及寄主范围测定 [J].南方农业学报,202 52(9):2482-2488.
[7]吴玉珠,陈 娜,胡军华,等.青脆李枯萎病致病菌的分离鉴定及药剂筛选 [J].湖南农业大学学报(自然科学版),2022,48(3):298-304
[8]于静亚,董立坤,王志华,等.石楠叶斑病病原鉴定及对药物敏感性测定 [J].植物病理学报,2017,47(4):440-447.
[9]熊朝伟,阮成江,吴 波,等.玉屏油茶叶枯病病原菌分子鉴定及防治药剂筛选 [J].分子植物育种,2019,17(6):1944-1950.
[10] 韦继光,徐 同,潘秀湖,等.拟盘多毛孢属的分类学研究进展 [J].广西农业生物科学,2006,25(1):78-85.
[11]韦继光,徐 同,郭良栋,等.根据形态学和分子系统学特征界定拟盘多毛孢属的种 [J].广西农业生物科学,2005,24(4):304-313.
[12]MAHARACHCHIKUMBURA S S N,GUO" L D,CHUKEATIROTE E,et al.Pestalotiopsis-morphology,phylogeny,biochemistry and diversity [J].Fungal Diversity,201 50(1):167-187.
[13] CROUS P W,SUMMERELL B A,SWART L,et al.Fungal pathogens of" Proteaceae [J].Persoonia-Molecular Phylogeny and Evolution of Fungi,201 27(1):20-45.
[14]ISMAIL A M,CIRVILLERI G,POLIZZI G.Characterisation and pathogenicity of" Pestalotiopsis uvicola and Pestalotiopsis clavispora causing grey leaf spot of mango (Mangifera indica" L.) in Italy [J].European Journal of Plant Pathology,2013,135(4):619-625.
[15]REN H Y,LI G,QI X J,et al.Identification and characterization of" Pestalotiopsis spp.causing twig blight disease of bayberry (Myrica rubra Sieb.amp; Zucc) in China [J].European Journal of Plant Pathology,2013,137(3):451-461.
[16]KEITH L M,VELASQUEZ M E,ZEE F T.Identification and characterization of Pestalotiopsis spp.causing scab disease of guava,Psidium guajava,in Hawaii [J].Plant Disease,2006,90(1):16-23.
[17]郑 丽,杨兴玉,谢昌平,等.油棕苗期叶斑病的病原鉴定及其生物学特性研究 [J].中国油料作物学报,2014," 36(6):794-801.
[18]陈全助,金亚杰,郭朦朦,等.闽楠叶斑病病原鉴定及其生物学特性测定 [J].植物病理学报,2018,48(3):313-323.
[19]傅 昱,李燕霞,刘婉蓉,等.岗梅枝枯病病原鉴定 [J]." 植物保护,2019,45(3):170-173.
[20]樊炳君,赵玉美,陈俊珠,等.云南核桃叶枯病病原鉴定及其生物学特性 [J].植物保护,2020,46(3):123-130.
[21]秦绍钊,刘文霞,李御企,等.贵州油茶叶枯病病原鉴定研究 [J].农业与技术,2019,39(23):16-17.
[22]尉莹莹,梁 晨,赵洪海,等.华东地区蓝莓采后病害病原鉴定及其多样性分析 [J].山东农业科学,2017,49(7):112-115.
[23]陈南泉,林河通,陈艺晖,等.橄榄小孢拟盘多毛孢(Pestalotiopsis microspora)的生物学特性研究 [J].保鲜与加工,2016,16(3):5-10.
[24]韦继光,徐 同.植物内生拟盘多毛孢的生物多样性 [J].生物多样性,2003,11(2):162-168.
[25]刘 韩,刘应高,李姝江,等.四川松树内生拟盘多毛孢的多样性及其防病效果 [J].西北农林科技大学学报(自然科学版),2015,43(12):41-48,57
[26]谢 津.黑老虎轮斑病的病原鉴定和毒素成分分析及病害防治研究 [D].南宁:广西大学,2020.
[27]管 斌,吕兴萍,徐 超,等.红叶石楠小孢拟盘多毛孢叶斑病化学防治试验 [J].西北林学院学报,2013,28(2):131-135.
[28]廖道林.广西柑橘黄斑落叶病防治药剂筛选 [J].现代园艺,202 44(10):32-33.
[29]阳廷密,张素英,唐明丽,等.广西柑桔黄斑落叶病防治药剂筛选 [J].中国南方果树,2018,47(4):29-31.
Identification of" Pathogen Causing" Meconopsis wilsonii" Leaf Spot and Screening of Fungicides for Control
TIAN Yunjing LU Junjia ZHANG Ziyue 2,YANG Mingguo 2,
LIU Mian 2,YANG" Fazhong3 and GU Xu4
(1.Landscape Architecture and Horticulture Sciences College,Southwest Forestry University,Kunming 650224,
China;2.Key Laboratory of Forest Disaster Warning and Control in Yunnan Province,Kunming 650233,China;
3.College of Chemical Engineering,Southwest Forestry University,Kunming 650504,China;
4.The Biodiversity Research Institute in Yunnan Province,Kunming 65020 China)
Abstract To determine the disease pathogen of" Meconopsis wilsonii and its pathogenicity to different species of plants,and to screen the inhibitory fungicides.It provides a theoretical basis for the scientific prevention and control of M.wilsonii disease.Using the disease leaves of M.wilsonii" collected from the seedling base of Southwest Forestry University as the experimental material,the strains were isolated and purified by the tissue isolation.Koch’s" rule was used to verify the pathogenicity of the strains and identify the strain species of M.wilsonii by morphological observation and molecular biology.And the pathogenicity of the pathogenic bacteria to different species of plants was determined using the isolated leaf inoculation method to determine their host range,and the indoor toxicity of 50% Carbendazim,50% Azoxystrobin,38% Boscalid,50% Prochloraz mangnse,75% Chlorthalonil and 80% Mancozeb to pathogenic bacteria was determined by toxic plate method.The strains were purified from the disease leaves of M.wilsonii,among which the pathogen of M.wilsonii disease was LRH-2.Observe the colony cultured for 7 days were circular whorls,mycelium white,and fusiform conidia have 2-3 accessory filaments.Combined with the rDNA-ITS sequence analysis,a phylogenetic tree was constructed and the strain was found to be clustered in the same branch as Pestalotiopsis microspora (strain number: KT459349).Combining morphological characteristics and ITS sequence analysis,LRH-2 was identified as P.microspora.The pathogenicity of 24 species of plants from 21 families was determined by isolated leaf inoculation method,and the results showed that the pathogenic symptoms of small spores on 13 species of test plants from 12 families appeared to varying degrees during the experimental observation period.The six elow-toxicity fungicides had inhibitory effect on LRH-2.The 50% Carbendazim and 38% Boscalid had more well inhibitory effect on LRH-2 with a concentration (EC50 ) of 0.447 and 0.497 mg·L-1.The pathogenic fungus of M.wilsonii was clearly identified as P.microspora,and the host range of the pathogen is confirmed to be potentially pathogenic to some plants,and its adaptability to the environment is strong,and 50% Carbendazim and 38% Boscalid had good control effect against it.
Key words Meconopsis wilsonii; Leaf spot; Pathogen identification; Pestalotiopsis microspora; Host range; Fungicides; Control effect
Received" 2023-07-26 Returned 2023-10-07
Foundation item The National Natural Science Foundation of China(No.32060695);Talent Training Finance Special Young Talents (Talent Training) of Yunnan Province (No.990122074).
First author TIAN Yunjing,female,master" student.Research area:horticultural plant diseases." E-mail:2111413923@qq.com
Correspondingauthor LU Junjia,female,Ph.D,associate professor.Research area:plant disease control,functional components.E-mail:58826911@qq.com
(责任编辑:郭柏寿 Responsible editor:GUO Baishou)

