耐辐射甲基杆菌JB18对菊苣幼苗生长及抗性的影响




摘要:为探究铅镉抗性菌株JB18对菊苣(Cichorium intybus L)幼苗的影响,在不同铅镉复合浓度胁迫土壤中种植菊苣。将菌株JB18接种到菊苣根部周围,测定菊苣幼苗部分生长指标、光合作用参数、抗氧化酶活性、蔗糖含量、蔗糖代谢酶的活性及基因表达量。结果表明:接种菌株JB18后,提高了菊苣幼苗含水量、抗坏血酸含量、叶绿素含量、胞间CO2浓度、蒸腾速率、净光合速率、过氧化物酶和超氧化物歧化酶活性,显著减少菊苣内丙二醛及铅镉含量。蔗糖合酶、蔗糖磷酸合酶、蔗糖转化酶活性显著提升,菌株JB18促进了叶片中蔗糖积累。RT-qPCR结果显示,受Pb-Cd胁迫并接种JB18的菊苣幼苗中SS和SPS基因的相对表达量与对照组相比,分别上调2.1倍和5.6倍。因此,菌株JB18能够提高受铅镉复合胁迫下菊苣幼苗植株光合作用速率和抗氧化能力,上调蔗糖代谢相关基因的表达,促进蔗糖的积累,提高菊苣幼苗的铅镉抗性。
关键词:菊苣;铅镉抗性;菌株JB18
中图分类号:Q94""" 文献标识码:A"""" 文章编号:1007-0435(2024)08-2505-09
Effects of Methylobacterium radiotolerans JB18 on the Growth and Resistance
of Cichorium intybus L Seedlings
JIN Zhong-min1,2*, LIU Yu-heng1, YUAN Xin-yue1, LIU Bo1, LI Chun-yue1,
LIU Li-jie1,2, QIN Xiang-yu1,2, YU Bao-gang1,2, LI Tie1,2
(1.College of Life Sciences and Agriculture and Forestry,Qiqihar University, Qiqihar, Heilongjiang Province 161006,China;
2.Heilongjiang Provincial Key Laboratory of Resistance Genetic Engineering and Coldland Biodiversity Conservation,
Qiqihar, Heilongjiang Province 161006, China)
Abstract:To investigate the effects of Pb-Cd-resistant strain JB18 on chicory seedlings,chicory was planted in different Pb-Cd composite concentration-stressed soils. Strain JB18 was inoculated around the roots of chicory,photosynthesis parameters,antioxidant enzyme activities,sucrose content,activities of enzymes involved in sucrose metabolism,and expression of related genes in chicory seedlings were determined. The results showed that inoculation with strain JB18 increased water content,ascorbic acid content,chlorophyll content,intercellular CO2 concentration,transpiration rate,net photosynthetic rate,peroxidase and superoxide dismutase activities,and significantly reduced malondialdehyde and Pb-Cd content in chicory seedlings. Sucrose synthase,sucrose phosphate synthase and sucrose converting enzyme activities significantly increased,and strain JB18 promoted sucrose accumulation in leaves. RT-qPCR results showed that the relative expression of SS and SPS genes in chicory seedlings subjected to Pb-Cd stress and inoculated with JB18 was up-regulated by 2.1-fold and 5.6-fold,respectively,compared with the control group. Therefore,strain JB18 was able to increase the photosynthesis rate and antioxidant capacity,up-regulate the expression of genes related to sucrose metabolism,promote the accumulation of sucrose,and improve the Pb-Cd resistance of chicory seedlings subjected to Pb-Cd compound stress.
Key words:Chicory;Pb-Cd resistance;Strain JB18
菊苣(Cichorium intybus L.)作为药食两用的植物,含有丰富的黄酮类化合物、碳水化合物和倍半萜内酯等物质[1],主要用于开发健康创新食品和保健品[2]。菊苣适应性强,并可通过反复刈割增加地上生物量[3],在菊苣叶中,可以检测到促进健康的化合物,如维生素、多酚、蛋白质和矿物质[4],菊苣幼株的主根是人类饮食中公认的益生元菊粉的来源[5]。有研究表明,药用植物的有效性主要与其活性成分有关,药用植物的重金属含量超标是主要质量问题之一,这可能与其生长环境的广泛污染有关[6]。减少作物中重金属含量对确保食品安全生产具有重要意义[7],如何在重金属含量较高的农田中保障菊苣的安全生产,是一个亟需解决的问题。
重金属污染的高毒性和在土壤及作物中积累能力对粮食安全构成严重威胁[8]。据统计,全球每年约有500万吨铅(Pb)排放到环境中,我国约有五分之一耕地受到Pb的污染[9]。Pb会导致自由基失衡而引起氧化应激[10]。Pb对植物的毒性的主要包括叶绿素降解、植物根系生长抑制和生长迟缓[11]。Pb中毒会导致人类心脑血管系统、内分泌系统等疾病发生[12]。我国耕地中的Cd超标率为7%,约2.786×109m2的农业土壤受到镉的污染[13],镉离子在土壤和水中具有流动性,能在土壤中长期循环和生物积累,可被植物吸收[14]。被Pb,Cd污染的植物通过食物链进入人体,使有毒物质在细胞内沉积,破坏蛋白质功能,损害大脑,导致癌症等重大疾病[15]。
微生物能够通过各种细胞和分子机制抵抗金属离子,如生物转化、酶解毒、外排物质产生和金属硫蛋白合成[16],微生物在环境中无处不在,在生物化学循环中发挥着关键作用[17],耐镉菌株添加到含有镉污染的油菜植株的花盆中,发现菌株能有效降低镉的生物毒性[18]。在Pb胁迫下观察到,接种耐铅枯草芽孢杆菌(Bacillus subtilis PbRB3)的绿豆(Vigna radiata)叶片中叶绿素和生物量增加[19]。Pb污染条件下接种丛枝菌根真菌可促进玉米生长,减轻铅对地上部光合作用等生理过程的抑制,提高玉米对Pb的耐受性[20]。本研究利用实验室筛选的铅镉抗性菌株JB18,将其接种至受不同铅镉复合浓度胁迫的菊苣幼苗周围,通过测定菊苣生长、生理生化指标,探讨接种JB18对Pb-Cd复合胁迫下菊苣幼苗的缓解效应,为微生物提高植物铅镉抗性提供理论基础。
1 材料与方法
1.1 土壤处理与供试菌株
菊苣种子由河南华丰草业提供。土壤由齐齐哈尔大学温室提供,将土壤经自然风干,过2 mm网筛。前期试验研究发现,菊苣能在含有铅镉污染的土壤中生长的最高Pb-Cd复合浓度为(1600/160)mg·kg-1,因此,本试验利用硝酸铅和氯化镉配制不同浓度梯度Pb-Cd复合溶液并加入至土壤中,使得土壤中Pb、Cd复合浓度分别为:Pb-Cd [(0/0)mg·kg-1、(200/20)mg·kg-1、(400/40)mg·kg-1、(800/80)mg·kg-1、(1600/160)mg·kg-1],将土壤装入塑料花盆中老化3个月。供试菌株JB18为对铅镉具有较高抗性的耐辐射甲基杆菌(Methylobacterium radiotolerans),GenBank登录号为MZ723900。
1.2 菌悬液的制备
将菌株JB18在牛肉膏蛋白胨培养基中于30℃、200 r·min-1条件下培养24 h后,进行离心、洗涤,再将培养物转移至无菌离心管中,使用无菌去离子水收集菌体2次,制成108 cfu·mL-1的菌悬液。
1.3 盆栽试验
在不同Pb-Cd复合浓度下设置了未接菌处理组(接种无菌水)和菌株处理组(接种菌株JB18),将种子表面清洗和消毒后种植在不同浓度铅镉处理后的土壤中,每盆均匀播种20粒饱满的种子。待菊苣生长4周后,在根部周围接种菌株JB18菌液(108 CFU·mL-1,2 mL)。接种4周后收获,测定菊苣叶片的叶绿素含量、净光合速率(Net photosynthetic rate,Pn)、气孔导度(Stomatal conductance,Gs)、胞间CO2浓度(Intercellular CO2 concentration,Ci)、蒸腾速率(Transpiration rate,Tr)、含水量、株高、丙二醛(Malondialdehyde,MDA)含量、抗坏血酸(Ascorbic acid,AsA)含量、超氧化物歧化酶(Superoxide dismutase,SOD)活性、过氧化物酶(Peroxidase,POD)活性、蔗糖含量、蔗糖合酶活性、蔗糖磷酸合酶活性、蔗糖转化酶活性及相关基因相对表达量。
1.4 指标测定
菊苣生长8周时,在不同处理组中随机选择10株幼苗用株高尺进行测定株高[21],鲜重法测定含水量[21],LI-6400XT便携式光合仪测量菊苣幼苗叶片Pn,Gs,Ci,Tr,比色法测定叶绿素含量[21],氮蓝四唑法测定SOD活性[21]、比色法测定POD活性[21],硫代巴比妥酸法测定MDA含量[21],AsA含量根据Fe3+还原法测定[21],分光光度计法测定蔗糖含量[21],采用电感耦合等离子质谱法(ICP-MS)测定Pb、Cd含量[21],蔗糖合酶活性、蔗糖磷酸合酶、蔗糖转化酶利用试剂盒(北京博奥森生物技术有限公司)测定。
1.5 RT-qPCR分析
以生长8周的菊苣叶片为试验材料。根据生理指标和蔗糖相关酶活性的变化趋势,发现在Pb-Cd(400/40)mg·kg-1浓度下变化较为显著,特设置无重金属胁迫未接种JB18的对照组(CK)、无重金属胁迫接种JB18(JB18)、Pb-Cd(400/40)mg·kg-1胁迫未接种JB18(HM)和存在Pb-Cd(400/40)mg·kg-1胁迫并接种JB18 (HM-JB18)四个处理组,选择参与蔗糖代谢途径的蔗糖合酶基因(SS)、蔗糖磷酸合酶基因(SPS)和蔗糖转化酶基因(INV),特异性引物见表1,利用CFX96孔板,使用ChamQ Universal SYBR qPCR Master Mix(Vazyme)进行荧光定量PCR,各处理重复三次,使用2-ΔΔCt法计算基因的相对表达水平。
1.6 数据处理
利用Excel 2021进行数据处理,GraphPad Prism 9.3.0图表处理,利用SPSS 26软件对数据进行方差分析(ANOVA),差异显著性在Plt;0.05水平上具有统计学意义。
2 结果与分析
2.1 JB18对Pb-Cd胁迫下菊苣幼苗生长的影响
随着Pb-Cd浓度上升,植株含水量及株高逐渐下降,与未接菌处理组相比,接种菌株JB18后,菊苣叶片含水量显著提高(Plt;0.01,图1A),Pb-Cd(200/20)mg·kg-1接种组中含水量相比未接种菌株JB18处理组提高率最大,为1.6%。在较高Pb-Cd胁迫浓度下菊苣株高显著提高(Plt;0.05,图1B),在Pb-Cd(1600/1600)mg·kg-1处理组株高提高了24.6%。
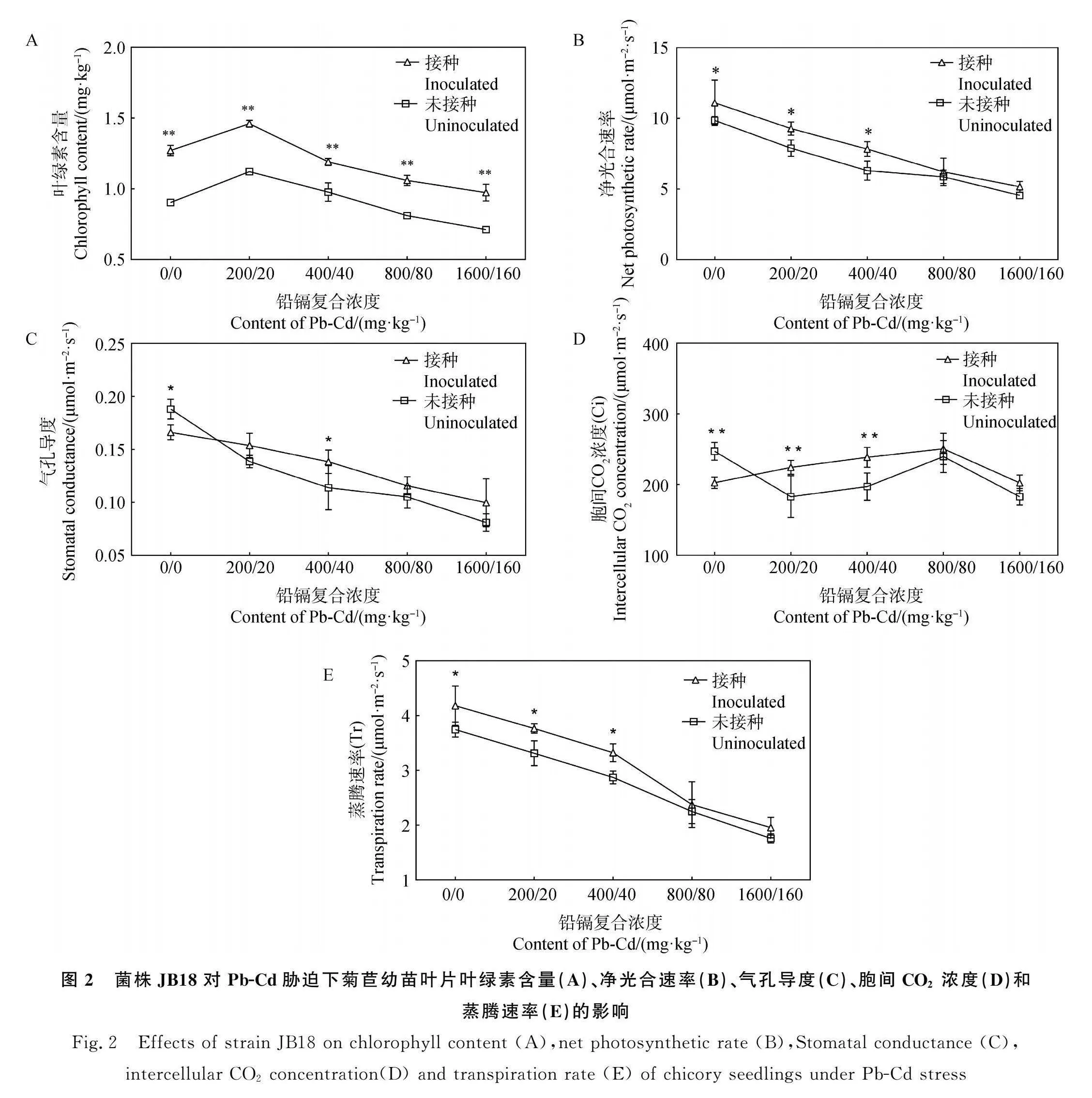
2.2 JB18对Pb-Cd胁迫下菊苣幼苗光合作用参数的影响
植株的叶绿素含量在铅镉复合胁迫下呈低浓度促进高浓度抑制现象(图2A),Pb-Cd(200/20)mg·kg-1处理组中叶绿素含量最高,与未接菌相比,提升了41.1%,植株在Pb-Cd(200/20)mg·kg-1、Pb-Cd(400/40)mg·kg-1胁迫下其Pn被显著提升(Plt;0.05,图2B);菊苣幼苗的Pn、Gs、Tr随Pb-Cd浓度增高而逐渐降低(图2B、2C、2E),其中在Pb-Cd(400/40)mg·kg-1浓度处理中,接种JB18后,Gs显著提升(Plt;0.05,图2C);同时菌株JB18可改善Pb-Cd胁迫对菊苣幼苗叶片中Ci下降的现象(图2D),还显著提高了低浓度Pb-Cd胁迫下菊苣幼苗叶片的Tr(Plt;0.05,图2E)。
2.3 JB18对Pb-Cd胁迫下菊苣幼苗抗氧化系统的影响
在Pb-Cd(0/0)mg·kg-1至Pb-Cd(400/40)mg·kg-1浓度胁迫下,接种菌株JB18后,菊苣幼苗叶片SOD活性、POD活性显著高于未接菌处理组(Plt;0.05,图3A、3C),MDA含量显著低于未接菌处理组(Plt;0.05,图3B)。菊苣幼苗的ASA含量随Pb-Cd浓度增高而降低,接种JB18后植株ASA含量显著提高(Plt;0.05,图3D)。
2.4 JB18对Pb-Cd胁迫下Pb和Cd含量的影响
由图4可知,菊苣幼苗地上部和根部Pb和Cd含量随Pb和Cd处理浓度升高而显著增加,且根部Pb和Cd含量远大于地上部,说明Pb和Cd主要在植株根部积累。在Pb-Cd(200/20)mg·kg-1处理下,JB18显著降低地上部Pb和Cd含量(Plt;0.05)与未接种相比分别降低了53.2%和26.3%,根部Pb和Cd含量与未接种相比分别降低54.1%和35.5%。
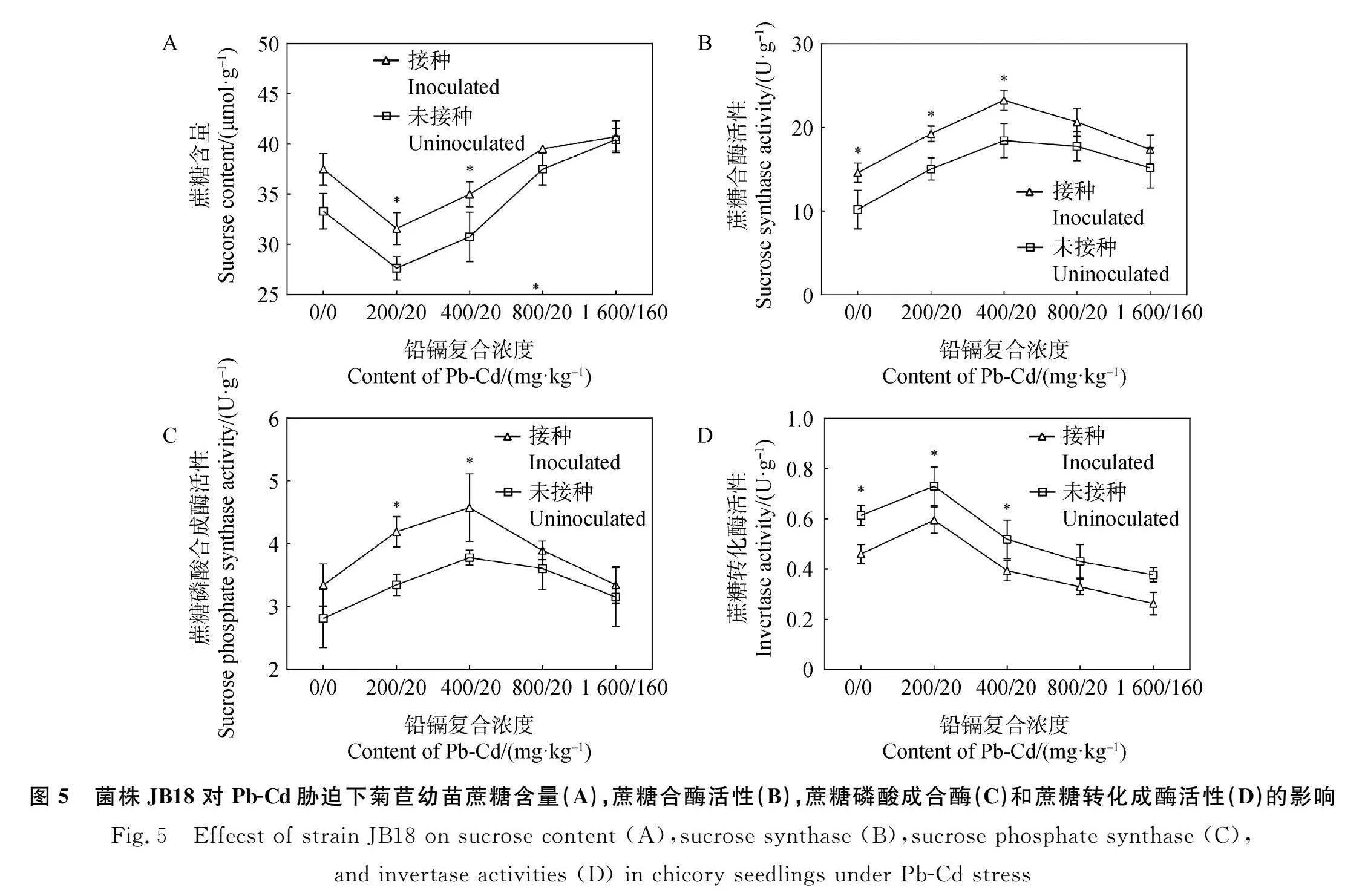
2.5 JB18对Pb-Cd胁迫下菊苣幼苗蔗糖含量及代谢酶活性的影响
菊苣幼苗的蔗糖含量随Pb-Cd浓度的增加呈现先降低后上升的趋势,接种菌株JB18后,在Pb-Cd(200/20)mg·kg-1、Pb-Cd(400/40)mg·kg-1处理下,叶片蔗糖含量显著提高(Plt;0.05),分别提高了14.2%,13.7%(图5A);蔗糖合酶活性也显著提升,分别提高了27.9%和16.3%(Plt;0.05,图5B);Pb-Cd胁迫下菊苣幼苗叶片蔗糖磷酸合酶活性和蔗糖转化酶活性随Pb-Cd浓度的提高而先上升再下降,接种JB18后,蔗糖磷酸合酶、蔗糖转化酶活性在较低胁迫浓度下变化显著(Plt;0.05,图5C-5D)。
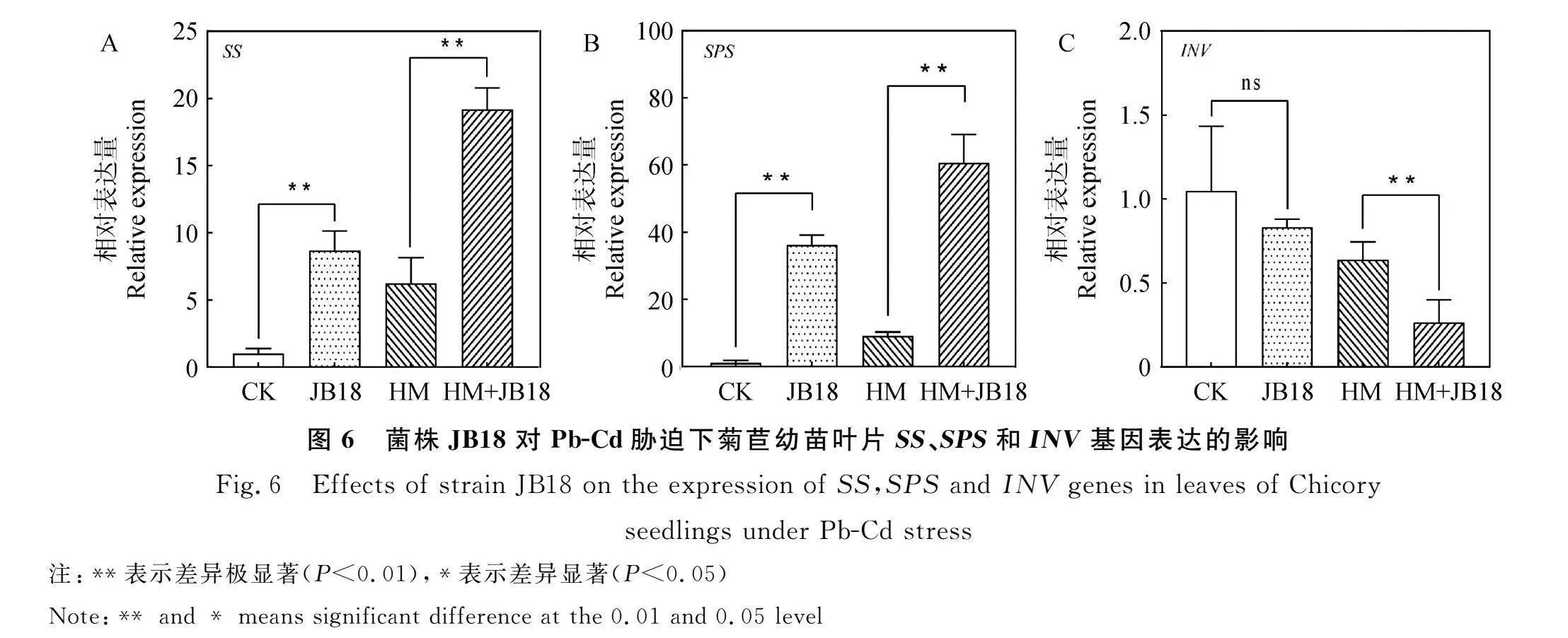
2.6 RT-qPCR结果分析
如图6所示,接种JB18后SS和SPS基因的相对表达量极显著上调(Plt;0.01,图6A-6B),与CK处理组比,分别上调了8.4倍和23.7倍,INV基因的相对表达量与CK处理组无明显差异(图6C);HM+JB18处理组中SS和SPS基因的相对表达量与HM处理组相比,分别上调2.1倍和5.6倍,INV基因显著下调(Plt;0.05,图6C)。
3 讨论
3.1 JB18对Pb-Cd胁迫下菊苣幼苗生长的影响
重金属污染会影响植物正常生理活动,铅镉胁迫会导致植株生长发育受限,根系黑化和绿叶数量面积减少等现象[22]。本试验中,接种菌株JB18后,菊苣植株含水量升高,这可能是由于细胞通过主动增加溶质,降低渗透势,提高吸水和保水能力[23]。菊苣株高受铅镉浓度影响较大,株高随铅镉浓度上升逐渐降低,说明铅镉离子抑制植株的地上部分伸长。接种菌株JB18后株高增加,这可能与细菌的促生特性的累积效应有关。有研究表明耐辐射甲基杆菌能降解除草剂异种生物,降解戊唑醇,具有抗重金属能力,产生ACG脱氨酶、有机酸、铁载体、赤霉素等促进植物生长的激素相互叠加共同促进植物生长[24-25]。耐重金属细菌通过离子交换、络合和沉淀降低了重金属的生物有效性,将有毒重金属由高毒性转化为毒性较小且不能移动的重金属[26]。
3.2 JB18对Pb-Cd胁迫下菊苣幼苗光合作用参数的影响
光合作用作为植物提供生长营养的主要作用途径,光合作用能力的强弱会影响植株的生长[27]。本研究表明,菊苣幼苗受到铅镉胁迫时,叶绿素含量表现为低浓度增加,高浓度降低的现象。在铅镉铜锌复合胁迫下,牧草中的叶绿素含量随着重金属浓度的增强也呈现低浓度增加,高浓度降低的现象[28]。低浓度Pb-Cd可能激发了植物的应急保护机制导致叶绿素含量上升,过量的Pb-Cd复合浓度会阻止Mg2+与叶绿体的结合减少叶绿素含量[29]。接种菌株JB18后,菊苣幼苗叶绿素含量明显提高,提升了菊苣幼苗在低浓度胁迫下的气孔开放程度,胞间CO2浓度,减缓Pn和Ci下降速率,这说明JB18在一定程度上能够缓解重金属对光合作用的不利影响。
3.3 JB18对Pb-Cd胁迫下菊苣幼苗抗氧化系统的影响
植物在受到重金属污染后,细胞内电子运输过程遭到破坏,影响酶活性,诱导活性氧过量合成、堆积,导致氧化损伤[30]。MDA含量与Pb-Cd浓度的增强成正比,铅镉浓度上升会导致膜脂质过氧化,代谢酶活性受抑制[31]。抗氧化酶系统可保护细胞,缓解毒性影响[32]。接种菌株JB18后,幼苗中MDA含量降低,部分处理组SOD,POD活性显著上升,因此菌株JB18可改善植物抗氧化系统抵抗铅镉胁迫。AsA是不可缺少的细胞氧化还原缓冲剂,AsA-GSH循环在维持氧化还原稳态以减轻氧化损伤方面发挥重要作用[33]。本试验发现,菊苣幼苗叶片中抗坏血酸含量与Pb-Cd浓度成反比,可能是AsA在清除活性氧的过程中会氧化成脱氢抗坏血酸(DHA),而脱氢抗坏血酸还原酶(DHAR)受重金属离子影响活性下降,最后导致AsA还原率降低。接种菌株JB18后,ASA含量显著提高。研究表明接种Pseudomonasaeruginosa和Burkholderia gladioli可提高Cd处理下DHAR和GR活性[34],导致AsA含量的增加。因此JB18很有可能通过提高DHAR及GR的活性而提高ASA含量,进而缓解铅镉胁迫的负面影响。
3.4 JB18对Pb-Cd胁迫下Pb和Cd含量的影响
重金属抗性菌株对减少植物体内重金属积累具有重要意义。一些细菌被证明可吸附土壤重金属,进而减少植物对重金属的积累。Naveed等[35]研究表明,在含Pb土壤中生长的绿豆根、茎和籽粒中的Pb含量较高,而接种了伯克霍尔德氏菌(Burkholderia phytofirmans PsJN)后,绿豆组织(根、茎和籽粒)对Pb的吸收降低,这可能是菌株PsJN通过形成金属结合蛋白和/或通过细胞内吸收Pb而降低了Pb的利用率。本研究中,接种菌株JB18后,与未接种相比,菊苣地上部分和根部铅镉含量降低,说明JB18的施用会干扰幼苗的吸收能力,显著降低植株Pb和Cd积累,这可能是由于细菌细胞表面吸附和固定了Pb和Cd[36],或者是细菌接种后根际土壤小团聚体比例增加,吸附了土壤中较多的Pb和Cd[37]。
3.5 JB18对Pb-Cd胁迫下菊苣幼苗蔗糖含量及代谢酶活性的影响
蔗糖作为支持植物体内代谢活动的主要能量物质,可调节逆境胁迫下的信号传导过程。其合成受到多种基因的调控[38],蔗糖合酶是蔗糖合成的关键酶和限速酶[39],它介导蔗糖和二磷酸腺苷(ADP)可逆转换为果糖和腺苷二磷酸葡萄糖(ADPG)[40]。蔗糖磷酸合酶在光合细胞中蔗糖的产生中起核心作用,它催化UDP葡萄糖和果糖-6-磷酸转化为蔗糖-6-磷酸[41]。本试验中,菌株JB18能够在Pb-Cd(200/20)mg·kg-1和Pb-Cd(400/40)mg·kg-1浓度胁迫下显著促进菊苣幼苗叶片蔗糖含量积累,接种菌株JB18后菊苣蔗糖合酶活性、蔗糖磷酸合酶活性、蔗糖转化酶活性均高于未接菌的对照组;RT-qPCR结果显示菊苣叶片在Pb-Cd胁迫并接种菌株JB18条件下,SS和SPS基因的相对表达量显著上调,INV基因相对表达量显著下调,这与王日明等逆境胁迫下结果相似[42]。JB18可能通过上调菊苣幼苗叶片的SS和SPS基因,下调INV基因表达,提高蔗糖合酶和蔗糖磷酸合酶活性、降低蔗糖转化酶活性,从而增加蔗糖在叶片中的积累。同时也有研究表明Ahmed从番茄根际分离得到一株Cunninghamella bertholletiae,可以通过提升碳水化合物来调节植物的铅镉胁迫[43]。菌株JB18有提升菊苣幼苗蔗糖含量和相关蔗糖代谢酶活性的能力,说明菌株JB18可加强叶片的蔗糖积累来调节菊苣的铅镉胁迫。
4 结论
接种菌株JB18能够显著提升植株含水量,增加叶片中叶绿素含量、胞间CO2浓度、蒸腾速率、气孔导度及光合速率,调节蔗糖代谢相关基因的表达,提高蔗糖代谢酶活性,促进植株蔗糖含量的积累,提高抗氧化系统能力,增强菊苣幼苗的铅镉抗性,从而缓解铅镉污染对菊苣幼苗生长的抑制。
参考文献
[1] PATHAK A,SINGH S P,TRIPATHI A M,et al. Cichorium intybus:A review on its medicinal importance[J]. Journal of Veterinary Pharmacology and Toxicology,2022,21(1):1-8
[2] WAN X H,GUO H,LIANG Y Y.et al. The physiological functions and pharmaceutical applicationsof inulin:A review[J]. Carbohydrate Polymers,2020,246(20):116589
[3] GHOLAMI H,FARD F R,SAHARKHIZ M J,et al. Yield and physicochemical properties of inulin obtained from Iranian chicory roots under vermicompost and humic acid treatments[J]. Industrial Crops and Products,2018,123:610-616
[4] PEROVIC′ J,SˇAPONJAC V T,KOJIC′ J,et al. Chicory(Cichorium intybus L.)as a food ingredient-Nutritional composition,bioactivity,safety,and health claims:A review[J]. Food chemistry,2021,336:127676
[5] MOSCATELLO S,BATTISTELLI A,MATTIONI M,et al. Yield,Fructans Accumulation,and Nutritional Quality of Young Chicory Plants as Related to Genotype and Nitrogen Fertilization[J]. Agronomy,2023,13(7):1752
[6] BQYE H,HYMETE A. Levels of heavy metals in common medicinal plants collected from environmentally different sites[J]. Middle East Journal of Scientific Research,2013,13(7):938
[7] 徐梦琪,杨文弢,杨利玉,等. 黔西北山区耕地重金属健康风险评价及环境基准[J]. 环境科学,2022,43(7):3799-3810
[8] ATUCHIN V V,ASYAKINA L K,SERAZETDINOVA Y R,et al. Microorganisms for Bioremediation of Soils Contaminated with Heavy Metals[J]. Microorganisms,2023,11(4):864
[9] SUN L J,GONG P,SUN Y F,et al. Modified chicken manure biochar enhanced the adsorption for Cd2+ in aqueous and immobilization of Cd in contaminated agricultural soil[J]. Science of the Total Environment,2022(851):158252
[10]PRIYADARSHANEE M,DAS S. Biosorption and removal of toxic heavy metals by metal tolerating bacteria for bioremediation of metal contamination:A comprehensive review[J]. Journal of Environmental Chemical Engineering,2021,9(1):104686
[11]MALIK B,PIRZADAH T B,TAHIR I,et al. Lead and aluminium-induced oxidative stress and alteration in the activities of antioxidant enzymes in chicory plants[J]. Scientia Horticulturae,2021(278):109847
[12]姚智卿.铅对人体健康的危害[J]. 微量元素与健康研究,2011,28(5):67-68
[13]SUN L J,GONG P,SUN Y F,et al. Modified chicken manure biochar enhanced the adsorption for Cd2+ in aqueous and immobilization of Cd in contaminated agricultural soil[J]. Science of the Total Environment,2022,851:158252
[14]IORI V,GAUDET M,FABBRINI F,et al. Physiology and genetic architecture of traits associated with cadmium tolerance and accumulation in Populus nigra L[J]. Trees,2016(30):125-139
[15]YUAN W Z,YANG N,LI X K. Advances in understanding how heavy metal pollution triggers gastric cancer[J]. BioMed research International,2016(10):7825432
[16]MATHIVANAN K,CHANDIRIKA J U,MATHIMANI T,et al. Production and functionality of exopolysaccharides in bacteria exposed to a toxic metal environment[J]. Ecotoxicology and Environmental Safety,2021,208:111567
[17]DAS S,LYLA P S,KHAN S A.Marine microbial diversity and ecology:importance and future perspectives[J].Current Science,2006:1325-1335
[18]MA B,SONG W,ZHANG X,et al. Potential application of novel cadmium-tolerant bacteria in bioremediation of Cd-contaminated soil[J]. Ecotoxicology and Environmental Safety,2023,255:114766
[19]ARIf M.S,YASMEEN T,SHAHZAD S M,et al. Lead toxicity induced phytotoxic effects on mung bean can be relegated by lead tolerant Bacillus subtilis (PbRB3)[J]. Chemosphere,2019,234:70-80
[20]杨怡森,孙晨瑜,马俊卿,等. 玉米接种丛枝菌根真菌后对土壤铅污染的耐受效应[J]. 生态与农村环境学报,2023,39(10):1316-1322
[21]苍晶.植物生理生化实验原理与技术[M]. 北京:高等教育出版社,2013:148-151
[22]FAZAL H,TARIQ A. A mini review on lead(Pb)toxicity in plants[J]. Journal of Biology and Life Science,2015,6(2):91-101
[23]曾秀存,许耀照,张芬琴,等. 两种基因型龙葵对镉胁迫的生理响应及镉吸收差异[J]. 农业环境科学学报,2012,31(5):885-890
[24]PHOTOLO M M,SITOLE L,MAVUMENGWANA V,et al. Genomic and physiological investigation of heavy metal resistance from plant endophytic Methylobacterium radiotolerans MAMP 4754,isolated from Combretum erythrophyllum[J]. International Journal of Environmental Research and Public Health,2021,18(3):997-1009
[25]PROMBUNCHACHAI T,NAKAEW N,CHIDBUREE A,et al. Effect of Methylobacterium radiotolerans ED5-9 with capability of producing indole-3-acetic acid (IAA) and 1-aminocyclopropane-1-carboxylic acid deaminase on the growth and development of Murdannia loriformis (Hassk.) Rolla Rao amp; Kammathy under in vitro condition[J]. Naresuan University Journal:Science and Technology,2017,25(2):21-31
[26]SABIR A,NAVEED M,BASHIR M A,et al. Cadmium mediated phytotoxic impacts in Brassica napus:Managing growth,physiological and oxidative disturbances through combined use of biochar and Enterobacter sp. MN17[J]. Journal of Environmental Management,2020,265:110522
[27]王建秋,曹子林,王晓丽,等.铅胁迫对滇白前生长、光合作用及叶绿素荧光的影响[J]. 草地学报,2021,29(11):2422-2427
[28]邹文桐,王艳君,曹智,等. 不同种植模式下重金属污染对牧草叶片光合特性和重金属含量的影响[J]. 热带亚热带植物学报,2021,29(1):31-40
[29]ANKET S,VINOD K,BABAR S,et al. Photosynthetic response of plants under different abiotic stresses:A review[J]. Journal of Plant Growth Regulation,2019,39(2):509-531
[30]HEYNO E,KLOSE C,KRIEGER-LISZKAY A.Origin of cadmium-induced reactive oxygen species production:mitochondrial electron transfer versus plasma membrane NADPH oxidase[J].New Phytologist,2008,179(3):687-699
[31]杜雪,彭玉兰,张新彤,等. 重金属铜、锌对火炬树幼苗生长及生理指标的影响[J]. 西南农业学报,2022,35(6):1407-1414
[32]金忠民,李春月,刘本松,等. 菌株JB12影响铅镉胁迫下菊苣黄酮合成的转录组分析[J]. 草地学报,2023,31(06):1648-1655
[33]QIN S,LIU H,NIE Z,et al. AsA-GSH cycle and antioxidant enzymes play important roles in Cd tolerance of wheat[J]. Bulletin of Environmental Contamination and Toxicology,2018,101(5):684-690
[34]KHANNA K,JAMWAL V L,KOHLI S K,et al. Plant growth promoting rhizobacteria induced Cd tolerance in Lycopersicon esculentum through altered antioxidative defence expression[J]. Chemosphere,2019,217:463-474
[35]NAVEED M,MUSTAFA A,AZHAR S Q T A,et al. Burkholderia phytofirmans PsJN and tree twigs derived biochar together retrieved Pb-induced growth,physiological and biochemical disturbances by minimizing its uptake and translocation in mung bean (Vigna radiata L.)[J]. Journal of Environmental Management,2020,257:109974
[36]JIN Z M,DENG S Q,WEN Y,et al. Application of Simplicillium chinense for Cd and Pb biosorption and enhancing heavy metal phytoremediation of soils[J]. Science of the Total Environment,2019,697:134148
[37]HAN H,SHENG X,HU J,et al. Metal-immobilizing Serratia liquefaciens CL-1 and Bacillus thuringiensis X30 increase biomass and reduce heavy metal accumulation of radish under field conditions[J]. Ecotoxicology and Environmental Safety,2018,161:526-533
[38]高慧兵,郁培义,孙宇靖,等. 铅锌胁迫下蓖麻叶糖代谢规律及相关酶基因差异表达分析[J]. 植物生理学报,2019,55(4):483-492
[39]DOEHLERT D C,HUBER S C. Regulation of spinach leaf sucrose phosphate synthase by glucosephosphate,inorganic phosphate,and pH[J]. Plant Physiol,1983,73(4):989-994
[40]KATHARINA S,ALEXANDER G,MARGO D,et al. Sucrose synthase:A unique glycosyltransferase for biocatalytic glycosylation process development[J]. Biotechnology Advances,2016,34(2):88-111
[41]SHEN J,XU Y,YUAN S,et al. Genome-Wide Identification of GmSPS Gene Family in Soybean and Expression Analysis in Response to Cold Stress[J]. International Journal of Molecular Sciences,2023,24(16):12878
[42]王日明,王志强,向佐湘,等. γ-氨基丁酸对高温胁迫下黑麦草光合特性及碳水化合物代谢的影响[J]. 草业学报,2019,28(2):168-178
[43]KAZEROONI E A,MAHARACHCHIKUMBURA S S N,ALSADI A M,et al. Effects of the rhizosphere fungus cunninghamella bertholletiae on the Solanum lycopersicum response to diverse abiotic stresses[J]. International Journal of Molecular Sciences,2022,23(16):8909
(责任编辑 刘婷婷)

