红豆草种质资源研究进展

摘要:红豆草(Onobrychis viciaefolia)是一种多年生豆科草本植物,产量高,富含蛋白质、粗脂肪、矿物质和氨基酸等牲畜所需的多种营养物质,适口性好、抗逆性强,素有“牧草皇后”之美誉。红豆草因富含缩合单宁而具有预防臌胀病的功能,是一种优良的豆科牧草,红豆草还具有生物固氮、改善土壤、保护生态环境等作用,在我国畜牧业发展和生态建设中发挥着重要作用。本文总结了红豆草的生物学特性、地域分布和种植栽培,特别是近年来国内外在红豆草种质资源产量、抗性和品质评价方面的研究进展,以及这些重要性状的分子机制研究,并提出存在的主要问题与展望,以期为红豆草种质资源的深入研究利用提供参考。
关键词:红豆草;抗逆性;遗传转化;生物学特征
中图分类号:S541""" 文献标识码:A"""" 文章编号:1007-0435(2024)08-2346-11
Research Progress on Germplasm Resources of Sainfoin (Onobrychis viciaefolia)
HUANG Hai-jun1, ZHANG Yu-qi1, DU Wen-xuan1, KONG Wei-ye2, SHEN Guo-an3,
LIU Ya-ling4, PANG Yong-zhen1*
(1. Institute of Animal Sciences of Chinese Academy of Agricultural Sciences, Beijing 100193, China; 2. College of Grassland
Science, Qingdao Agricultural University, Qingdao, Shandong Province 266109, China; 3. Chinese Academy of Medical Sciences,
Institute of Medicinal Pant Development, Beijing 100193, China;4. National Center of Pratacultural Technology Innovation
(under preparation), Hohhot, Inner Mongolia 010070, China)
Abstract:Onobrychis viciaefolia (sainfoin) is a perennial leguminous herbaceous plant with high yield,which is rich in various nutrients required by livestock such as protein,crude fat,minerals,and amino acids. Sainfoin has good palatability and strong stress resistance,and is known as “the Queen of Forage”. Sainfoin also functions in nitrogen fixation,soil improvement,and protection of ecological environment. Sainfoin is rich in condensed tannins,which functions in preventing bloat disease. Sainfoin is an excellent legume forage,and it plays an important role in the development of animal husbandry and ecological construction in China. This article summarizes the biological characteristics,ecological distribution,and cultivation of sainfoin,especially the research progress in the evaluation of yield,resistance,and quality of sainfoin germplasm resources both at home and abroad in recent years,as well as progress on the molecular mechanism of these important traits. The main problems and prospects are proposed,in order to provide reference for the in-depth investigation and utilization of sainfoin.
Key words:Sainfoin;Resistance;Genetic transformation;Biological characteristics
1 红豆草概况
红豆草(Onobrychis viciaefolia Scop.)又名驴喜、驴食豆和圣车轴草,是蝶形花亚科驴食草属的多年生豆科牧草,多数为野生种。红豆草根系强大,具有丰富的侧根,在侧根、根毛上着生着大量的根瘤,具有很强的固氮能力[1];红豆草主茎直立,茎粗且中空,茎壁光滑,分枝数多;叶长圆形,深绿色,叶量丰富,叶背和叶缘具有白色短茸毛。红豆草的花为蝶形花,总状无限花序;花冠粉红色、略带紫色或白色,花具有丰富的蜜腺,是一种理想的绿化、园艺和观赏的蜜源植物[2-3]。红豆草荚果扁平、黄褐色,表面具有突起网状脉,荚果边缘呈锯齿状或无锯齿,表面无毛或具短柔毛;种子为半圆形或肾形,千粒重为13~16 g,带荚千粒重约21 g,种皮坚硬,休眠率高,种子硬实率常达4%~20%[4]。
红豆草地域分布比较广,主要分布于欧洲、中亚、西亚以及非洲北部[5],伊朗被认为是红豆草基因多样性中心[6]。红豆草的栽培起源于法国,我国最早种植的红豆草是1944年从英国引入的普通红豆草,20世纪40年代后又从原苏联、加拿大、美国等引入[7-9]。‘普通’红豆草(Onobrychis viciaefolia Scop.)是我国的主要栽培品种,主要种植于我国的甘肃、山西、陕西、内蒙古、青海等地[10]。我国还有部分红豆草野生种分布在新疆天山北坡海拔1000~2000 m的半阴坡处[11],分别是‘小花’红豆草(Onobrychis micrantha)、‘顿河’红豆草(Onobrychis tanaitica)、‘高加索’红豆草(Onobrychis transcaucasica)和‘美丽’红豆草(Onobrychis pulchella)[12]。目前我国种植的主要红豆草品种有‘普通’红豆草、‘沙生’红豆草(Onobrychis viciaefolia arenaria)、‘雷蒙特’红豆草(Onobrychis viciaefolia ‘reymont’)、‘埃斯基’红豆草(Onobrychis transcaucasica)[13]。我国目前自主培育的红豆草有以下几个地方品种(表1),分别是甘肃农业大学和甘肃省草原总站陈宝书等于1990年选育成的‘甘肃’红豆草(Onobrychis viciaefolia ‘Gansu’)[14],内蒙古农牧学院乌云飞等于1995年由‘麦罗斯’红豆草(Onobrychis viciaefolia ‘Melrosa’)为材料混合选育出的抗寒品种‘蒙农’红豆草(Onobrychis viciaefolia ‘Mengnong’)[15],新疆奇台县草原工作站张鸿书等于2007年选育成的‘奇台’红豆草(Onobrychis viciaefolia ‘Qitai’)[16],以及由甘肃省草原技术推广总站高占琪等2022年选育出的‘草红1号’红豆草(Onobrychis viciaefolia ‘Caohong 1’)。
2 红豆草遗传多样性研究
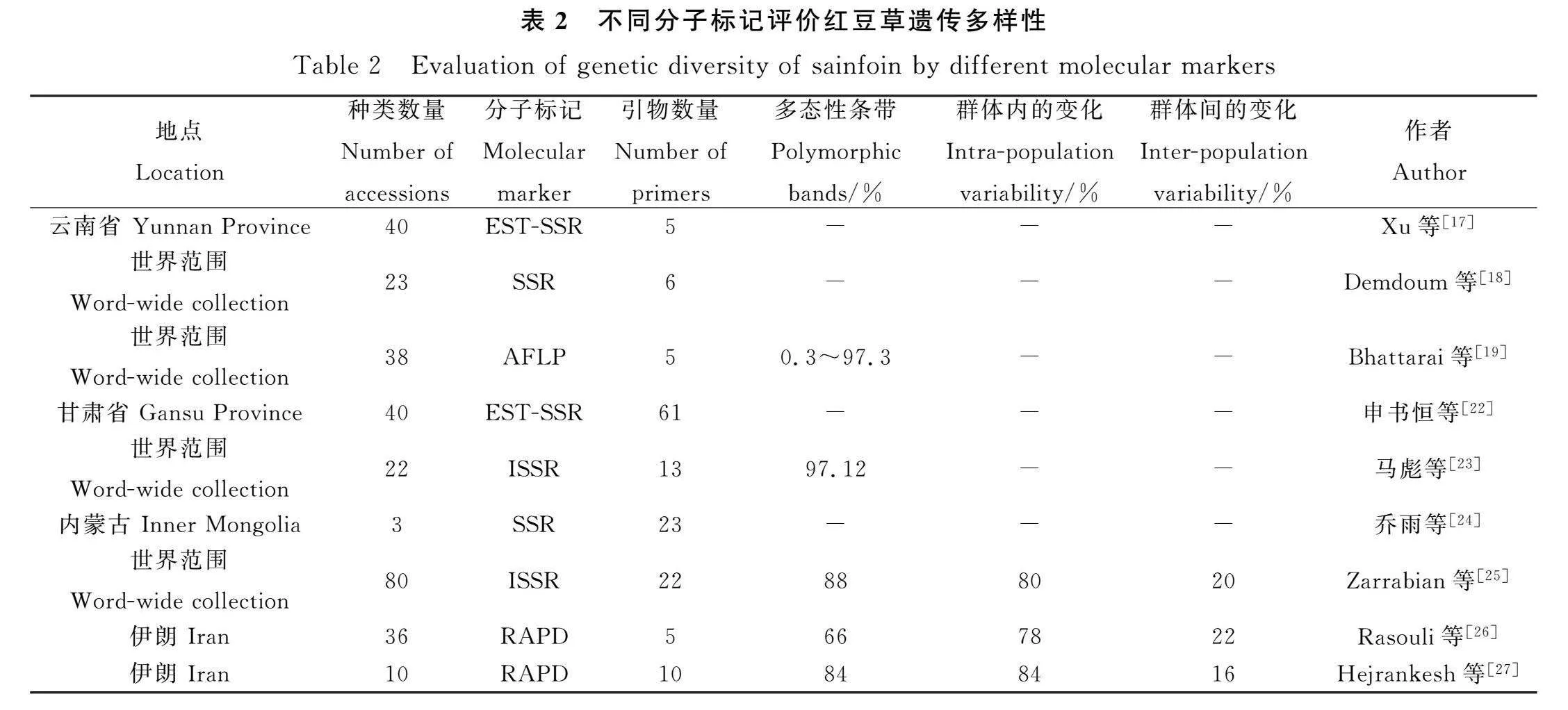
当前,红豆草种质资源的遗传多样性研究与发掘利用尚不够深入,主要依赖于简单序列重复(Simple sequence repeat,SSR) 和简单序列重复间(Inter-Simple sequence repeat,ISSR)等传统的遗传标记方法。尽管这些技术都能在一定程度上分析红豆草材料的遗传多样性,但仅依赖单一的遗传标记方法有时难以全面揭示其内在的遗传变异和多样性关系。
例如,Xu等学者采用61对EST-SSR引物,对来自五个不同地区的40个野生红豆草单株进行了遗传背景研究,揭示了种群间不同程度的基因交流[17]。Demdoum等人则运用SSR引物,成功构建了23份野生红豆草材料的指纹图谱,并发现其基因型与地理分布密切相关,尤其是来自英国材料与东欧材料之间存在较远的亲缘关系[18]。Bhattarai等人通过扩增片段长度多态性(Amplified fragment length polymorphism,AFLP)引物对全球38份红豆草种质资源进行了遗传变异研究,结果表明品种内的遗传变异程度较高[19]。Avci等则从其他豆科植物中筛选出适用于红豆草的SSR引物,为物种多样性的保护和新品系培育提供了支持[[20]。Mora-Ortiz等对5份不同来源的红豆草种质资源进行了测序,并通过系统发育分析揭示了其与红三叶和紫花苜蓿的近缘关系,为后续的遗传研究提供了丰富的遗传多态性来源[21]。在国内,陶彦彤针对抗寒型红豆草品系进行了SSR遗传多样性分析,成功将不同品系进行了聚类[13]。申书恒等人通过EST-SSR扩增条带测序,验证了红豆草作为同源四倍体的特性[22]。马彪等人利用ISSR分子标记技术,将22份国内外红豆草种质资源划分为四大类群,揭示了显著的遗传差异[23]。乔雨等人的研究进一步指出,蒙农红豆草的SSR位点具有高频多态性,为基因定位和分子标记辅助育种提供了潜力[24]。
尽管对红豆草的分子标记研究已取得显著进展,但当前使用的标记技术仍相对单一,新型分子标记如单核苷酸多态性(Single nucleotide polymorphisms,SNP)等尚未得到广泛应用。因此,有必要进一步开发更准确、高效的遗传标记,以深入剖析红豆草种质资源的重要性状,挖掘与高产、优质、高抗相关的基因,实现优良基因的定位。这将为红豆草种质资源的保护和合理利用提供坚实的遗传学支撑,推动红豆草产业的可持续发展。
3 红豆草的产量研究
红豆草的产量受到多种因素的影响,包括品种差异、生长年限、生长环境以及栽培管理策略等。在甘肃省武威市,郭博等人的研究表明,普通红豆草在该地区的气候条件下显示出最高的产草量,经过四年的种植,其亩(1亩=0.067 hm-2)产鲜草量可达约3900 kg,尤其在结荚期产草量达到最大,而一年刈割三茬时其产草量最高[28]。此外,李建伟在甘肃省临潭县的高寒山区进行了种植试验,发现红豆草及其相关品种如甘肃红豆草、‘甘农一号’苜蓿等,均因其高营养价值、高产量和强适应性而适合在该地区种植,有助于改善退化的草坪并建设人工草坪[29]。Zhou等人的研究进一步证实了红豆草的高产能和优质特性,且多数情况下其性能优于苜蓿[30]。高占琪等人则针对高寒牧区的红豆草进行了产草量和营养物质的评价,指出盛花期为最佳利用期[31]。付萍等人在甘肃省二阴地区的研究揭示了红豆草在该区域的适应性,每年可刈割两次,平均年干草产量达到11 976 kg·hm-2,显示了其作为牧草推广种植的潜力[32]。
针对高寒山区的特殊环境,曹国顺等人在甘肃夏河县进行的种植试验表明,红豆草在前三年内的鲜草产量平均为87 540 kg·hm-2,体现了其高产特性[33]。孙玉兰对国内外红豆草材料的评价揭示了其在盛花期具有最佳的鲜草和干草产量,同时指出结荚期时茎叶比、干鲜比、株高和生长速度达到最大[34]。南丽丽等人的研究则聚焦于红豆草新品系P1,P2和P3,分析显示这些新品系具有优良的综合性能[35]。宋书红等人的研究发现,红豆草在现蕾期具有较高的产量和营养价值,推荐在第一茬时刈割[36-37]。朱兴运等人的对比研究则显示,红豆草在第二年盛花期的干草产量比同条件下种植的苜蓿高出30%,且蛋白质含量和多种氨基酸含量也更高[38]。韩德林在青海省同仁县的研究进一步证实了红豆草在该地区的种植优势,其生长速度和产草量在灌溉条件下显著高于紫花苜蓿[39]。
红豆草的栽培管理以基肥为主,追肥为辅。卡米拉等人的研究表明,适量施用有机肥料和过磷酸钙作为底肥,并在土壤贫瘠的地区加施硝酸铵,可以有效提升红豆草的产量和品质[40]。尽管红豆草在我国豆科饲草中种子生产规模位居第二(种子产量为0.18万t),但其产种量仍与紫花苜蓿有差距[41],说明我国红豆草的产种量偏低,应加强对红豆草栽培管理技术的研究,推广先进的管理模式和栽培技术,提高红豆草的产量。同时应加强红豆草与其他作物的间作试验,在不同地区、不同环境条件下进行系统比较和优化配置,实现资源互补和效益最大化。更重要的是,还需不断加强红豆草种质资源收集和保存工作,扩大种质资源的规模,为有效选育更高产的资源和培育新品种提供更多的遗传资源。另一方面,还需要深入研究红豆草产量的遗传调控机制,挖掘与高产相关的关键基因,并开展基因编辑、转基因等新技术的应用研究。
4 红豆草抗性研究
4.1 红豆草抗旱性研究
红豆草作为一种适宜我国北方生长的优质豆科牧草,在干旱半干旱地区其耐旱种质资源和品种的筛选与培育显得尤为重要。国内外多项研究已充分证实了红豆草具备卓越的抗旱性能。Malisch等人的研究显示,在长达14周的干旱胁迫下,红豆草的生物量减少幅度仅为37%,凸显了其即便在水分供应受限条件下,仍能维持生长与再生的能力[42]。此外,不同品系的红豆草在抗旱性上表现出显著的差异。于闯[43]的研究中比较了国内红豆草材料(如甘肃红豆草和蒙农红豆草)与俄罗斯引进的红豆草材料在干旱条件下的生理响应。结果显示,引进的红豆草材料在抗旱性方面表现更佳,这为我国红豆草种质资源的优化提供了重要参考。戴相进的研究则揭示了红豆草在水分胁迫下,虽然叶片蒸腾作用受到一定影响,但其水分利用效率却呈现出上升趋势,进一步证明了其抗旱潜力[44]。车轩等人对红豆草和变异小冠花在干旱条件下的生理特性进行了比较研究,发现红豆草在抗旱能力上显著优于变异小冠花[45]。此外,Irani等人对不同生态型红豆草基因型在缺水胁迫下的克隆繁殖和资源特性进行了深入分析,发现红豆草在缺水条件下能够通过增加类胡萝卜素、游离脯氨酸含量以及多种酶的活性来应对胁迫,从而维持其生存与繁衍[46]。余如刚等人通过聚乙二醇(PEG)模拟干旱胁迫处理,对白三叶、红豆草和紫花苜蓿三种豆科牧草进行了比较研究。结果显示,随着PEG浓度的增加,红豆草受到的胁迫影响相对较小,进一步证明了其相较于其他豆科牧草具有更强的抗旱性[47]。这些研究虽然为红豆草的抗旱性评价提供了重要依据,但总体来看,当前的研究尚缺乏系统性和深度,限制了对抗旱基因的深入挖掘与应用。因此,未来的研究应更加聚焦于红豆草抗旱机制的深入探索,以及耐旱基因资源的挖掘与利用,从而为红豆草的种植和推广提供更加坚实的理论支撑。
4.2 红豆草抗寒性研究
目前,国内外关于红豆草抗寒性的研究相对较少,多数研究集中在红豆草种内或与其他豆科牧草间的抗寒性比较[48],而对其生理生化特性及抗寒机制的深入探讨尚显不足。吴渠来等人的研究表明,红豆草在冬季至春季期间可能面临因气温波动引发的冻害风险[49]。曹国顺等人在甘肃省夏河县的高寒牧区进行了红豆草种植试验,详细评估了其生育期、生长高度、分枝数、鲜草产量、越冬率及抗逆性等多项指标,发现红豆草在海拔3000 m的高寒地区表现出良好的适应性,适合作为该区域的人工草地建植材料[33]。Meyer等人通过在不同低温条件下对十种豆科牧草进行存活率及抗寒性的对比分析,发现红豆草幼苗阶段即展现出较高的抗寒能力[50]。何海鹏等人进一步研究了红豆草幼苗在4℃低温处理下的形态和生理指标变化,对国内外22份红豆草材料的抗寒性进行了综合评价,结果显示甘肃红豆草和材料9155的耐寒能力尤为显著[51]。田丰等人则选取了来自俄罗斯和国内的红豆草材料,通过测定株高、叶面积、地上生物量等形态指标以及脯氨酸、可溶性蛋白含量和过氧化物酶活性等生理指标,对其抗寒性进行了深入研究,结果表明部分引进的俄罗斯材料在抗寒性上表现更佳[52]。
然而,当前红豆草抗寒性的评价标准尚不统一,缺乏明确的评价指标和方法。不同研究者可能采用不同的评估指标,导致研究结果难以直接比较。红豆草的抗寒性受多种环境因素的影响,包括温度、光照、湿度和土壤条件等,这些因素的相互作用使得抗寒性评价变得复杂。此外,红豆草种质资源间的抗寒性表现存在差异,因此在评估时需充分考虑种质资源的多样性。为解决上述问题,需要进一步深入研究并改进抗寒性评价方法,确立统一、准确的评价标准,以便科学评估红豆草的抗寒性。同时,还应深入探究抗寒性的生理和分子机制,为红豆草的选育、栽培及推广应用提供更为坚实的科学基础。
4.3 红豆草耐盐碱性研究
耐盐碱性是植物在盐渍环境中生存和繁衍的关键能力。鉴于我国拥有广袤的盐碱地资源,总面积达3.33×108hm2,因此,培育具有优良耐盐碱性的豆科牧草,如红豆草,对于改良盐碱地、促进畜牧业发展具有重要意义。目前的研究揭示了红豆草在盐碱胁迫下的生理与生化响应机制,包括调节离子平衡、积累有机溶质和增强抗氧化能力等策略来适应盐碱环境。
李辉的研究表明,高碱和盐碱混合胁迫显著抑制了红豆草幼苗的生长[53]。而伍国强等人的进一步试验显示,高盐胁迫对红豆草幼苗生长具有抑制作用,但适当浓度的KCl处理能有效缓解这种抑制[54]。王玉祥等人针对奇台红豆草的盐胁迫试验揭示了其出色的耐盐性,能在高达1.5%的NaCl浓度下维持高发芽率[55]。周万海等人的研究也表明,甘肃红豆草在NaCl浓度低于75 mmol·L-1时能够正常生长[56]。包桂荣等人通过不同浓度的NaCl和Na2CO3溶液处理红豆草种子,发现低浓度下的发芽率相对较高[57]。伍国强等人的研究揭示了红豆草在NaCl胁迫下钠离子吸收与转运机制,发现NaCl胁迫能导致幼苗体内离子平衡受到破坏[58]。王晓栋等人对17份不同来源的红豆草种质进行了耐盐性评价,发现国外种质如加拿大和美国来源的红豆草具有较强的耐盐性[59]。刘鑫等人的研究同样表明,不同红豆草材料在耐盐性上存在显著差异[60]。王晓栋还对比了10份豆科牧草的耐盐性,发现毛苕子的耐盐性最强,而红豆草居中[61]。贾姝通过实生苗侵染法,将甜菜BvNHX基因转入红豆草中,获得了耐盐性增强的过表达植株[62]。
这些研究不仅为红豆草在盐碱地种植提供了理论依据,也为遗传改良耐盐碱性提供了新思路。然而,目前耐盐碱性的研究仍面临一些挑战,如缺乏耐盐碱的红豆草品种,且耐盐碱机制尚未完全阐明。因此,未来的研究需要更加深入地探索耐盐碱性的生理与分子机制,同时利用现代生物技术和遗传工程手段,培育出更多具有优良耐盐碱性的红豆草品种,以更好地利用盐碱地资源,促进畜牧业的发展。
4.4 红豆草对低磷胁迫的耐受性研究
土壤中含有丰富的磷酸盐离子,但其易与其他金属离子形成难溶的沉淀化合物,很难被植物直接吸收利用[58],种植红豆草或其他植物时增施磷肥虽能提高产量,但磷肥施用过多会严重污染耕地,使水体富营养化,破坏生态环境,因此创制耐低磷胁迫的红豆草种质资源以及培育对磷利用效率高的品种对解决“磷危机”具有重要意义。
杨浩等人的研究发现,在红豆草生长的关键期,适量施用磷肥(45 kg·hm-2 P2O5)能显著提高种子产量,增产幅度达25%。这一结果表明,在甘肃高寒雨养区,科学施用磷肥对红豆草种子生产具有显著效果[64]。陈洁等人通过营养沙培法,在低磷和常规磷条件下,对11份红豆草材料进行了比较。研究结果显示,低磷条件对红豆草幼苗生长有明显抑制,但不同材料对低磷的响应存在差异。其中,材料5和甘肃红豆草显示出较强的耐低磷特性[65]。另一项研究还表明,低磷胁迫下,红豆草根系形态发生显著变化,以应对逆境[66]。江海慧等人对甘肃红豆草、蒙农红豆草及三个新品系进行了耐低磷性评估。结果显示,新品系P2在低磷胁迫下表现出色,且新品系的耐低磷性能均优于蒙农红豆草[67]。这些研究为红豆草在磷素限制条件下的种植和管理提供了重要的理论依据和实践指导。
综合而言,目前对于红豆草耐低磷机制的研究才刚刚起步,现有的耐低磷研究主要集中在室内试验和小规模试验田中进行,这些研究方法可能无法完全反映红豆草在实际生产环境中的耐低磷特性。因此,未来的研究可以更多地关注大规模的田间试验,以更好地模拟真实的农田条件,并考察红豆草在不同土壤类型、气候条件和施肥管理方法下的耐低磷表现。目前对红豆草如何适应低磷环境、调节磷吸收利用以及促进磷代谢等方面的研究还十分有限,因此,在以后的研究中可以运用现代分子生物学和遗传学等新技术手段研究红豆草耐低磷性机制,推动红豆草抗逆育种技术研究,培育出更加耐低磷的品种。
4.5 红豆草病虫害研究
在红豆草病害的研究历程中,灰霉病和菌核病是最早在英国被记录的两种主要病害[68]。紧接着在德国,研究人员发现了红豆草黄萎病,这是另一种重要的疾病威胁[69]。随后,Hughes等人在英国进一步报道了格孢腔环斑病[70]、壳针孢叶斑病[71]和柱格孢灰霉病[72]等多种红豆草病害,这些发现揭示了红豆草在生长过程中所面临的多样化挑战。
进入20世纪70年代,红豆草病害的研究又有了新的进展。在美国,镰刀菌根腐病被证实对红豆草的生长产生了显著影响[73]。而到了90年代,前苏联的研究人员则报道了茄腐镰孢根腐病这一新的病害威胁[74]。随着时间的推移,红豆草病害的种类和分布范围不断扩展。在伊朗地区,研究者们发现了包括锈病、丝核菌根颈腐烂病、疫霉根腐病、壳二孢叶斑病和白粉病等在内的五种主要病害[75-79]。这些病害的多样性不仅增加了红豆草种植的复杂性,也为防控策略的制定和品种改良提出了新的挑战。在后续的研究中,土耳其也相继报道了白粉病、茄腐镰孢根腐病和壳二孢叶斑病等病害[80-82]。这些研究不仅增进了对红豆草病害的理解,也为制定更为全面有效的防控措施提供了科学依据。
而我国在红豆草病虫害方面的研究起步较晚,相较于国外的研究,我国直至20世纪80年代才开始深入探讨这一领域。红豆草病害在我国主要集中发生在甘肃、新疆、内蒙古、宁夏等地,其病害类型多样且频发。1984年,刘若等人[83]率先报道了红豆草刺盘孢炭疽病、叶点霉叶斑病、尾孢叶斑病以及轮枝孢黄萎病等五种重要病害,这一发现为我国红豆草病害研究奠定了重要基础。随后,廖春华等在1986至1988年间,进一步揭示了新疆地区红豆草中的锈病、白粉病和立枯病等病害的存在[84-86],为病害的防控提供了更多实践指导。在甘肃、内蒙古、新疆等不同地区,陈林等人对多个红豆草品种种子中的真菌进行了深入研究,共发现了25种真菌,这一发现极大地丰富了红豆草病害的研究内容,为病害的识别与防控提供了科学依据[87]。与此同时,Jafari等人针对35个红豆草居群的牧草产量、农艺性状以及白粉病进行了深入研究,揭示了多叶类型红豆草对白粉病的敏感性,为品种选择和改良提供了重要参考[88]。冷小云等则通过细交链孢和红豆草壳二孢病原菌的接种试验,评估了七个红豆草品种对这两种病原菌的抗病性,发现各品种间存在显著差异,其中埃斯基品种在抗黑斑病和轮纹病方面表现出色[89]。朱建兰等的研究则深入探讨了黑斑病和黑腐病对红豆草生理特性的影响,揭示了受感染叶片和茎中叶绿素、氨基酸和纤维素含量的下降以及可溶性糖和蛋白质含量的上升,为病害的生理机制提供了深入理解[90-91]。
在最新的研究中,李彦忠等于2012至2013年间在甘肃省多个县份进行了红豆草病害的全面调查,共发现13种病害,包括新病害大茎点霉黑斑病和疔座霉叶斑病,以及甘肃地区新记录的尾孢霉斑病和壳针孢叶斑病,这一发现极大地扩展了对红豆草病害的认识[92]。刘宇萱等则在内蒙古成功分离并鉴定了导致红豆草黄萎病的病原菌,即大丽轮枝孢菌,为病害的防控提供了重要病原学依据[93]。
综合而言,我国对红豆草病害研究起步较晚、研究基础较薄弱,现有的研究均集中在对病原菌的鉴定,还未涉及病原菌防治。为了防治病虫害可通过深耕、轮作、修剪等方式来减少病原菌的滋生,也可通过使用抗菌剂进行喷洒和灌根的化学防治方法,更有效的方法是通过筛选抗病性新种质和培育抗病性的新品种,或者通过分子育种方法创制抗病新材料和新品种。
5 红豆草品质性状研究
5.1 红豆草蛋白质含量研究
牧草的营养价值主要取决于其内含的营养成分,其中粗蛋白含量尤为关键,因此提升蛋白质含量成为提高牧草品质和营养价值的重要策略[94]。然而,当前关于红豆草蛋白质积累、改良及其综合利用的研究尚显不足。
陈光耀对两年生和三年生红豆草在不同生长阶段的营养成分进行了详细的研究,发现干物质中粗蛋白含量在13.58%~24.75%间波动,其中分枝期的粗蛋白含量高达24.75%[95]。此外,周维书等人利用凯氏定氮法对不同部位的红豆草进行了蛋白质含量测定,揭示了种子、种皮、叶片和茎之间蛋白含量的显著差异,其中种子中的蛋白质含量最高,达到了32.54%[96]。刘秀梅进一步比较了不同生态区域种植的一年生和二年生红豆草的蛋白质含量,发现其与株高、生长速度、鲜干比、干草产量、粗纤维、茎叶比和分枝数等性状存在一定的关联性,其中株高对蛋白质含量的影响最为显著[97]。黄振艳等在评估贮藏了10年的蒙农红豆草的发芽率和蛋白含量时,发现尽管发芽率有所波动(18.5%~86.0%),但蛋白含量始终保持在较高水平(23.78%~28.06%),表明红豆草即使在失去种用价值后,其营养价值仍具有较高的保持性[98]。付萍等在甘肃省不同立地条件下对红豆草的适应性进行了系统评价,结果显示在和政县种植的红豆草粗蛋白含量高达20.25%,且在甘肃省二阴地区不同年份间,其蛋白和纤维等营养成分差异不大,第二年时达到峰值[32]。这一发现表明红豆草在和政县等地具有良好的适应性,具备较高的推广和应用潜力。
红豆草因其丰富的蛋白质含量而具有极高的饲用价值,这些蛋白质主要通过动物消化转化为肉类产品,为人类提供优质的蛋白质来源。红豆草蛋白质的含量受品种、生长环境、收获时间等多种因素的综合影响,这为未来通过遗传改良和农业管理措施提升其营养价值提供了研究方向。
5.2 红豆草类黄酮/缩合单宁研究
缩合单宁,也被称为原花青素[99],是由黄烷-3-醇通过碳-碳双键组成的寡聚物或多聚物,是一大类重要的类黄酮化合物。随着人们对缩合单宁结构、生理活性、化学性能等各方面的不断探索,发现缩合单宁具有抗氧化、抗炎、抗菌、抗寄生虫和抗病毒等生物活性,饲草中缩合单宁含量高或者饲粮中添加适量的缩合单宁不但不影响反刍动物采食量,而且能改善瘤胃环境,减少甲烷产量,并能提高反刍动物的生产性能和健康水平。因此,缩合单宁的研究吸引了众多科研人员的注意,并取得了一系列重要发现。这些成果不仅深化了对单宁生物合成的理解,更为提升单宁合成与积累的植物育种工作提供了理论的指导。
然而,当前国内外关于红豆草中缩合单宁的研究尚显不足,主要集中在不同品种红豆草缩合单宁含量的比较上。红豆草缩合单宁的含量因材料、生长期和品种差异而异。例如,Koupai-Abyazani等人的研究表明,26种红豆草样本均含有多种类黄酮化合物,如儿茶素、表儿茶素等[100]。Stringano等人在对37种红豆草材料的研究中发现,缩合单宁含量存在显著差异,且其在不同组织间的分布亦有所不同,如叶片中的含量通常高于茎秆和全株[101]。刘秀丽等人的研究进一步揭示了蒙农红豆草中缩合单宁的分布规律,发现叶片为主要储存部位,并在生长期内含量达到峰值[102]。McAllister等人的研究则表明,不同品系的红豆草在缩合单宁含量上存在显著差异,且再生过程中的含量普遍高于刈割前[103]。张晓庆等人针对甘肃红豆草的研究发现,缩合单宁含量随生长阶段的变化而变化,营养期、初花期和盛花期的含量各异[104]。魏伯平等人的研究关注了不同豆科牧草中总黄酮和总皂苷的积累与分布,发现叶片中的总黄酮含量普遍高于茎部,且红豆草等牧草是提取皂苷产品的优质材料[105]。Qiao等人则通过对比分析不同花色红豆草的花青素成分,并筛选出可能参与花青素合成调控的关键基因,为红豆草花色改良提供了理论依据[106]。
在分子层面,关于红豆草缩合单宁生物合成途径及其调控机制的研究尚需深入。陈春艳成功克隆了与缩合单宁单体合成相关的BAN和LAR基因,并在紫花苜蓿愈伤组织中过量表达这些基因,显著提高了缩合单宁的含量[107]。本团队综合分析了来自不同地区的46份红豆草种质资源,通过转录组学分析,筛选出一系列可能参与缩合单宁生物合成与调控的候选基因,特别是OvMYBPA2这一关键的MYB类调控基因。通过在紫花苜蓿毛状根中过量表达OvMYBPA2基因,发现可溶性缩合单宁含量显著上升,进一步证明了该基因在缩合单宁合成调控中的重要作用[108]。这些研究为深入理解红豆草缩合单宁的生物合成与调控机制,以及通过基因工程手段改良红豆草品质提供了重要参考。
国内外目前对红豆草缩合单宁及其他类黄酮的研究主要集中在成分鉴定、含量分析和转录组测序等方面,对其合成途径关键基因的挖掘还十分有限,对已挖掘关键基因在豆科牧草分子改良方面的应用研究有待进一步加强。
6 红豆草遗传转化研究
稳定的遗传转化体系是进行红豆草功能基因验证和分子改良的重要技术手段,目前红豆草的遗传转化技术仍面临很多挑战,包括转化效率低、转基因植株的遗传不稳定性等问题。
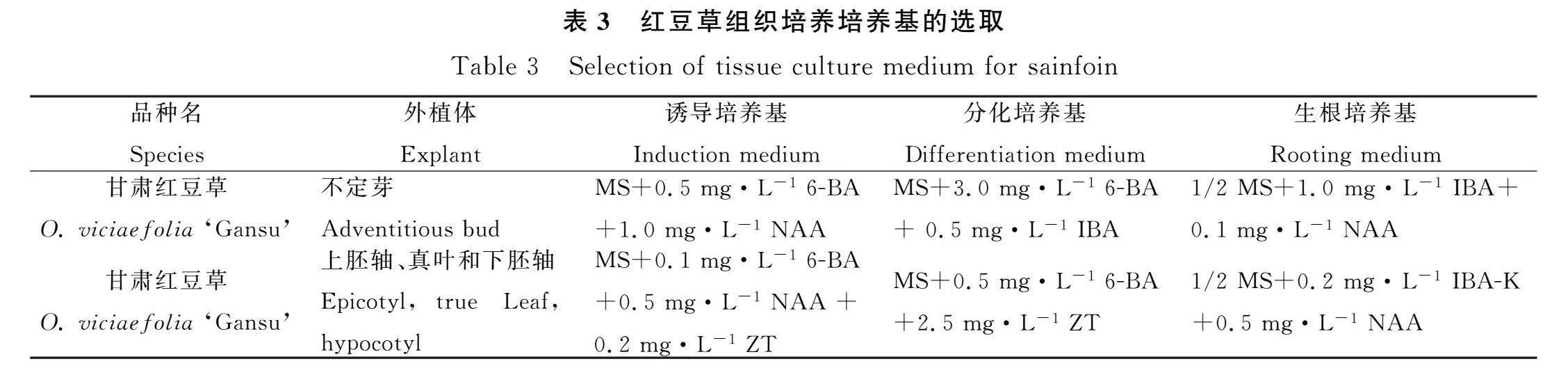
早期研究,如Arcioni等在1983年通过悬浮培养法成功诱导红豆草叶片形成愈伤组织,进而获得再生小植株,为后来的研究奠定了基础[109]。近年来,云雅聪在红豆草遗传转化领域取得了显著进展。通过综合分析不同红豆草材料的试验结果,确定了诱导愈伤组织形成的最佳激素配比为MS+6-BA(1.0~2.0 mg·L-1)+ NAA(0.01~1.0 mg·L-1)+ KT(0~2.0 mg·L-1)+ CH(0~2.0 g·L-1)[110]。进一步的研究中,云雅聪等人在MS基本培养基上对蒙农红豆草的不同部位进行了愈伤组织诱导试验,结果显示,在MS培养基中添加2 mg·L-12,4-D+1 mg·L-1 6-BA+1 mg·L-1 KT时,不同部位诱导出愈伤组织的顺序为下胚轴、子叶、叶片和幼茎,其中下胚轴的愈伤组织诱导效果最佳,诱导率高达86%。同时发现,在MS培养基中添加0.1 mg·L-1 NAA+2.0 mg·L-1 6-BA时,分化率达到24%,这对于芽的分化极为有利[111]。刘瑞凝等人也针对埃斯基红豆草的下胚轴和叶片等外植体进行了初始愈伤组织诱导研究,发现在将液体悬浮培养转移到固体分化培养过程中,分化培养基中添加高浓度的细胞分裂素能够有效提高再生植株的频率[112]。这些研究成果不仅为红豆草遗传转化体系的优化提供了重要参考,也为未来红豆草的功能基因验证和分子改良奠定了坚实的基础。
在遗传转化研究领域,国内学者对红豆草进行了广泛的探索与深入研究(如表3所示)。刘明志等人通过根癌农杆菌C58和T37对红豆草的下胚轴和子叶进行离体感染试验,观察到转化瘤组织与未感染愈伤组织在可溶性蛋白质含量上相似,但转化细胞系的过氧化物酶和L-苯丙氨酸解氨酶活性却显著增强,这一现象激发了对转化细胞生化特性的深入思考[113]。王毓美等人则选取红豆草下胚轴为外植体,利用根癌农杆菌LBA440进行遗传转化。其研究结果表明,转基因植株叶片愈伤组织的同工酶谱表现出显著差异,这进一步揭示了遗传转化对红豆草生理特性的潜在影响机制[114]。贾姝[62]在红豆草遗传转化方面取得了显著进展,成功将甜菜的BvNHX基因导入红豆草,并初步构建了其组培体系。通过对比分析,发现红豆草的下胚轴是最佳的外植体选择,并确定了MS(Murashige and Skoog)培养基(MS+0.5 mg·L-16-BA+0.2 NAA)为最佳的愈伤组织培养基配方。同时还优化了不定芽分化的培养基配方,为红豆草的遗传改良提供了有价值的参考。雷雄雄的研究为红豆草遗传转化带来了新的方向,也从杨树中克隆出PeDWF4基因,并成功将其转入红豆草,初步建立了PeDWF4-红豆草转基因系[115]。这一创新性的尝试显著提高了红豆草的直接再生率,尽管因生根困难未能获得真正的转基因植株,但为红豆草的遗传改良和品种优化提供了宝贵的经验和启示。
综上所述,国内学者在红豆草遗传转化领域进行了深入且系统的研究,从不同角度揭示了遗传转化对红豆草生理特性的影响机制,为红豆草的遗传改良和农业生产应用提供了坚实的理论基础和实践指导。
7 问题与展望
我国对红豆草种质资源的研究起步较晚,发展缓慢,在目前的文献报道中,分析比较的红豆草种质资源数目在2~46份之间,与国外相比,我国红豆草种质资源面临数量低、老化等严重问题。目前我国已审定登记的红豆草育成品种数量仅为4个,近十几年来十分缺乏培育的新品种,容易导致红豆草在种植过程中遇到同一类病虫害或环境胁迫时产生较大损失。因此,通过种质资源收集、引进、多种诱变技术丰富红豆草种质资源的多样性,通过品种选育增加红豆草品种的数量是非常必要的。
目前对红豆草种质资源的评价与鉴定工作还较为落后。首先是对主要的性状缺乏统一的评价指标和方法。由于红豆草在不同地区和环境条件下种植存在较大的差异,指标设置和评价标准还很缺乏,例如耐寒性和耐盐碱性的评价指标均不一致,需要建立一套全面而客观的评价指标体系,使其具有代表性和可比性。同时,还应开发研究适用于红豆草种质资源精准鉴定的新方法和技术,如分子标记技术、基因测序技术和影像技术等,提高种质资源评价的效率和准确性。另外,还需要建立一套科学、全面的精准鉴定指标体系,涵盖形态特征、生理特性、抗逆性和农艺性状等多个评价指标,便于对同一种质资源的多个指标进行综合分析评价,筛选优异的种质资源。
全基因组测序可以为红豆草提供更全面、系统的遗传信息,从而有助于揭示其分子机制。近期He等[116]报道了关于一份红豆草种质资源的基因组,该研究为后续红豆草的功能基因组研究奠定了良好的基础,同时该研究还重点分析并发现部分缩合单宁生物合成的基因发生复制,为后续解析红豆草的缩合单宁的代谢调控提供了参考。整体而言,目前对于红豆草抗逆性其他方面的基因功能的研究较少,未来应加强红豆草分子生物学研究的相关工作,包括获得更多关于其基因组功能基因的信息,建立更完善的红豆草分子标记方法,扩大可用于红豆草遗传多样性评价和利用的标记位点数量,挖掘具有实际应用潜力的关键基因。同时结合基因表达谱分析、蛋白质组学研究等,深入探究红豆草关键性状形成的分子机制。通过加强红豆草的分子生物学研究,可以更好地阐明红豆草重要性状形成的遗传基础和分子机制,为其遗传改良和有效利用提供科学依据。
转基因技术在现代农业中具有重要的应用价值,可以为红豆草的抗性改良和农艺性状优化提供更多可能性。但是目前对红豆草的转基因研究相对滞后,还没有建立高效稳定的红豆草遗传转化体系,对已知的内源功能基因还未进行成功的稳定遗传转化。所以加强红豆草的转基因技术研究,筛选合适的基因型、外植体、培养条件,建立高效的红豆草转基因技术体系是进行红豆草遗传改良研究的前提条件,为后续进行基因编辑提供可能。
参考文献
[1] 翟桂玉. 高产优质豆科牧草-红豆草[J]. 农业知识,2007(18):35-36
[2] 柴素荣,吴振国. 适宜兰州新区绿化种植的节水型草坪地被植物[J]. 农业科技与信息,2012(13):27-30
[3] 孙兴邦. 红豆草开花习性的观察[J]. 中国草原,1983(3):60-62
[4] 王晓微,特木其勒图,马文虎,等. 红豆草的栽培技术及利用[J]. 四川草原,2004(8):59
[5] 金巨和. 优良牧草—红豆草简介[J]. 甘肃畜牧兽医,1982(1):39-44
[6] CELIK A,KARAKAYA A,AVCI S. Powdery mildews observed on Onobrychis spp.in Turkey[J]. Australasian Plant Disease,2011,6(1):49-53
[7] AZUHNWI B N,BOLLER B,MARTENS M,et al. Morphology,tannin concentration and forage value of 15 swiss accessions of sainfoin (Onobrychis viciifolia Scop.) as influenced by harvest time and cultivation site[J]. Grass and Forage Science,2011,66(4):484-487
[8] LIU Z,LANE G P F,DAVIES W P. Establishment and production of common sainfoin (Onobrychis viciifolia Scop.) in the UK. 2. Effects of direct sowing and under sowing in spring barley on sainfoin and sainfoin-grass mixtures[J]. Grass amp; Forage Science,2008,63(2):242-248
[9] BILIGETU B,JEFFERSON P G,LARDNER H A,et al. Evaluation of sainfoin (Onobrychis viciifolia) for forage yield and persistence in sainfoin-alfalfa (Medicago sativa) mixtures and under different harvest frequencies[J]. Canadian Journal of Plant Science,2021(4):101
[10]陈默君,贾慎修. 中国饲用植物[M]. 北京:中国饲用植物,2002:15-16
[11]陈宝书,聂朝相,刘淑炽. 红豆草的产量和营养成分的研究[J]. 甘肃农业大学学报,1983(4):82-88
[12]刘秀丽,李元恒. 红豆草单宁的研究概况[J]. 畜牧与饲料科学,2016,37(12):52-57
[13]陶彦彤. 红豆草新品系遗传多样性及抗寒转录组研究[D]. 呼和浩特:内蒙古师范大学,2021:66
[14]陈宝书. 红豆草[M]. 兰州:甘肃科学技术出版社,1992:8-42
[15]乌云飞,石凤翎,崔志明. 蒙农红豆草的选育及其特征特性的研究[J]. 中国草地,1995(4):24-28
[16]张磊,阿不力孜,张博,等. 奇台红豆草品种比较试验[J]. 草原与草坪,2008(6):23-27
[17]XU Y,JIA R,ZHOU Y,et al. Development and characterization of polymorphic EST-SSR markers for paphiopedilum henryanum (Orchidaceae)[J]. Applications in Plant Science,2018,6(5):152-156
[18]DEMDOUM S,MUOZ F,DELGADO I,et al. EST-SSR cross-amplification and genetic similarity in Onobrychis genus[J]. Genetic Resources and Crop Evolution,2012,59(2):253-260
[19]BHATTARAI S,COULMAN B,FU Y B,et al. Genetic diversity and relationship of sainfoin (Onobrychis viciifolia Scop.) germplasm as revealed by amplified fragment length polymorphism markers[J]. Annual Meeting of Canadian Society of Agronomy,2018,98(3):95-97
[20]AVCI S,ILHAN E,ERAYMAN M,et al. Analysis of Onobrychis genetic diversity using SSR markers from related legume species[J]. Journal of Animal amp; Plant Sciences,2014,24(2):556-566
[21]MORA-ORTIZ M,SWAIN M T,VICKERS M J,et al. De-novo transcriptome assembly for gene identification,analysis,annotation,and molecular marker discovery in Onobrychis viciifolia[J]. BMC Genomics,2016,17(1):756
[22]申书恒. 红豆草EST-SSR分子标记开发与遗传多样性分析[D]. 兰州:兰州大学,2019:31
[23]马彪,魏少萍,苗佳敏,等. 基于ISSR分子标记的红豆草资源遗传多样性分析[J]. 四川农业大学学报,2023,41(4):619-625
[24]乔雨. EMS诱导蒙农红豆草优良突变体筛选及花色变异机理研究[D]. 呼和浩特:内蒙古农业大学,2020:101
[25]ZARRABIAN M,MAJIDI M M,EHTEMAM M. Genetic diversity in a worldwide collection of sainfoin using morphological,anatomical,and molecular markers[J]. Crop Science,2013,53:2483-2496
[26]RASOULI M,JAFARI A,TABAEI-AGHDAEI S R,et al. Assessment of genetic variability of 36 populations of sainfoin (Onobrychis viciifolia Scop.) based on RAPD markers[J]. International Journal of Biological Sciences,2013,3:15-26
[27]HEJRANKESH N,ALIMOUSAVIZADEH S.et al. Evaluation of genetic diversity of sainfoin (Onobrychis viciifolia Scop.) landraces using RAPD markers[J]. Current Alzheimer Research,2014,2:739-748
[28]郭博,陈宝书,温尚文. 红豆草主要经济性状的研究[J]. 甘肃畜牧兽医,1983(1):22-25
[29]李建伟. 高寒山区不同播量的11种牧草(组合)生长和品质特性研究[D]. 兰州:甘肃农业大学,2012:76-78
[30]ZHOU Z,SHANGGUAN Z. Nutritive value of sainfoin (Onobrychis viciaefolia) harvested at different maturity stages[J]. Pakistan Journal of Biological Sciences,2006,9(2):104-110
[31]高占琪,豆卫,张榕,等. 甘肃红豆草在高寒牧区的生产性能和营养价值评价[J]. 中国饲料,2011(11):32-33
[32]付萍,张榕,耿小丽,等. 甘肃省二阴地区红豆草生产性能和营养品质评价[J]. 中国草食动物科学,2020,40(2):78-80
[33]曹国顺,夏燕. 甘南高寒牧区红豆草引种试验[J]. 甘肃农业,2015(16):28-29
[34]孙玉兰. 20份红豆草种质资源评价[D]. 乌鲁木齐:新疆农业大学,2022:54
[35]南丽丽,温素军,魏凡,等. 红豆草新品系的草产量及营养价值研究[J]. 草地学报,2020,28(2):383-388
[36]宋书红,杨云贵,张晓娜,等. 不同刈割时期对紫花苜蓿和红豆草产量及营养价值的影响[J]. 家畜生态学报,2017,38(2):44-51
[37]宋书红,陈志飞,张晓娜,等. 刈割茬次对紫花苜蓿、红豆草产量和营养价值的影响[J]. 黑龙江畜牧兽医,2017(7):143-146
[38]朱兴运,于锋,余玲,等. 红豆草和紫花苜蓿营养价值研究总结[J]. 草业科学,1988(3):31-35
[39]韩德林. 红豆草和紫花苜蓿在同仁县生产性状的初步比较结果[J]. 青海草业,2001,10(2):14-16
[40]卡米拉,米克热依,玛尔孜亚. 红豆草的栽培及利用[J]. 新疆畜牧业,2009(1):63-64
[41]陈涛. 灌溉与硼肥对河西地区紫花苜蓿和红豆草新品系种子产量及质量的影响[D]. 兰州:兰州大学,2023:43
[42]MALISCH C S,SALMINEN J,KLLIKER R,et al. Drought effects on proanthocyanidins in sainfoin (Onobrychis viciifolia Scop.) are dependent on the plant’s ontogenetic stage[J]. Journal of Agricultural and Food Chemistry,2016,64(49):9307-9316
[43]于闯. 不同红豆草种质材料的抗逆性及品质特性研究[D]. 兰州:甘肃农业大学,2017:55-56
[44]戴相进. 土壤水分胁迫下红豆草的水分生理与光合特性[D]. 泰安:山东农业大学,2014:28-29
[45]车轩,梁宗锁,吴珍. 2种豆科牧草对干旱的生理响应及抗旱性评价[J]. 草业科学,2010,27(11):89-94
[46]IRANI S,MAJIDI M M,MIRLOHI A,et al. Assessment of drought tolerance in sainfoin:physiological and drought tolerance indices[J]. Agronomy Journal,2015,107(5):1771-1781
[47]余如刚,杜雪玲,陈楚,等. PEG胁迫对三种豆科牧草种子萌发及幼苗生理影响[J]. 干旱地区农业研究,2012,35(5):99-103
[48]乔洁,刘元和,姚永华,等. 4种豆科牧草抗寒性能比较研究[J]. 草原与草坪,2010,30(1):68-73
[49]吴渠来,赵宇光,卢云慧. 冷季苜蓿和红豆草的抗冻性[J]. 内蒙古农牧学院学报,1989(2):98-105
[50]MEYER D W,BADARUDDIN M. Frost tolerance of ten seedling legume species at four growth stages[J]. Crop Science,2001,41(6):1838-1842
[51]何海鹏,南丽丽,马彪,等. 红豆草种质苗期耐寒性筛选及评价[J]. 中国草地学报,2023,45(5):41-49
[52]田丰,于闯,付双军,等. 7份红豆草对低温的生理响应及抗寒性评价[J]. 甘肃农业科技,2018(10):21-26
[53]李辉. 红豆草耐盐碱性研究及其组培体系的建立[D]. 兰州:兰州理工大学,2019:47
[54]伍国强,李辉,雷彩荣,等. 添加KCl对高盐胁迫下红豆草生长及生理特性的影响[J]. 草业学报,2019,28(6):45-55
[55]王玉祥,徐珊,陈爱萍,等. 盐胁迫对奇台红豆草种子萌发的影响[J]. 中国农学通报,2011,27(20):40-44
[56]周万海,师尚礼,周娟娟. NaCl胁迫对甘肃红豆草生理特性的影响[J]. 草原与草坪,2012,32(3):1-5
[57]包桂荣,乌日汗,宝布仁其其格,等. 不同盐分对红豆草种子萌发的影响[J]. 内蒙古民族大学学报,2010,25(6):640-642
[58]伍国强,贾姝,刘海龙,等. 盐胁迫对红豆草幼苗生长和离子积累及分配的影响[J]. 草业科学,2017,34(8):1661-1668
[59]王晓栋,石凤翎. 17份红豆草种质材料种子萌发期耐盐性研究[J]. 种子,2008,27(7):38-41
[60]刘鑫,汪堃,梁鹏飞,等. 红豆草苗期耐盐种质筛选及综合评价[J]. 西南农业学报,2022,35(9):2171-2179
[61]王晓栋. 10份豆科牧草种质材料耐盐性研究[D]. 乌鲁木齐:内蒙古农业大学,2008:35
[62]贾姝. 超表达BvNHX基因提高红豆草耐盐性的研究[D]. 兰州:兰州理工大学,2017:31
[63]黄杰,张郎织,邢玉芬,等. 低磷胁迫对崖州硬皮豆生长及酸性磷酸酶活性的影响[J]. 草地学报,2021,29(7):1462-1468
[64]杨浩,耿小丽,武慧娟,等. 磷肥对甘肃临夏地区红豆草种子生产及土壤养分的影响[J]. 草业科学,2023,40(3):779-785
[65]陈洁,魏少萍,梁鹏飞,等. 不同红豆草材料耐低磷性评价及种质筛选[J]. 中国草地学报,2022,44(3):72-80
[66]陈洁,南丽丽,汪堃,等. 低磷胁迫对红豆草根系构型的影响[J]. 干旱地区农业研究,2023,41(2):61-69
[67]江海慧,汪堃,陈洁,等. 低磷胁迫对红豆草新品系幼苗生长及生理特性的影响[J]. 草原与草坪,2020,40(6):95-101
[68]CARRUTHERS W. Annual reports of the consulting botanist[J]. Joural of Royal Agricultural Society of England,1902,59:176-195
[69]RICHTER H,KLINKOWSKI M. Wirtelplz-Welkekrankheit and luzerne und exparsette[J]. Nachrichtenblatt des Deutschen Pflanrenschutzdienst (Berlin),1938,18:57-58
[70]HUGHES S J. Studies on some diseases of sainfoin (Onobrychis sativa): I. Ring-spot caused by Pleospora herbarum (Pers.) Rabenh.[J]. Transactions of the British Mycological Society,1946,28(3):86-90
[71]HUGHES S J. Studies on some diseases of sainfoin (Onobrychis sativa): III. Leaf-spot caused by Septoria Orobina sacc[J]. Transactions of the British Mycological Society,1947,32(1):60-62
[72]HUGHES S J. Studies on some diseases of sainfoin (Onobrychis sativa):II. The life history of Ramularia onobrychidis Allescher[J]. Transactions of the British Mycological Society,1949,32(1):34-59
[73]SEARS R G,DITTERLINE R L,MATHRE D E. Crown and root rotting organisms affecting sainfoin (Onobrychis viciifolia) in Montana[J]. Plant Disease Reporter,1975(59):423-426
[74]AULD D L,DITTERLINE R L,MATHRE D E,et al. Pathogenicity of fusarium solani on sainfoin (Onobrychis viciifolia) fungal diseases[J]. Plant Disease Reporter,1976,60(8):666-669
[75]SHARIFNABI B,BANIHASHEMI Z. Study of Leveillula taurica the incitant of sainfoin powdery mildew in esfahan province [J]. Iranian Journal of Plant Pathology,1990,26:7-9
[76]SHARIFNABI B,BANIHASHCMI Z. Sainfoin rust in Iran[J]. Iranian Journal of Plant Pathology,1995,31(1-4):106-107
[77]SHARIFNABI B,BANIHASHCMI Z. Rhizoctonia root and crown rot of sainfoin in Iran [J]. Iranian Journal of Plant Pathology,1996,32(3-4):184-186
[78]SHARIFNABI B,BANIHASHCMI Z. Study of phytophthora root rot of sainfoin in Iran [J]. Iranian Journal of Plant Pathology,1997,33(1-2):18-21
[79]SHARIFNABI B,FATEHI J. Ascochyta blight of sainfoin in Iran [J]. Iranian Journal of Plant Pathology,1996,32(1-2):29
[80]EKEN C. First report of Ascochyta fabae on sainfoin in Turkey [J]. Plant Pathology,2003,52(3):421
[81]KARAKAYA A. Leveillula taurica on Onobrychis viciaefolia in Turkey[J]. Mycotaxon,1998,66:359-361
[82]EKEN C,DEMIRCI E. Species of Fusarium on sainfoin in Erzurum,Turkey [J]. New Zealand Journal of Agricultural Research,2004,47(2):261-263
[83]刘若,侯天爵. 我国北方豆科牧草真菌病害初步名录[J]. 中国草原,1984(1):56-60
[84]廖春华. 红豆草锈病简报[J]. 新疆农业科学,1987(6):26
[85]廖春华,侯保荣. 红豆草白粉病初报[J]. 中国草原,1986(5):68
[86]廖春华. 红豆草苗期立枯病简报[J]. 新疆农业科学,1988(3):18-19
[87]陈林. 红豆草(Onobrychis viciaefolia Scop)种带真菌研究[D]. 兰州:兰州大学,2010:41
[88]JAFARI A A,RASOLI M,TABAEIAGHDAEI S R,et al. Evaluation of herbage yield,agronomic traits and powdery mildew disease in 35 populations of sainfoin (Onobrychis sativa) across 5 environments of Iran[J]. Romanian Agricultural Research,2014,31(31):41-48
[89]冷小云. 红豆草品种对黑斑病和轮纹病的抗性评价[D]. 兰州:兰州大学,2009:34
[90]朱建兰. 黑腐病对红豆草茎叶蛋白质、氨基酸等含量的影响[J]. 草业科学,2006,23(4):67-70
[91]张俊忠,王齐,朱建兰. 黑斑病对红豆草营养成分的影响[J]. 甘肃农业大学学报,2008,43(4):118-120
[92]李彦忠,聂红霞. 甘肃省红豆草病原真菌鉴定及病害发生动态调查[J]. 植物保护学报,2016,43(2):222-232
[93]刘宇萱,王乐,张园园,等. 内蒙古红豆草黄萎病菌的分离鉴定及其生物学特性[J]. 中国草地学报,2021,43(3):85-93
[94]田兵,冉雪琴,薛红,等. 贵州42种野生牧草营养价值灰色关联度分析[J]. 草业学报,2014,23(1):92-103
[95]陈光耀. 红豆草经济性状的动态研究[J]. 草业科学,1990,7(5):41-46
[96]周维书,吉卯祉,周维经. 红豆草化学成份的研究(一)粗蛋白质和游离氨基酸含量的测定[J]. 中国草原,1986(4):36-37
[97]刘秀梅. 甘肃红豆草在不同生态区域的适应性[D]. 兰州:甘肃农业大学,2010:47-49
[98]黄振艳,石凤翎,高霞,等. 2种不同贮藏年限牧草种子的活力和营养物质变化[J]. 种子,2012,31(12):5-8
[99]MUELLER-HARVEY I. Tannins:Their nature and biological significance [J]. Journal of the Science of Food and Agriculture,1999:17-70
[100]KOUPAI-ABYAZANI M R,MUTR A D,BOHM B A,et al. The proanthocyanidin polymers in some species of Onobrychis[J]. Phytochemistry,1993,34(1):113-117
[101] STRINGANO E,CARBONERO C H,SMITH L M J,et al. Proanthocyanidin diversity in the EU ‘HealthyHay’ sainfoin (Onobrychis viciifolia) germplasm collection[J]. Phytochemistry,2012,77:197-208
[102]刘秀丽,毕力格吐,李树森,等. 利用盐酸-正丁醇法测定蒙农红豆草缩合单宁的含量[J]. 今日畜牧兽医,2018,34(3):8-10
[103]MCALLISTER T A,ACHARYA S N,OMINSHI K H,et al. Tannin contents of sainfoin (Onobrycyhis viciifolia Scop) grown with or without irrigation and harvested at different growth stages[C]//XXI International Grassland Congress and the VIII International Rangeland Congress,2008:197-208
[104]张晓庆. 红豆草中单宁对饲粮蛋白质保护的效果[D]. 兰州:甘肃农业大学,2005:33-34
[105]魏伯平,张咏梅,曹致中. 9种豆科牧草总黄酮和总皂苷积累规律的研究[J]. 草地学报,2012,20(1):88-95
[106]QIAO Y,CHENG Q,ZHANG Y,et al. Transcriptomic and chemical analyses to identify candidate genes involved in color variation of sainfoin flowers[J]. BMC Plant Biology,2021,21(1):61
[107]陈春艳. 甘肃红豆草原花青素合成途径的两个关键酶基因的克隆和功能分析[D]. 兰州:甘肃农业大学,2016:70-72
[108]JIN Z,JIANG W,LUO Y,et al. Analyses on flavonoids and transcriptome reveals key MYB Gene for proanthocyanidins regulation in Onobrychis viciifolia [J]. Front Plant Science,2022,13:918-941
[109]ARCIONI S,MARIOTTI D. Tissue culture and plant regeneration in Onobrychis viciaefolia [J]. Z. Pflanzenzucht,1983,3(90):192-197
[110]云雅聪. 不同红豆草材料愈伤组织诱导及植株再生的研究[D]. 呼和浩特:内蒙古农业大学,2016:35
[111]云雅聪,米福贵,靳慧卿,等. 蒙农红豆草愈伤组织诱导及植株再生的研究[J]. 草业与畜牧,2016(4):18-23
[112]刘瑞凝,李兆红. 红豆草下胚轴及叶片悬浮细胞系的建立与植株再生[J]. 农业生物技术学报,1994(2):67-75
[113]刘明志. 农杆菌介导的红豆草转化及其特性[J]. 长沙大学学报,2005,19(5):27-30
[114]王毓美,李武兴,陈曦,等. 几丁质酶基因转化亚麻、红豆草、骆驼刺的同工酶研究[J]. 西北植物学报,2001(1):26-31
[115]雷雄雄. PeDWF4-红豆草和PeDWF4-紫苏转基因系建立及PeCPD-马铃薯转基因系分析[D]. 兰州:兰州大学,2015:35
[116]HE J,TIAN D,LI X,et al. A chromosome-level genome assembly for Onobrychis viciifolia reveals gene copy number gain underlying enhanced proanthocyanidin biosynthesis[J]. Communications Biology,2024,7(1):19
(责任编辑 闵芝智)

