外源油菜素内酯对盐胁迫赖草生理特性的影响


收稿日期:2024-02-01;修回日期:2024-04-02
基金项目:山西省重点研发计划(农业领域)(202102140601006);山西省现代农业产业体系建设专项;农业农村部饲草高校生产模式创新重点实验室;山西省重点实验室项目(202104010910017)共同资助
作者简介:
杜利霞(1978-),女,汉族,内蒙古呼和浩特人,副教授,博士,主要从事牧草种质资源及育种方面的教学与研究,E-mail:dulixia0328@126.com
摘要:为探究油菜素内酯(Brassinolide,BR)对盐胁迫赖草的修复作用,本研究采用盆栽模拟试验,以‘晋北’赖草(Leymus secalinus ‘Jinbei’)为材料,用不同浓度(0.05,0.10,0.15,0.20 μmol·L-1)的BR喷施盐(500 mmol·L-1NaCl)胁迫的赖草叶片,通过对赖草幼苗光合生理指标的研究,筛选修复盐胁迫损伤的最适BR浓度。结果表明,500 mmol·L-1NaCl胁迫后,对赖草表型及生理方面都达到了损伤的程度,不同浓度的BR处理盐胁迫后的赖草,能起到修复作用。Na+,K+对BR的作用比较敏感,K+/Na+提高了49.85%,效果显著(Plt;0.05);BR喷施后,超氧阴离子(Superoxide anion free radical,O-2)含量、相对电导率显著降低,超氧化物歧化酶(Superoxide dismutase,SOD)活性显著降低,过氧化氢酶(Catalase,CAT),过氧化物酶(Peroxidase,POD)活性增加不明显,叶绿素含量增加,但净光合速率提高缓慢。综合分析,BR处理主要通过调节离子运输抵抗离子胁迫带来的伤害,增加叶片渗透调节物质、降低活性氧损伤,保护细胞膜,达到修复盐胁迫的作用,且用0.15 μmol·L-1BR对赖草的修复效果最佳。
关键词:赖草;油菜素内酯;盐胁迫;光合生理;主成分分析
中图分类号:S543.9""" 文献标识码:A"""" 文章编号:1007-0435(2024)11-3442-09
Effects of Exogenous Brassinolide on the Physiological Characteristics of
Leymus secalinus Under Salt Stress
DU Li-xia*, QIN Shi-li, ZHANG Qian, LIAO Ming-wang, WANG Kai-xin, HOU Xiang-yang
(College of Grassland Science, Shanxi Agricultural University, Key Laboratory for Model Innovation in Forage Production
Efficiency, Ministry of Agriculture and Rural Affairs, Taigu, Shanxi Province 030801, China)
Abstract:In order to explore the optimal brassinolide (BR) concentration for repairing salt-stressed damage,Leymus secalinus ‘Jinbei’ was treated with 500 mmol·L-1 NaCl for 15 days,and then was sprayed with BR of different concentrations (0.05,0.10,0.15,0.20 μmol·L-1). Through the measurement and analysis of photosynthetic and physiological indexes of L.secalinus seedlings,the repairing effects of brassinolide on salt-stressed was investigated. The results showed that the phenotype and physiology of L.secalinus reached the degree of damage under 500 mmol·L-1 NaCl stress,and BR could play a repairing role. Na +and K+ were sensitive to BR,and K+/Na+ increased by 49.85% (Plt;0.05). After spraying BR,the content of superoxide anion free radical (O-2) and relative conductivity was decreased significantly,the activities of superoxide dismutase (SOD) was increased significantly,the activities of catalase (CAT) and peroxidase (POD) did not increase significantly,the chlorophyll content was increased,but the net photosynthetic rate was increased slowly. The above results showed that BR treatment could regulate ion transport and increase osmotic regulatory substances in leaves to resist the damage caused by ion stress,enhance antioxidant defense and reduce the oxidative damage of cells,so as to repair the damage caused by salt stress. 0.15 μmol·L-1 BR treatment had the best repairing effects on L.secalinus under salt stress.
Key words:Leymus secalinus;Brassinolide;Salt stress;Photosynthetic physiology;Principal component analysis
土壤盐渍化是一个世界性的生态问题,全球有各种盐碱地约 9.54×108hm2,分布于100多个国家,占到陆地面积的10%[1],其中我国各类盐碱地面积约为 9.913×107 hm2,分布于从热带到寒温带、滨海到内陆、湿润地区到极端干旱区的广袤地区[2]。盐胁迫影响植物的生长、生物量和矿物质养分的吸收[3],是植物生长发育的主要非生物胁迫因素[4]。幼苗期是植物生活史中对盐胁迫十分敏感的时期,对植物幼苗期耐盐性的研究成了人们关注的焦点。
近年来,土壤盐渍化程度呈现上升趋势,2023年中央一号文件第十一条指出,加快培育耐盐碱作物等新品种,把盐碱地由原来的治理向选育耐盐碱植物适应盐碱地而转变。赖草[Leymus secalinus(Georgi)Tzvel.]是禾本科(Poaceae)小麦族(Triticeae)赖草属(Leymus Hochst)中旱生多年生草本植物,在我国,赖草主要分布在西北、东北西部、华北、西南各地区,其品质优良、营养丰富,具有适应性强、耐盐碱、抗旱和抗寒等优良特性[5],是牧草领域盐碱地“适种”植物的首选材料。但在高盐地区,赖草生长也会受到抑制。因此,如何进一步提高赖草耐盐性,在高浓度盐碱地区种植显得尤为重要。
使用外源物质增强植物的耐盐性是常见的研究手段[6],研究表明,油菜素内酯(Brassinolides,BRs)可通过促进植物DNA,RNA和蛋白质的合成,增强酶的活性,从而提高植物的耐盐碱能力、耐旱和抗病性[7],进而缓解环境胁迫对植株的损伤[8]。宋建超等[9]研究表明添加外源2,4-表油菜素内酯(2,4-epibrassinolide,EBR)能够有效缓解100 mmol·L-1 NaCl胁迫对垂穗披碱草种子萌发和幼苗生长的抑制作用,以0.010和0.100 μmol·L-1 EBR处理效果最佳。吴春杏等[10]研究发现,喷施适当浓度2,4-表油菜素内酯可以有效缓解玉米盐胁迫,改善玉米光合作用,使其抗盐能力增强。EBR不仅可以提高老化燕麦种子活力[11],还能改善水稻对高温胁迫的耐受性[12]。但目前BR施用在牧草上特别是对盐胁迫赖草的影响尚未见报道。因此本研究对盐胁迫后的赖草喷施油菜素内酯,通过测定光合生理等指标的变化,探讨BR对盐胁迫赖草的缓减效应,并筛选修复盐胁迫损伤的最适BR浓度,为赖草种植于高浓度盐碱地提供理论依据。
1 材料与方法
1.1 试验材料及处理
‘晋北’赖草(Leymus secalinus ‘Jinbei’)种子采自山西农业大学草业学院试验田,试验于山西农业大学草业学院温室中进行。精选籽粒饱满且大小一致的赖草种子,用2%的次氯酸钠溶液浸泡消毒5 min,用无菌去离子水冲洗3遍后,均匀播种到装有5 kg混合基质(沙子∶蛭石=2∶1)的花盆内(直径30 cm,高20 cm),每个花盆均匀播种50粒。待出苗3周后定苗,留生长一致的幼苗20株,每周用Hoagland营养液浇灌一次。
根据前期研究结果[13],选择500 mmol·L-1的NaCl为处理组,对照组浇灌等量的蒸馏水,为了避免盐激反应。开始处理时每天以100 mmol·L-1递增,达到最终浓度后开始计算胁迫时间。赖草定苗5周后(即赖草出苗8周后)开始处理,每天下午通过称重来检测水分消耗并进行补充。NaCl胁迫15天后(赖草叶片表现出枯黄症状时),喷施不同浓度的BR,每个处理3次重复。试验采用随机区组排列,共设置如下6个处理:1)CK1,0 mmol·L-1NaCl+0 μmol·L-1BR;2)CK2,500 mmol·L-1NaCl+0 μmol·L-1BR;3)T1,500 mmol·L-1NaCl+0.05 μmol·L-1BR;4)T2,500 mmol·L-1NaCl+0.10 μmol·L-1BR;5)T3,500 mmol·L-1NaCl+0.15 μmol·L-1BR;6)T4,500 mmol·L-1NaCl+0.20 μmol·L-1BR。BR处理14 d后进行取样指标的测定。
1.2 测定指标及方法
1.2.1 表型数据的测定 每个处理随机选取3个植株,分别用卷尺和游标卡尺测定植株的株高(Plant height,PH)、茎粗(Stem diameter,SD)、叶长(Leaf length,LL)和叶宽(Leaf width,LW)。
1.2.2 相对电导率、丙二醛的测定 采用电导法测定相对电导率(Relative electric conductivity,REC),硫代巴比妥酸法测定丙二醛(Malonaldehyde,MDA)含量[14]。
1.2.3 脯氨酸、可溶性糖的测定 采用蒽酮比色法测定可溶性糖(Soluble sugar,SS)含量,酸性茚三酮法测定脯氨酸(Proline content,Pro)含量[14]。
1.2.4 叶绿素含量及净光合速率的测定 采用分光光度法测定叶绿素含量[14],利用便携式光合作用测量系统(Li-6400)进行净光合速率的测定。
1.2.5 活性氧代谢相关指标的测定 采用对氨基苯磺酸法测定超氧阴离子(Superoxide anion free radical,O-2),氮蓝四唑(NBT)比色法测定超氧化物歧化酶(Superoxide dismutase,SOD)活性,钼酸铵比色法测定过氧化氢酶(Catalase,CAT)活性,愈创木酚法测定过氧化物酶(Peroxidase,POD)活性[14]。
1.2.6 Na+,K+含量的测定 采用火焰分光光度计法测定Na+,K+含量。
1.3 数据处理
运用Excel 2021整理统计数据,使用软件SPSS 25.0对数据进行one-way ANOVA方差分析和Duncan多重比较检验、相关性分析和主成分分析,差异显著水平为0.05(Plt;0.05),使用软件Origin 2021作图。文中数据为平均值±标准偏差。
2 结果与分析
2.1 BR对盐胁迫赖草生长状况的影响
由图1及表1可知,500 mmol·L-1NaCl处理后,赖草生长受到一定影响,株高、茎粗、叶长、叶宽均显著减小(Plt;0.05)。随着BR浓度的增加,赖草株高呈现显著上升趋势(Plt;0.05),T4处理下达到最高为35.6 cm,相比于CK2,显著提高了18.27%(Plt;0.05);茎粗在BR不同浓度之间无差异,与CK1,CK2差异显著(Plt;0.05);叶长在T1-T3处理下有所增加,但与CK2无显著差异;叶宽在T2处理下有所增加,但与CK1,CK2均无显著性差别。
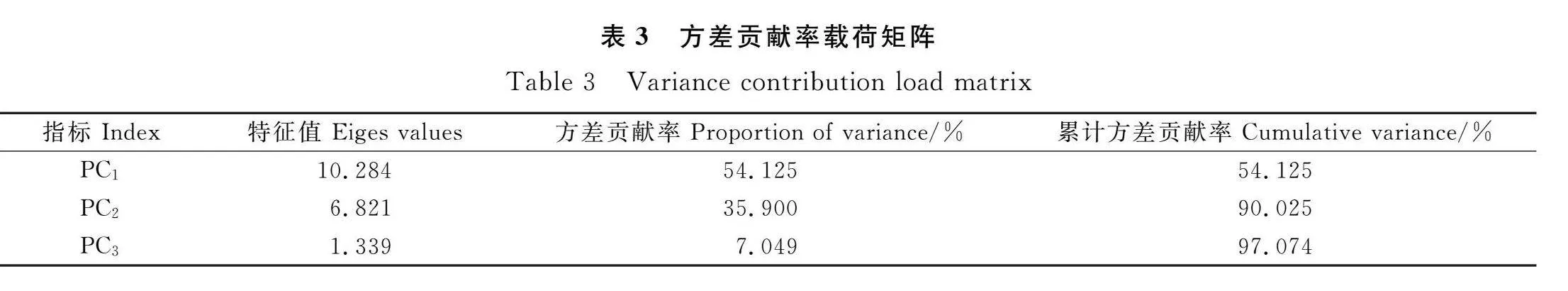
2.2 BR对盐胁迫赖草细胞膜透性的影响
500 mmol·L-1NaCl处理后,赖草叶片REC和MDA含量均显著增加(Plt;0.05)(图2)。随着BR浓度的增加,REC呈下降趋势,T2-T4处理下REC均显著低于CK2(72.90%)(Plt;0.05),在T3处理下达到最低,为51.59%,相比于CK2下降了29.23%(图2A)。MDA随着BR浓度的增加呈下降趋势,T2-T4处理下,MDA含量显著低于CK2(Plt;0.05),这说明BR处理后,膜脂过氧化程度有所减轻(图2B)。
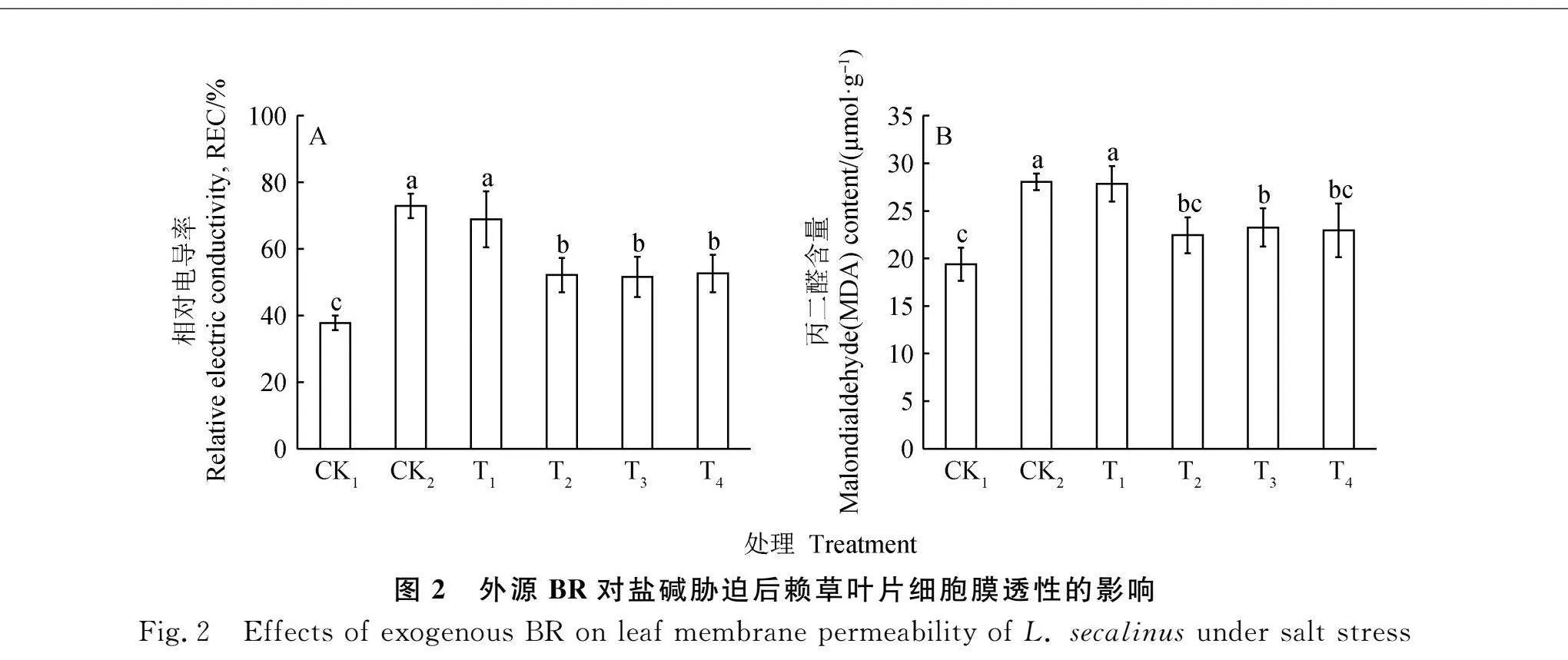
2.3 BR对盐胁迫赖草渗透调节物质的影响
500 mmol·L-1NaCl处理后,赖草叶片脯氨酸含量由488.34 μg·g-1(CK1)显著提高至674.70 μg·g-1(CK2)(Plt;0.05),可溶性糖含量由5.28 mg·g-1(CK1)显著提高至6.30 mg·g-1(CK2)(Plt;0.05)(图3)。对盐胁迫后赖草进行不同浓度BR处理,脯氨酸含量均显著高于CK2(Plt;0.05),T3处理下达到最高,为789.77 μg·g-1,相比于CK2增加了14.57%,相比于CK1增加了61.72%(图3A)。可溶性糖随着BR浓度增加含量有所增加,T1-T4处理下显著高于CK1(Plt;0.05),T4处理下显著高于CK2(Plt;0.05)(图3B)。
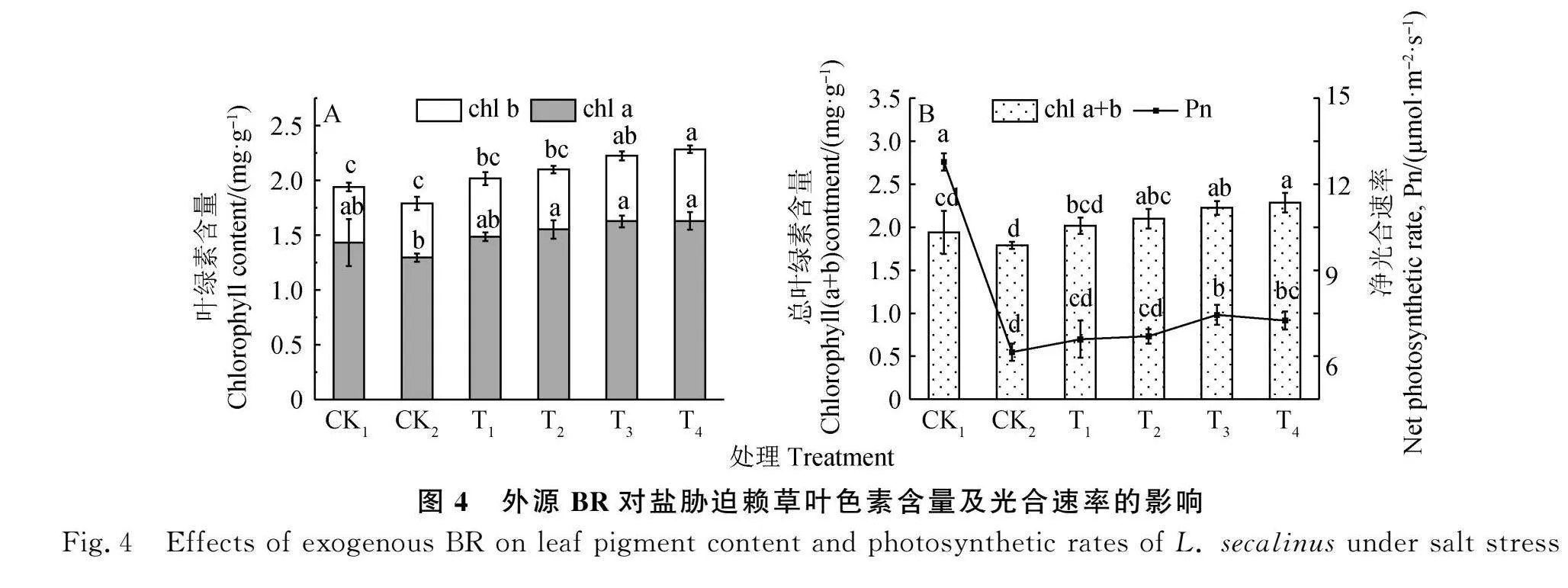
2.4 BR对盐胁迫赖草叶绿素含量及光合速率的影响
叶绿素含量在NaCl胁迫前后无显著变化,但净光合速率显著降低(Plt;0.05),CK2处理比CK1降低了49.04%(图4)。BR处理对Chl a,Chl b,Chl(a+b)含量和净光合速率均有提升作用,Chl a,Chl b,Chl(a+b)分别在T2,T4,T2处理下与CK2差异显著(Plt;0.05)(图4A-B)。净光合速率在T3处理下与CK2差异显著(Plt;0.05)(图4B),T1-T4处理均显著低于CK1(Plt;0.05),可以看出盐胁迫严重制约了赖草幼苗光合作用能力,BR对其损伤的缓减能力有限,未达到胁迫之前的水平。
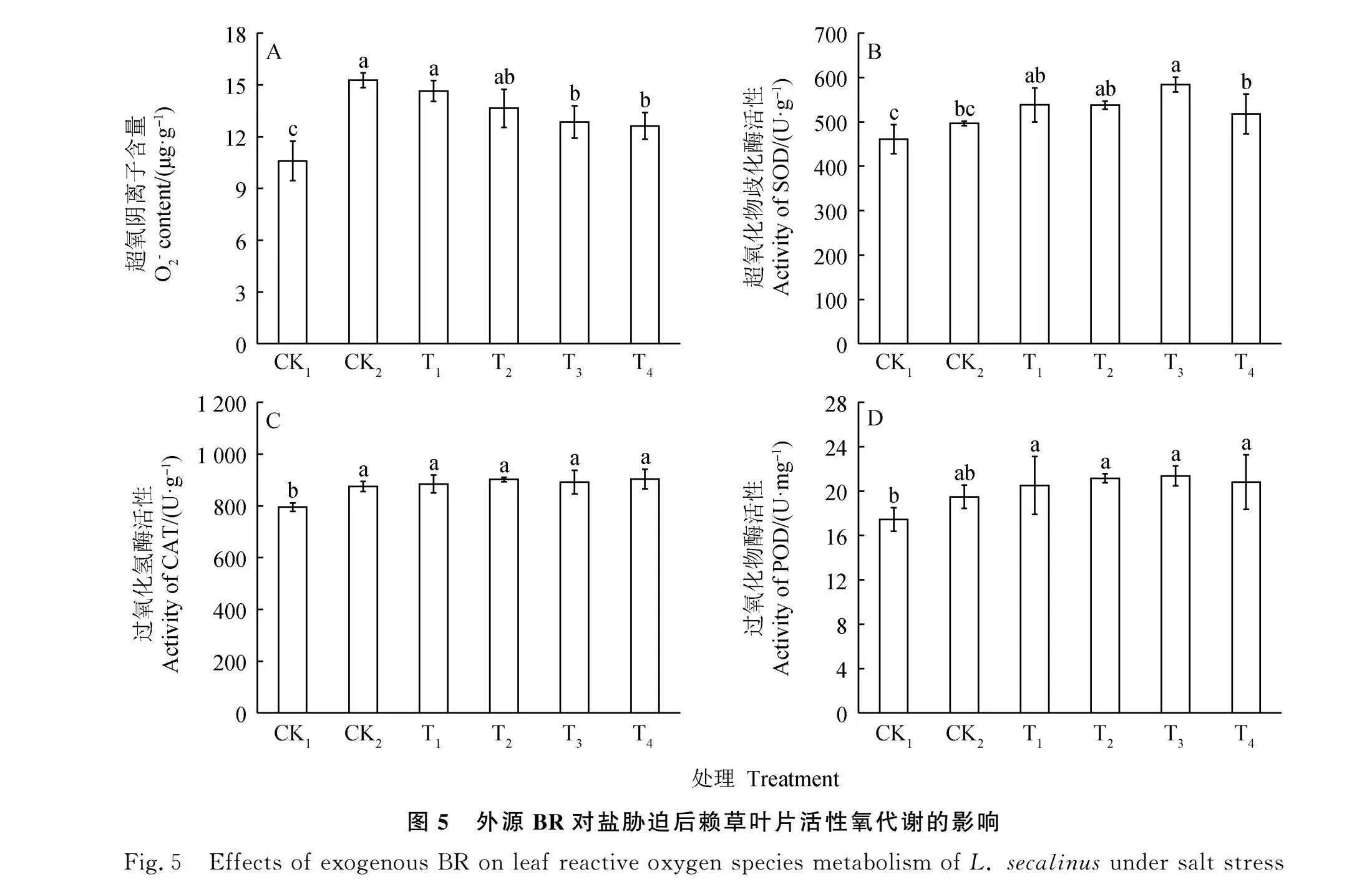
2.5 BR对盐胁迫后赖草活性氧代谢的影响
NaCl胁迫处理后,O-2含量较CK1显著增加,增加量达到44.15%(Plt;0.05),BR处理后,O-2含量随着BR浓度的增加呈现逐渐下降趋势,T3-T4处理下,O-2含量显著低于CK2(15.27 μg·g-1)(Plt;0.05),分别较CK2降低了15.81%,17.31%(图5A)。NaCl胁迫处理后,CAT活性较CK1显著增加,增加量达到了10.07%(Plt;0.05),SOD,POD活性在盐胁迫前后无显著变化;BR处理后,CAT,POD活性无显著变化(图5C-5D),T3处理下,SOD活性显著高于CK1,CK2(Plt;0.05)(图5B)。
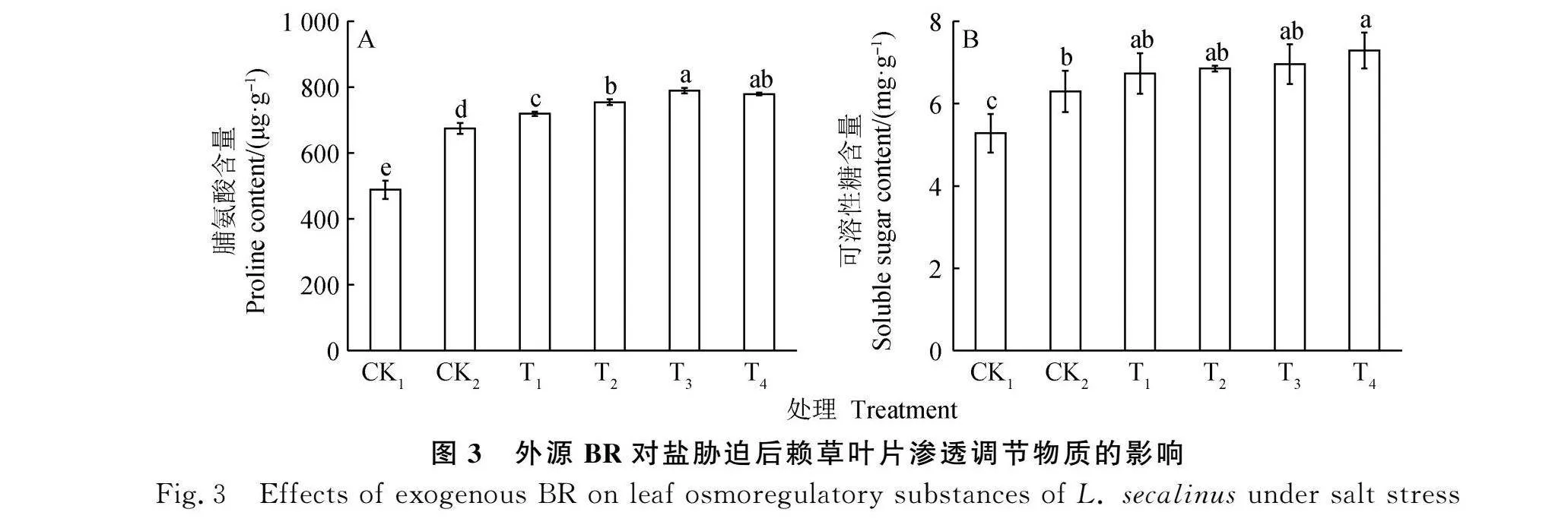
2.6 BR对盐胁迫后赖草叶片Na+,K+含量的影响
赖草叶片Na+含量在NaCl胁迫后显著增加,K+含量显著降低(Plt;0.05);BR处理后,Na+含量随着BR浓度增加呈现显著下降趋势,T4处理下Na+含量较CK2下降17.56%(Plt;0.05),K+含量随着BR浓度增加呈现上升趋势,T4处理,K+含量达到4.71 mg·g-1,较CK2提高了24.34%,且T2-T4处理下与CK1无显著差别(图6A)。
K+/Na+在NaCl胁迫后显著降低,随着BR浓度增加呈上升趋势(Plt;0.05),在T1-T4处理下显著高于CK2(图6B),可以看出,Na+,K+对BR的影响较为敏感,并且其效果非常显著。
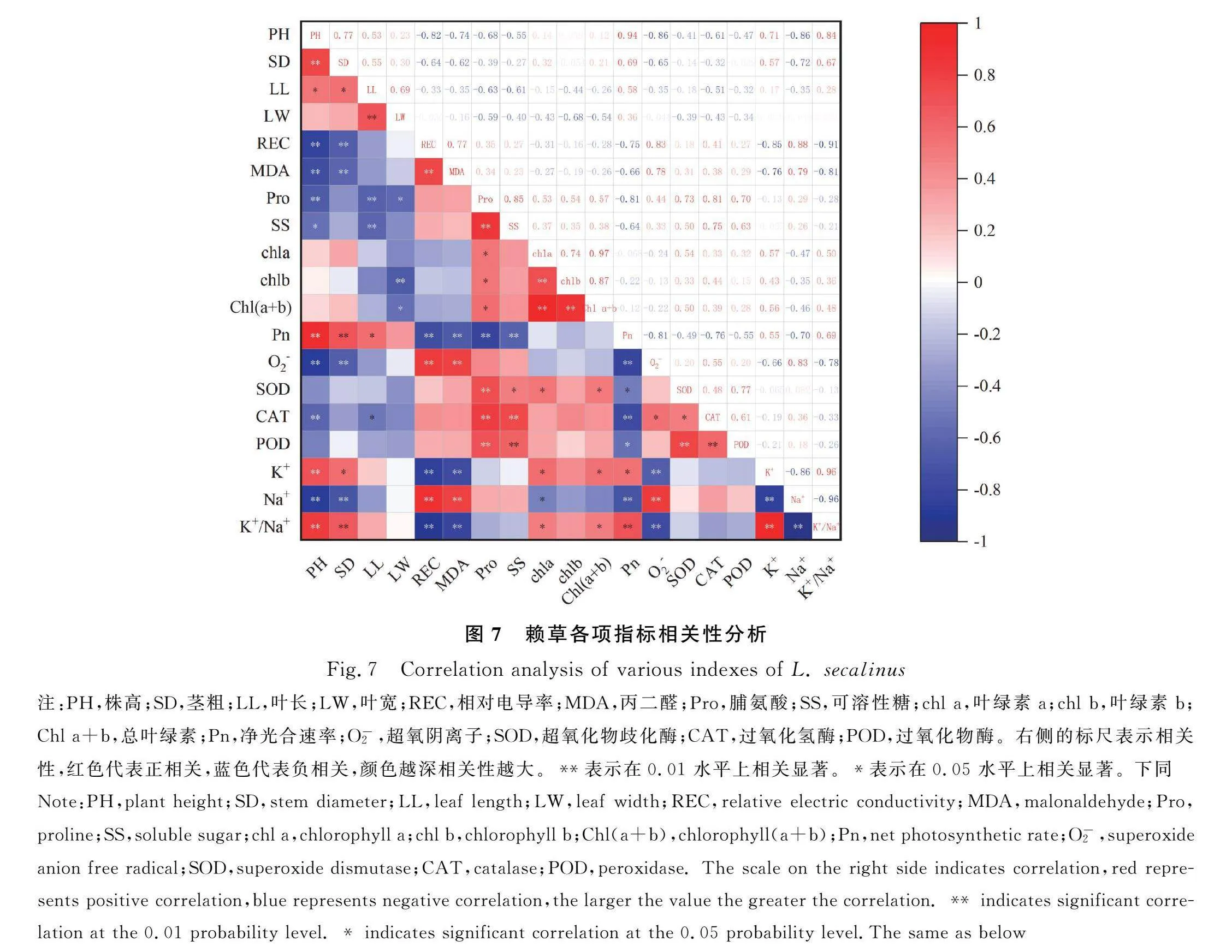
2.7 BR处理后赖草指标相关性分析
对赖草19个指标进行相关性分析,结果如图7所示。在赖草表型指标间、细胞膜透性指标间、细胞渗透物质指标间、各种叶绿素间、抗氧化酶间及离子运输指标间均呈极显著相关关系(Plt;0.01),说明这些类指标无论哪一个发生变化其他的同类指标都会发生改变。Na+含量、O-2含量和细胞膜透性指标呈极显著正相关关系(Plt;0.01),三者均与株高、茎粗呈极显著负相关关系(Plt;0.01),说明盐胁迫会引起细胞内O-2增加,破坏细胞膜透性,打破离子平衡,影响植物生长。渗透调节物质含量与抗氧化酶活性呈极显著正相关关系(Plt;0.01),表明盐胁迫下植物同时调动渗透调节系统和抗氧化系统,二者相辅相成。K+含量与Na+含量和细胞膜透性指标极显著负相关(Plt;0.01),表明赖草通过提高对K+的吸收来减低对Na+的吸收,缓解Na+胁迫,降低盐胁迫对细胞膜的破坏。
2.8 主成分分析
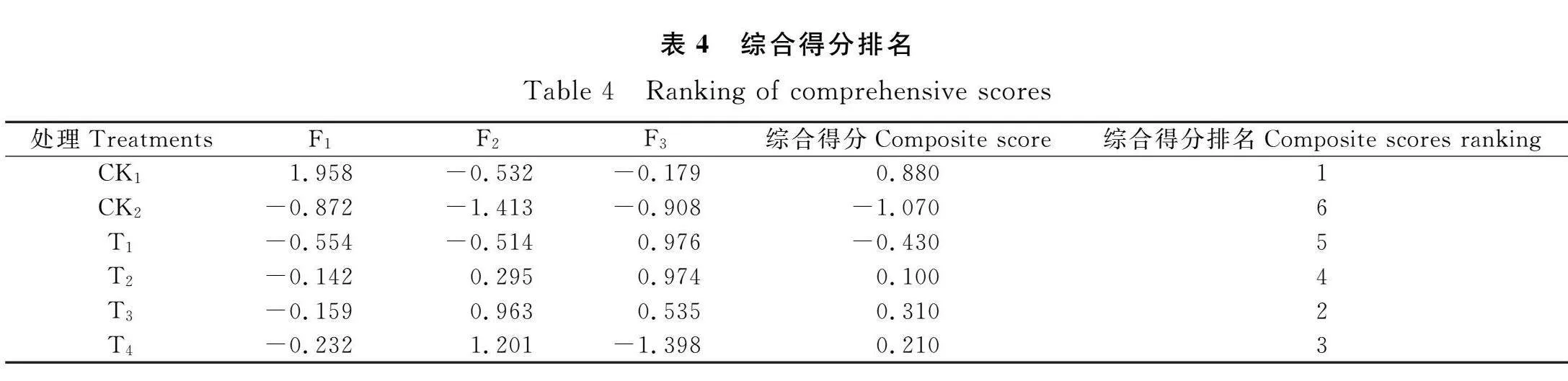
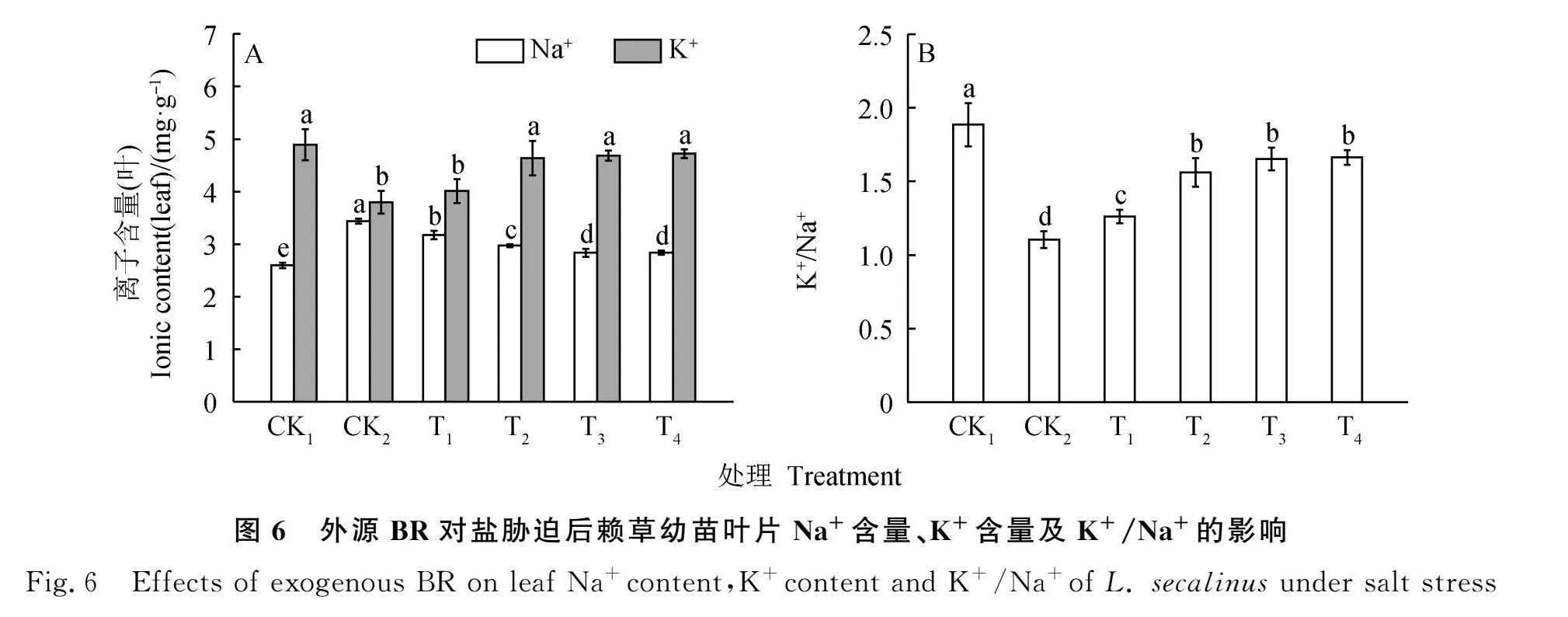
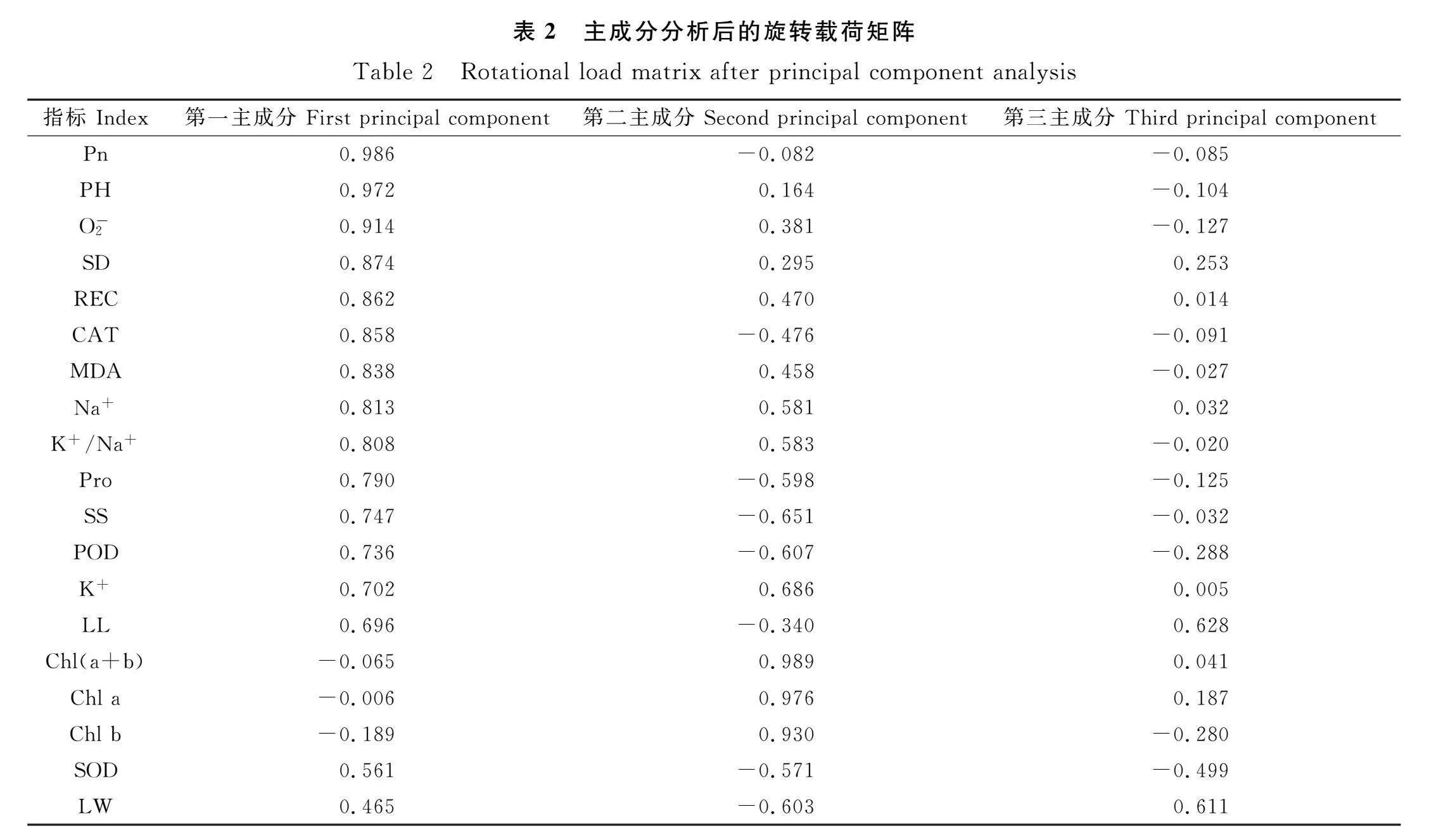
采用主成分降维的方法对BR处理后赖草19项指标进行分析。将累计方差贡献率大于80%,并且特征值≥1作为判别的条件,成功提取3项主成分因子。第一主成分(PC1)的特征值为10.284,贡献率为54.125%,第二主成分(PC2)的特征值为6.821,贡献率为35.900%,第三主成分(PC3)的特征值为1.339,贡献率为7.049%,3个主成分累计贡献率达97.074%,具有较好的代表性,与BR对赖草盐胁迫后的修复能力具有直接联系,可作为评价BR对赖草盐胁迫后修复能力的综合指标(表3)。第一主成分(PC1)综合了株高、茎粗、叶长、REC,MDA,O-2,CAT,POD,Na+,K+,K+/Na+,Pro,SS,第二主成分(PC2)综合了K+,Na+,K+/Na+,Pro,SS,POD等指标的信息,第三主成分(PC3)综合了叶长、叶宽等指标的信息(表2)。得分(F)是每个主成分得分与对应贡献率乘积之和,即F=F1×54.125%/97.074%+F2×35.900%/97.074%+F3×7.049%/97.074%(表3)。由表3可知,赖草在各处理下的综合得分排名为CK1gt;T3gt;T4gt;T2gt;T1gt;CK2,由此可得,在试验所设处理中,T3处理下盐胁迫后赖草的修复能力最好。
3 讨论与结论
3.1 BR对盐胁迫后赖草生长及光合的缓减效应
植物在受到非生物胁迫后,体内生理代谢会首先会做出响应。盐胁迫会导致叶绿素合成代谢减弱而降解代谢加强,引起叶绿素含量下降[15],离子胁迫和氧化胁迫会导致类囊体的紊乱和颗粒薄片的减少[16],叶绿体结构损伤,进一步抑制光合作用,加速叶片衰老。研究表明,植物中BR信号的减少会影响叶绿素合成,量子光子收集和光能转移,导致光合能力下降[17],外源BR处理可诱导叶绿素生物合成通路基因的上调表达以及降解通路基因的下调表达[18]。高战武等[19]的研究发现,盐胁迫下施用EBR能改善羊草光合色素、气体交换参数和叶绿素荧光参数指标,维持羊草光合作用。本试验中,NaCl胁迫后,赖草表型出现了变化,说明此时体内的生理代谢物质已经受到影响,测定结果发现叶绿素含量、光合作用均受到一定抑制;喷施BR后,赖草表型生长状况有所改善,叶绿素含量显著提高,T3处理下赖草生长状况、光合作用显著高于CK2,这与母德伟[20]对水稻的研究结果一致。
3.2 BR对盐胁迫后赖草氧化胁迫的缓减作用
植物细胞内活性氧(ROS)的积累是触发植物盐胁迫反应的初始信号[21],活性氧积累会造成膜脂过氧化,导致细胞膜透性增大,膜结构和功能受到损伤[22]。本试验研究显示,NaCl处理后,赖草叶片REC,MDA含量及O-2含量增加,说明盐胁迫后赖草膜脂过氧化严重,细胞膜受破坏。BR作为新型高效的植物激素,同时是一种抗氧化剂,可调控逆境胁迫下植株体的活性氧代谢平衡,更好地抵御逆境胁迫。雷新慧等[23]对荞麦种子进行了EBR浸种预处理,抑制了盐胁迫下荞麦幼苗MDA含量的增加;宋建超等[9]对垂穗披碱草的研究发现,EBR处理能够显著提高NaCl胁迫下垂穗披碱草幼苗脯氨酸、可溶性糖、可溶性蛋白含量和抗氧化酶活性,降低丙二醛含量,从而有效降低氧化损伤。赖草在盐胁迫后喷施BR,显著降低了叶片REC,MDA和O-2含量,表明BR处理可以有效缓解盐胁迫对赖草膜结构、膜功能带来的伤害,降低膜脂过氧化程度,减轻过氧化危害。
3.3 BR对盐胁迫后赖草离子胁迫、渗透胁迫的缓减作用
除了氧化胁迫,土壤中高离子浓度还会对植物造成离子胁迫和渗透胁迫。植物抵抗盐胁迫带来的细胞离子和渗透胁迫主要有两个方面:一是调节离子膜运输,增强K+的吸收,同时减少Na+的吸收及向叶子的转移,以保持最佳K+/Na+比,进而维持细胞渗透压和膨胀压力[24-25];另一方面通过合成渗透调节物质来激活渗透调节,如脯氨酸、可溶性糖等,这些渗透调节物质的含量与植物抗性高低有着直接关系[26]。寇江涛等[27]对紫花苜蓿的研究发现,盐胁迫下EBR处理可以增强有机物的合成和积累,促进对无机离子的选择性吸收和运输,维持体内的离子代谢平衡,提高苜蓿幼苗的耐盐性。尚秉琛等[28]对水稻幼苗的研究中发现,盐胁迫下喷施BR可有效提高蔗糖代谢,缓解渗透压并降低膜脂过氧化带来的损伤。本试验中,一定浓度BR处理后,赖草叶片脯氨酸含量、可溶性糖含量、K+含量显著高于CK1,Na+含量显著低于CK2,说明用BR处理盐胁迫后的赖草,可以有效调节植株内细胞质和液泡之间渗透势的平衡,用以抵抗离子胁迫及渗透胁迫。
植物对盐胁迫的响应是一个复杂的生理生化过程,仅通过单一指标、单一方面分析BR对赖草耐盐碱能力的提高较为片面[29]。采用多个指标进行评价,指标间又存在一定的相关性,且相关程度并不一致,所以采用主成分分析方法,将测定的19个单项指标转化为3个互为独立的综合指标,对各处理下赖草的耐盐碱能力进行鉴定与评价。对测定的19个指标进行主成分分析,根据综合评价可知,赖草在不同浓度BR处理下的综合得分排名T3gt;T4gt;T2gt;T1gt;CK2,T3处理(0.15 μmol·L-1 BR)能有效修复赖草的盐胁迫损伤。
综上,用BR处理盐胁迫后的赖草,能增强赖草防御保护机制,缓解盐胁迫对赖草带来的伤害,促进赖草生长,且0.15 μmol·L-1为最佳浓度。
参考文献
[1] WICKE B,SMEETS E,DORNBURG V,et al. The global technical and economic potential of bioenergy from salt-affected soils[J]. Energy amp; Environmental Science,2011,4(8):2669-2681
[2] 杨劲松,姚荣江,王相平,等. 中国盐渍土研究:历程、现状与展望[J]. 土壤学报,2022,59(1):10-27
[3] 王乙富. 壳聚糖改性生物炭促进盐胁迫下小麦种子萌发和幼苗生长[J]. 分子植物育种,2023,21(19):6493-6499
[4] YAO Y D,YANG Y,PAN Y,et al. Crucial roles of trehalose and 5-azacytidine in alleviating salt stress in tomato:Both synergistically and independently[J]. Plant Physiology and Biochemistry,2023,203:108075
[5] 杜利霞,赵凯玥,王凯鑫,等. 6-BA引发对赖草种子萌发、贮藏物质和内源激素的影响[J]. 草地学报,2020,28(3):667-674
[6] 曹亦芹,程碧真,李州. 胺鲜酯(DA-6)浸种对盐胁迫下白三叶种子萌发及抗盐性的影响[J]. 草地学报,2023,31(1):140-147
[7] SHARMA I,PATI P K,BHARDWAJ R. Effect of 2,4-epibrassinolide on oxidative stress markers induced by nickel-ion in Raphanus sativus L.[J]. Acta Physiologiae Plantarum,2011,33(5):1723-1735
[8] 孙珊珊,安勐颍,韩烈保,等. 外源2,4-表油菜素内酯对多年生黑麦草幼苗耐盐性的影响[J]. 草地学报,2014,22(5):1045-1050
[9] 宋建超,杨才艳,杨航,等. 外源2,4-表油菜素内酯对NaCl胁迫下垂穗披碱草种子萌发及幼苗生理特性的影响[J]. 草原与草坪,2023,43(6):121-129
[10]吴春杏,胡志辉,鲁寒英,等. EBR对盐胁迫下玉米幼苗光合及抗氧化系统的影响[J]. 江苏农业科学,2023,51(13):109-116
[11]李尹琳,王勃,夏方山,等. 外源油菜素内酯引发对老化燕麦种子萌发特性的影响[J]. 畜牧与饲料科学,2023,44(4):94-100
[12]THUSSAGUNPANIT J,JUTAMANEE K,KAVEETA L,et al. Comparative effects of brassinosteroid and brassinosteroid mimic on improving photosynthesis,lipid peroxidation,and rice seed set under heat stress[J]. Journal of Plant Growth Regulation,2015,34(2):320-331
[13]杜利霞,董宽虎,乔志宏,等. NaCl胁迫对赖草幼苗生理特性的影响[J]. 草原与草坪,2013,33(1):1-4,10
[14]王学奎. 植物生理生化实验原理和技术[M]. 第2版.北京:高等教育出版社,2006:74-223
[15]孙聪,郭金丽. 盐胁迫下欧李叶片叶绿素代谢与超微弱发光的关系[J]. 果树学报,2023,40(7):1411-1420
[16]ZAHRA J,NAZIM H,CAI S G,et al. The influence of salinity on cell ultrastructures and photosynthetic apparatus of barley genotypes differing in salt stress tolerance[J]. Acta Physiologiae Plantarum,2014,36(5):1261-1269
[17]ALI MUMTAZ M,MUNIR S,LIU G Z,et al. Altered brassinolide sensitivity1 transcriptionally inhibits chlorophyll synthesis and photosynthesis capacity in tomato[J]. Plant Growth Regulation,2020,92(2):417-426
[18]朱瑞婷,牛奎举,张娣君,等. 外源2,4-表油菜素内酯对镉胁迫下草地早熟禾叶绿素代谢的影响[J]. 草地学报,2021,29(4):635-643
[19]高战武,范春燕,鄢上钦,等. 盐碱胁迫下外源油菜素内酯与AM真菌对羊草光合特性及抗氧化酶系统的影响[J]. 山东农业科学,2022,54(5):44-52
[20]母德伟. 外源油菜素内酯缓解水稻幼苗盐胁迫伤害的机制[D]. 湛江:广东海洋大学,2022:65
[21]ZHAO S S,ZHANG Q K,LIU M Y,et al. Regulation of plant responses to salt stress[J]. International Journal of Molecular Sciences,2021,22(9):4609
[22]丁伟伦,陈慧英,汤坤贤,等. 盐胁迫下夹竹桃生理光合特性及生态修复应用[J]. 海洋开发与管理,2023,40(9):66-76
[23]雷新慧,万晨茜,陶金才,等. 褪黑素与2,4-表油菜素内酯浸种对盐胁迫下荞麦发芽与幼苗生长的促进效应[J]. 作物学报,2022,48(5):1210-1221
[24]NIKˇOLIC′ N,GHIRARDELLI A, SCHIAVON M,et al. Effects of the salinity-temperature interaction on seed germination and early seedling development:a comparative study of crop and weed species[J]. BMC Plant Biology,2023,23(1):446
[25]VAN ZELM E,ZHANG Y X,TESTERINK C. Salt tolerance mechanisms of plants[J]. Annual Review of Plant Biology,2020,71:403-433
[26]李瑞强,王玉祥,孙玉兰,等. 盐胁迫对5份无芒雀麦苗期生长和生理生化的影响及综合性评价[J]. 草业学报,2023,32(1):99-111
[27]寇江涛,康文娟,苗阳阳,等. 外源2,4-表油菜素内酯对NaCl胁迫下紫花苜蓿幼苗光合特性及离子吸收、运输和分配的影响[J]. 草业学报,2016,25(4):91-103
[28]尚秉琛,何昊,李丹丹,等. 油菜素内酯引发对盐胁迫下水稻幼苗生长及生理特性的影响[J]. 江西农业大学学报,2023,45(4):795-805
[29]赵昕玥,王晓敏,赵云雅,等. 不同地区小茴香苗期耐盐性综合评价及耐盐指标筛选[J]. 西北农林科技大学学报(自然科学版),2024,52(7):125-135
(责任编辑 闵芝智)

