陆地棉环核苷酸离子通道蛋白基因 GhCNGC8克隆及初步表达分析


摘 要 为明确环核苷酸门控离子通道蛋白基因GhCNCG8对棉花抗逆方面的作用。利用棉花叶片克隆获得该基因,生物信息学方法分析其理化性质、结构和进化关系,利用qRT-PCR(实时荧光定量)方法分析基因在黄萎病菌、干旱、盐胁迫以及激素诱导下GhCNCG8表达模式和组织表达特异性;构建该基因VIGS沉默载体,利用农杆菌介导方法转化该基因到棉花叶片中,荧光定量PCR方法检测沉默效率。以棉花叶片cDNA为模板成功克隆GhCNGC8基因,该基因开放阅读框为2 247 bp,编码748 个氨基酸。进化树分析结果表明,陆地棉GhCNGC8基因与拟南芥AtCNGC8基因关系较近,多序列结果比对显示,GhCNGC8蛋白结构符合CNGCs家族蛋白结构特征。qRT-PCR结果表明,该基因对黄萎病、干旱、盐处理等胁迫及茉莉酸(JA)、水杨酸(SA)和双氧水(H2O2)处理均有一定程度的响应,qRT-PCR分析结果表明,GhCNGC8基因在根、茎、叶、花、萼片和苞片中均有表达,叶中表达量最高。构建该基因的VIGS沉默载体转化棉花,qRT-PCR结果表明,该基因在棉花中已经沉默,表达量相比对照植株降低70%左右,表明GhCNGC8沉默载体构建成功并在棉花体内正常运行,GhCNGC8可能在棉花抗逆方面发挥重要作用。
关键词 棉花;GhCNGC8;基因克隆;表达分析;载体构建
环核苷酸门控离子通道(CNGCs)蛋白广泛存在于动植物体内,是钙离子传播途径之一。钙离子(Ca2+)是一种重要的第二信使,在植物中调节多种信号途径,如激素、病原菌、盐胁迫、光信号和昼夜节律。CNGCs是非选择性阳离子通道蛋白,由2 个或3 个不同类型的亚基形成异四聚体复合体,由环核苷酸(cAMP和cGMP)直接结合打开,并依赖Ca2+被钙调素和磷酸化所调节[1]。在植物中,CNGC由6 个跨膜(TM)结构域、位于第5和第6跨膜结构域之间的P环和钙调素结构域(CaMBD)以及环核苷酸结构域(CNBD)构成。环核苷酸(cNMP)是植物体内一种重要的第二信使,可以与CNBD相结合,从而激活CNGCs,促胞外Ca2+内流;当细胞内Ca2+过多时,CaM会结合到CaMBD处,从而钝化CNGC蛋白活性,抑制胞外Ca2+内流[2]。
作为一种阳离子通道蛋白,CNGC蛋白介导钙离子在细胞溶质中的积累以及将外部光学和气味信号转化为生物电信号[3-4]。在拟南芥中,AtCNGCs 参与了各种生物过程,调节生长和发育的不同方面,以及生物和非生物应激反应,如根毛尖生长、叶片生长和衰老、花的转变、花粉的极化生长、离子摄取和稳态,以及应对病原体和食草动物的攻击[5-6]。对低结实率的水稻突变体(sss1-D)研究表明, OsCNGC13可以通过促进花粉管在花柱组织中的生长来促进结实率。GhCNGCs基因家族广泛参与植物抗逆胁迫适应过程,在调节生物生长发育和环境响应方面发挥重要作用[7]。在水稻中,对一个天然突变体cds1的分离和鉴定表明, OsCNGC9介导细胞质钙离子升高,正向调控对稻瘟病的抗性[8]。在棉花中, GhCNGC1沉默增强了抗黄萎病和耐盐性, GhCNGC12沉默的植株则降低了对黄萎病和耐盐性的抗性[9]。目前对 GhCNGC8在棉花中的抗逆研究较少。病毒诱导的基因沉默技术(Virus-induced gene silencing, VIGS)是近年来发展迅速且应用广泛的一项RNA沉默技术[10]。VIGS技术不同于传统的植物基因功能研究方法,因其无需遗传转化及突变体获取,又具有操作简单、成本低、速度快、高通量等优势,已经成为开展基因功能研究最常用的技术手段之一。
棉花在全世界广泛种植,是天然纤维的主要来源,具有重要的经济价值。棉花在其生长周期中会遭遇各种生物胁迫和非生物胁迫,对其产量和品质造成巨大影响。发掘棉花抗逆相关基因并利用转基因手段创制抗性新种质对于棉花抗性育种具有重要意义。本研究从棉花叶片中克隆得到GhCNGC8基因,通过荧光定量PCR法分析该基因在棉花受到不同逆境胁迫和激素处理时的表达模式。同时构建该基因的 VIGS 沉默载体并通过农杆菌介导侵染棉花获得沉默植株,为进一步验证棉花 GhCNGC8基因的生物学功能奠定基础。
1 材料与方法
1.1 材料
供试材料为TM-1,由新疆农业科学院核技术生物技术研究所农作物生物技术重点实验室提供。大肠杆菌菌种DH5α、农杆菌菌种GV3101、BP反应入门载体、VIGS干涉技术载体pTRV1和pTRV2等均属于商品化菌株或载体。质粒提取试剂盒、oligo(dT)18、RNAase抑制剂、dNTP、pMD18-T Vector、T4-DNA连接酶、内切酶EcoRI和KpnI、ExTaq酶、PCR产物回收试剂盒等均为TaKaRa公司产品,荧光定量PCR试剂盒为TOYOBO公司产品;卡那霉素、庆大霉素、MES、乙酰丁香酮、MgCl2 及培养基配制等化学试剂均为国产分析纯。
1.2 方 法
1.2.1 棉花种植及胁迫和激素处理
将TM-1棉花种子水中浸泡24 h后播种于营养土中,12 h光照/12 h黑暗,温度为26" ℃~28" ℃光照培养。湿度保持在60%及以上,7 d浇1次水,在幼苗两叶一心时选取长势及大小一致的棉苗,黄萎病菌胁迫处理参照邵武奎等[11] 的方法,盐处理参照李月等[12]的方法,干旱处理参照王娜等[13]的方法,激素处理分别用200" μmol/L茉莉酸、2 mmol/L水杨酸、1 mmol/L H2O2处理10 min、清水(MOCK)浸泡棉苗根系之后将棉苗继续种植于营养钵中。各组处理均在0.5 h、1 h、 3 h等时间点取棉花根系,提取RNA后反转录为cDNA进行表达模式分析。
1.2.2 棉花总RNA的提取与cDNA第一链的合成
将液氮内收集的各组织在研钵中研磨成粉末,使用北京天根公司的RNAperp Pure Plant Kit提取试剂盒提取RNA,提取步骤参照说明书。RNA 的质量和完整性使用 Thermo Scientific(NanoDrop 1000)核酸分析仪和1.2%琼脂糖凝胶电泳进行检测。选择高质量的 RNA 进行反转录。使用全式金公司Removal and cDNA Synthesis Super Mix试剂盒进行cDNA第一链的合成,具体步骤参照说明书。
1.2.3 陆地棉" GhCNGC8基因的克隆及生物信息学分析
根据笔者前期的转录组数据,使用Primer 5软件设计特异性引物,以上述棉花叶片cDNA作为模板,使用高保真聚合酶TransStart FastPfu DNA Polymerase进行PCR扩增。PCR扩增体系为:高保真聚合酶1 μL、正向引物1 μL、反向引物 1 μL、Buffer 10 μL、2.5 mmol/L dNTPs 4 μL、cDNA 1 μL 和 dd H2O 补齐至 50 μL。PCR 扩增程序:95" ℃ 2 min;98" ℃ 20 s,57" ℃ 30 s,72" ℃ 120 s,循环 35 次;72" ℃ 5 min;4" ℃ 保存。扩增产物经过1 %凝胶电泳检测后,回收目的条带,连接 pEASY-Blunt-Zero 克隆载体,转化到大肠杆菌感受态细胞中,挑选单克隆提取质粒进行酶切鉴定,将正确阳性质粒送至上海生工公司进行测序。
GhCNGC8蛋白质理化性质预测利用网站(http://web.expasy.org/protparam/)进行在线程序计算 。蛋白质信号肽预测分析使用SignalP(http://www.cbs.dtu.dk/services/SignalP)在线程序。跨膜结构利用在线软件TMHMM(http://www.cbs.dtu.dk/services/ TMHMM/)进行预测。选取拟南芥AtCNGC8(NP_001323012.1)、陆地棉GhCNGC8(Gh_A05G1012.1)、黄褐棉GmCNGC8(XP_040874262.1)、玉米ZmCNGC8(NP_001152538.2)、小麦TaCNGC8(XP_044377681.1)、水稻OsCNGC8(XP_015612168.1)、海岛棉GbCNGC8(KAB2081333.1)、雷蒙德氏棉GrCNGC8(XP_012448061.1)、树棉GaCNGC8(XP_017605331.1),利用MEGA11和GENE DOC软件进行序列多重比对,利用MAGA11软件构建系统进化树,并利用Bootstrap对各分支可靠性进行检测。
1.2.4 荧光定量PCR
通过Primer 5软件设计 GhCNGC8特异性检测引物。以cDNA为模板," UBQ7基因[14]为内参基因,使用ABI Step one 系统,采用北京全式金公司TransScript Green One-Step qRT-PCR SuperMix 试剂盒进行荧光定量PCR,依据目的基因和内参基因Ct值,利用2-ΔΔCt 法计算基因的相对表达量[15]。目的基因和内参基因荧光定量引物见表1。
1.2.5 陆地棉GhCNGC8基因片段克隆和VIGS载体构建
载体构建参照李名江等[16]和胡子曜等[17]进行。根据棉花 GhCNGC8序列,目的基因靶标序列利用SGN-VIGS 在线软件(https://vigs.solgenomics.net)设计完成。在其上下游片段5′端分别引入EcoRI 和 KpnI酶切位点,以棉花cDNA片段为模板,扩增得到目的片段。将目的片段连接到‘B-Zero’克隆载体上,构建重组载体 B-Zero- GhCNGC8,并转化入大肠杆菌Trans-T1感受态细胞,涂板后挑单克隆进行菌液PCR,然后进行双酶切鉴定。挑选正确质粒送上海生工进行测序。提取测序正确的质粒和烟草脆裂病毒 pTRV2 空载体质粒,双酶切后回收目的片段和线性化pTRV2质粒, 目的片段与线性质粒使用T4连接酶进行4 ℃过夜连接,将构建好的载体转入大肠杆菌Trans-T1 感受态细胞并进行酶切验证,提取质粒并采用冻融法转入‘GV3101’农杆菌感受态细胞,挑选单克隆进行PCR验证。将验证正确的农杆菌扩繁并加入70%的甘油,保存于-80 ℃,备用。
1.2.6 农杆菌介导的VIGS侵染棉花及沉默效率检测
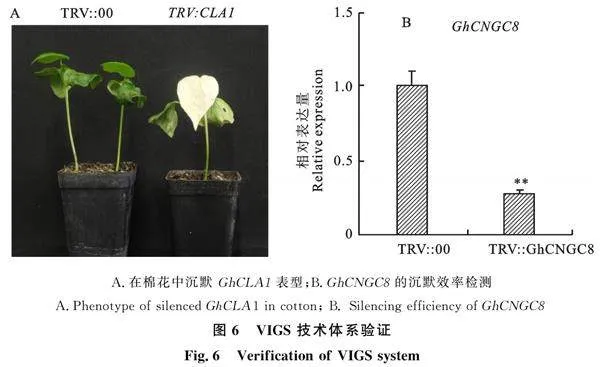
参照李秀青等[18]的方法将重组质粒TVR2- GhCNGC8、阳性对照TVR2-CLA1和阴性对照(TRV2)与TVR1 按照同浓度按体积1∶1混合侵染棉花叶片,侵染棉花叶片15 d左右,阳性对照TVR2-CLA1出现叶绿素缺失导致的白化表型,拍照记录。取阴性对照和试验组第二片真叶,每个样本取3个技术重复。提取RNA并反转录为cDNA。利用荧光定量方法检测沉默效率,检测引物见表1。
2 结果与分析
2.1 GhCNGC8基因克隆和生物信息学分析
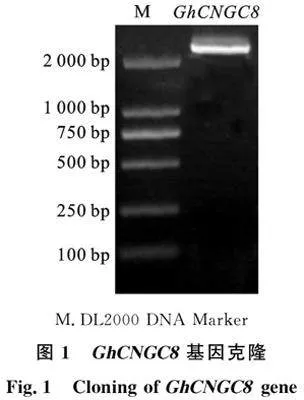
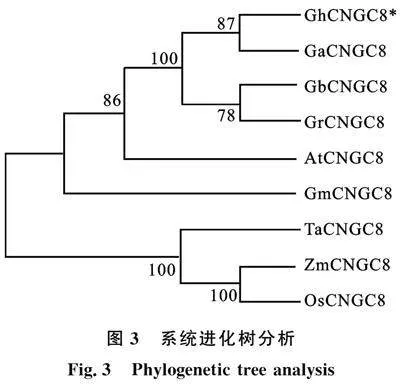
以陆地棉遗传标准系TM-1的叶片cDNA为模板进行PCR扩增,扩增片段大小符合预期(图1)。经测序,结果与目标基因转录组拼接数据一致,表明该目的片段为目标基因GhCNGC8(Gh_A05G1012)。表2为棉花" GhCNGC8的生物信息学分析,从表中可以看出,该基因开放阅读框为2 247 bp,编码748个氨基酸,相对分子质量85.93 ku,理论等电点8.95,平均疏水性为负值,表明该蛋白为碱性亲水性蛋白,拥有信号肽的概率为0.002 5,亚细胞定位预测结果显示该蛋白定位在细胞膜上。由图2可知, 多重序列比对显示该蛋白含有6个跨膜(TM)结构域、1个p环,该蛋白质C端含有钙调素结构域(CaMBD)、环核苷酸结构域(CNBD)和CaM结合位点异亮氨酸-谷氨酸胺IQ,符合CNGCs结构特征。系统进化树分析结果表明(图3),GhCNGC8蛋白与其他棉花种关系同源性最高,其次与拟南芥AtCNGC8同源性较高。
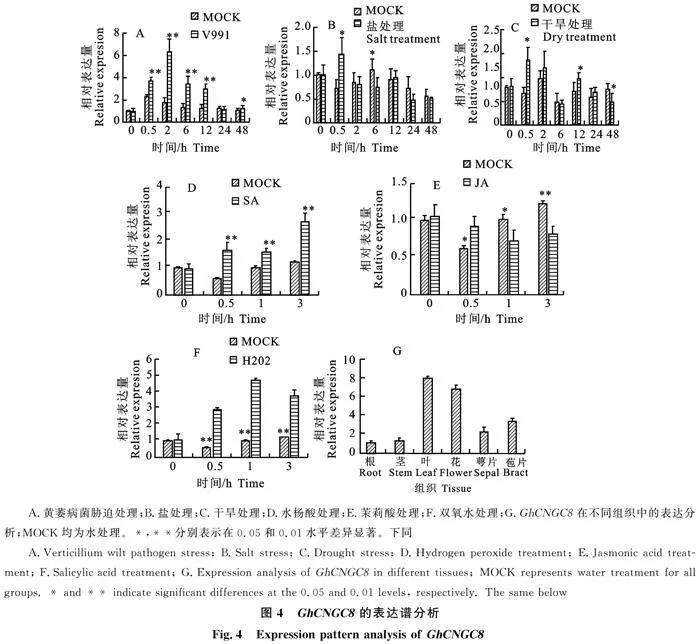
[2.2 GhCNGC8基因的表达模式分析
利用qRT-PCR技术检测 GhCNGC8在不同处理下的表达模式,结果表明,GhCNGC8基因对不同胁迫处理及激素处理均有应答反应。从图4-A可以看出,在黄萎病菌处理下, GhCNGC8表达量先增加后降低,在2 h处理下最高,极显著高于对照。在盐胁迫处理下, GhCNGC8表达量呈现先增高后降低的趋势,0.5 h处理最高,显著高于对照,与0 h相比,0.5 h表达量增高1.5 倍(图4-B)。在干旱处理下,GhCNGC8表达量呈先增高后降低,0.5 h表达量最高,0 h和24 h表达量基本一致,低于其他时间(图4-C)。水杨酸处理下,随着处理时间延长, GhCNGC8的表达量显著增加,与0 h相比,3 h表达量增加2.5倍(图4-D)。在茉莉酸处理下,GhCNGC8表达量有一定程度下降,与0 h相比,GhCNGC8表达量在3 h下降0.6倍(图4-E),与对照相比,0.5 h和3 h有显著性差异。与黄萎病处理相同,H2O2处理下 GhCNGC8表达量先增加后降低,与0 h相比,1 h表达量上升4.3倍(图4-F)。 GhCNGC8在不同组织中的表达变化表明, GhCNGC8基因在叶、花和苞片中表达量较高,叶中表达量最高,根、茎和萼片中处于低水平表达(图4-G),表明该基因存在组织表达特异性。
2.3 GhCNGC8沉默载体构建和技术验证
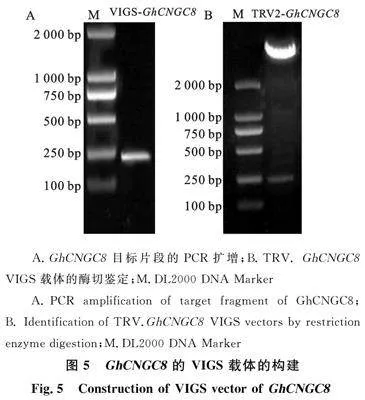
利用增加酶切位点引物将 GhCNGC8靶序列进行PCR扩增,PCR产物经琼脂糖凝胶电泳验证后表明大小符合预期(图5-A),将目标序列克隆并测序,结果与目标片段一致。经EcoRI和KpnI酶切阳性质粒后将目标片段连接到VIGS沉默载体中,进行双酶切验证,出现两条目标条带(图5-B),一条远超2 000 bp,另一条约在250左右,结果符合预期,说明VIGS载体构建成功。将构建好的VIGS载体转入到农杆菌中。
待棉花第一片真叶未出现之前,将TRV:GhCNGC8、TRV:CLA1、TRV:RNA2与TRV:RNA1相同浓度等体积混合,用注射器注射到棉花子叶中,两周后观察棉花表型,发现新长出的棉花真叶已经白化(图6-A),此时利用qRT-PCR技术检测"GhCNGC8在棉花体内的表达量,结果表明,GhCNGC8的表达量已经远低于对照水平(图6-B)。证明构建好的VIGS载体已经在棉花体内正常运行,成功获得了GhCNGC8沉默植株。
3 讨" 论
植物CNGC家族在发育和应对外界非生物胁迫方面发挥重要作用,包括冷、热、干旱、激素、光周期和共生现象[19]。有关研究证明CNGC家族是控制细胞内钙库进入胞质内外的主要途径,和多种植物抗逆活动相关联[20]。前人研究表明,拟南芥CNGC6通过促进高温胁迫下Ca2+流入细胞质,中度高温会提高细胞质中cAMP(cyclic adenosine monophosphate)水平[21]。沉默棉花 GhCNGC82和 GhCNGC31的表达减弱了棉花对黄萎病抗性和耐盐性[9]。 OsCNGC9能介导胞质钙升高,正向调控水稻稻瘟病抗性, OsCNGC9过表达增强了水稻PTI(病原体相关分子模式(PAMP)触发免疫)和稻瘟病抗性[22]。前人研究表明[23],CNGC家族基因在调控棉花抗逆方面具
有差异表达和功能多样性。有关棉花GhCNGC8相关的抗逆研究较少。本研究从转录组数据中获得一个棉花抗逆基因 GhCNGC8。利用同源克隆技术得到该基因,其开放阅读框为2 247 bp,编码748个氨基酸,通过分析其理化性质得到该基因分子质量85.93 ku,理论等电点位8.95,平均疏水性为负值,表明该蛋白为碱性亲水性蛋白,利用在线软件分析得到该蛋白拥有信号肽的概率为0.002 5,推测该蛋白不含信号肽,不属于分泌蛋白,亚细胞定位预测结果显示该蛋白定位在细胞膜上。植物CNGC结构包括6个跨膜结构域 (S1~S6),其中S4区域发挥电压传感器作用[24]。环核苷酸结构域(CNBD)位于C末端,由3个α螺旋和2个β折叠构成。植物钙调素结构域(CaMBD)同样位于C端,且序列分析证明和CNBD存在一定程度重叠,不同CNGC基因CaMBD数量有所不同,如AtCNGC12发现3个CaMBDs,这可能和CNGC功能有关[25]。多序列比对显示该蛋白含有6个跨膜(TM)结构域、一个p环,该蛋白质C端含有CaMBD、(CNBD)和CaM结合位点异亮氨酸-谷氨酸胺IQ,符合CNGCs基本结构特征。进化树分析表明该基因与拟南芥 AtCNGC8关系较近。
前人研究证明,植物诱导蛋白的表达通常和耐受性相关,基因表达模式通常是功能的指标[26]。本研究通过qRT-PCR技术探究了 GhCNGC8基因在不同组织以及黄萎病、盐胁迫和干旱等3种胁迫下的表达模式。GhCNGC8在不同组织特异性表达,在一定程度上可以反应该基因在棉花生长发育中的作用,该基因在棉花根、茎、叶片、花、萼片和苞片中均有表达,推测该基因可能在棉花生长发育中发挥重要作用。前人研究表明拟南芥 AtCNGC2和AtCNGC4在调节花转变、花粉生长和花粉管伸长发挥重要作用[27]。该基因在叶和花中表达量显著高于其他组织,花中表达量较高暗示该基因可能与棉花生殖生长有关。本研究表明 GhCGNC8棉花转录本受黄萎病菌、盐胁迫和干旱等胁迫处理影响,且在不同处理下存在一定差异, CNGC家族作为一种钙离子通道蛋白,可能在植物调控抗逆信号网络中存在重要作用,该基因在黄萎病菌处理下反应最为强烈,建议后续研究主要关注该基因与黄萎病的关系。
植物在应对外界胁迫过程中激素起到了重要信号转导的作用,JA、SA作为核心成员是目前研究最多的两条防卫途径。前人研究表明,茉莉酸信号通路中LOX、AOS、 MYC2等基因与黄萎病呈正相关,棉花植株在感染黄萎病后体内也聚集了大量的茉莉酸[28]。水杨酸通过调节NPR3和NPR4介导的NPR1的降解,将其保持在适当水平调控植物免疫应答反应[29]。低浓度过氧化氢作为一种信号分子,可以触发植物对各种外界胁迫的抗性[30]。本研究分析了3种激素诱导下该基因的表达情况,结果表明,在H2O2处理下,GhCNGC8表达量显著性增加,与0 h相比,1 h表达量增加5倍。在水杨酸处理下, GhCNGC8表达量同样显著性增加。Chen等[31]发现,陆地棉GhCNGC4表达量受到水杨酸处理时显著性增加,茉莉酸处理对 GhCNGC4表达量没有显著性影响。GhCNGC40受到茉莉酸和水杨酸处理后表达量呈显著性下降[9],上述结果与本研究有所不同,可能与CNGC家族基因功能复杂性有关。CNGC家族不同成员的抗逆分子模式相同,但在抗逆作用中存在冗余现象[32]。该基因与水杨酸和双氧水关系较为密切,推测该基因可能通过调节水杨酸和双氧水激素信号通路途径调节GhCNGC8抗逆功能。
4 结" 论
本研究克隆得到棉花环核苷酸门控离子通道蛋白基因GhCNGC8,生物信息学分析得到该基因开放阅读框为2 247 bp,编码748个氨基酸。系统进化树分析表明该基因与拟南芥AtCNGC8关系较近,多重序列比对显示该蛋白含有6个跨膜(TM)结构域、一个p环,该蛋白质C端含有钙调素结构域(CaMBD)、环核苷酸结构域(CNBD)和CaM结合位点异亮氨酸-谷氨酸胺IQ,符合CNGCs结构特征。GhCNGC8[QX)]在棉花根、茎、叶、花、萼片和苞片中均有表达,且在叶中表达量最高。该基因响应黄萎病菌、盐和干旱等逆境胁迫,同时对茉莉酸、水杨酸和H2O2等信号分子也有不同程度反应。
参考文献 Reference:
[1] KAUPP U B,SEIFERT R.Cyclic nucleotide-gated ion channels[J].Physiological" Reviews,2002,82(3):769-824.
[2]FISCHER C,DEFALCO T A,KARIA P,et al.Calmodulin as a Ca2+" Sensing subunit of Arabidopsis cyclic nucleotide-gated channel complexes[J].Plant Cell Physiology,2017,58 (7):1208-1221.
[3]CHRISTEN C Y" Y,DAVID A C.The group IV-A cyclic nucleotide-gated channels,CNGC19 and CNGC20,localize to the vacuole membrane in" Arabidopsis thaliana[J].Aob Plants,2013,5:12.
[4]MICHALAKIS S,BECIROVIC E,BIEL M.Retinal cyclic nucleotide-gated channels:from" pathophysiology to therapy[J].Internatinal Journal of Molecular Science,2018,19(3):749.
[5]DUSZYN M,SWIEZAWSKA B,SZMIDT-JAWORSKA A,et al.Cyclic nucleotide gated channels (CNGCs) in plant signalling current knowledge and perspectives[J].Journal of Plant Physiology,2019,241:153035.
[6]JHA S K,SHARMA M,PANDEY G K.Role of cyclic nucleotide gated channels in stress management in plants[J].Current Genomics,2016,17(4):315-329.
[7]LEI C,WENWEN W,HAILUN H,et al.Genome-wide" identification,characterization and experimental expression analysis of CNGC gene family in gossypium.[J].Internatinal Journal of Molecular Science, 2023,24(5):4617.
[8]安立昆,任晴雯,姚晓华,等.青稞酸性磷酸酶基因HvnACP2 克隆和亚细胞定位研究[J].西北农业学报,2023,32(10):1534-1543.
AN L K,REN Q X,YAO X H,et al.Cloning and subcellular localization of acid phosphatase-encoding gene HvnACP2 in hulless barley[J].Acta Agriculturae Boreali-occidentalis Sinica,2023,32(10):1534-1543.
[9]ZHAO J H,PENG S,CUI H T.Dynamic expression,differential regulation and functional diversity of the CNGC family genes in cotton[J].Internatinal Journal of Molecular Science,2022,23(4):2041.
[10] 李 姣,于宗霞,冯宝民.植物中病毒诱导基因沉默技术的研究与应用进展[J].分子植物育种,2019,17(5):1537-1542.
LI J,YU Z X,FENG B M.Advances in research and application of virus induced gene silencing in plants[J].Molecular Plant" Breeding,2019,17(5):1537-1542.
[11]邵武奎,赵 准,胡文冉,等.陆地棉钙依赖蛋白激酶GhCDPK28-A10参与抗黄萎病的功能分析[J].棉花学报,2023,35(1):17-28.
SHAO W K,ZHAO ZH,HU W R,et al.Functional analysis of cotton calcium-dependent protein kinas e GhCDPK28-A10 involved in resistance to Verticillium wilt[J].Cotton Science,2023,35(1):17-28.
[12]李 月,吾尕力汗·阿不都维力,周垚均,等.陆地棉小GTP结合蛋白基因" [QX(Y15] GhRop4 [QX)]的克隆及其表达分析[J].棉花学报,2020,32(1):21-29.
LI Y,WUDAERHAN ABUDUOWEILI,ZHOU Y J,et al.Molecular cloning and expression analysis of a small GTP-binding protein gene [QX(Y15] GhRop4[QX)]" in Gossypium hirsutum.L[J].Cotton Science,2020,32(1):21-29.
[13]王 娜,赵资博,高 琼,等.陆地棉盐胁迫应答基因GhPEAMT1的克隆及功能分析[J].中国农业科学,2021, 54(2):248-260.
WANG N,ZHAO Z B,GAO Q,et al. Cloning and functional analysis of salt Stress response gene GhPEAMT1 in upland cotton[J].Scientia Agricultura Sinica,2021, 54(2):248-260.
[14]袁 伟,万红建,杨悦俭.植物实时荧光定量 PCR 内参基因的特点及选择[J].植物学报,2012,47(4):427-436.
YUAN W,WANG H J,YANG Y J.Characterization and selection of reference genes for real-time quantitative RT-PCR of plants[J].Chinese Bulletin of Botany,2012, 47(4):427-436.
[15]LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-delta delta C(T)) method [J].Methods,2001, 25(4):402-408.
[16]李名江,雷建峰,祖丽皮耶·托合尼亚孜,等.棉花 [QX(Y15] GhIQM1[QX)]基因克隆及抗黄萎病功能分析[J].作物学报,2022,48(9):2265-2273.
LI M J,LEI J F,ZULIPIYE TUOHENIYAZI,et al. Cloning and functional verification of" [QX(Y15] GhIQM1[QX)]" gene of cotton in response to verticillium wilt[J].Acta Agronomica Sinic,2022,48(9):2265-2273.
[17]胡子曜,代培红,刘 超,等.陆地棉小GTP结合蛋白基因 [QX(Y15] GhROP3[QX)]的克隆、表达及VIGS载体的构建[J].生物技术通报,2021,37(9):106-113.
HU Z Y,DAI P H,LIU CH,et al.Molecular cloning,expression and VIGS construction of a small GTP-binding protein gene" [QX(Y15] GhROP3[QX)]" in Gossypium hirsutum[J].2021,Biotechnology Bulletin,2021,37(9):106-113.
[18] 李秀青,李 月,刘 超,等.棉花黄萎病相关基因GhAAT的克隆与功能鉴定[J].分子植物育种,2020,18(4):1048-1053.
LI X Q,LI Y,LIU CH,et al.Cloning and functional identification of cotton verticillium wilt related gene GhAAT[J].Molecular Plant Breeding,2020,18(4):1048-1053.
[19]JAMMES F,HU H C,VILLIERS F,et al.Calcium-permeable channels in plant cells[J].FEBS Press Journal,2011,278(22):4262-4276.
[20]CHARPENTIER M,SUN J,MARTINS T" V,et al.Nuclear-localized cyclic nucleotide-gated channels mediate symbiotic calcium oscillations[J].Science,2016,352 (6289):1102-1105.
[21]GAO F,HAN X W,WU J H,et al.A heat-activated calcium-permeable channel-Arabidopsis cyclic nucleotide-gated ion channel 6-is involved in heat shock responses[J].The Plant Journal,2012,70(6):1056-1069.
[22]WANG J,LIU X,ZHANG A,et al.A cyclic nucleotide-gated channel mediates cytoplasmic calcium elevation and disease resistance in rice[J].Cell Research,2019,29:820-831.
[23]ZHAO J,PENG S,CUI H,et al.Dynamic expression,differential regulation and functional diversity of the CNGC" family genes in cotton[J].Internatinal Journal of Molecular Science,2022,23(4):2041.
[24]KAUPP U B,SEIFERT" R.Cyclic nucleotide-gated ion channels[J].Physical" Reviews,2002,82 (3):769-824.
[25]DEFALCO T A,MOEDER W,YOSHIOKA K.Opening the gates:Insights into cyclic nucleotide-gated channel-mediated signaling[J].Trends Plant Science,2016,21 (11):903-906.
[26]LI J B,LUAN Y S,LIU Z.Overexpression of SpWRKY1 promotes resistance tophytophthora nicotianae and tolerance to salt and drought stress in transgenic tobacco[J].Physiologia Plantarum,2015,153(3):248-266.
[27]WU Y,YIN H,LIU X,et al.P2K1 Receptor,heterotrimeric Galpha protein and CNGC2/4 are involved in extracellular ATP-promoted ion influx in the pollen of Arabidopsis thaliana[J].Plants,2021,10(8):1743.
[28]SHABAN M,MIAO Y,ULLAH A,et al.Physiological and molecular mechanism of defense in cotton against Verticillium dahliae[J].Plant Physiology and" Biochemistry,2018,125:193-204.
[29]FU Z Q,YAN S,SALEH A,et al.NPR3 and NPR4 are receptors for the immune signal salicylic acid in plants[J].Nature,2012,486:228-232.
[30]刘零怡,赵丹莹,郑 杨,等.植物在低温胁迫下的过氧化氢代谢及信号转导[J].园艺学报,2009,37(11):1701-1708.
LIU L Y,ZHAO D Y,ZHENG Y.Hydrogen peroxide metabilism and signal transduction under cold sterss[J].Acta Horticulturae Sinica,2009,37(11):1701-1708.
[31]CHEN L,WANG W,HE H,et al.Genome-wide identication,characterization and experimental expression analysis of CNGC gene family in gossypium[J].Internatinal Journal of Molecular Science,2023,24(5):4617.
[32]刘梦娇,易 航,蔡新忠.环核苷酸门控离子通道基因 [QX(Y15] CNGC3[QX)]正调控拟南芥抗核盘菌免疫[J].浙江大学学报,2022,48(5):594-604.
LIU M J,YI H,CAI X ZH.Cyclic nucleotide gated ion channel gene" [QX(Y15] CNGC3[QX)] positively regulates immunity" against sclerotinia sclerotiorum in Arabidopsis[J].Journal of Zhejiang University,2022,48(5):594-604.
Molecular Cloning and Preliminary Expression Analysis of [QX(Y15] GhCNGC8[QX)] Gene in Gossypium hirsutum
ZHAO Zhun1,HU Wenran1,SHAO Wukui1,2" and" HUANG Quansheng1
(1.Institute of Nuclear Technology and Biotechnology, Xinjiang Academy of Agricultural Sciences, Key Laboratory" of Crop Biotechnology of Xinjiang Uygur Autonomous Region,Urumqi 830091,China; 2.College of" Life Sciences,Xinjiang Agricultural University, Urumqi 830052,China)
Abstract To investigate the role of the [QX(Y15] GhCNGC8[QX)] gene in cotton stress resistance, we cloned it from cotton leaves using PCR and utilized bioinformatics methods to analyze its physicochemical properties, structure, and evolutionary relationships. We used qRT-PCR to analyze the expression patterns of [QX(Y15] GhCNGC8[QX)]"" under various various stress conditions, including infection by Fusarium wilt pathogen, drought, salt stress, and hormone induction, as well as its tissue-specific expression.We constructed a VIGS vector targeting this gene and transformed it into cotton leaves using Agrobacterium-mediated methods. The gene silencing efficiency was assessed using quantitative fluorescence PCR. The [QX(Y15] GhCNGC8[QX)] gene was successfully cloned from cotton leaf cDNA, possessing an open reading frame of 2 247 bp that encodes 748 amino acids. Phylogenetic analysis indicated a close relationship between the upland cotton [QX(Y15] GhCNGC8[QX)] gene and the Arabidopsis [QX(Y15] AtCNGC8[QX)] gene. Multiple sequence alignment revealed that the [QX(Y15] GhCNGC8[QX)] protein conforms to the structural characteristics of CNGC family proteins. qRT-PCR results showed that the gene responded to Fusarium wilt, drought, salt stress, as well as jasmonic acid, salicylic acid, and hydrogen peroxide treatments to varying degrees. The [QX(Y15] GhCNGC8[QX)] gene expression was detected in roots, stems, leaves, flowers, sepals, and bracts, with the highest expression in leaves. Transformation of the [QX(Y15] GhCNGC8[QX)] gene VIGS silencing vector into cotton resulted in successful silencing, with expression levels reduced by approximately 70% compared to control, confirming the successful construction and normal operation in cotton. GhCNGC8 may play a significant role in cotton stress resistance.
Key words Cotton;GhCNGC8;Gene cloning;Expression analysis;Vector construction
Received" 2023-11-01""" Returned 2024-02-29
Foundation item Open Project for Key Laboratories of Xinjiang Uygur Autonomous Region (No.2022D04008);Construction Project for the State Key Laboratory for Stress Resistance Genetic Improvement and Germplasm Innovation of Crops in Arid Desert Region (No.ZYYD2022B07).
First author ZHAO Zhun, male, assistant research fellow. Research area: cotton molecular biology breeding. E-mail: 1790998478@qq.com
Corresponding"" author HUANG" Quansheng, male, research fellow.Research area: crop stress tolerance mechanisms. E-mail: hquansheng@126.com
(责任编辑:顾玉兰 Responsible editor:GU Yulan)
基金项目:新疆重点实验室开放课题项目(2022D04008);省部共建干旱荒漠区作物抗逆遗传改良与种质创新国家重点实验室培育建设项目(ZYYD2022B07)。
第一作者:赵 准,男,助理研究员,主要从事棉花分子生物育种。E-mail:1790998478@qq.com
通信作者:黄全生,男,研究员,主要从事作物耐逆机制研究。E-mail:hquansheng@126.com

