套作玉米对华中五味子幼苗生长及根际土壤微生物群落的影响
摘" 要" 玉米套作如何影响华中五味子(Schisandra sphenanthera Rehd.et Wils) 幼苗生长及根际微生物群落结构尚不清楚。本研究通过大田试验将华中五味子与玉米套作,探究套作对华中五味子植株生物量的影响,并使用高通量测序技术对华中五味子根际土壤的细菌、真菌群落结构进行测定。结果表明,套作增加华中五味子生物量(茎长、地径、地上部分干质量、地下部分干质量)。此外,和单作相比,与玉米套作显著改变了华中五味子土壤微生物群落结构,且提高了部分与华中五味子生物量呈正相关根际促生菌如Pseudomonas(假单胞菌)、Gaiella、Kotlabaea等的丰度。且这些与华中五味子呈正相关的细菌、真菌受氮、磷、铝等及部分微量元素调控。本研究将为华中五味子幼苗管理提供候选方案及相关理论依据。
关键词" 华中五味子; 套作与单作; 生物量; 根际微生物; 根际微生物溯源
doi:10.7606/j.issn.1004-1389.2024.08.011
https://doi.org/10.7606/j.issn.1004-1389.2024.08.011
收稿日期:2023-07-04" 修回日期:2023-09-13
基金项目:国家重点研发计划 (2022YFD1602000,2019YFD1712600);中央引导地方科技发展专项资助(2022ZY1-CGZY-02,2022ZY1-CGZY-03)。
第一作者:孙萌迪,女,硕士研究生,从事微生态研究。E-mail:13204655634@163.com
通信作者:李玉龙,男,博士,从事微生态相关研究。E-mail:leeeyulong@163.com
华中五味子(Schisandra sphenanthera Rehd.et Wils)为木兰科(Magnoliaceae)五味子属多年生落叶木质藤本植物,主要分布于秦巴山区的陕西、四川、湖北等地[1]。其干燥成熟果实为药材南五味子,有收敛固涩、益气生津、补肾宁心之功效,抗氧化、保肝效果明显[2-5],收录于《中华人民共和国药典》(2020版)[6]。华中五味子鲜果颜色鲜艳,口感良好,秦巴山区产地也大量用作水果食用。目前市场上的华中五味子主要来源于野生资源。随着近年来华中五味子在药材和水果领域的需求激增,野生资源由于缺乏科学管护导致产量不稳定、质量不均一,难以满足市场的需求。加之野生华中五味子大多生长于陡坡、林下,人工采摘成本高。规模化科学种植华中五味子是产业发展的必然选择。
华中五味子喜温暖湿润气候和肥沃、排水好、微酸性腐殖土环境。盛果期华中五味子植株在阳光比较充足地块生长良好,但幼苗移栽1" a~2 a内在强光环境下生长缓慢,生产中习惯采取搭遮阳网、搭棚等措施降低强光对幼苗的照射。虽然效果明显,但生产和管理成本明显提升,因此选择合适的华中五味子幼苗管理方式对于降低生产成本具有重要的意义。基于此,本研究以1 a生移栽的华中五味子与玉米套作,探究在玉米为华中五味子幼苗遮阴的条件下,华中五味子的生长及土壤理化性质及根际土壤微生物群落的改变情况,以期为华中五味子幼苗管理提供候选方案。
1" 材料与方法
1.1" 试验方案
试验于2020-2021年在柞水县下梁镇" (33.6822° N,109.1112° E)开展。共设置3个处理,包括华中五味子单作、玉米单作、玉米和华中五味子套作。试验方案采用随机区组设计,共分3个区组,每个区组划分3个小区。每个小区面积" 2.4 m×1.8 m=4.32 m2,小区内行间距为60 cm,每行长度为2 m。华中五味子种苗于2020年11月种植,每行种植5株,间距为40 cm。玉米于2021年5月种植,玉米单作小区行间距为60 cm,每行株间距40 cm,种植5株。套种处理玉米种植于每行华中五味子中间位置,每行种植5株玉米。整块试验大田统一施肥量,其中氮肥(N)用量为120 kg/hm2、磷肥(P2O5)100"" kg/hm2、钾肥(K2O)为 110" kg/hm2均匀撒施。
1.2" 样本和数据采集
土壤样品采集及生物量统计于2021年10月进行,每个小区单作处理在中间随机选取9株华中五味子或玉米植株,套作处理分别选取9株华中五味子及相邻的玉米植株测量华中五味子茎长、地径、地下部分干质量和地上部分干质量及玉米株高、单株生物量。再从9株中选取3个华中五味子或玉米样本,将附着在根上的土壤一起挖出,用灭菌后的牙刷将附着在根际上的土壤刷下,混合后收集到无菌自封袋中,放入冰盒,迅速拿回实验室,置于- 80 ℃冰箱冷冻保存。玉米和华中五味子测量根长后,于60" ℃烘箱中烘干称量。各处理3个小区均用以上方法采样,最终各处理均采集3份根际玉米或华中五味子土壤样品。本试验共采集4个处理样本,分别为:套作玉米(IM)、单作玉米(SM)、套作华中五味子(IS)及单作华中五味子(SS)。
1.3" 土壤理化性质测定及土壤总DNA提取
采用全自动间断化学分析仪 (Westco SmartChem 300,Italy) 测定土壤铵态氮、硝态氮含量[7-8]。采用重铬酸钾容量法[9]测定有机质含量。土壤微量元素含量参考《HJ 780-2015 土壤和沉积物无机元素的测定波长色散X射线荧光光谱法》采用X-RAY荧光谱仪进行测定。经消毒后的土壤,利用试剂盒(MoBio PowerSoil" DNA Isolation Kit),根据说明书提示提取土壤样品基因组DNA。
1.4" 高通量测序及数据分析
对12个独立的样本进行细菌16S rDNA和真菌ITS rDNA基因的高通量测序。细菌测序前端引物为338F “ACT CCT ACG GGA GGC AGC A”,后端引物为806R “GGA CTA CHV GGG TWT CTA AT”。真菌测序设计前端引物为ITS5-1737-F“GGA AGT AAA AGT CGT AAC AAG G”。后端引物为ITS2 “GCT GCG TTC TTC ATC GAT GC”。将扩增后的序列建库并在Illumina PE250测序平台测序。
使用Trimmomatic软件[10]对测序结果进行质控并去接头。将去接头后的序列导入Qiime2[11],使用dada2插件对序列进行降噪、质控、双端合并以及去除嵌合体,并生成扩增序列变体(amplicon sequence variant,ASV)特征表、代表序列;使用feature-classifier插件根据扩增引物序列对Silva 16S数据库和Unite ITS数据库进行序列提取及物种分类器训练,用训练好的分类器进行物种注释。
1.5" 数据分析
在R4.1.0中,采用Villanueva等[12]对玉米和华中五味子各生物量指标及根际微生物alpha多样性指标进行组间整体Kruskal-Walis(KW)检验和组内两两之间t检验。采用qiime2R包(https://github.com/jbisanz/qiime2R)将qiime2输出的特征表结果导入到R环境中,采用yyeasy(https://github.com/yanpd01/yyeasy)包绘制稀释曲线,采用Vegan[13]包计算α多样性所需要的香农(Shannon)指数、Chao1指数并对群落进行beta多样性分析。使用edgeR包筛选相对于五味子单作,五味子套种根际土壤上调及下调的细菌、真菌ASV(Plt;0.01及上下调倍数gt;2倍)。使用psych包筛选上调、下调ASV中与和五味子生物量显著相关的ASV,使用corrplot包对与生物量显著相关的ASV与土壤环境因子进行mantel检验。华中五味子根际微生物溯源分析采用R语言的Sourcetracker软件包进行分析[14]。
2" 结果与分析
2.1" 华中五味子和玉米生物量
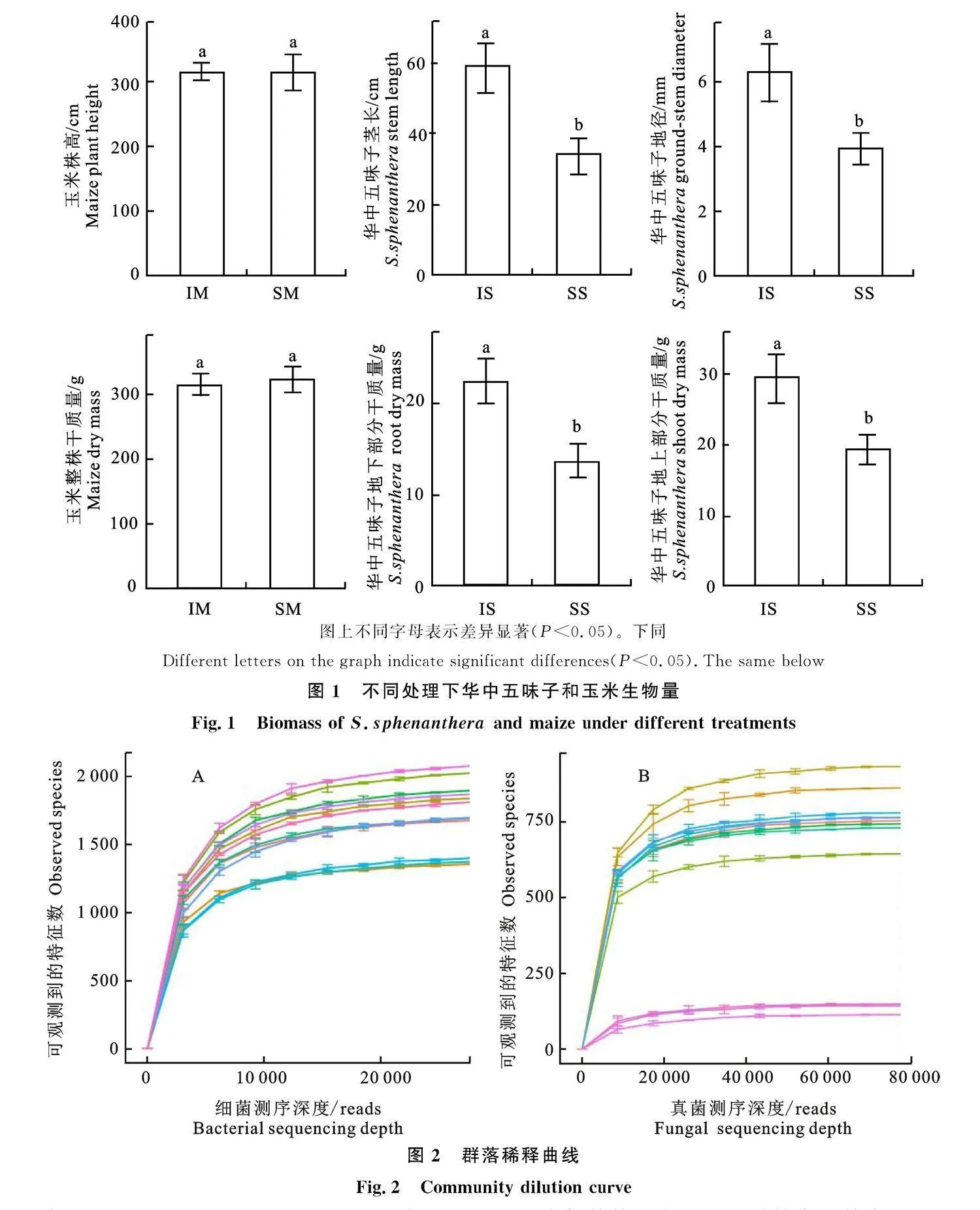
如图1所示,玉米单作和套作模式下,玉米各生物量无差异,而华中五味子部分生物量有差异。套作华中五味子茎长、地径、地下部分干质量、地上部分干质量上较单作增加51.3%、60.3%、" 52.4%、63.4%(Plt;0.05)。
2.2" 不同处理微生物alpha及beta多样性
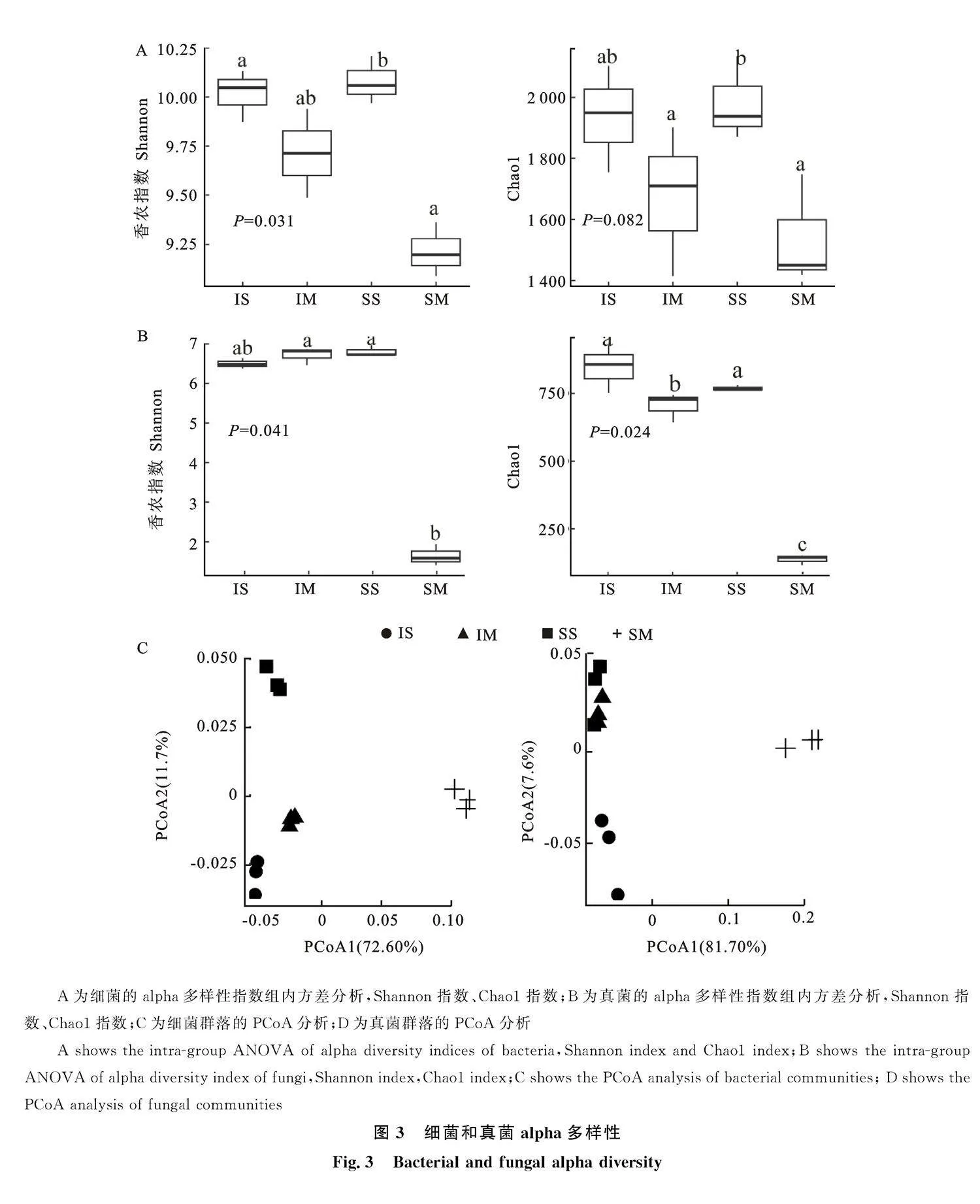
各样品细菌(图2-A)、真菌(图2-B)稀释曲线均趋于平稳,说明每个样品测序数量已经满足数据分析需求。
如图3-A所示,对细菌来说,套作玉米的Shannon指数和Chao1指数较单作玉米分别增加5.4%、8.9%(Plt;0.05),套作华中五味子(IS)与单作华中五味子(SS)Shannon指数和Chao1指数差异不显著(P gt; 0.05)。如图3-B所示,对真菌来说,套作玉米的Shannon指数和Chao1指数较单作玉米分别增加30.2%、42.2%(Plt;" 0.05),套作华中五味子(IS)与单作华中五味子(SS)Shannon指数和Chao1指数差异不显著" (Pgt;0.05)。如图3-C所示,根际土壤样本中的细菌群落的主成分1(PCoA1)和主成分2(PCoA2)的样品差异性分布达到72.6%和" 11.7%,并且每个群落土壤样品的细菌群落相对集中。SS、IS、SM与IM在PCoA1和PCoA2水平上都很好的分离,表明4个处理细菌群落结构差异均显著(Plt;0.05)。图3-D为真菌PCoA主坐标主成分分析,PCoA1和PCoA2的样品差异性分布达到81.7%和7.6%。SS与IS、SM与IM群落结构差异均显著(Plt;0.05)。
2.3" 套作及单作处理下华中五味子和玉米根际微生物物种丰度
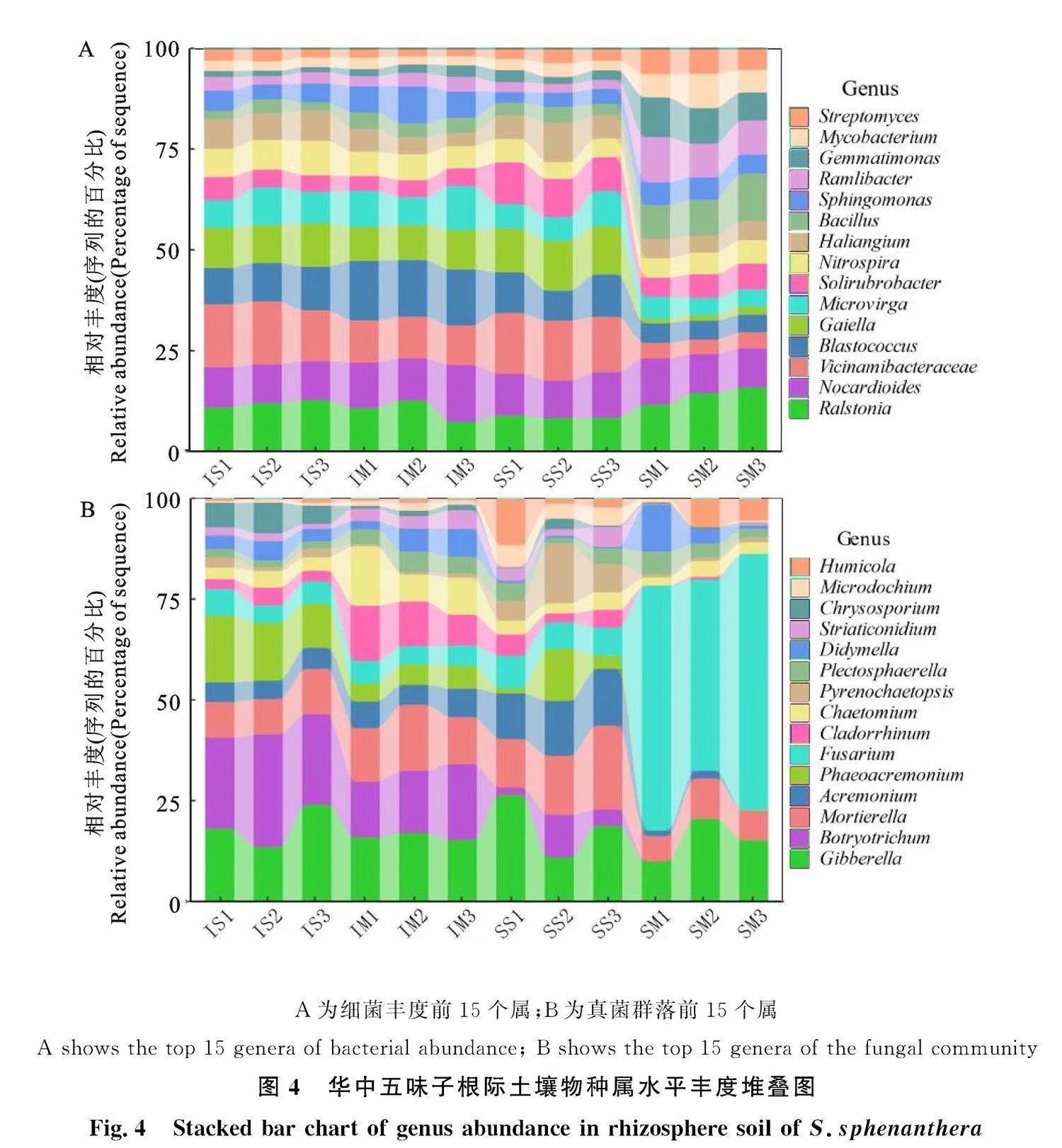
如图4-A所示,细菌前15个属中,SM群落组成与其他3个处理差异较大。其中SM处理根际土壤中沙壤土杆菌(Ramlibacter)和芽孢菌(Bacillus)丰度高于IS、IM及SS处理,而SM处理Vicinamibacteraceae丰度低于其余3个处理。对于IS和SS处理,IS处理增加了华中五味子根际土壤中硝化螺旋菌属(Nitrospira)的丰度。
如图4-B所示,不同处理土壤真菌群落结构差异明显。SM中镰刀菌(Fusarium)远高于其他3组。与SS相比,IS处理增加了根际土壤微生物中毛葡孢属(Botryotrichum)、Chrysosporium与Plectosphaerella的丰度,减少了Pyrenochaetopsis的丰度。与SM处理相比,IM处理增加了见毛壳菌属(Chaetomium)、及高山被孢霉属(Mortierella)等的相对丰度。
2.4" 套作及单作处理下华中五味子根际微生物物种差异及与土壤环境因子的关系
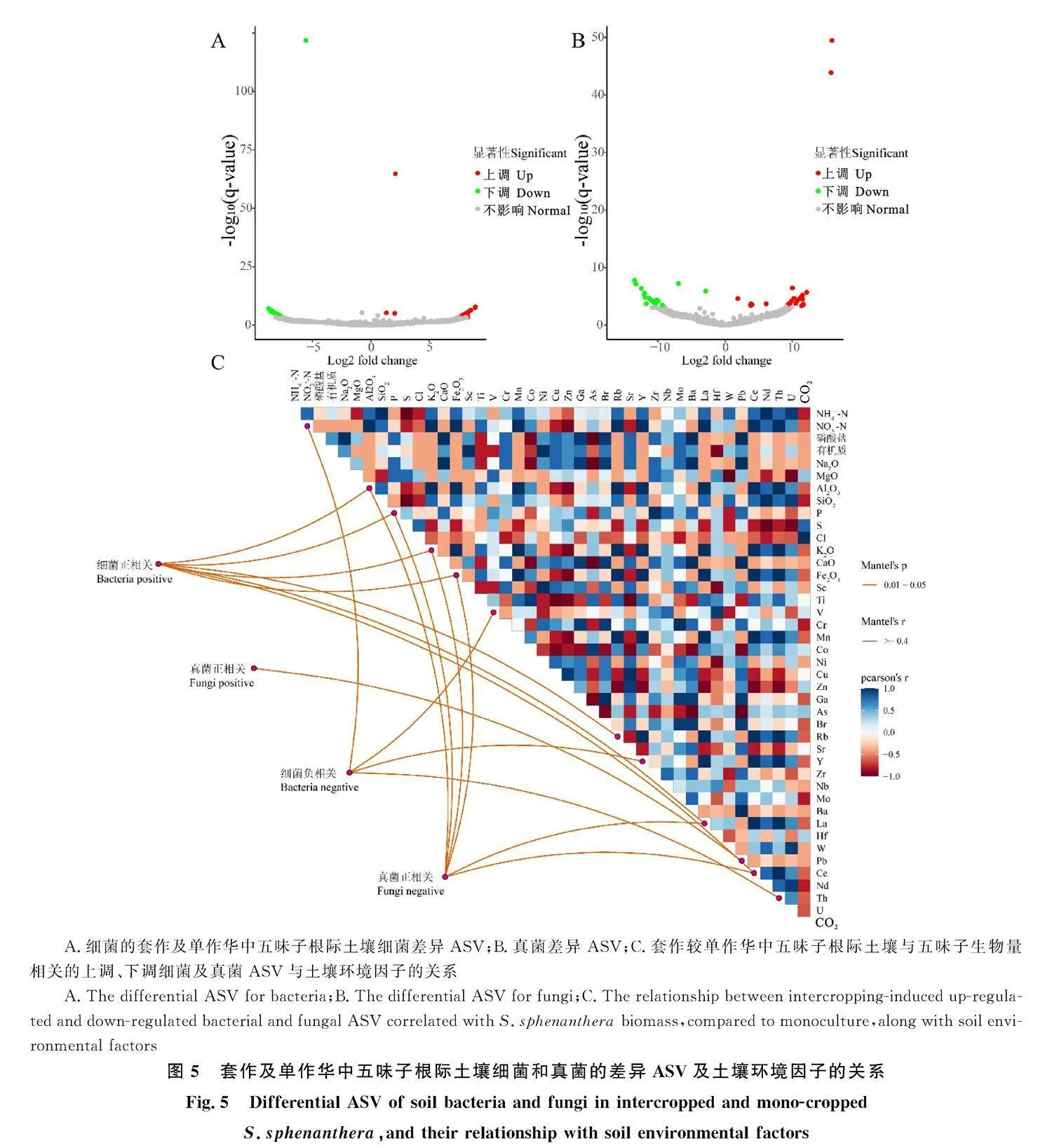
由图5-A可看出,与单作相比,ASV水平下,套种华中五味子有30个细菌ASV相对丰度增加,有33个细菌ASV相对丰度降低(Plt;0.01)。由图5-B可见,9个真菌ASV相对丰度增加,9个真菌ASV相对丰度降低(Plt;0.01)。通过进一步相关性分析表明(图5-C),差异细菌ASV中,属于假单胞菌属(Pseudomonas)、Gaiella、Marmoricola等属的ASV与华中五味子生物量呈正相关,属于硝化螺旋菌属(Nitrosspira)、假诺卡氏菌属(Pseudonocardia)、Methylibium等的ASV与华中五味子生物量呈负相关。差异真菌ASV中,Kotlabaea、Botryotrichum、地顶孢霉(Acremonium)等属的ASV与华中五味子生物量呈正相关,高山被孢霉(Mortierella)、Pyrenochaetopsis等属的ASV与华中五味子生物量呈负相关。Mantel分析表明,与华中五味子生物量负相关的细菌ASV受NH+4-N、V、Y、Th元素驱动,正相关的细菌受Al、P、K、Fe、Rb、La、Ce元素驱动。与真菌正相关的ASV受Pb驱动,与真菌呈负相关的ASV受Al、P、K、Fe、La、Ce等元素驱动。
2.5" 华中五味子根际微生物溯源分析
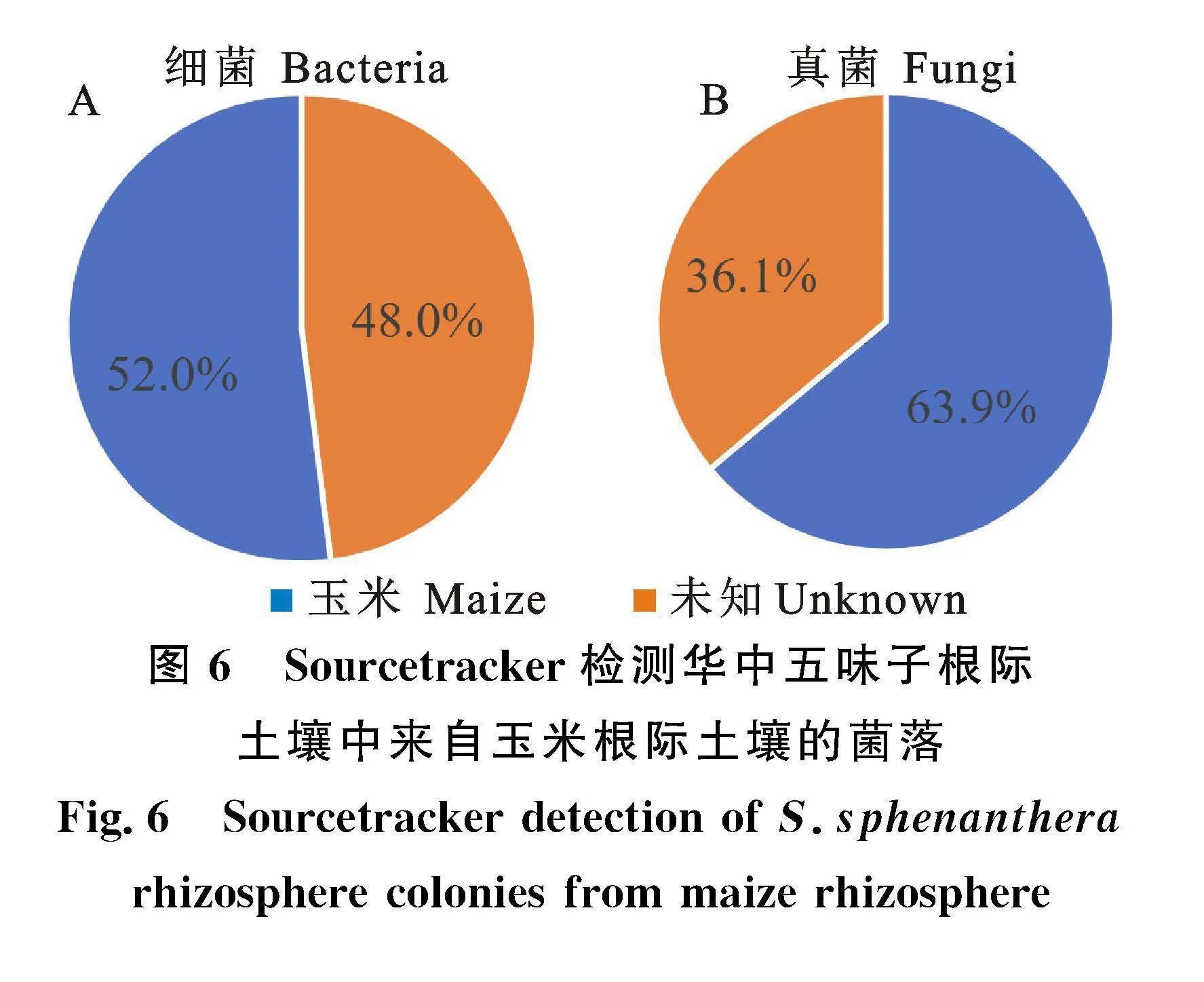
对华中五味子根际微生物溯源结果表明(图6),华中五味子根际中有52.0%的细菌与玉米根际细菌有关,有48.0%的根际微生物来源未知(图6-A);有" 63.9%的真菌与玉米根际真菌有关,有36.1%的根际微生物来源未知(图6-B)。
3" 讨" 论
华中五味子幼苗移栽前1" a~2 a内在强光环境下生长缓慢,生产中习惯采取搭遮阳网、搭棚等措施降低强光对幼苗的照射。虽然效果明显,但生产和管理成本明显提升。基于此,本研究以1 a生移栽的华中五味子与玉米套作,探究华中五味子幼苗在玉米为遮阴的条件下,华中五味子及玉米的生长及根际土壤微生物群落的改变情况,并从微生物的角度探讨玉米遮阴对华中五味子生长的影响。
本研究发现,套作与单作华中五味子根际土壤细菌和真菌alpha多样性差异不显著,表明不同栽培模式对华中五味子根际土壤微生物种类数
没有显著影响。而beta多样性分析(PCoA)显示,套作华中五味子处理的微生物群落与单作华中五味子的处理不同,这表明种植模式对土壤微生物群落结构有着显著的影响。对具体的物种差异分析表明,套种华中五味子较单作富集了多种微生物,例如Pseudomonas(假单胞菌)、Gaiella、Kotlabaea及Podospora(柄孢壳菌)等。Pseudomonas常见于土壤中,前人研究表明假单胞菌具有多种防治植物病害及促进植物生长方面的特性,包括抑制植物病原菌生长、铁载体产生、固氮和磷酸盐溶解,及产生植物生长促进类物质[15-17];Eevers等[18]发现Gaiella(加氏菌属)可降解芳香族化合物,而一些导致中药材连作障碍的自毒物质也属于芳香族化合物[19],因此推测加氏菌属可以缓解由自毒物质引起的连作障碍;Yung等[20]发现Kotlabaea在荨麻和杨树的共生关系中发挥作用,在植物根际微生物群落的稳定性方面发挥作用,可以帮助降解植物残渣等有机物,并与植物根系形成共生关系;Quach等[21]发现Podospora对植物吸收无机磷具有关键作用。此外发现,套种还增加了华中五味子根际Marmoricola、Vicinamibacteraceae、Latescibacterota、Botryotrichum、Acremonium等在内的与华中五味子生物量呈正相关的微生物,推测这些微生物可能与华中五味子生物量增加也有关,但尚无相关报道,需要进一步试验验证。
进一步分析与华中五味子生物量相关的微生物群落变化的驱动因子发现,与华中五味子幼苗生物量呈正相关的细菌、真菌受氮、磷、铝等元素调控。Suter等[22]发现,氮驱动某一类核心微生物群落结构变化,促进了草-豆科植物混种体系下草产量的增加。Yan等[23]发现土壤总氮驱动土壤细菌群落结构进而增加牧草生物量;Fan等[24]发现土壤施氮肥驱动土壤细菌群落结构进而提高小麦产量。陈凤等[25]证明充足的磷肥供应可以维持土壤微生物动态平衡,这可能与稻-油轮作系统土地生产力增加有关。邱浩等[26]认为Al3+与土壤中微生物多样性相关,增加土壤中Al3+含量可减少作物病害,从而提高产量。而本研究中五味子生物量的提高可能与之前研究具有相同的机制。除土壤中的大量、中量元素外,本研究还发现微量元素如V、Rb、Y、La、Pb、Ce、和U可调控与华中五味子生物量正相关的差异微生物群落结构。因此,这些结果意味着未来可以通过增施微量元素肥料调控微生物群落结构,进而提高华中五味子产量及品质。
除土壤化学元素外,通过微生物溯源发现,华中五味子根际有接近或超过一半的细菌、真菌物种来源于玉米根际,这表明除土壤化学元素外,套作植物等生物因子对华中五味子根际微生物群落结构也有影响。而华中五味子根际增加的有益菌是否有部分来源于玉米根际尚待进一步研究。
4" 结" 论
华中五味子和玉米套作可以调控华中五味子根际土壤微生物多样性及功能微生物丰度。这些结果表明,华中五味子与玉米套作调控了土壤的肥力和生物学相关功能,从而改善土壤质量和植物生长。这一研究结果对于华中五味子生产具有一定的理论和实际生产指导意义。
参考文献" Reference:
[1]" 李会娟,魏雪苹,齐耀东,等.华中五味子野生抚育中的关键技术[J].中国现代中药,2019,21(5):625-628.
LI H J,WEI X P,QI Y D,et al.Key technique on wild medicinal materials tending of Schisandra sphenanthera[J].Modern Chinese Medicine,2019,21(5):625-628.
[2]江林春,韦洁敏,白尚尚,等.华中五味子根际土壤真菌群落特征研究[J].延安大学学报(自然科学版),2020,39(4):15-20.
JIANG L CH,WEI J M,BAI SH SH,et al. Characteristics of rhizosphere soil fungi community of Schisandra sphenanthera Rehd[J].Journal of Yanan University(Natural Science Edition),2019,21(5):625-628.
[3]孙,彭修娟,徐" 虹.南五味子化学成分及药理学研究进展[J].陕西中医学院学报,2007,136(4):74-75.
SUN Y Y,PENG X" J,XU" H.Advances in chemical composition and pharmacological research of Schisandra sphenanthera[J].Journal of Shaanxi University of Chinese,2007,136(4):74-75.
[4]黄" 玲,陈" 玲,张振林.五味子多糖对荷瘤鼠瘤体抑制作用的病理学观察[J] 中药材,2004(3):202-203.
HUANG L,CHEN" L,ZHANG ZH" L.Pathological observations of fructus schisandrae polysaccharide on Anti tumor effects in S180-bearing mice[J].Journal of Chinese Medicinal Materials,2004(3):202-203.
[5]姜海慧,张" 婷,张化为,等.醋制对南五味子抗CCl4致急性肝损伤大鼠的影响[J].中国野生植物资源,2021, 40(11):1-5.
JIANG H H,ZHANG T,ZHANG H W,et al.Effect of vinegar on acute liver injury induced by CCl4 in rats with Schisandra sphenanthera[J].Chinese Wild Plant Resources,2021,40(11):1-5.
[6]国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2020.
Chinese Pharmacopoeia Commission.Pharmacopoeia of the People’s" Republic of China 2020[M].Beijing:China Medical Science Press,2020.
[7]张英利,尚浩博,马爱生,等.连续流动注射法测定土壤和植物中全磷[J].理化检验(化学分册),2007(8):649-652.
ZHANG Y L,SHANG H B,MA A SH,et al.Determination of total phosphorus in soil and plants by using the AA3 continuous flow analyzer[J].Part B:Chemical Analysis,2007(8):649-652.
[8]范" 丽,刘红兵,陈" 斌,等.AA3连续流动分析仪氮磷联测方法研究[J].四川农业与农机,2018,221(3):32-35.
FAN L,LIU H B,CHEN B,et al.AA3 continuous flow analyzer for nitrogen and phosphorus co-methods[J].Sichuan Agriculture and Agricultural Machinery,2018,221(3):32-35.
[9]鲍士坦.土壤农化分析[M].北京:中国农业出版社,2018.
BAO SH T.Soil Agricultural Chemistry Analysis [M].Beijing:China Agriculture Press,2018.
[10]" BOLGER A M,LOHSE M,USADEL B.Trimmomatic:a flexible trimmer for Illumina sequence data[J].Bioinformatics,2014,30(15):2114-2120.
[11]BOLYEN E,RIDEOUT J R,DILLON M R,et al.Reproducible,interactive,scalable and extensible microbiome data science using QIIME 2[J].Nature Biotechnology,2019,37(9):852-587.
[12]VILLANUEVA R A M,CHEN Z J.ggplot2:elegant graphics for data analysis,2nd edition[J].Measurement-Interdisciplinary Research and Perspectives,2019, 17(3):160-167.
[13]VEGAN" D P.A package of R functions for community"" ecology[J].Journal of Vegetation Science,2003,14(6):927-930.
[14]KNIGHTS D,KUCZYNSKI J,CHARLSON E S,et al.Bayesian community-wide culture-independent microbial source tracking[J].Nature Methods,2011,8(9):761-U107.
[15]SAH S,KRISHNANI S,SINGH R.Pseudomonas mediated nutritional and growth promotional activities for sustainable food security[J].Current Research in Microbial Sciences,2021,2:100084.
[16]AKTER S,KADIR J,JURAIMI A S,et al.In vitro evaluation of" Pseudomonas bacterial isolates from rice phylloplane for biocontrol of Rhizoctonia solani and plant growth promoting traits[J].Journal of Environmental Biology,2016,37(4):597-602.
[17]GEORGIEVA T,EVSTATIEVA Y,SAVOV V,et al.Assessment of plant growth promoting activities of five rhizospheric" Pseudomonas strains[J].Biocatalysis and Agricultural Biotechnology,2018,16:285-292.
[18]EEVERS N,GIELEN M,SANCHEZ-LOPEZ A,et al.Optimization of isolation and cultivation of bacterial endophytes through addition of plant extract to nutrient media[J].Microbial Biotechnology,2015,8(4):707-715.
[19]冯" 静,周冰谦,刘" 谦,等.药用植物根际微生物与酚酸类自毒物质致害机制及作用关系研究[J].中华中医药杂志,2020,35(8):4049-4052.
FENG J,ZHOU B" Q,LIU Q,et al.Study on the relationship between rhizosphere microorganism and phenolic acids and its countermeasures[J].China Journal of Traditional Chinese Medicine and Pharmacy,2020,35(8):4049-4052.
[20]YUNG L,BERTHEAU C,TAFFOREAU F,et al.Partial overlap of fungal communities associated with nettle and poplar roots when co-occurring at a trace metal contaminated site[J].The Science of the Total Environment,2021,782:146692.
[21]QUACH M,MELE P M,HAYDEN H L,et al.Proximity to subsurface drip irrigation emitters altered soil microbial communities in two commercial processing tomato fields[J].Applied Soil Ecology,2022,171:104315.
[22]SUTER M,CONNOLLY J,FINN J A,et al.Nitrogen yield advantage from grass-legume mixtures is robust over a wide range of legume proportions and environmental conditions[J].Global Change Biology,2015,21(6):2424-2438.
[23]YAN H L,GU S S,LI S Z,et al.Grass-legume mixtures enhance forage production via the bacterial community[J].Agriculture Ecosystems amp; Environment,2022,338:108087.
[24]FAN K K,DELGADO-BAQUERIZO M,GUO X S,et al.Biodiversity of key-stone phylotypes determines crop production in a 4-decade fertilization experiment[J].Isme Journal,2021,15(2):550-561.
[25]陈" 凤,王晓双,甘国渝,等.长期施用磷肥对稻-油轮作土壤磷组分及微生物多样性的影响[J].华中农业大学学报,2021,40(1):168-178.
CHEN F,WANG X SH,GAN" G Y,et al.Effects of long-term application of phosphorus fertilizer on soil phosphorus fractions and microbial diversity in rice-rapeseed rotation[J].Journal of Huazhong Agricultural University,2021,40(1):168-178.
[26]邱" 浩,陈佳阳,赖佑圳,等.附子内生菌及根际土壤性质与附子生物碱积累的关系研究[J].植物科学学报,2021,39(6):643-653.
QIU H,CHEN J Y,LAI Y ZH,et al.Relationships between endophytic structure,rhizosphere soil properties and aconite alkaloids accumulations in Aconitum carmichaelii Debx[J].Plant Science Journal,2021,39(6):643-653.
Effect of Intercropped Maize on Growth of Schisandra sphenanthera
Seedlings and Soil Microbial Community in Rhizosphere
SUN Mengdi,YAN Pengdong,QIU Hao,SHANG Jingjing,
SUN Haoxuan,CUI Langjun and" LI Yulong
(National Engineering Laboratory for Resource Development of Endangered Crude Drugs in Northwest China,
The Key Laboratory of Medicinal Resources and Natural Pharmaceutical Chemistry,the Ministry of
Education,College of Life Sciences,Shaanxi Normal University,Xi’an" 710119 China)
Abstract" The effect of maize intercropping on seedling biomass and the rhizosphere microbial community structure of Schisandra sphenanthera Rehd.et Wils" remains unclear.In this field study,we investigated the effect of maize intercropping on plant biomass of S.sphenanthera,and determined the bacterial and fungal community structure in the rhizosphere soil of both maize and"" S.sphenanthera""" using high-throughput sequencing.The results showed that maize intercropping increased the biomass (including stem length,ground-stem diameter,shoot dry" mass" and root dry" mass) of S.sphenanthera.Furthermore,compared with monocropping,the maize intercropping significantly changed the rhizosphere soil microbial community structure of S.sphenanthera,with an increase in the relative abundance of certain plant-rhizosphere promoting microbes such as Pseudomonas,Gaiella and Kotlabaea.These microbes exhibited a positive correlation with S.sphenanthera biomass.The results suggest that the abundance of these bacteria and fungi,positively associated with" S.sphenanthera" biomass,was influenced by elements like N,P,Al" and other elements.This study provides potential solutions and relevant theoretical basis for the management of S.sphenanthera seedlings.
Key words" Schisandra sphenanthera Rehd.et Wils; Intercropping and monoculture; Biomass; Rhizosphere microorganisms; Rhizosphere microbial source tracking
Received"" 2023-07-04""" Returned" 2023-09-13
Foundation item" National Key Research and Development Program (No.2022YFD1602000," No.2019YFD1712600); the Special Project for Central Government Guiding Local Science and Technology Development (No.2022ZY1-CGZY-02,No.2022ZY1-CGZY-03).
First author" SUN" Mengdi,female,master" student.Research area:microbial ecology.E-mail:13204655634@163.com
Corresponding"" author" LI" Yulong,male,Ph.D.Research area:microbial ecology.E-mail:leeeyulong@163.com(责任编辑:潘学燕" Responsible editor:PAN Xueyan)

