基于KASP技术快速检测略阳乌鸡MSTN和 KLF7基因SNP及其与体质量性状关联性分析


摘" 要" 为高效、低成本对略阳乌鸡SNP变异位点进行准确分型并评价其选育效果,采用KASP技术对略阳乌鸡群体MSTN基因外显子1的g.233Agt;G位点和" KLF7基因内含子2的g.1022Cgt;T位点,进行连续四个世代SNP多态分析。结果显示:MSTN基因检测到AA、AG、GG 3种基因型," KLF7基因检测到CC、CT、TT 3种基因型;两个位点均为中度多态,MSTN基因位点P1代、" KLF7基因位点P3和P7代偏离Hardy--Weinberg遗传平衡状态,其余各代均处于平衡状态;体质量与多态位点关联分析表明,MSTN基因位点AA型体质量显著高于AG和GG型," KLF7基因位点杂合型体质量显著高于纯和型,且体质量性状随世代显著提高(Plt;0.05),研究结果表明经过世代选育后略阳乌鸡体质量性状选育效果显著,同时表明两个位点均可以作为略阳乌鸡肉用性状选育的有效选择位点。
关键词" KASP技术;MSTN;" KLF7;关联分析;体质量性状选育
doi:10.7606/j.issn.1004-1389.2024.08.001
https://doi.org/10.7606/j.issn.1004-1389.2024.08.001
收稿日期:2023-12-15" 修回日期:2024-01-02
基金项目:2023畜禽新品种培育-略阳鸡(K3031223079)。
第一作者:蔡瑛婕,女,硕士研究生,研究方向为动物遗传育种与繁殖。E-mail:caiyingjie2022@nwafu.edu.cn
通信作者:张建勤,女,博士,副教授,博士生导师,研究方向为动物遗传育种与繁殖。E-mail:zhangjianqin0822@nwafu.edu.cn
单核苷酸多态性(Single Nucleotide Polymorphism,SNP)作为动植物基因组中最常见的遗传变异类型之一,已经应用于基因定位、遗传图谱构建、亲缘关系分析及遗传标记辅助选择等多个基础研究领域[1-2]。SNP检测和分型技术包括TaqMan探针法、PCR-RFLP、PCR-SSCP、竞争性等位基因特异性PCR 技术(Kompetitive Allele Specific PCR,KASP)、SNP芯片等方法。利用SNP多态性标记的主要障碍之一是基因分型的效率和成本[3],其中,PCR-RFLP难以找到合适的内切酶,SNP芯片检测成本较高,TaqMan探针法价格昂贵且检测设计不够灵活[4],PCR-SSCP步骤繁琐,较为耗时,效率低[5],而KASP技术具有低成本、高通量、高特异性和高灵敏度等优势被更多关注和应用[6-7],KASP技术是一种基于已知SNP位点的终点荧光基因分型技术,该检测方法可使用等位基因特异性荧光对共显性标记进行基因分型,将双等位基因SNP基因分型为同源等位基因1、同源等位基因2及杂合型[8]。 近年来,KASP技术在畜禽研究领域被广泛应用,例如牛、羊、家禽等经济动物的产乳[9-12]、生长繁殖等[13-18]生产性状基因SNP位点挖掘及遗传疾病鉴定[19-20]、动物福利[21]方面。
MSTN基因是转化生长因子-β超家族最重要的成员之一,目前在羊、牛和家禽等物种上已被定位和标记,马丽娜等[22]通过TaqMan探针法检测了滩羊MSTN基因SNP分型并发现RS417816017位点XY型个体具有生长优势,高峰等[23]对西门塔尔牛MSTN基因直接测序,比对了突变前后MSTN基因的理化性质,任冰冰等[24]和左斌等[25]证明MSTN基因多态性可以作为草科鸡、泸宁鸡和米易鸡屠宰性状的候选基因。KLFs是真核生物中重要的调控因子," KLF7是KLFs家族的成员之一,研究表明,牛" KLF7基因内含子2中g.42025 Tgt;C、g.42075 Agt;G的SNP多态性可作为牛生长性状的遗传标记[26],董定娟等[27]发现在广西黄鸡和宁海黄鸡" KLF7基因上,有两个相同的位点18000Agt;C、45125Tgt;A对部分屠体性状有极显著或显著影响。
本试验以肉用系略阳乌鸡P1代、P3代、P5代和P7代母鸡作为试验材料,通过KASP技术迅速检测MSTN基因和" KLF7基因SNP变异类型,并与体质量性状进行关联分析,进一步验证MSTN基因和" KLF7基因作为影响略阳乌鸡体质量性状重要候选基因的世代选育效果,为略阳乌鸡生长性状的精确选育提供理论参考。
1" 材料与方法
1.1" 试验材料
随机选择肉用系略阳乌鸡P1代、P3代、P5代和P7代各200只母鸡,均来自于陕西省龙佳农业科技发展有限公司(龙昊乌鸡种源繁育中心)。记录略阳乌鸡8周龄体质量,翅下静脉采集血样,装入含有抗凝剂的5 mL真空采血管,置于" -80 ℃冰箱中保存,备用。
1.2" 主要仪器和试剂
主要试剂:蛋白酶K、三羟甲基氨基甲烷盐酸盐Tris-Hcl、乙二胺四乙酸EDTA、十二烷基硫酸钠SDS(杨凌康博生物试剂经营部);氯化钠(杨凌索来宝生物化学玻璃仪器供应站)。
主要仪器:超微量分光光度计(Nanodrop 2000,赛默飞世尔科技公司)、实时荧光定量PCR仪(FQD-96A,杭州博日科技有限公司)。
1.3" DNA提取
采用酚氯仿法提取DNA,用Nanodrop 2000和1%琼脂糖凝胶电泳测定DNA的纯度和浓度,-80 ℃保存,备用。
1.4" KASP检测
1.4.1" 引物设计" 根据GenBank上公布的鸡MSTN、" KLF7基因序列(GenBank登录号均为NC_052538),按照KASP技术原理,利用Premier 5.0软件设计引物,该基因设计包含两条具有竞争性等位基因特异性的正向引物和一条反向通用引物。两条正向引物的3′端各自连接着已知序列的等位基因1或等位基因2,5′端连接不同的荧光探针,根据荧光信号的颜色,可以识别出样品的SNP基因型。引物的退火温度值控制在" 55 ℃~60 ℃,使用Oligo 7.56软件对引物进行评估,避免引物出现错配、发卡结构或二聚体等问题。引物序列如表1所示,由北京擎科生物科技股份有限公司合成。
1.4.2" KASP分型
PCR反应体系总体积为" 5.0 μL,包括2.0 μL质量浓度为10 ng·μL-1的DNA,2.5 μL KASP Master Mix(LGC公司,UK),0.07 μL KSAP Primer mix和0.43 μL去离子水。反应中同时设置用去离子水代替DNA的空白对照,以防止试验结果的偏差。PCR反应在Thermal Cycler PCR仪(S1000TM,USA)上进行。PCR反应程序为:95 ℃,10 min;95 ℃,15 s,从61 ℃以每循环递减0.6 ℃至55 ℃,45 s,共10个循环;95 ℃,15 s,55 ℃退火和延伸45 s,共进行30个循环。PCR反应结束后进行荧光扫描和基因分型分析。
1.5" 数据处理
使用Excel 2022整理和计算样品的基因频率、基因型频率和多态信息含量(Polymorphism Information Content,PIC),采用X2检验分析研究位点是否处于Hardy-Weinberg平衡状态,利用SPSS 26.0软件处理和分析KASP分型结果与略阳乌鸡的生长性状之间存在的相关性,均使用单因素方差分析(One-Way ANOVA)和最小显著差异法(Least Significant Difference,LSD)进行多重比较,以Plt;0.05表示差异显著,结果以“平均值±标准差”的形式表示。
2" 结果与分析
2.1" KASP分型结果
KASP分型结果揭示(图1,图2),200只略阳乌鸡个体在MSTN和" KLF7基因中均发现3种基因型。
2.2" Hardy--Weinberg平衡检验
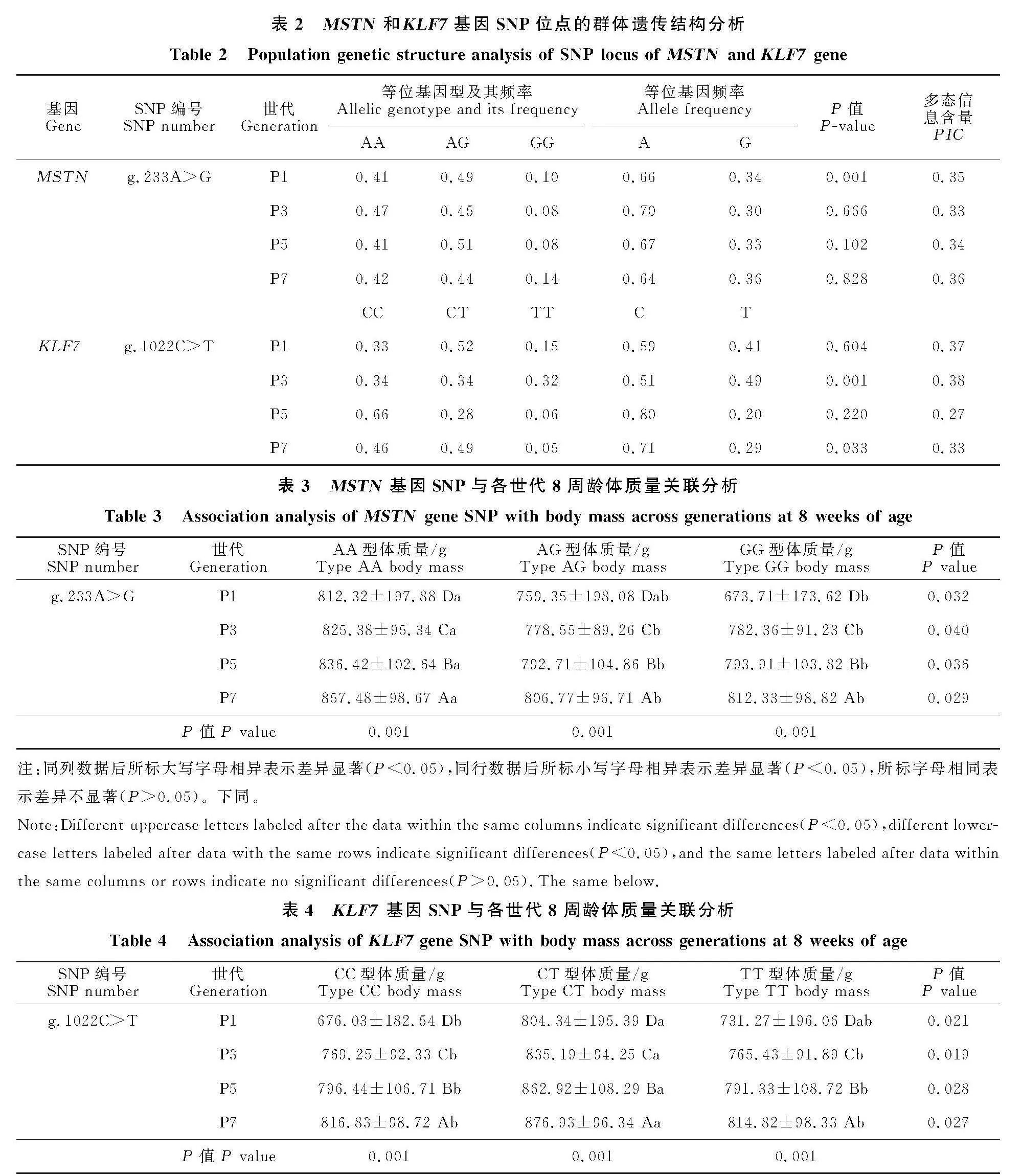
如表2所示,AA、AG基因型频率为0.41~0.51,CC、CT基因型频率为0.33~0.66,GG、TT基因型频率最低,在连续4 个世代中,等位基因A、等位基因C为优势等位基因;X2检验结果表明,MSTN基因位点P1代、" KLF7基因位点P3代和P7代偏离Hardy--Weinberg遗传平衡状态,其余各代均处于平衡状态;根据等位基因频率计算突变位点的PIC,均为0.25~0.5,说明两个SNP位点为中度多态。
2.3" SNP与体质量关联分析
由表3和表4可知,MSTN基因的" g.233Agt;G基因型位点与略阳乌鸡各世代8周龄体质量显著相关(Plt;0.05),在P1代中,AA型个体体质量显著高于GG型(Plt;0.05),而AG型个体与AA型、GG型均无显著差异(Pgt;" 0.05)。在P3、P5和P7代中AA型个体显著高于AG型和GG型(Plt;0.05),而AG型和GG型无显著差异(Pgt;0.05)。
KLF7基因上的SNP位点g.1022Cgt;T与略阳乌鸡各世代8周龄体质量显著相关,在P1代中,CT型个体体质量显著高于CC型(Plt;" 0.05),而TT型个体与CC型、CT型均无显著差异(Pgt;0.05)。在P3、P5和P7代中CT型个体显著高于CC型和TT型(Plt;" 0.05),而CC型和TT型无显著差异(Pgt;0.05)。同时,MSTN基因位点和" KLF7基因位点的体质量性状均随世代传递显著提高(Plt;0.05)。
3" 讨" 论
3.1" KASP分型技术的应用
KASP技术相较于DHPLC、Taqman探针法、PCR-SSCP、PCR-RFLP等技术具有速度更快、适用范围广、灵活性更强等优势[28],但仍具有一定的局限性,如本研究KASP分型结果显示,除了3种分型结果外,还存在少量紫色信号,分析原因可能为模板DNA存在降解或浓度不高等问题,导致DNA片段化,出现了分型不明确的现象,表明模板DNA质量的高低对于KASP检测成功率有重要影响,因此,实验室小规模检测条件下应当保证模板DNA的质量并调整到相似的浓度。同时,KASP荧光信号的定量处理会产生分型错误,SNP位点需在已知条件下才能进行检测,对未知位点难以开展研究;对模板DNA质量要求较高;突变型等位基因数量过小时,难以区分野生型和突变型个体;若SNP位点距离较近时,KASP引物设计会受到影响导致无法进行有效PCR扩增。虽然KASP技术与基因精准分型的研究需求有一定差距,但相较于其他技术,KASP可作为一种更可靠、更迅速、更准确的检测方法适用于基础研究领域,也有必要提升KASP引物设计技术及模板DNA质量等基础条件,并建立KASP数据库及基因分型技术体系,为种质资源鉴定、分子标记辅助育种、群体分析等提供重要的辅助手段。
本试验将KASP技术应用于略阳乌鸡与生长性状相关的SNP多态性连续世代研究,迅速快捷、准确低成本地完成了基因分型工作,以期为分子遗传标记辅助育种提供理论支持,推动略阳乌鸡分子遗传标记辅助育种或其他家禽的育种" 进程。
3.2" 群体内的遗传多样性
本试验对略阳乌鸡SNP位点进行PIC分析,显示MSTN和" KLF7的两个SNP位点在略阳乌鸡的各世代中呈现为中度多态性,庄嘉楠等[29]通过微卫星DNA分析来自3个散养场的黑羽和白羽略阳乌鸡,发现略阳乌鸡群体具有较高的遗传多态性,相较本研究结果揭示的多态性高,主要是因为本研究的略阳乌鸡群体是经过选育的群体,多样性必然会较低。研究人员对宁海黄鸡和广西黄鸡" KLF7基因多态性进行分析,结果显示,宁海黄鸡和广西黄鸡" KLF7基因大多数位点属中度多态[27],这与本研究结果相同。关联分析结果显示,MSTN基因AA型体质量显著高于AG和GG型,表明AA型为优势基因型,提示A等位基因是提高体质量的优势等位基因。" KLF7基因杂合型体质量显著高于纯和型,然而这并不能证明该等位基因与体质量有直接的相关性,这一SNP位点的杂合状态可能通过影响体质量相关的基因或基因产物,进而影响个体体质量。MSTN基因及" KLF7基因的优势基因型在P3代、P5代、P7代相较P1代优势更为明显,体质量性状随世代显著提高,说明本品种选育对略阳乌鸡体质量性状具有显著的选育效果。X2检验分析结果表明,略阳乌鸡MSTN基因各世代群体基因型频率仅有P1代偏离Hardy-Weinberg遗传平衡状态,表明略阳乌鸡体质量性状选择强度对该位点影响较小,并未打破遗传平衡状态。" KLF7基因各世代群体基因型频率P1代、P5代处于Hardy-Weinberg遗传平衡状态,而P3代、P7代反之,表明在略阳乌鸡体质量性状选育过程中,该位点呈现平衡与不平衡状态交替出现的现象,分析原因为存在等位基因的分离以及基因连锁现象,导致该位点存在某些非随机关联。
3.3" 体质量性状与MSTN基因型之间的关联" 分析
MSTN基因编码一种抑制肌肉细胞增殖和分化的生长因子,其基因突变或缺失可导致肌肉生长和发育的异常[30]。利用MSTN基因的遗传变异信息,选择有利遗传变异,可以促进家畜的生长和发育,提高肉质和产量,从而为畜牧业的发展做出重要贡献。本试验对MSTN基因潜在的SNP位点进行探究,通过KASP技术进行分型,进一步分析SNP位点与体质量的相关性。KASP分型结果显示,g.233Agt;G变异位点与不同基因型之间8周龄体质量具有显著差异(Plt;0.05)。这与张跟喜等[31]的研究结果相似,MSTN基因c.234Ggt;A发生变异可以负调控边鸡体质量。任冰冰等[24]和左斌等[25]在草科鸡、泸宁鸡和米易鸡的研究中均证明了MSTN基因可以调控鸡群的生长,证明MSTN基因可作为影响家禽生长性状的候选基因,也可以作为分子标记进行辅助选择育种。
3.4" 体质量性状与KLF7基因型之间的关联分析
KLFs家族是一类广泛存在于真核生物中的转录因子," KLF7是KLFs家族重要的家族成员之一,目前," KLF7基因的研究主要集中在大型经济动物如牛和猪等,对于家禽的研究较少,并且该基因与生长性状的相关研究较为有限。Ma等[26]对4个不同品种共计1 002头牛进行研究,结果表明" KLF7基因的g.42025 Tgt;C、g.42075 Agt;G变异位点与牛的生长性状之间存在极显著的关联。这项研究为探索" KLF7基因在畜牧业中的应用提供了重要的理论基础。家禽方面,Zhang等[32]研究发现,鸡" KLF7基因SNP位点141Agt;G显著促进肉鸡的腹脂质量和腹脂率。 本研究结果表明,SNP变异位点对不同世代的8周龄体质量有显著影响,证明" KLF7基因位点变异与略阳乌鸡的体质量性状存在相关性,这与Zhang等[32]的研究结果一致。" KLF7基因与脂肪沉积有关[33],结合以上研究结果,推测" KLF7基因位点变异通过影响脂肪生成,进而影响家禽体质量性状。
4" 结" 论
KASP技术具有低成本、迅速、准确度高等优点,但会由于DNA模板质量问题出现分型不明确现象;MSTN基因的g.233Agt;G位点和" KLF7基因的g.1022Cgt;T位点均可以作为略阳乌鸡体质量性状有效选择位点。
参考文献" Reference:
[1]" 齐丽娜,陆雪林,杨凯旋,等.基于SNP芯片分析新浦东鸡的遗传多样性和遗传结构[J].畜牧兽医学报,2023," 54(12):4962-4971.
QI L N,LU X L,YANG K X,et al.Analysis of genotic diversity and benetic structure of now pudong chicken based on SNP chipa[J].Acta Veterinaria et Zootechnica Sinica,2023,54(12):4962-4971.
[2]胡尊铠,朱志伟,刘子辉,等.小麦高质量SNP对产量及根系表型的潜在影响分析与在线数据库的构建[J].西北农业学报,2023,32(11):1718-1724.
HU Z K,ZHU ZH W,LIU Z H,et al.Potential effect of high quality SNPs in wheat on yield and root phenotype and online database construction[J].Acta Agriculturae Boreali-occidentalis Sinica,2023,32(11):1718-1724.
[3]YANG S J,YU W T,WEI X C,et al.An extended KASP-SNP resource for molecular breeding in Chinese cabbage(Brassica rapa L.ssp.pekinensis)[J].Plosone,2020, 15(10):0240042.
[4]SHI P,SHEN X J,CHEN J C,et al.KASP genotyping and semi-quantitation of G275E mutation in the α6 subunit of" Thrips palmi" nAChR gene conferring spinetoram resistance[J].Pest Management Science,2023,79(5):1777-1782.
[5]宋玉朴,孙永峰,冯自强,等.SNP分型检测技术及其在畜禽遗传和育种中的应用研究进展[J].中国畜牧杂志,2021, 57(7):37-42.
SONG Y P,SUN Y F,FENG Z Q,et al.Research progress on the genomic selection breeding in swine[J].Chinese Journal of Animal Science,2021,57(7):37-42.
[6]马士龙,谢书琼,刘益丽,等.KASP技术及其在牛SNP分型中的应用研究进展[J].江苏农业科学,2022,50(11):31-37.
MA SH L,XIE SH Q,LIU Y L,et al.Research progress of KASP technology and its application in bovine SNP typing[J].Jiangsu Agricultural Sciences,2022,50(11):31-37.
[7]CHEN Z J,TANG D G,NI J X,et al.Development of genic KASP SNP markers from RNA-Seq data for map-based cloning and marker-assisted selection in maize[J].BMC Plant Biology,2021,21(1):157.
[8]ANDERSON J D,GASTELBONDO M,CHAMBERS A H.Diagnostic KASP markers differentiate Vanilla planifolia,V.odorata,V.pompona,and their hybrids using leaf or cured pod tissues[J].Molecular Biology Reports,2023," 50(1):707-717.
[9]徐昊祺,许静漪,胡丽蓉,等.中国荷斯坦牛PIK3CB基因多态性及其与繁殖和产奶性状的关联分析[J].中国畜牧兽医,2022,49(9):3438-3452.
XU H Q,XU J Y,HU L R,et al.Polymorphism of PIK3CB gene and its association analysis with reproductive and milk production traits in Chinese Holstein cattle[J].China Animal Husbandry amp; Veterinary Medicine,2022,49(9):3438-3452.
[10]" FONTANESI L,CAL" D G,GALIMBERTI G,et al.A candidate gene association study for nine economically important traits in Italian Holstein cattle[J].Animal Genetics,2014,45(4):576-580.
[11]武泽文,顾亚玲,张" 娟,等.A2纯合基因型荷斯坦奶牛的筛选[J],黑龙江畜牧兽医,2019(8):44-47.
WU Z W,GU Y L,ZHANG J,et al.Screening of A2 homozygous genotype Holstein cows[J].Heilongjiang Animal Science and Veterinary Medicine,2019(8):44-47.
[12]许静漪,徐昊祺,胡丽蓉,等.MET基因多态性与中国荷斯坦牛繁殖和泌乳性状的关联分析[J].畜牧兽医学报,2022,53(11):3769-3785.
XU J Y,XU H Q,HU L R,et al.Association analysis of MET gene single nucleotide polymorphism with reproduction and milk production traits in Chinese Holstein cattle[J].Acta Veterinaria et Zootechnica Sinica,2022," 53(11):3769-3785.
[13]周建强,司" 思,祁增源,等.牦牛SMAD1基因第1外显子SNPs检测及与生长性状的关联分析[J].西北农业学报,2023,32(2):179-186.
ZHOU J Q,SI S,QI Z Y,et al.Detection of SNPs in exon 1 of SMADI gene and its association with growth traits in" yak[J].Acta Agriculturae Boreali-occidentalis Sinica,2023,32(2):179-186.
[14]刘玲玲,马海玉,刘武军,等.不同绵羊品种FSHR基因多态性及其与产羔数的关联分析[J].西北农业学报,2020,29(8):1132-1140.
LIU L L,MA H Y,LIU W J,et al.Polymorphism of FSHR gene and its association with litter size in different Sheep breeds[J].Acta Agriculturae Boreali-occidentalis Sinica,2020,29(8):1132-1140.
[15]薛" 蕾.山羊Indels筛选鉴定及其与生产性状关联分析[D].重庆:西南大学,2019.
XUE L.Screening theindel and its association with the productive traits in goats(Capra hircus)[D].Chongqing:Southwest University,2019.
[16]赵睿骁.金川多肋牦牛的分子标记筛选及分型[D].成都:西南民族大学,2021.
ZHAO R X.Screening and typing of molecular markers for multi-rib Jinchuan yak[D].Chengdu:Southwest Minzu University,2021.
[17]RODRIGUES C S,DE FARIA D A,LACERDA T S," et al.Lentivirus susceptibility in Brazilian and US Sheep with TMEM154 mutations[J].Genes,2023,14(1):70.
[18]ESUMA W,EYOO O,GWANDU F,et al.Validation of KASP markers associated with cassava mosaic disease resistance,storage root dry matter and provitamin A carotenoid contents in Ugandan cassava germplasm[J].Frontiers in Plant Science,2022(13):1017275.
[19]梁若冰,谢" 岩,范学华,等.中国荷斯坦公牛脊椎畸形综合征和尿苷酸合酶缺乏症遗传缺陷检测[J].中国奶牛,2014(7):22-26.
LIANG R B,XIE Y,FAN X H,et al.Identification of CVM and DUMPS carriers in Chinese Holstein bulls[J].China Dairy Cattle,2014(7):22-26.
[20]吕小青,劳兰兰,赵" 凤,等.北京地区荷斯坦母牛群体HH1遗传缺陷基因抽样调研[J].中国奶牛,2019(1):12-14.
L"" X Q,LAO L L,ZHAO F,et al.The random sampling for genetic defect HH1 in Chinese Holstein cows in Beijing area[J].China Dairy Cattle,2019(1):12-14.
[21]颜" 泽,肖" 炜,张胜利,等.基于KASP技术的牛3种无角基因联合检测方法研究[J].农业生物技术学报,2021,29(3):610-618.
YAN Z,XIAO W,ZHANG SH L,et al.Multiplex detection of three Cattle (Bos taurus) polled variants based on KASP assay[J].Journal of Agricultural Biotechnology,2021,29(3):610-618.
[22]马丽娜,李颖康,于" 洋,等.滩羊肌肉抑制素(MSTN)基因TaqMan探针SNP分型及其与生长性状的关联研究[J].黑龙江畜牧兽医,2016(3):4-6.
MA L N,LI Y K,YU Y,et al.Single nucleotide polymorphism (SNP) genotyping of myostatin (MSTN) gene"" using TaqMan probe assay and its association study with the growth traits in Tan sheep[J].Heilongjiang Animal Science and Veterinary Medicine,2016(3):4-6.
[23]高" 峰,邢沈阳,于海滨,等.牛MSTN基因克隆及编码区E1-224-Agt;C定点突变前后生物信息学对比分析[J].中国兽医学报,2014,34(5):825-830.
GAO F,XING SH Y,YU H B,et al.Cloning of bovine MSTN gene and bioinformatics comparative analysis betweem coding region with E1-224-Agt;C mutation site and normal type[J].Chinese Journal of Veterinary Science,2014,34(5):825-830.
[24]任冰冰,王康环,蒋" 利,等.草科鸡MSTN基因多态性与其生长性状的相关性[J].贵州农业科学,2014,42(6):14-19.
REN B B,WANG K H,JIANG L,et al.Relationship of polymorphisms of MSTN gene with growth traits in Caoke chicken[J].Guizhou Agricultural Sciences,2014, 42(6):14-19.
[25]左" 斌,任冰冰,蒋小松,等.泸宁鸡和米易鸡MSTN基因多态性及其与生长性状的关联性[J].贵州农业科学,2015,43(7):26-30.
ZUO B,REN B B,JIANG X S,et al.Polymorphism of Myostatin (MSTN) gene and correlation between MSTN polymorphism and growth traits in Luning and Miyi chicken[J].Guizhou Agricultural Sciences,2015,43(7):26-30.
[26]MA L,QU Y J,HUAI Y T,et al.Polymorphisms identifi-cation and associations of ""KLF7 gene with cattle growth traits[J].Livestock Science,2011,135(1):1-7.
[27]董定娟,曹海月,董信阳,等.宁海黄鸡和广西黄鸡" KLF7基因多态性及其与屠体性状的相关分析[J].农业生物技术学报,2017,25(2):282-290.
DONG D J,CAO H Y,DONG X Y,et al.Polymorphisms of"" KLF7 gene in Ninghai and Guangxi yellow chickens (Gallus gallus)and its association with carcass traits[J].Journal of Agricultural Biotechnology,2017,25(2):282-290.
[28]赵" 越,孙宇峰,徐" 磊,等.KASP标记技术在作物基因定位中的应用进展[J].北方园艺,2023(19):122-127.
ZHAO Y,SUN Y F,XU L,et al.Application progress of KASP marker technology on crop gene location[J].Northern Horticulture,2023(19):122-127.
[29]庄嘉楠,路宏朝,杨" 鸽,等.略阳乌鸡黑羽和白羽群体微卫星遗传多态性分析[J].中国家禽,2021,43(4):107-112.
ZHUANG J N,LU H ZH,YANG G,et al.Analysis of microsatellite genetic polymorphisms in black and white populations of Liouyang black" chickens[J].China Poultry,2021,43(4):107-112.
[30]王可人,游绍航,主" 性,等.贵州杂交黄牛MSTN基因cDNA克隆、生物信息学及多态性分析[J].家畜生态学报,2023,44(4):13-21.
WANG K R,YOU SH" H,ZHU X,et al.cDNA Cloning,bioinformatics and polymorphism analysis of MSTN gene of hybrid Guizhou yellow cattle[J].Journal of Domestic Animal Ecology,2023,44(4):13-21.
[31]张跟喜,曹宁贤,丁馥香,等.边鸡MSTN基因C.234位点对生长性状的遗传效应分析[J].中国兽医学报,2013,33(9):1470-1474.
ZHANG G X,CAO N X,DING F X,et al.Genetic effect of the C.234 locus of the MSTN gene on growth traits in Bian chicken[J].Chinese Journal of Veterinary Science,2013,33(9):1470-1474.
[32]ZHANG Z W,WANG Z P,ZHANG K,et al.Cloning,tissue expression and polymorphisms of chicken Kruppel-like factor 7 gene[J].Animal Science Journal,2013,84(7):535-542.
[33]ZHANG Z W,WANG H X,SUN Y N,et al." KLF7 modulates the differentiation and proliferation of chicken preadipocyte[J].Acta Biochimica et Biophysica Sinica,2013,45(4):280-288.
Rapid Detection of SNPs in MSTNand KLF7 Genes" in Lueyang
Black-bone" Chickens and Their Correlation with
Body Mass Traits Based on KASP Technique
CAI Yingjie,GUO Tong,ZHOU Jie,ZHANG Huiya and ZHANG Jianqin
(College of Animal Science and Technology,Northwest Aamp;F University,Yangling" Shaanxi" 712100,China)
Abstract" To accurately identify SNP sites and evaluate their application in the breeding effect of Lueyang black-bone chickens efficiently and cost effectively,KASP technology was used to analyze the SNPs in the first exon of MSTN gene (g.233Agt;G) and the second intron of"" KLF7 gene (g.1022Cgt;T) in the population of Lueyang black-bone chickens over four generations (P1,P3,P5,and P7).The results showed that AA,AG,and GG genotypes were detected in the MSTN gene,CC,CT and TT genotypes were found in KLF7 gene.The SNPs in MSTN gene in P1 and"" KLF7 gene in P3 and P7 deviated from the Hardy-Weinberg genetic equilibrium,while they were in equilibrium in the other generations.The association analysis" between body mass and SNPs showed that chickens with AA genotype in MSTN had significantly higher body mass than those with AG and GG genotypes,the individuals with heterozygous SNP in"" KLF7 had higher body mass than those with homozygous genotype.The body mass trait increased significantly after generations of breeding (Plt;0.05).The results suggest that both SNP loci can be used for body mass trait selection in breeding Lueyang black-bone chickens.
Key words" KASP technology;MSTN;" KLF7;Correlation analysis;Selection for body mass traits
Received ""2023-12-15""" Returned" 2024-01-02
Foundation item" 2023 Breeding of New Breeds of Livestock and Poultry-Lueyang Chicken"" (No.K3031223079).
First author" CAI Yingjie,female,master" student.Research area:animal genetics,breeding and reproduction.E-mail:caiyingjie2022@nwafu.edu.cn
Corresponding"" author" ZHANG Jianqin,female,Ph.D,associate professor,doctoral supervisor.Research area:animal genetics,breeding and reproduction.E-mail:zhangjianqin0822@nwafu.edu.cn
(责任编辑:顾玉兰" Responsible editor:GU Yulan)

