多重连接探针扩增技术检测食源性致病菌




摘要:基于多重连接探针扩增技术(MLPA),建立了一种能够同时检测食品中11种常见食源性致病菌的方法。通过设计并合成特异性MLPA探针,与高温变性后的标准菌株DNA进行杂交、连接、PCR扩增反应,利用毛细管电泳法分析PCR扩增产物。结果表明,利用11对探针分别对单一致病菌核酸样品进行检测,每种待测物均为单一峰,未出现杂峰,说明11对探针之间不存在交叉影响,探针特异性良好;利用11对探针同时对混合致病菌核酸样品进行多重检测,每种待测物均可得到与预期大小一致的扩增峰,扩增峰之间互不干扰,空白对照中没有扩增出任何目的扩增峰,说明该体系能同时检测多种食源性致病菌。该技术检测结果特异性强,可检出的最低致病菌污染量为1.5×105 CFU/mL,作为对传统微生物检测技术的补充,MLPA技术可应用于食源性致病菌的早期筛查以及食品微生物安全风险的监控。
关键词:食源性致病菌;多重连接探针扩增技术;食品检测
中图分类号:TS207.4" " " " "文献标识码:A
文章编号:0439-8114(2024)11-0168-07
DOI:10.14088/j.cnki.issn0439-8114.2024.11.028 开放科学(资源服务)标识码(OSID):
Detection of foodborne pathogenic bacteria using multiplex ligation-dependent probe amplification
HE Ming-yang, WANG Ming-qiu, LIU Yan, LI Shi-yao, FU Wen-wen,
GUO Ya-qing, ZHOU Tao-hong, ZHANG Li, PENG Qing-zhi
(Hubei Provincial Institute for Food Supervision and Test/Key Laboratory of Detection Technology of Focus Chemical Hazards in Animal-derived Food for State Market Regulation/Hubei Provincial Engineering and Technology Research Center for Food Quality and Safety Test,Wuhan" 430075, China)
Abstract: A method for simultaneous detection of 11 common foodborne pathogenic bacteria in food was established based on the multiplex ligation-dependent probe amplification (MLPA). By designing and synthesizing specific MLPA probes, hybridization, ligation, and PCR amplification reactions with standard strain DNA after high-temperature denaturation were performed. The size and presence of PCR amplification products were analyzed by capillary electrophoresis. The results showed that using 11 pairs of probes to detect single bacterial nucleic acid samples, each analyte had a single peak and no impurity peaks appeared, indicating that there was no cross influence between the 11 pairs of probes and the specificity of the probes was good;using 11 pairs of probes for simultaneous multiplex detection of mixed pathogenic nucleic acid samples, each analyte could obtain amplification peaks of the same size as expected, and the amplification peaks did not interfere with each other. No target amplification peak was amplified in the blank control, indicating that the system could simultaneously detect multiple foodborne pathogenic bacteria. The detection results of this technology were highly specific, with a minimum detectable contamination level of 1.5×105 CFU/mL. As a supplement to traditional microbiological detection techniques, MLPA technology could be applied for early screening of foodborne pathogenic bacteria and monitoring of food microbiological safety risks.
Key words: foodborne pathogenic bacteria; multiplex ligation-dependent probe amplification; food testing
随着全球经济水平提升、产业链规模扩大、生产技术迭代更新,全球食品安全风险正在不断加大。据估计,每年约6亿人因食用被污染的食物患病,导致约42万人死亡,其中70%是由食品中的致病性微生物污染导致[1,2]。根据2018—2021年中国大陆食源性疾病暴发监测结果报道,微生物引起的食源性疾病是主要因素,且所占比例逐年上升,甚至超过了50%[3-5]。沙门氏菌、金黄色葡萄球菌、蜡样芽胞杆菌、单核细胞增生李斯特氏菌、副溶血性弧菌等感染均导致过食源性疾病的暴发[3-5]。近年来,多种食源性致病菌在全国食品抽检和风险监测中均被检出[6-11]。因此,为确保食品安全并最大限度地减少食源性疾病的发生,对食品中致病菌进行高效、准确、灵敏地检测变得至关重要。
食源性致病菌的传统检测手段主要通过增菌扩大、分离培养、生化鉴定等步骤获得[12],但是传统培养法耗时耗力,通常需要2~3 d进行初步鉴定,1周以上的时间确认致病菌的种类,且针对不同致病菌需要使用不同的培养基和鉴定试剂,检测步骤也各不相同[13]。基于此,多种快速检测手段被开发和建立,如实时荧光定量PCR法、酶联免疫吸附法、生物芯片等,这些方法可以用来补充及协助传统方法,帮助提高食品中致病菌检测的效率及灵敏度[13]。多重连接探针扩增技术(Multiplex ligation-dependent probe amplification,MLPA),是一种结合核酸杂交和PCR扩增的高通量多重核酸检测方法,已经被应用于肿瘤诊断、病毒检测、遗传性疾病检测等领域[14,15]。该方法具有以下优点:①所需样品量较少,MLPA检测系统仅需20 ng DNA就可完成检测,且探针靶序列长度较传统PCR法短,对模板DNA质量要求较低,可用于检测高度片段化的样品[14];②检测通量高,基于病原微生物核酸的检测方法主要为实时荧光定量PCR法,该法虽然灵敏度及稳定性高,但多重检测需不同荧光标记,1次可检测最多3~6个靶标[13,16,17]。而MLPA检测系统可灵活地通过添加不同探针来实现高水平的多重检测,无需进行不同荧光标记,1个碱基数差异的核酸序列就能区分,单次反应可靶向检测20~50个目标基因[14,15]。③检测流程便捷,MLPA操作流程简单,仅需进行简单的分子生物学操作即可进行毛细管电泳分析,耗时短,最短仅1 d就可完成检测。考虑到MLPA在多重靶标检测中的优势及对食源性致病菌高效快速的检测要求,本研究拟建立能同时对11种常见食源性致病菌检测的MLPA检测技术,以达到对多种食源性致病菌快速检测的目的,为食源性致病菌检测分析及监管提供新的技术手段。
1 材料与方法
1.1 材料与试剂
1.1.1 标准菌株 沙门氏菌ATCC14028、空肠弯曲菌CMCC22072、铜绿假单胞菌CICC21636、单核细胞增生李斯特氏菌ATCC19115、阪崎肠杆菌ATCC29544、金黄色葡萄球菌ATCC6538、副溶血性弧菌CMCC20032、创伤弧菌CICC10383、大肠埃希氏菌O157∶H7 NCTC12900、蜡样芽胞杆菌CICC21261、产气荚膜梭菌CICC24571均为湖北省食品质量安全监督检验研究院实验室储藏菌株。待加标食品样品:糕点(早餐包)、肉制品(火腿肠)、奶粉均购自商超店。
1.1.2 试剂 细菌基因组 DNA 提取试剂盒(DP302)[天根生化科技(北京)有限公司];MiniBEST Universal Genomic DNA Extraction Kit(9765)[宝生物工程(大连)有限公司];营养肉汤(Nutrient broth,NB)、脑心浸液肉汤(Brain heart infusion broth,BHI)等微生物培养基(北京陆桥技术股份有限公司);MLPA探针(北京擎科生物科技股份有限公司);SALSA MLPA EK5 Reagent kit 100 reactions-FAM(荷兰MRC-Holland公司);毛细管电泳阴阳极缓冲液、POP-7胶、Hi-Di Formamide、GeneScan 500 LIZ dye Size Standard[赛默飞科技公司(中国)有限公司];Premix Ex Taq(Probe qPCR)[宝生物工程(大连)有限公司]。
1.2 仪器与设备
BSP-250型生化培养箱(上海博讯实业有限公司医疗设备厂)、VITEK2 COMPACT 30型全自动微生物鉴定及药敏分析系统(法国梅里埃公司)、LEGEND MICRO 21型通风型微量台式离心机(德国Eppendorf公司)、NanoDrop ONE型超微量分光光度计(美国Thermo公司)、C1000 Touch型PCR仪(美国Bio-rad公司)、A11 basic型研磨仪(德国IKA公司)、3500毛细管基因分析仪(美国ABI公司)。
1.3 试验方法
1.3.1 细菌基因组DNA提取 参考GB 4789.41—2016《食品安全国家标准 食品微生物学检验》系列标准、GB 8538—2022《食品安全国家标准 饮用天然矿泉水检验方法》及实验室已建立的检测方法对待测标准菌株进行复苏、纯化、鉴定。菌株鉴定无误后,使用对应的增菌液或通用增菌液NB、BHI对待测菌株扩大培养至108~109 CFU/mL,取1 mL菌悬液,12 000 r/min离心2 min,弃上清液,细菌沉淀按照细菌基因组DNA提取试剂盒(DP302)说明书进行DNA提取,提取到的DNA使用NanoDrop ONE型超微量分光光度计对其进行浓度和纯度测定。DNA浓度保证至少达20 ng/μL,-20 ℃保存备用。
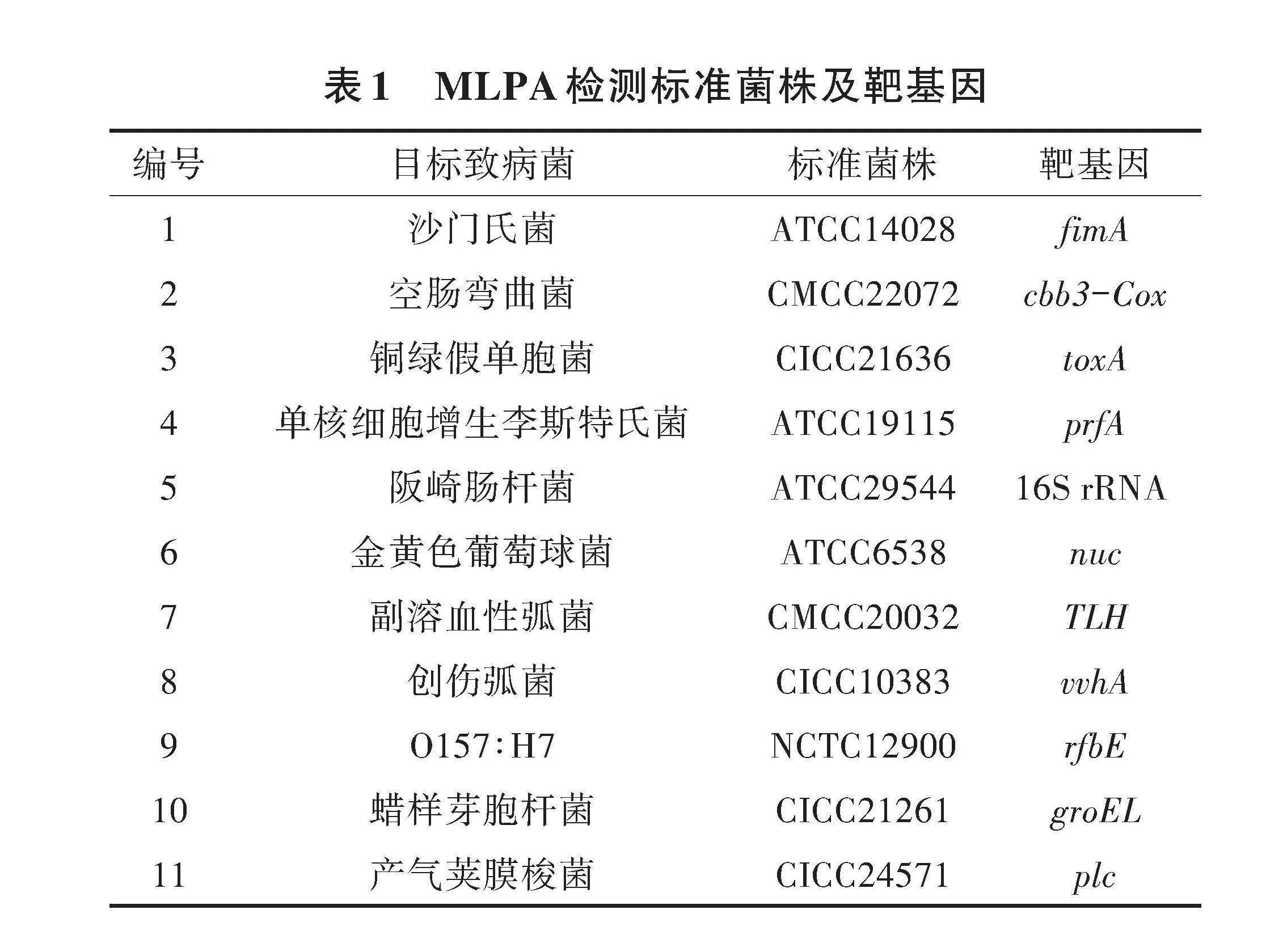
1.3.2 靶标基因的选择 MLPA靶基因的选择原则为各靶基因应没有或有很小的同源性。常用病原菌靶基因一般为目标菌毒力基因或细胞色素C等结构基因。依据现有标准和文献研究中有关11种目标菌常用靶基因报道[18-26],确立11个靶标基因,如表1所示。靶基因序列通过2种方式获得,①标准及文献已有报道的Genebank序列号,直接在NCBI数据库中检索获得;②参考标准或文献提供的引物序列,利用引物序列在NCBI数据库中进行核酸序列比对,获得10条同源性gt;95%的序列,采用DNAMAN 7软件进行序列比对,剔除一致性较差的序列,导出的比对后序列用于后续探针设计。
1.3.3 MLPA探针的设计与合成 MLPA探针的设计是该技术的关键步骤。MLPA技术所用探针包括左探针(Left probe oligo,LPO)和右探针(Right probe oligo,RPO),每个探针包含3种结构:PCR 通用引物序列、填充片段序列(加在通用引物序列和杂交序列之间,用于调节扩增片段长度)、与靶序列完全互补的左右杂交序列(Left hybridising sequence,LHS;Right hybridising sequence,RHS),如图1所示。
按照MRC-Holland公司官网提供的引物设计策略,针对靶标基因序列进行相应引物探针的设计。MLPA探针设计时要注意以下几个关键点:①杂交片段GC含量在50%左右为宜;②同一靶标的LPO和RPO的熔解温度Tm要接近,且Tm≥71 ℃;③LHS和RHS的长度在26~30 bp为宜,最低不能低于21 bp;④LPO和RPO自由能ΔG≥0,ΔG可在网站http://www.unafold.org/DNA_form.php中检测,参数设置为[Na+]=0.35 mol/L,Folding temperature=65 ℃,其他参数为默认值。为避免交叉反应,探针设计完成后进行BLAST核酸序列比对验证,确定探针特异性。针对每个靶标序列,设计合成了1~3对探针,探针由北京擎科生物科技有限公司合成。
1.3.4 MLPA反应 MLPA反应条件和程序参照SALSA MLPA EK5 Reagent试剂盒说明书和文献报道[14,25]进行,模板变性(95 ℃变性5 min)、探针及变性模板杂交(60 ℃杂交16 h)、连接反应(54 ℃,15 min;98 ℃,5 min)、PCR扩增(95 ℃ 30 s,60 ℃ 30 s,72 ℃ 60 s,循环35次,72 ℃ 20 min)、PCR产物毛细管电泳分析(GeneScan 500 LIZ dye Size Standard作为内参标记质控)。在3500 Series Data Collection Software 3上对MLPA检测结果进行分析,确定标准阳性结果峰值的大小和位置。
1.3.5 人工污染样品的制备 选择糕点、肉制品、奶粉作为人工污染样品的待加标样品。首先,使用研磨器将糕点及肉制品研磨均匀(奶粉无需研磨);为排除本底微生物影响,对研磨均匀的食品样品进行121 ℃高压蒸汽灭菌15 min,使其不含食源性致病菌;其次,在无菌条件下称取10 g灭菌后的待加标样品,共称取6份(其中4份为糕点样品、1份为肉制品样品、1份为奶粉样品),全部加入到90 mL的无菌磷酸盐缓冲液中,使用均质器混合均匀,制备人工污染样品;随机选择几种致病菌作为加标菌,使用比浊仪测定所选菌悬液浓度(将每种菌悬液浓度调整至与0.5号麦氏浊度标准管浊度一致,致病菌污染量为1.5×108 CFU/mL),分别取每种致病菌菌悬液1 mL,加入到灭菌后的待加标样品中,6份样品加入的致病菌种类互不相同,得到含有不同食源性致病菌的6份人工污染样品(致病菌污染量为1.5×107 CFU/mL)。取1~5 mL样品混悬液进行DNA提取及后续MLPA检测。
2 结果与分析
2.1 单一靶标MLPA探针特异性分析
将不同靶标设计合成的1~3对探针分别与11种靶标菌的标准菌株DNA进行MLPA试验,检测MLPA探针的特异性和稳定性。MLPA检测用探针应特异性良好,无非特异扩增峰,每种靶标扩增片段长度不相互重叠,相邻靶标扩增片段大小应至少相差1 bp。综合以上要求,经过筛选及调整填充片段大小,最终确认的11对MLPA检测探针序列如表2所示。
将11对MLPA探针分别与11种食源性致病菌标准菌株DNA进行单一靶标的MLPA检测,结果如图2所示,横坐标表示片段大小,纵坐标表示信号值,黑色峰为扩增片段目标峰,浅灰色峰为GeneScan 500 LIZE dye Size Standard(LIZ-500分子量内标),是确定目标片段大小的参照片段,标准物大小分别为50、75、100、139、150 bp。探针对单一靶标DNA检测的结果均为单一峰,未出现杂峰,说明11对探针之间不存在交叉影响,探针特异性良好;且11个靶基因扩增片段的大小不同,且扩增片段大小相差均大于1.00 bp,致病菌扩增片段大小分别为沙门氏菌(88.94 bp)、空肠弯曲菌(93.47 bp)、铜绿假单胞菌(94.53 bp)、单核细胞增生李斯特氏菌(98.71 bp)、阪崎肠杆菌(106.58 bp)、金黄色葡萄球菌(110.59 bp)、副溶血性弧菌(114.99 bp)、创伤弧菌(118.67 bp)、大肠埃希氏菌O157∶H7(120.89 bp)、蜡样芽胞杆菌(123.40 bp)、产气荚膜梭菌(129.87 bp)。为进一步确认扩增峰为目标基因,将PCR扩增产物送去基因测序公司(北京擎科生物科技有限公司)进行测序,并将测序序列在NCBI中进行BLAST序列比对,比对结果显示同源性gt;90%,均为目标菌株靶标基因,确认所测结果为目标菌。
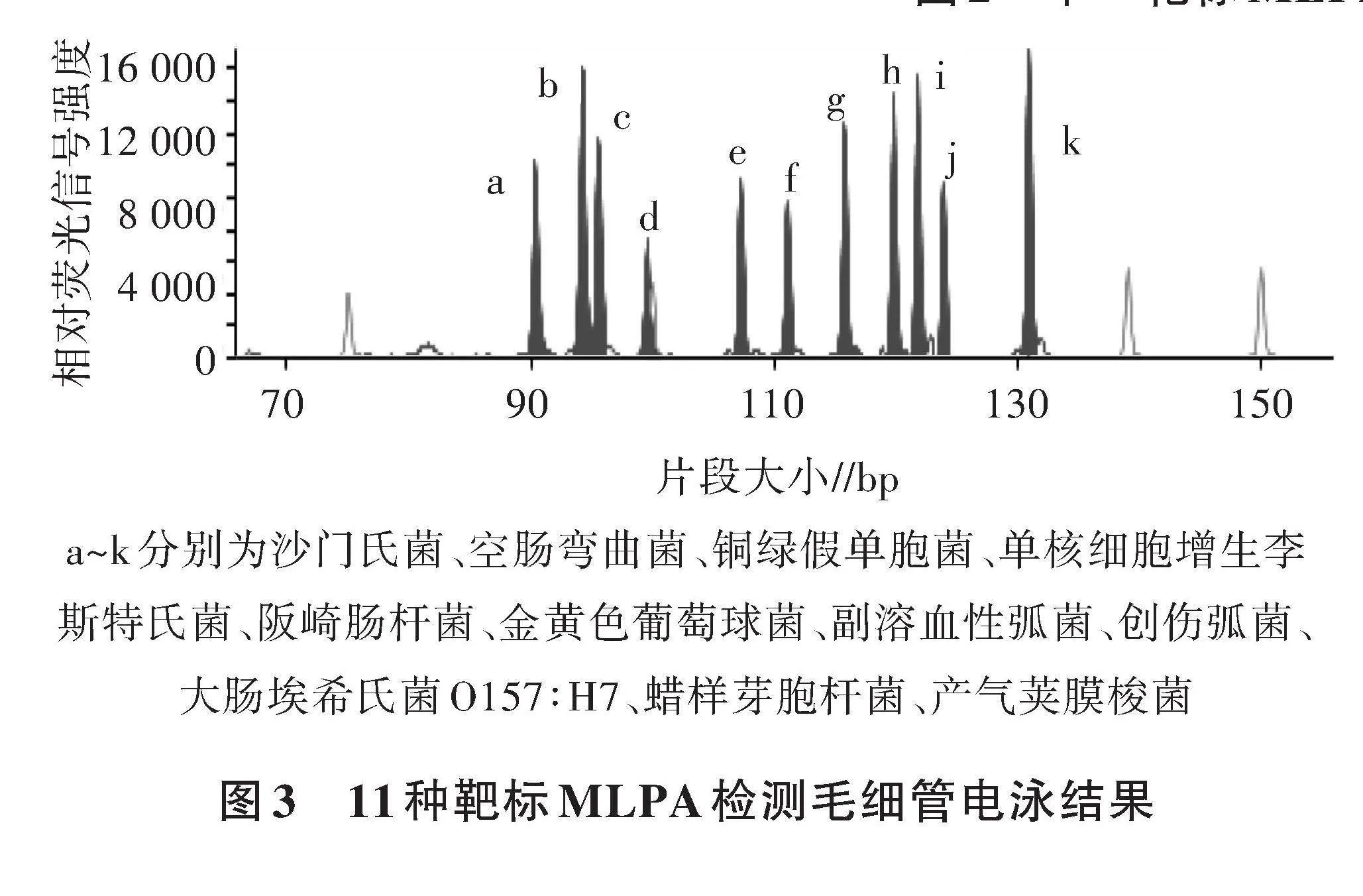
2.2 11种食源性致病菌的MLPA多重检测
为了验证MLPA致病菌检测方法在11种病原微生物多重检测分析中的适用性,制备含有11种致病菌标准菌株DNA的混合核酸样品,每种致病菌DNA浓度为(20±10) ng/μL,并以无模板的TE作为空白对照。利用11对探针同时对混合致病菌核酸样品进行多重检测(图3),每种待测物均可得到与预期大小一致的扩增峰,扩增峰之间互不干扰。空白对照中没有扩增出任何目的扩增峰,说明该体系能同时检测多种食源性致病菌。混合探针实际片段大小与理论值存在一些偏差,其原因可能是以下2个方面,① GeneScan 500 LIZ dye Size Standard与待测片段荧光标记不同导致电泳迁移率不同;②不同片段DNA结构和碱基组成的不同导致电泳迁移率不同。
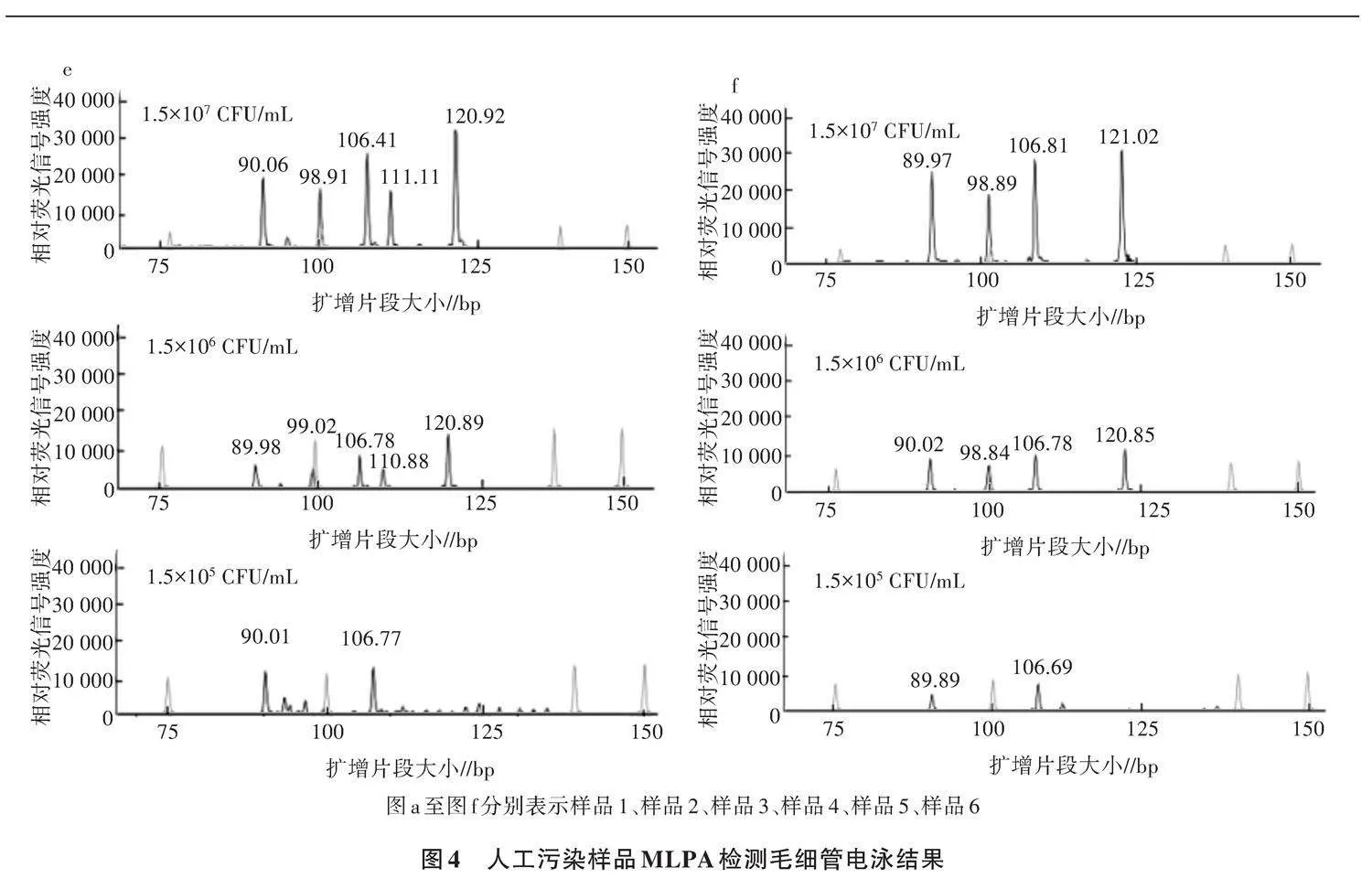
2.3 MLPA多重检测在人工污染样品中的应用
考虑到食品基质干扰、DNA提取等因素可能会对MLPA检测体系的特异性和检出限产生影响,本研究制备了不同食品基质成分的人工污染食品样品,用来模拟含有待测致病菌的食品,分析该技术在食源性病原微生物检测中的可行性。6种人工污染样品致病菌添加情况如下:样品1加入了铜绿假单胞菌、副溶血性弧菌及产气荚膜梭菌(3种菌,每种致病菌污染量为1.5×107 CFU/mL);样品2加入了金黄色葡萄球菌、沙门氏菌、阪崎肠杆菌、单核细胞增生李斯特氏菌(4种菌,每种致病菌污染量为1.5×107 CFU/mL);样品3中加入金黄色葡萄球菌、沙门氏菌、阪崎肠杆菌、单核细胞增生李斯特氏菌、大肠埃希氏菌O157∶H7、蜡样芽孢杆菌(6种菌,每种致病菌污染量为1.5×107 CFU/mL);样品4中加入金黄色葡萄球菌、沙门氏菌、阪崎肠杆菌、创伤弧菌、副溶血性弧菌、空肠弯曲菌、大肠埃希氏菌O157∶H7、蜡样芽孢杆菌(8种菌,每种致病菌污染量为1.5×107 CFU/mL);样品5中加入沙门氏菌、单核细胞增生李斯特氏菌、阪崎肠杆菌、金黄色葡萄球菌、大肠埃希氏菌O157∶H7(5种菌,每种致病菌污染量为1.5×107 CFU/mL);样品6中加入沙门氏菌、单核细胞增生李斯特氏菌、阪崎肠杆菌、大肠埃希氏菌O157∶H7(4种菌,每种致病菌污染量为1.5×107 CFU/mL)。样品1至样品4的食品基质为糕点,样品5的食品基质为肉制品,样品6的食品基质为奶粉。上述6种人工污染样品经DNA提取后进行MLPA检测。结果(图4)显示,对于不同食品基质样品,在致病菌污染量为1.5×107 CFU/mL时,食源性致病菌MLPA多重检测技术可以检测出各种目标病菌,检测结果峰值大小与标准菌株DNA模板检测结果一致,且特异性良好。本研究建立的食源性致病菌MLPA多重检测技术可应用于食品中致病菌检测。
为进一步探究较低浓度的细菌污染量是否能被MLPA技术检出,对上述6份人工污染样品混悬液(1.5×107 CFU/mL)进行梯度稀释,得到分别为1.5×105、1.5×106 CFU/mL的样品梯度稀释液,按照同样的方法对不同浓度梯度致病菌污染的人工污染样品进行MLPA检测。结果(图4)表明,添加致病菌种类较少的样品(种类数≤6种),在细菌污染量为1.5×106 CFU/mL时,所有目标菌的扩增峰可以被检测到,其中样品1在细菌污染量为1.5×105 CFU/mL时仍可出现相对荧光信号强度大于3 000的扩增峰;而添加致病菌种类较多的样品(种类数为8种),在细菌污染量≤1.5×106 CFU/mL时,MLPA无法检测出全部加标致病菌的目标峰,甚至出现非特异性扩增条带,原因可能是不同种病原菌DNA提取的获得率存在差异,DNA模板量过低时,检测的特异性降低,出现非特异性扩增,甚至模板量较低的扩增反应会被模板量较高的扩增反应影响,导致无法测出。在使用MLPA技术在对食品样品进行检测时,鉴于食品中病原菌含量较低,在检测前可对食品样品进行预增菌处理,加大样品中待测菌浓度,提高待测目标DNA的获得率,从而保证MLPA多重检测体系检出全部目标病菌,提高食源性致病菌的检出率。
3 小结与讨论
依赖于MLPA检测技术,本研究开发了一种食源性致病菌的多重检测技术,该技术设计的探针对可随意组合,可以在1次反应中同时对11种常见食源性致病菌进行检测鉴定。该技术所有探针反应条件相同,无需分开操作,引物探针不需要额外标记不同的荧光信号,避免了在多种病菌检测鉴定中重复配制体系、分开扩增等问题。该技术检测结果特异性强,可检出的最低致病菌污染量为1.5×105 CFU/mL。作为对传统微生物检测技术的补充,MLPA技术可对问题样品进行早期快速检测,为食源性致病菌高通量筛查和重大突发食品安全问题应急响应提供了更方便快捷的手段。
参考文献:
[1] WHO. The burden of foodborne diseases[EB/OL]. https://www.who.int/news-room/fact-sheets/detail/food-safety,2022-05-19.
[2] 孙献周,于 琪,张 巧.食品中食源性致病菌污染现状及危害[J].河南医学高等专科学校学报,2021,33(3):335-339.
[3] 韩海红,寇柏洋,马 洁,等.2018年中国大陆食源性疾病暴发监测资料分析[J].中国食品卫生杂志,2022,34(4):822-829.
[4] 李红秋,郭云昌,宋壮志,等.2019年中国大陆食源性疾病暴发监测资料分析[J].中国食品卫生杂志,2021,33(6):650-656.
[5] 李红秋,贾华云,赵 帅,等.2021年中国大陆食源性疾病暴发监测资料分析[J].中国食品卫生杂志,2022,34(4):816-821.
[6] 王天瑞.2018—2020年国家食品安全监督抽检情况的分析与讨论[J].山西医药杂志,2022,51(9):1043-1045.
[7] 姜晓燕,李小彦.国家食品安全监督抽检中微生物抽检现状及问题分析[J].食品安全导刊,2020(12):36.
[8] 张 健,王大虎,罗健梅,等.广州市网络外卖食品中食源性致病菌污染状况监测与分析[J].医学动物防制,2022,38(5):444-447.
[9] 程春荣,戴 蕾,赵瑞臻,等.2019—2020年郑州市食品安全风险监测结果分析[J].医药论坛杂志,2022,43(7):69-72.
[10] 郝慧蕾,王宜凤,孟南希,等.2016-2018年黑龙江省哈尔滨市两类食品中食源性致病菌监测结果分析[J].预防医学论坛,2022,28(11):853-856.
[11] 宋 夏,徐碧瑶,蔡 华,等.2016—2020年上海市市售即食食品微生物污染状况分析及评价[J].中国食品卫生杂志,2022,34(4):767-772.
[12] UMESHA S, MANUKUMAR H M. Advanced molecular diagnostic techniques for detection of food-borne pathogens: Current applications and future challenges[J]. Critical reviews in food science and nutrition,2018,58(1):84-104.
[13] LAW J W F, AB MUTALIB N S, CHAN K G, et al. Rapid methods for the detection of foodborne bacterial pathogens: Principles, applications, advantages and limitations[J]. Frontiers in microbiology,2015,5:770.
[14] SCHOUTEN J P, MCELGUNN CL J, WAAIJER R, et al. Relative quantification of 40 nucleic acid sequences by multiplex ligation-dependent probe amplification[J]. Nucleic acids research, 2002, 30(12): 57.
[15] 王雨萌,周 柯,邵春艳,等.多重连接探针扩增技术(MLPA)在病原微生物检测与疾病诊断中的应用[J].农业生物技术学报,2021,29(10):2031-2042.
[16] 方文捷,刘 加,潘炜华,等.多重连接探针扩增技术在临床病原体检测中的应用[J].中国真菌学杂志,2015,10(5):307-311.
[17] EMIR H, AIDA G, CARA W. A novel approach for simultaneous detection of the most common food-borne pathogens by multiplex qPCR [J]. Biomol Biomed, 2023,23(4):640-648.
[18] MOHAMMED A. A Review of modern methods for the detection of foodborne pathogens[J]. Microorganisms,2023,11(5):11051111.
[19] 许业莉,相大鹏,蔡 颖.食源性致病微生物中应用于PCR检测的靶基因[J].检验检疫科学,2003(6):52-54.
[20] MANN E,HEIN I,MESTER P, et al. A robust and poisson validated quantitative 5’nuclease TaqMan® Real-Time PCR assay targeting fima for the rapid detection of Salmonella spp. in food[J]. Food analytical methods,2013,6(4):991-995.
[21] SN/T 1870—2016,出口食品中食源性致病菌检测方法 实时荧光PCR法[S].
[22] 曲 岩. 铜绿假单胞菌增菌培养基的研制及PCR快速检测方法的建立[D].南京:南京农业大学,2019.
[23] SN/T 1632.2—2013,出口奶粉中阪崎肠杆菌(克罗诺杆菌属)检验方法第2部分:PCR方法[S].
[24] CHUNG B, SHIN GW, NA J, et al. Multiplex quantitative foodborne pathogen detection using high resolution CE-SSCP coupled stuffer-free multiplex ligation-dependent probe amplification[J]. Electrophoresis,2012,33:1477-1481.
[25] SN/T 1869—2007,食品中多种致病菌快速检测方法 PCR法[S].
[26] KIM S Y,CHUNG B,CHANG J H,et al.Simultaneous identification of 13 foodborne pathogens by using capillary electrophoresis-single strand conformation polymorphism coupled with multiplex ligation-dependent probe amplification and its application in foods[J]. Foodborne pathogens and disease,2016,13(10): 566-574.
何名扬,王鸣秋,刘 艳,等. 多重连接探针扩增技术检测食源性致病菌[J]. 湖北农业科学,2024,63(11):168-174,222.
收稿日期:2023-10-13
基金项目:湖北省重点研发计划项目(2020BCA091);湖北省食品质量安全监督检验研究院联合创新项目(HBQT-LH202102)
作者简介:何名扬(1992-),女,湖北襄阳人,工程师,硕士,主要从事食品微生物检验技术研究,(电话)15549409336(电子信箱)
hmylovecnblue@qq.com;通信作者,彭青枝(1969-),女,湖北武汉人,高级工程师,硕士,主要从事食品安全研究与检测研究,
(电话)13971572455(电子信箱)1415720863@qq.com。

