芯片式支原体qPCR检测技术的开发与应用研究
摘 要 目的:为解决目前支原体检测方法操作复杂、耗时长、灵敏度低等问题,按照《中华人民共和国药典》(ChP)、美国药典(USP)、欧洲药典(EP)生物制品支原体检测方法及验证指导原则,构建一种快速芯片式的支原体检测方法,并对该方法检测能力进行验证。方法:采用Taqman探针法,并利用快速qPCR仪结合芯片检测支原体,快速高效,可极大降低检测成本。结果与结论:本研究建立的基于qPCR的支原体检测方法特异性强、稳定性佳、可重复性好,可为支原体感染的诊断检测和流行病学调查提供方法学支持。
关键词 支原体残留 探针法 qPCR
中图分类号:Q93-332 文献标志码:A 文章编号:1006-1533(2024)19-0085-05
引用本文 姚杰, 黄懿. 芯片式支原体qPCR检测技术的开发与应用研究[J]. 上海医药, 2024, 45(19): 85-89.
Development and application of chip qPCR technology for mycoplasma detection
YAO Jie, HUANG Yi
(Shanghai Tanshi Biotechnology Co., Ltd., Shanghai 201206, China)
ABSTRACT Objective: In order to solve the problems of complex operation, long time and low sensitivity of the current detection methods for mycoplasma, a rapid chip-based mycoplasma detection method was established and a simple methodological validation was performed according to the principles of biological product mycoplasma inspection and method validation guidance in the Chinese Pharmacopoeia (ChP), United States Pharmacopeia (USP), and European Pharmacopoeia (EP). Methods: The mycoplasma residue in cells or biological products was accurately and stably detected by Taqman probe method based on the rapid qPCR instrument combined with the chip, which was fast and efficient and could greatly reduce the detection cost. Results Conclusion: The qPCR-based mycoplasma detection method established in this study has high specificity, stability, and certain repeatability and can provide methodological support for the accurate diagnosis and detection of mycoplasma infection and epidemiological investigation.
KEY WORDS mycoplasma residue; probe method; qPCR
支原体(mycoplasma)是一类最小的、没有细胞壁、高度多形性的原核细胞型微生物,通常大小在0.1~0.3 mm之间。由于其能形成丝状与分枝形状,故称为支原体[1]。支原体广泛存在于人和动物体内,其中部分支原体具有高致病性,它们寄生于宿主细胞中,通过攫取宿主细胞营养物质及其代谢产生毒素等方式威胁宿主(如人类和动植物)健康[2]。《欧洲药典》第2.6.7章公布了生产用细胞库以及临床治疗用细胞库检测用的支原体菌种或菌株,包括莱氏支原体(A. laidlawii)、鸡毒支原体(M. gallisepticum)、发酵支原体(M. fermentans)、猪鼻支原体(M .hyorhinis)、口腔支原体(M. orale)、肺炎支原体(M. pneumoniae)、滑液囊支原体(M. synoviae)。尽管自然界常见的支原体有120多种[3],但污染细胞的支原体主要是以上这7种,占所有支原体感染的90%以上[4]。支原体感染影响宿主细胞的活性和功能,可导致培养的细胞缓慢死亡,不仅会造成依赖细胞的活性分析检测结果不可靠,还会导致生产的生物制品存在安全隐患[5]。因此,对细胞和疫苗等生物制品进行支原体检测十分必要。
目前国内外常用的支原体残留检测方法有培养法、DNA的荧光染色法、扫描电镜法、PCR法、实时荧光定量PCR法(qPCR法)[6],检测时间从1 d到4周不等,且检测结果存在较大偏差[7]。近年来,PCR技术已经应用于多项残留支原体的检测[8],它的高特异性和灵敏度可以满足研究甚至工业生产的质量要求[9]。本研究主要介绍我们在qPCR Taqman探针法的基础上[10],开发及优化出一套快速荧光定量的芯片式检测方法,总结支原体核酸的制备和PCR产物验证等方法,为检测细胞培养中支原体污染提供一种简单、快速、可靠的技术。
1 材料和方法
1.1 仪器和试剂
GD-106快速荧光定量PCR仪(qPCR,北京吉检生物科技有限公司);芯片(北京吉检生物科技有限公司);1384高速冷冻离心机、Heracell 150i CO2培养箱、1384生物安全柜(Thermo公司)。
CHO-K1细胞、HEK293细胞(美国典型培养物保藏中心);DMEM培养基、支原体DNA提取纯化试剂盒(湖州申科生物技术有限公司);基因扩增液(北京吉检医疗科技有限公司);引物探针及PC(支原体特征序列,即阳性对照)/IC(内参系列,即阴性对照)由上海探实生物科技有限公司自主设计,第三方合成。
1.2 方法
1.2.1 支原体DNA的纯化
1)样品处理 将15 mL的细胞转移至50 mL无菌低吸附离心管,在4 ℃下1 000×g离心5 min,沉淀上清液中的细胞。把离心去除细胞后的上清转移至20 mL的超滤浓缩管进行离心浓缩(4 ℃,12 000×g,10 min);用2 mL基础培养基重悬,将超滤浓缩管内液体转移至离心管中,在4 ℃下16 000×g离心30 min后弃上清留支原体沉淀,用一定体积的试剂盒稀释液得到体积为约1.5 mL的支原体样品浓缩液。
2)样品制备 上述样品加入裂解液及蛋白酶k进行消化后应用磁珠法对样品进行富集和纯化,最后在70 ℃下进行洗脱回收,获样品待用。
1.2.2 qPCR反应体系的设计
1)配置qPCR反应体系 反应体系包括反应样品、引物探针混合液、基因扩增液以及IC。其中,引物探针包括PC和IC引物探针。
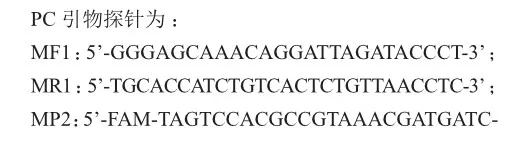
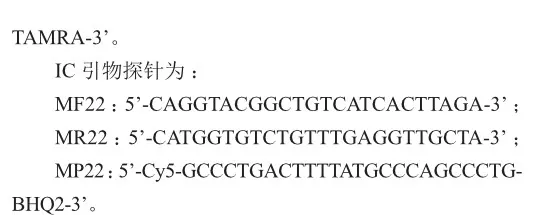
优化前后qPCR反应体系(15 mL)见表1,NTC(no template control)加入水作为样本进行检测,标记为空白对照。
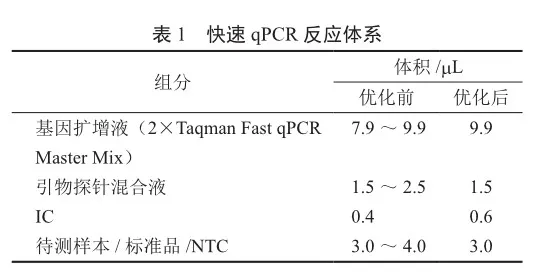
2)装配芯片 将配置完成的qPCR反应体系添加至芯片式反应容器内。
3)扩增条件 50 ℃变性60 s,95 ℃变性30 s,95℃ 15 s,60 ℃ 25 s,45个循环,总时间约为42 min;反应结束后,得到两组CT(cycle threshold,即循环数阈值)值。
4)结果判断 两组PC和IC的CT值进行比较,判断支原体的阴、阳性。根据qPCR仪自动给出的CT值进行定性判断,在IC的CT值大于35的前提下,PC的CT大于35则为阳性,否则为阴性。
检测时设置空白对照组和阳性对照组。其中,空白对照组中基因样品用无核酶的水替代;阳性对照组中基因样品用PC替代。
1.2.3 PCR反应产物的验证
根据设计的PC引物探针和IC引物探针,可得到如下PC和IC扩增序列,其中PC来自于支原体保守区域,IC来自于pUC57质粒序列。PC序列(268 bp,GGTTAACAGAGTGACAGATGGTGCA)和IC序列(214 bp,ACCATGGTACACCTGACTCCTGAGG)后如表2配制PCR体系进行扩增,经琼脂糖电泳验证。
1.2.4 普通PCR反应条件
按照表1和2配制PCR反应体系后,设置PCR仪反应条件为98 ℃变性3 min,98 ℃变性30 s,60 ℃退火15 s,72 ℃延伸30 s,45个循环;反应结束后PCR产物(目的序列)经1%琼脂糖凝胶电泳分析可分别得到两条基因条带。通过判断目的基因条带的大小,验证PC及IC是否与引物设计的片段大小一致。
2 结果
2.1 双通道判断阴、阳性
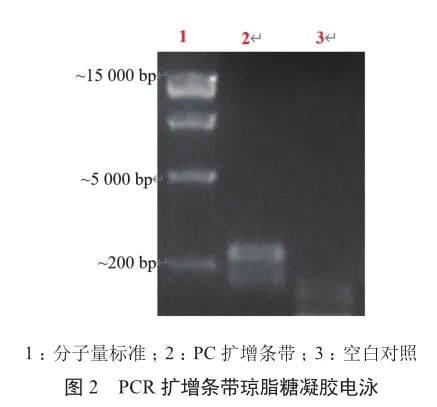
PC的FAM通道的CT值约为23.13,CY5通道的CT值约为23.95,空白对照的FAM通道未出峰,CY5通道的CT值约为23.90(图1)。阳性对照PC产生一条约300 bp的特异性扩增产物,空白对照产生一条约200 bp的特异性扩增产物,即内部对照IC的扩增,符合理论分析结果(图2),表明快速芯片式支原体qPCR检测方法能快速检测支原体。
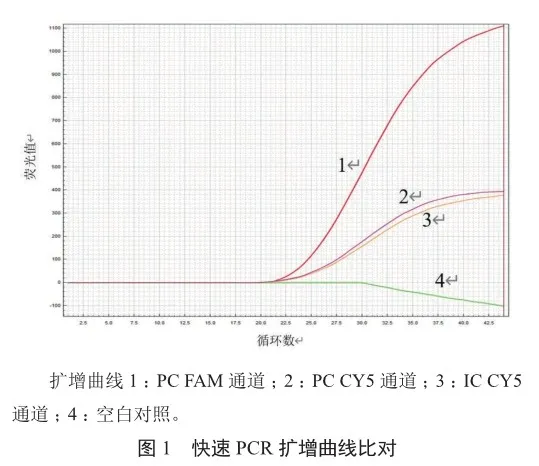
2.2 专属性分析
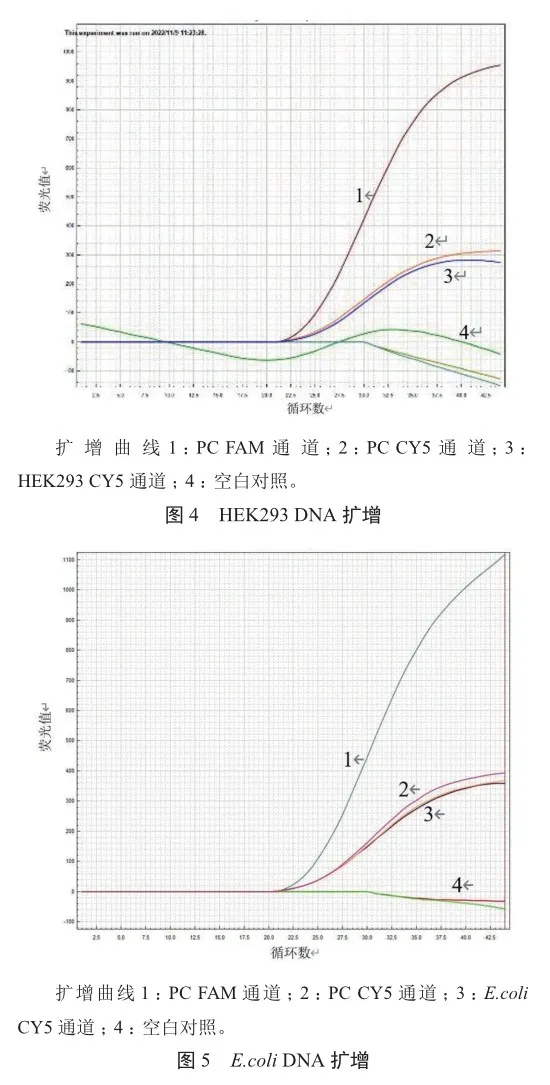
分别选用CHO、HEK293、E.coli 3种宿主细胞DNA,采用芯片式支原体检测系统进行qPCR检测。结果显示,CHO、HEK293、E.coli 3种宿主细胞DNA与支原体检测试剂均无交叉反应;支原体PC样本、CHO、HEK293、E.coli 3种宿主细胞DNA样本和空白样本的CY5通道均出峰,说明扩增反应无抑制;支原体PC FAM通道的CT值分别为23.98、23.26和23.20,而CHO、HEK293、E.coli 3种宿主细胞DNA均未出峰(图3~5),表明快速芯片式支原体qPCR检测方法对支原体具有专属性。
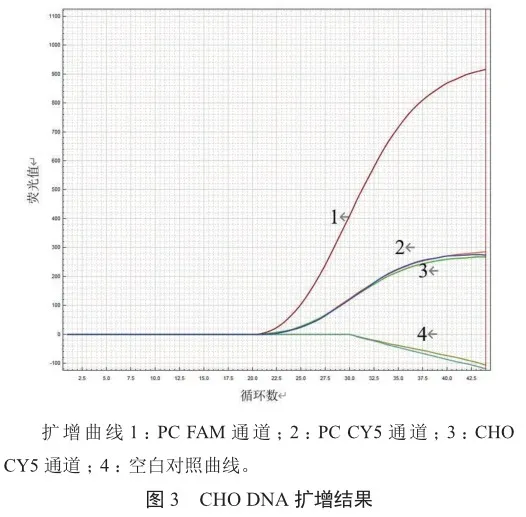
2.3 稳定性分析
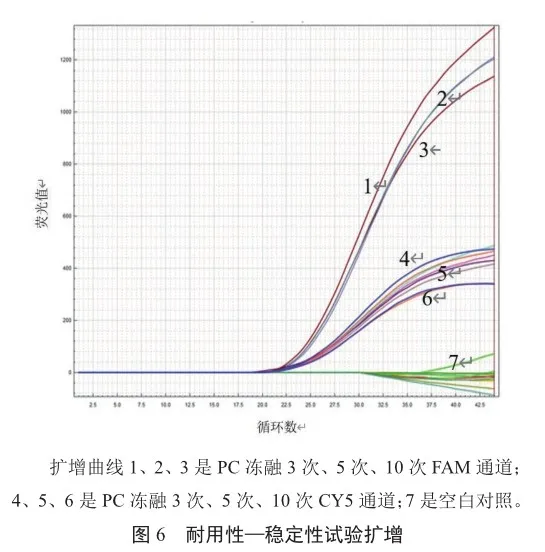
支原体检测试剂反复冻融3次、5次、10次后各体系双通道的CT值无较大差异,证明检测试剂稳定性较好,不受反复冻融影响;冻融3次、5次、10次的FAM通道CT值的RSD为1.13%,CY5通道CT值的RSD为1.18%,CT值无明显差异(图6),表明快速芯片式支原体qPCR检测方法具有良好的稳定性。
2.4 灵敏度分析
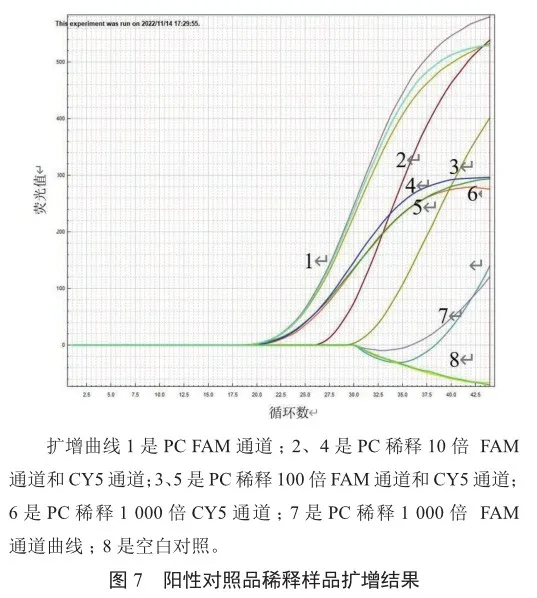
采用2 000 copies/mL的支原体阳性对照,将支原体阳性对照品稀释10倍、100倍、1 000倍后进行检测,结果显示,10倍稀释的PC FAM通道的CT值为27.47,100倍稀释的PC FAM通道的CT值为30.74,1 000倍稀释的PC未检出,同时10倍、100倍、1 000倍稀释的PC CY5通道的CT值分别为23.21,23.16,23.41,说明本发明的灵敏度可达20 copies/mL(图7)。表明快速芯片式支原体qPCR检测方法对支原体具有较高的灵敏度。
3 讨论
综上,芯片式的qPCR检测方式,相比于孔板式的传统方法,具有体系小,反应灵敏的特点,结合快速qPCR仪和反应扩增液可以将检测时间缩短至40 min,从而极大地缩短检测时间,是一种快速、准确且低成本的检测技术。总而言之,该方法具有以下几点优势:①检测速度快,通量高。支原体qPCR检测通常需要经过45个循环的扩增,相当于一次反应需要2 h的仪器运行时间才能获得最终的结果,再以扩增结果的CT值进行支原体阴阳性判断。我们建立的快速支原体检测系统也需要进行45个循环的扩增,但总共耗费的时间缩短为42 min。另外整个系统分为16个检测盒,总检测通量为48个,各个检测盒可独立运行程序,适用于随到随检,大大提高了检测的效率。②体系小,成本低。传统的qPCR体系设置为30 mL,在0.1 mL的多孔板中进行PCR扩增相对稳定,本方法的芯片式qPCR检测体系缩小至传统qPCR体系的1/2,从而使检测试剂用量至少减少1倍,操作更加简单快捷。③灵敏度更高。目前的支原体检测试剂盒的最低灵敏度是10 CFU/mL,本方法的支原体检测试剂的灵敏度可达1 CFU/mL,检测限度更低。④与传统PCR检测方法具有一致性,可应用于医学病原体检测、环境病原体监测、海关检验检疫、科学研究及实验教学等,另外在植被保护、动物医学、食品安全、司法鉴定等领域有潜在的应用价值。
参考文献
[1] Anonymity. Mycoplasmas[J]. Br Med J, 1965, 2(5477): 1499- 1500.
[2] 陈耐寒, 撒亚莲. 细胞制剂支原体检测方法概述[J]. 检验医学, 2022, 37(7): 684-687.
[3] 魏红梅. PCR技术在支原体检测中的应用[J]. 微生物学免疫学进展, 1993(1): 13-20.
[4] 张贵刚,刘艳霞. 细胞培养中支原体PCR检测进展[C]//中国畜牧兽医学会2008年学术年会暨第六届全国畜牧兽医青年科技工作者学术研讨会论文集. 2008: 313-316.
[5] Dobrovolny PL, Bess D. Optimized PCR-based detection of mycoplasma[J]. J Vis Exp, 2011(52): 3057.
[6] Young L, Sung J, Stacey G, et al. Detection of mycoplasma in cell cultures[J]. Nat Protoc, 2010, 5(5): 929-934.
[7] 卢勇, 贾继宗, 唐静, 等. 3种支原体检测方法的比较[J].中国生物制品学杂志, 2015, 28(10): 1067-1071.
[8] 王建霞, 李红. PCR技术在支原体检测中的应用[J]. 中国比较医学杂志, 2005, 15(3): 186-189.
[9] Uphoff CC, Drexler HG. Detection of mycoplasma contaminations in cell cultures by PCR analysis[J]. Hum Cell, 1999, 12(4): 229-236.
[10] Uphoff CC, Drexler HG. Detection of mycoplasma contaminations[J]. Methods Mol Biol, 2013, 946: 1-13.

