金丝皇菊组培快繁体系建立







摘""" 要:金丝皇菊药用价值高,属于重要的茶菊生产品种。为建立苗株快速繁殖体系,以金丝皇菊为研究对象,采用组织培养的方法,研究NAA、6-BA 2种激素对金丝皇菊愈伤组织、茎尖诱导、丛生芽诱导、根系诱导等试验的影响。结果表明:培养基MS+30 g·L-1蔗糖+0.5 mg·L-1 NAA+1.0 mg·L-16-BA 最适合诱导叶片形成愈伤组织,30 d后愈伤诱导率达到100%;培养基MS+30 g·L-1蔗糖+0.1 mg·L-1NAA +1.5 mg·L-16-BA适用于茎尖诱导培养,培养的不定芽活性强,分化率高;不定芽增殖试验中,最佳增殖培养基为MS+30 g·L-1蔗糖+1.0 mg·L-16-BA+0.1 mg·L-1 NAA;不添加任何激素的MS培养基15 d生根率达到100%,且叶绿、茎段粗壮,植株长势好。综上,本研究为金丝皇菊的无毒苗繁育研究奠定基础,对乡村茶用菊花产业可持续发展有重要意义。
关键词:金丝皇菊;组织培养;植物激素;扩繁
中图分类号:S682.1+1"""""""""" 文献标识码:A"""""""" DOI 编码:10.3969/j.issn.1006-6500.2024.07.001
A Preliminary Study on the Tissue Culture Technology of Dendranthema morifolium
GAO Min1, HUO Wenwen1, CHEN Ting1, LI Pengpeng1, HE Libo2, XU Lu1
(1. College of Horticulture, Hunan Agricultural University, Changsha, Hunan 410128, China; 2. College of Landscape Architecture and Art Design, Hunan Agricultural University, Changsha, Hunan 410128, China)
Abstract: Dendranthema morifolium with high medicinal value, is the important tea chrysanthemum variety. In order to establishment of a rapid seedling propagation system, this study took Dendranthema morifolium as the experimental material. Tissue culture was used. By studying the effects of two hormone NAA and 6-BA, on the healing tissues, shoot tips, cluster buds, and roots. The results showed that the most suitable medium for inducing leaves to form healing tissue was MS+30 g·L-1 sucrose + 0.5 mg·L-1NAA+1.0 mg·L-16-BA , and the healing induction rate reached 100% after 30 days. The optimal shoot tip induction medium was MS+30 g·L-1 sucrose+0.1 mg·L-1NAA +1.5 mg·L-16-BA, which induced the formation of indeterminate buds with strong activity and high differentiation rate. The best proliferation medium was MS+30 g·L-1 sucrose+1.0 mg·L-16-BA +0.1 mg·L-1NAA. The rooting rate in MS medium without hormone reached 100% after 15 days, and showed great growth with greener leaves and stronger stems. In conclusion, this study lays the foundation for the study of non-toxic seedling breeding of Dendranthema morifolium, which is of great significance for the sustainable development of chrysanthemum industry for tea in the countryside.
Key words: Dendranthema morifolium Jinsihuangju; tissue culture; phytohormone; propagation
收稿日期:2024-06-03
基金项目:湖南省教育厅科学研究重点项目(22A0143);长沙市软科学研究计划项目(kh2302045)
作者简介:高敏(1998—),女,甘肃天水人,在读硕士生,主要从事新菌功能挖掘等研究。
通讯作者简介:许璐(1988—),女,湖南长沙人,副教授,博士,主要从事观赏植物栽培与应用、观赏植物与微生物互作研究。
金丝皇菊(Dendranthema morifolium Jinsihuangju)为多年生宿根花卉,属于药用菊花品种。近几年,金丝皇菊作为茶用菊花,受到消费者的喜爱,具有较大的市场经济价值[1],产量与市场需求随之增加。目前,江西、安徽、湖南、贵州等地均建有金丝皇菊种植基地。
金丝皇菊的繁殖仍采用传统扦插方法,该方法虽然操作简便,但繁殖效率远不及组织培养扩繁的效率[1]。国内外关于菊花组织培养技术的研究较多,菊花的茎段、茎尖、花蕾、花瓣均可通过组织培养技术诱导出芽或愈伤组织,达到快速扩繁的目的[2-7]。
组织培养技术可以完全隔绝外界不良因素的干扰,能够保证苗株质量和生产质量。根据当前国内外的研究,能够侵染菊花的病毒有20多种,且植物病毒极易通过多种害虫和植物汁液传播,而传统扦插方法较难完全隔绝害虫的干扰。多年的无性扦插繁殖和普通露天的栽培方式极易引发植物病毒病害,导致病毒在苗株内积累,苗株死亡或花朵质量下降,造成极大的损失[8]。并且,繁殖的苗株品质无法保证,需要进行脱毒处理,获得无毒苗,从而解决菊花感染病毒病害的问题。唯有通过茎尖培养技术,才能获得脱毒苗,而茎尖培养技术要建立在组织培养技术体系的基础上[9-14]。通过研究脱毒苗和扦插苗,结果表明,脱毒苗可以明显减轻病虫害的发生,增加产量,提高质量。因此,利用组织培养技术获得的脱毒苗发展前景广阔。
组织培养技术常应用于菊花,但是关于金丝皇菊的研究较少,仅有少量关于金丝皇菊营养成分、种植技术、组培扩繁等方面的研究[15-21],且不同品种的菊花之间存在差异。因此,需建立金丝皇菊组织培养体系,以便快速解决金丝皇菊传统繁殖方法的多种弊端,并为后续脱毒育苗工作提供基础。本研究采用金丝皇菊茎段作为外植体,得到无菌苗后,以无菌苗为试验材料,从不同培养基组合中筛选出诱导愈伤组织、茎尖诱导、丛生芽诱导、根系诱导的多种最佳培养基组合。
1 材料与方法
1.1 试验仪器与试剂
试验仪器:电子分析天平、全自动高压灭菌锅、超净工作台、植物恒温培养箱。试剂:6-苄氨基嘌呤(6-BA)、萘乙酸(NAA)、0.1%升汞、MS培养基等。1.2 植物材料
本试验使用湖南农业大学花卉基地的金丝皇菊植株,取其顶部幼嫩茎段作为外植体。
1.3 试验方法
1.3.1 培养条件与基本培养基 培养条件:培养温度为25~28 ℃,光照强度为3 000~4 500 lx(16 h·d-1);茎尖诱导试验中,培养温度为光照28 ℃,黑暗14 ℃,光照强度为8 000~12 000 lx(14 h·d-1)。基本培养基:MS粉4.43 g·L-1、琼脂粉7 g·L-1、蔗糖30 g·L-1、6.2≤pH≤6.6。
1.3.2 初代培养处理 春季选取健康的金丝皇菊嫩枝,流水冲洗2 h,75%酒精灭菌30 s,无菌水冲洗1遍,以0.1% HgCl2溶液浸泡8 min,无菌水冲洗5遍,用无菌滤纸擦净,切成带1~2个芽点的茎段,接种到JD培养基中(表1)。每瓶接种3个,每30 d继代1次。
1.3.3 丛生芽的增殖 从初代培养的无菌苗上,切取40个2 cm顶芽,接种到KF1、KF2、KF3、KF4培养基中(表1),每个处理重复10次。
1.3.4 愈伤培养 在超净工作台内,从初代培养的无菌苗上,切取90个1 cm2含主叶脉的成熟叶片;在主叶脉处,划出1~2个伤口,叶背与培养基贴合,接种到YS1、YS2、YS3培养基中(表1)。每瓶接种3个叶片,每组设置10瓶。
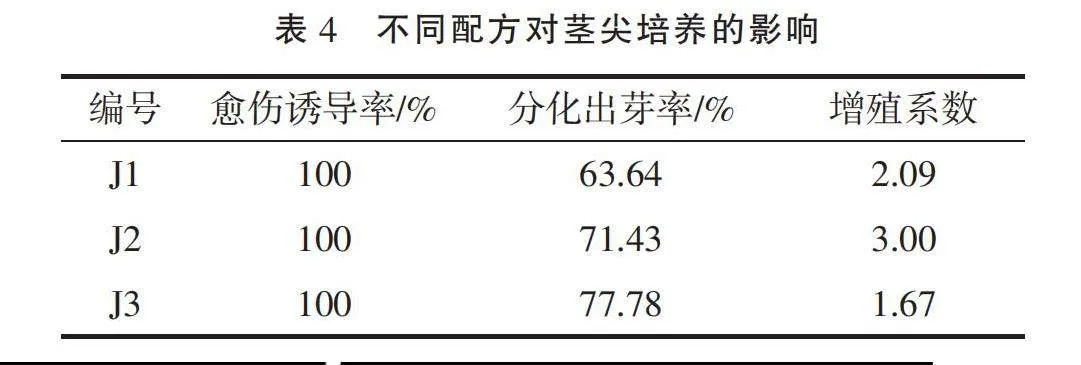
1.3.5 茎尖诱导培养 从初代培养的无菌苗上,切下0.5 cm顶芽,在体式显微镜下,挑取0.8~1.2 mm茎尖,接种到J1、J2、J3组培养基中(表1),每组设置10个重复。
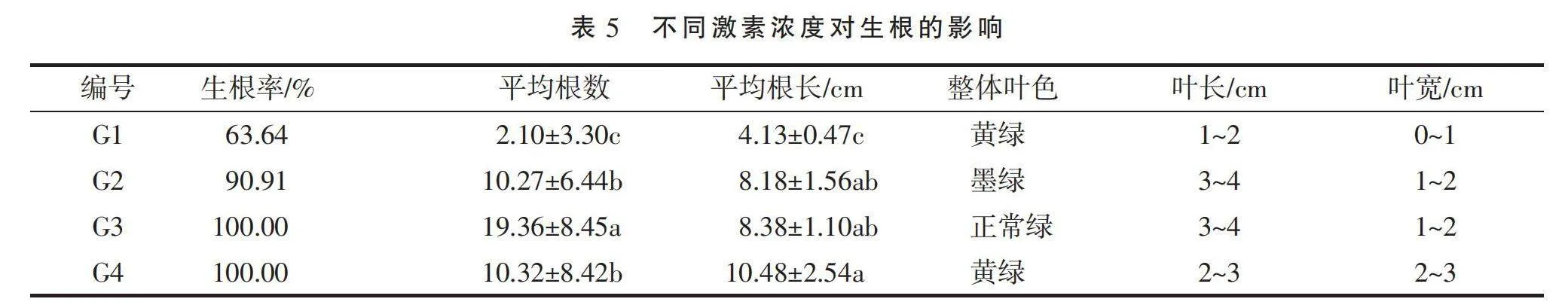
1.3.6 根系诱导 在超净工作台内,切取长度为2~3 cm、长势和大小相一致的顶芽,接种到G1、G2、G3、G4培养基中(表1),每组设置10瓶。
1.4 数据统计方法
试验所得数据用SPSS 23.0、Excel 2016软件进行统计分析。
2 结果与分析
2.1 外植体处理与初代培养结果
初代培养中,经0.1% HgCl2溶液消除处理8 min后,外植体极少出现感菌与褐化现象,且苗株生长正常,这与李云玲等[22]研究结果一致。
2.2 顶芽诱导丛生芽增殖结果
经过30 d的培养和观察,KF1、KF2、KF3、KF4培养基的丛芽增殖效果见表2。由表2可知,4种激素组合均能诱导金丝皇菊丛生芽增殖,但诱导效果存在显著差异。KF2组诱导成功率达到100%,增殖系数最高,但存在不定芽过小、叶片颜色偏黄(图1-B)等问题;KF1组增殖系数略低于KF2组,不定芽叶色正常,生长状态良好,未发生黄化(图1-A);KF3、KF4组黄化严重,部分植株诱导失败,褐化死亡(图1-C、图1-D)。因此,适量浓度的6-BA更适合丛芽增殖,即KF1更适合诱导金丝皇菊丛芽的增殖。
2.2 愈伤组织诱导结果
叶片接种21 d后,3个激素组合的愈伤诱导率均达到100%,但各组在愈伤组织的体积、颜色、活性上存在显著差异(表3)。YS1和YS2组褐化率极高,愈伤组织活性低(图2-A、图2-B),严重影响不定芽分化效果;YS3褐化率较低,大部分愈伤组织体积大,颜色呈黄绿色(图2-C),活性高,少量愈伤组织已经分化出不定芽。因此,YS3组对金丝皇菊愈伤组织的诱导效果较好,NAA激素对愈伤组织的诱导具有较好的效果。
2.3 茎尖诱导出芽结果
经过10 d的培养,接入3种不同培养基的茎尖均形成愈伤组织,并呈分化的趋势。30 d后,分化率趋于稳定,统计数据见表4。J3组(图3-C)茎尖分化率最高,不定芽健壮,褐化现象较少,但增殖数量比J2组(图3-B)少;J1(图3-A)组的分化率和增殖系数均低于J2、J3组,且不定芽较弱,叶片分化不明显;3组茎尖所分化的不定芽均出现玻璃化情况。将分离后的丛芽转到不含激素的MS培养基中,并且加强培养光照和温差,不定芽的形态逐渐发育正常且形成较发达的根系。综合茎尖的分化出芽率、增殖系数和诱导效果,J2激素组合适用于茎尖诱导培养。
2.4 生根诱导结果
经过15 d的培养,4个处理组的金丝皇菊不定芽均分化出根系(图4)。G3、G4组对根系的诱导效果较明显,所有不定芽均分化出发达的根系,G3激素组合(图4-C)平均根长适当、平均根数最多(表5),植株生长迅速;G1、G2组存在诱导失败的现象。因此,G3组诱导效果最好,即6-BA与NAA 2种激素对根系诱导均存在一定的抑制作用。
3 讨论与结论
3.1 讨论
3.1.1 外植体处理与初代培养 外植体的采集时间、处理方法、消毒试剂的选择等均关系着初代培养的效率。本研究中,金丝皇菊初代培养方法能够在保证低污染率和褐化率的前提下,得到较优质的组培苗,但需注意外植体采集时间应在4―5月。此时,金丝皇菊生长迅速,幼嫩部分内生菌含量少,更容易获得无菌组培苗[23-24]。在其他季节,金丝皇菊外植体均含有大量种类复杂的内生菌,这会导致消毒困难、造成大量污染、浪费材料,并且采用杀菌药剂浸泡、适量加入抗生素、增加流水冲洗与消毒时间等措施均较难解决高污染率等问题。
3.1.2 植物激素对不定芽与愈伤组织诱导的影响" 梁小敏等[25]研究表明,适宜增殖培养的6-BA浓度为0.3 mg·L-1,这与本研究结果存在差异。原因可能是试验处理采用的6-BA浓度范围不同。本研究中,相较于增殖系数,1.0 mg·L-16-BA诱导丛芽增殖的增殖系数远高于0.3 mg·L-16-BA,因此1.0 mg·L-16-BA诱导丛芽增殖的效果更好。丛生芽增殖和诱导出芽所需的NAA浓度是一致的,加入适量浓度的NAA均能提高诱导率,但浓度过高会引起植株叶片黄化。而在愈伤诱导试验中,0.5 mg·L-1NAA能显著促进叶片成熟组织脱分化,形成愈伤组织,且部分愈伤组织能够直接分化,形成不定芽,但这一浓度高于菊花花蕾愈伤诱导的最适浓度。因此,向茎尖诱导培养基中加入少量的NAA,可以促进茎尖分生组织形成愈伤组织,避免NAA对不定芽生长的抑制。
3.1.3 植物激素对组培苗生根诱导的影响 在部分菊花组培苗的根系诱导试验中,均有少量的植物激素促进根系的形成。但是,金丝皇菊组培苗的根系诱导的试验结果发现,6-BA对金丝皇菊组培苗根系的形成具有强烈的抑制作用;NAA能够促进根系的形成与根的伸长,但对根系数量的增长和植株的生长具有抑制作用;而采用不添加激素的MS培养基诱导生根,在根系数量、根系长度和植株生长情况方面均表现出良好效果,并且组培苗存在大量适宜长度的根系有利于提高其炼苗和移栽的成活率。崔乐源等[26]在茶用菊花金丝皇菊的组培快繁技术研究中提到,最佳生根培养基为1/2MS+0.5 mg·L-1 6- BA+0.1 mg·L-1 NAA+0.4%活性炭,这与本研究结果不同。原因可能是活性炭本身就有吸附有毒物质、增加培养基中养分、利于根生长的特性。而本研究以空白MS培养基诱导金丝皇菊组培苗的根系,这种方法既简单方便、节省成本,也能获得根系发达的优质组培苗。植物激素对金丝皇菊组培苗生根诱导的研究还有很大的进步空间,有待进一步挖掘。
3.1.4 茎尖丛芽的诱导与玻璃化 茎尖脱毒技术可以去除菊花所携带的病毒,获得脱毒组培苗,茎尖诱导是茎尖脱毒技术的重要环节。在本研究的茎尖诱导再分化过程中,诱导率与分化率较高,丛生芽生长迅速,但存在苗株玻璃化、叶片形态发育不正常等问题,通过及时分苗转瓶与调整培养环境后,苗株发育逐渐正常。组培苗玻璃化常与培养温度、光照、激素有关系[27]。后续的研究发现,茎尖丛生芽诱导成功后,将分离的玻璃化丛生芽接入不含激素的培养基中进行培养,加强光照与昼夜温差能够快速解除玻璃化,诱导发达的根系,从而缩短获得脱毒组培苗的时间和提高繁殖效率。这为后续研究金丝皇菊茎尖脱毒技术打下了基础,也为后续解决组织玻璃化问题提供了思路。
3.2 结论
本研究探究了不同激素组合对金丝皇菊组培苗的诱导效率。经过不定芽的诱导、愈伤组织的诱导、茎尖诱导培养、根系诱导多项试验,建立了一套金丝皇菊组织培养繁殖体系,共筛选出4种培养基配方:培养基MS+30 g·L-1蔗糖+0.5mg·L-1NAA+1.0 mg·L-1
6-BA 最适合诱导叶片形成愈伤组织,30 d后愈伤诱导率达到100%;培养基MS+30 g·L-1蔗糖+0.1 mg·L-1NAA+1.5 mg·L-16-BA适用于茎尖诱导培养,培养的不定芽活性强,分化率高;不定芽增殖试验中,最佳增殖培养基为MS+30 g·L-1蔗糖+1.0 mg·L-16-BA+0.1 mg·L-1 NAA;不添加任何激素的MS培养基15 d生根率达到100%。基于以上快繁体系,可更节约、高效地获得金丝皇菊组培苗,为今后优质高效快繁和无毒苗繁育研究奠定基础。但金丝皇菊的大量内生菌无法去除,且组织玻璃化问题较为严重,这些问题对金丝皇菊的组培技术造成了一定的影响,金丝皇菊的高效快繁工作仍需深入研究,这将有助于实现金丝皇菊的无毒苗繁育和产业的可持续发展。
参考文献:
[1] 赵维萍, 王艳琪, 刘洋, 等. 药用菊花组织培养技术研究进展[J]. 安徽农学通报, 2019, 25(12): 36-38, 44.
[2] 龚明霞, 陈小凤, 方锋学, 等. 菊花离体快繁技术研究[J]. 北方园艺, 2010(1): 172-173.
[3] 田梅. 菊花花蕾的组织培养技术[J]. 宁夏农林科技, 2011, 52(7): 28.
[4] EARLE E D, LANGHANS R W. Propagation of Chrysanthemum in vitro. I. Multiple plantlets from shoot tips and the establishment of tissue cultures[J]. Journal of the American Society for Horticultural Science, 1974, 99(2): 128-131.
[5] 徐式近, 徐忠传. 不同菊花品种高效直接再生体系的构建[J]. 江苏农业科学, 2013, 41(11): 52-54, 100.
[6] 刘玉堂, 赵宪争, 杨迎霞, 等. 不同激素浓度对食用菊花组织培养的影响[J]. 农学学报, 2014, 4(5): 67-69.
[7] BHATTACHARYA P, DEY S, DAS N, et al. Rapid mass propagation of Chrysanthemum morifolium by callus derived from stem and leaf explants[J]. Plant Cell Reports, 1990, 9(8): 439-442.
[8] 史晓斌, 谢文, 张友军. 植物病毒病媒介昆虫的传毒特性和机制研究进展[J]. 昆虫学报, 2012, 55(7): 841-848.
[9] DEVI R, HANDA A, KAPOOR S. Occurrence and distribution of chrysanthemum virus B (CVB) in chrysanthemum (Dendranthema grandiflora Tzvelen)[J]. International Journal of Farm Sciences, 2018, 8(2): 166-168.
[10] 张静雅, 何衍彪. 植物病毒病检测及防治技术研究进展[J]. 安徽农学通报, 2019, 25(12): 79-81, 83.
[11] ZHOU Y, WANG Y Y, SONG Y R, et al. Stem apex detoxification culture markedly improved several physiological characters of chrysanthemum ‘YUTAI’[J]. Plant Cell, Tissue and Organ Culture (PCTOC), 2014, 119(2): 369-381.
[12] 金凤媚, 宋建, 薛俊, 等. 北京地区侵染菊花的番茄斑萎病毒分子检测与基因组部分序列分析[J]. 华北农学报, 2020, 35(1): 175-184.
[13] KIM C K, JEON S M, SAVITRI W D, et al. Elimination of chrysanthemum stunt viroid (CSVd) from an viroidinfected chrysanthemum through shoot tip culture[J]. Flower Research Journal, 2012, 20(4): 218-222.
[14] 陈婕, 秦士娇, 王晔青, 等. 4种方法脱除杭白菊菊花B病毒效果研究[J]. 中国植保导刊, 2021, 41(1): 66-69.
[15] 赵艳莉, 戴妙飞, 曹琴, 等. 金丝皇菊脱毒苗田间性状研究[J]. 特产研究, 2023, 45(4): 69-73, 81.
[16] 韩宇. 中国菊文化与菊花产业[J]. 现代园艺, 2015(11): 25-26.
[17] ROP O, MLCEK J, JURIKOVA T, et al. Edible flowers--a new promising source of mineral elements in human nutrition[J]. Molecules, 2012, 17(6): 6672-6683.
[18] 李曦, 郭灵安, 雷欣宇, 等. 金丝皇菊的营养成分分析与评价[J]. 现代食品科技, 2019, 35(11): 237-241, 260.
[19] 刘向东, 尹陈茜, 陈雪峰, 等. 废弃物基质对高温气候下 “金丝皇菊” 生长的影响[J]. 江西农业大学学报, 2020, 42(4): 707-717.
[20] BANU N A, HOSSAIN M, ISLAM R, et al. Chrysanthemum morifolium Ramat.: an in vitro plantlets regeneration protocol[J]. Plant Environment Development, 2014, 3(2): 36-39.
[21] 张玲玲, 公菲菲, 原喆, 等. 不同基质对杭白菊和金丝皇菊扦插生根的影响[J]. 山西农业科学, 2021, 49(1): 54-58, 92.
[22] 李云玲, 孙虎, 苗锦山, 等. 黄山贡菊茎尖脱毒快繁技术研究[J]. 北方园艺, 2014(1): 106-108.
[23] 杨国泰, 李亮, 张冬敏, 等. 克服植物组织培养中内生菌污染的研究[J]. 中国园艺文摘, 2011, 27(12): 180-182.
[24] 李建书. 浅谈植物组织培养如何减少污染[J]. 教学仪器与实验, 2014, 30(3): 41-42.
[25] 梁小敏, 夏慧敏, 龚福保, 等. 金丝皇菊离体培养技术[J]. 浙江农业科学, 2022, 63(12): 2872-2874.
[26] 崔乐源, 盛夏薇, 郭佳琳, 等. 茶用菊花 “金丝皇菊” 的组培快繁技术研究[J]. 天津农业科学, 2023, 29(1): 7-11, 26.
[27] 赵春莉, 李金英. 植物组织培养中污染原因及其控制方法[J]. 吉林农业科学, 2010, 35(6): 11-13.

