油茶根际高效解磷菌的筛选及其解磷特性
摘 要:【目的】从油茶根际土壤中筛选得到一株高效解磷细菌,研究其解磷特性及对油茶生长的影响。【方法】利用无机磷选择培养基进行解磷菌的筛选,观察其性状并确定其分类地位;测定其生长曲线,确定菌株生长最佳时间;利用功能性选择培养基测定菌株的固氮、解钾、解蛋白酶、解纤维素酶、解淀粉酶、产铁载体能力,并测定其分泌IAA的含量,将其与油茶炭疽病病原菌进行拮抗试验,研究其是否具有抗病能力;确定菌株耐盐性、最适生长的氮、碳源以及磷酸钙添加量;将解磷菌发酵液通过灌根和叶面喷施2种方式处理盆栽油茶,测定解磷菌对油茶叶片PAL、PPO、POD酶活性、土壤脲酶、土壤酸性磷酸酶活性以及土壤有效磷含量的影响。【结果】筛选得到高效解磷菌株CSUFT-GXP-084,其D/d值为3.67,溶磷量为60.35 mg/L,分子鉴定确定其为北澳伯克霍尔德氏菌Burkholderia territorii,该菌株具有固氮、解蛋白酶、产铁载体能力,分泌IAA的含量为4.42 mg/L,对油茶炭疽病的5种病原菌的生长均具有抑制作用;菌株CSUFT-GXP-084盐耐受范围在0~5%,最适菌株CSUFT-GXP-084发挥解磷能力的氮、碳源分别为硫酸铵和蔗糖,最适磷酸钙添加量为2 g/L。CSUFT-GXP-084菌液叶面喷施对油茶叶片的PAL、PPO、POD活性影响较大,灌根对土壤中的脲酶以及酸性磷酸酶活性影响较大。菌液灌根和叶片喷施处理后土壤中的有效磷含量分别较CK提升了1.58倍、1.70倍。【结论】菌株CSUFT-GXP-084具有高效解磷能力,能够提高油茶叶片酶活性、土壤酶活性以及土壤有效磷含量,可应用于微生物菌肥以及菌剂的制备。
关键词:解磷菌;解磷特性;油茶;北澳伯克霍尔德氏菌;有效磷含量
中图分类号:S794.4 文献标志码:A 文章编号:1673-923X(2024)10-0094-11
基金项目:“十四五”国家重点研发计划项目(2023YFD1401302);广西自筹经费林业科技项目(桂林科研[2022ZC]第28号);湖南省油茶产业科研示范项目(湘财资环指[2023]66号);省级林业科技攻关与创新项目(XLKY202321)。
Screening of high-efficiency phosphorus-solubilizing bacteria in the rhizosphere of Camellia oleifera and their phosphorus solubilizing characteristics
XUE Yi1, LUO Dun2, ZHOU Guoying1, LIU Jun’ang1, DENG Xiaojun1,3
(1. a. Hunan Provincial Key Laboratory for Control of Forest Diseases and Pests; b. Key Laboratory of National Forestry and Grassland Administration on Control of Artificial Forest Diseases and Pests in South China; c. Key Laboratory of Cultivation and Protection for NonWood Forest Trees, Ministry of Education, Central South University of Forestry Technology, Changsha 410004, Hunan, China; 2. Guangxi State-owned Bobai Forest Farm, Yulin 537600, Guangxi China; 3. Guangxi Forestry Research Institute, Nanning 530002, Guangxi, China)
Abstract:【Objective】A strain of highly efficient phosphorus-solubilizing bacteria was isolated from the rhizosphere soil of Camellia oleifera, and its phosphorus-solubilization characteristics and effects on the growth of C. oleifera were investigated.【Method】Inorganic phosphorus selection medium was used for the screening of the phosphorus-solubilizing bacteria. The morphological characteristics were observed, and the taxonomic status was determined. The growth curve was determined to identify the optimal growth time of the strain. Functional selection medium was used to determine the strain’s ability of nitrogen fixation, potassium solubilization, protease solubilization, cellulase solubilization, amylase solubilization, and iron-producing carriers, as well as to determine the content of its secretion of indole-3-acetic acid (IAA). Antagonistic experiments against the pathogen of Camellia anthracnose were conducted to evaluate its disease resistance. The optimal salt concentration, suitable nitrogen and carbon sources and optimal calcium phosphate addition were determined. The fermented broth of the phosphate-solubilizing bacteria was applied to potted C. oleifera through root irrigation and foliar spraying, and the activities of phenylalanine ammonialyase (PAL), polyphenol oxidase (PPO), peroxidase (POD) in leaves, as well as urease and acid phosphatase activities in the soil and soil content of effective phosphorus, were measured.【Result】The efficient phosphate-solubilizing strain CSUFT-GXP-084 was isolated, with a D/d value of 3.67. The dissolved phosphorus content was 60.35 mg/L. Molecular identification confirmed it as Burkholderia territorii. The strain exhibited nitrogen fixation, protease, and iron carrier production ability, with an IAA secretion content of 4.42 mg/L. It inhibited the growth of five kinds of pathogens causing anthracnose in C. oleifera. Additionally, the salt tolerance range of strain CSUFT-GXP-084 was 0 %~5 %. The most suitable nitrogen and carbon sources for the phosphorus solubilization ability of the strain CSUFT-GXP-084 were ammonium sulfate, and the optimal amount of calcium phosphate was 2 g/L. Foliar spraying of the CSUFT-GXP-084 bacterial solution had greater effects on the PAL, PPO, and POD activities of the oil tea leaves, while root irrigation had greater effects on urease and acid phosphatase activities in the soil. The effective phosphorus content in the soil increased by 1.58 times and 1.70 times compared with CK after the root irrigation and leaf spraying treatments, respectively.【Conclusion】The strain CSUFT-GXP-084 demonstrates a high phosphorus solubilization ability, enhancing enzyme activity of C. oleifera leaves, soil enzyme activity, and effective phosphorus content in the soil; thus, it holds potential applications in microbial fertilizers and biocontrol agents.
Keywords: phosphorus-solubilizing bacteria; phosphorus solubilization characteristics; Camellia oleifera; Burkholderia territorii; available phosphorus content
油茶Camellia oleifera作为我国种植面积最大、产油量最高的木本油料作物,拥有较高的生态和经济价值。现如今农业上为使作物能够有效吸收磷,在生产过程中大量施用磷肥,但植物对磷肥的转化吸收效率只有5.0%~25.0%[1],施肥过后大量的无机磷酸盐肥料在土壤中迅速固定化,转化为无效磷累积在土壤中[2],其余大部分磷元素还会迅速转化为土壤中不溶的物质,使植物无法利用[3]。因此,如何提高油茶土壤磷素有效性,减少磷肥施用是亟待解决的问题。
磷在自然界中以多种有机磷和无机磷的形式存在,但主要以不溶或极难溶的无机磷形式存在[4],在植物的生长发育、抗逆性和产量品质等方面发挥着重要的作用[5]。土壤中存在大量微生物,其中解磷微生物(Phosphate solubilizing microorganisms, PSM)的解磷能力被认为是与植物磷营养相关的最重要的性状之一。解磷菌可以将难溶性磷分解为能够被植物吸收利用的有效磷。根据研究得知,解磷菌主要有芽孢杆菌属Bacillus、根瘤菌属Rhizobium、假单胞菌属Pseudomonas、伯克霍尔德氏菌属Burkholderia等 [6-7]。这一大类微生物可以通过释放磷酸酶、有机酸以及降低土壤pH值的方式,将土壤难溶性磷溶解为有效磷来促进植物对磷元素的吸收,它在土壤磷循环中发挥着关键作用[8]。
目前大多是从农作物土壤分离解磷微生物。本研究从广西国有博白林场内采集油茶根际土壤进行解磷细菌的分离筛选,并从中筛选出一株具有高效解磷能力的细菌,对其解磷特性进行分析,利用其发酵液施用到油茶盆栽上后,分析其对油茶叶片酶活性和盆栽土壤酶活性以及土壤有效磷含量的影响,以期为油茶微生物功能菌肥及菌剂的研制提供优良的种质资源和科学理论依据。
1 材料与方法
1.1 土壤样品采集
土壤样品于2023年3月采自广西壮族自治区玉林市博白县国有博白林场油茶种植区5~8年生油茶根际。
1.2 培养基
PKO无机磷培养基:葡萄糖 10.0 g、(NH4)2 SO4 0.5 g、NaCl 0.3 g、MgSO4·7 H2 O 0.3 g、FeSO4·7 H2 O 0.03 g、MnSO4·4 H2 O 0.03 g、KCl 0.3 g、Ca3(PO4)2 2 g、酵母提取粉0.5 g、琼脂 18.0 g、去离子水定容至1 L。去琼脂为PKO无机磷液体培养基。
LB培养基:胰蛋白胨10.0 g、酵母提取物5.0 g、NaCl 10.0 g、琼脂18.0 g,加去离子水定容至1 L。去琼脂为LB液体培养基。
1.3 菌株的分离初筛及解磷能力测定
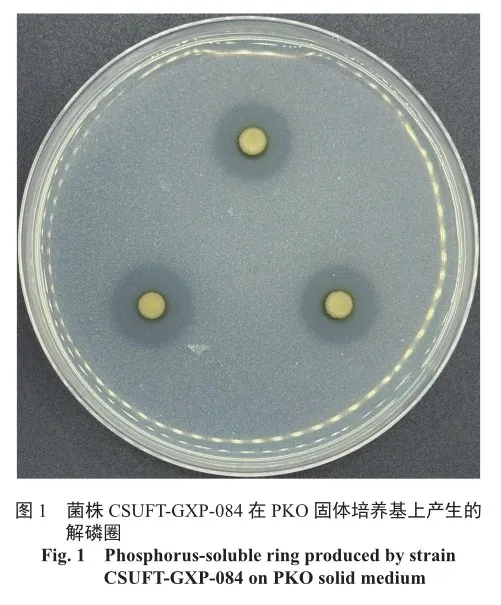
取油茶根际土壤5 g,加入45 mL的无菌水后放入振荡箱中振荡30 min后进行系列梯度稀释,分别吸取10-4、10-5、10-6 3个梯度的土壤悬液100 μL涂布至PKO无机磷固体培养基上,置于30 ℃恒温培养箱内倒置培养5 d后,挑选出具有解磷圈的菌落,纯化后编号于4 ℃保藏备用。
将获得的解磷菌活化后,接种至PKO固体培养基培养,通过测定菌株的D/d(溶磷圈直径/菌落直径)值来初步确定菌株的解磷能力。选取D/d值较大的菌株接种于PKO无机磷液体培养基中进行培养后,采用钼锑抗比色法[9]测定上清液中的有效磷含量。
1.4 菌株的微生物学鉴定
1.4.1 形态学特征观察
采用稀释涂布法将解磷菌涂布在LB固体培养基上培养至长出单菌落,观察菌株单菌落的生长情况及菌落特征,并对菌株进行革兰氏染色。
1.4.2 基于16s rDNA基因系列测定的系统发育树构建
利用细菌16s rDNA的通用引物对菌株基因进行PCR扩增后将产物送往上海生工生物工程有限公司测序,将所得序列在NCBI数据库中与已知菌株序列进行BLAST同源性分析对比,后通过MEGA11软件构建菌株系统发育树,确定其分类学地位。
1.5 菌株生长曲线测定
将菌株种子液按1%接种量接种至LB液体培养基中,以不接种菌液的LB液体培养基为对照,一起置于30 ℃,180 r/min恒温摇床振荡培养,每2 h测定发酵液OD600值并绘制生长曲线。
1.6 菌株促生能力测定
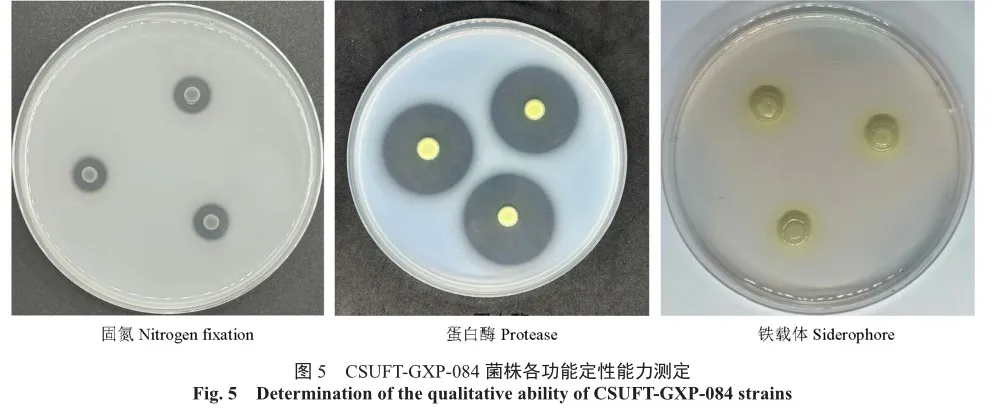
采用阿须贝氏无氮固体培养基、钾细菌筛选固体培养基、蛋白酶活性测定固体培养基、淀粉水解固体培养基、纤维素固体培养基、MSA-CAS固体培养基测定菌株相应能力。IAA含量测定采用Salkowski比色法进行定量测定[10]。
1.7 菌株对油茶炭疽病的抑菌谱测定
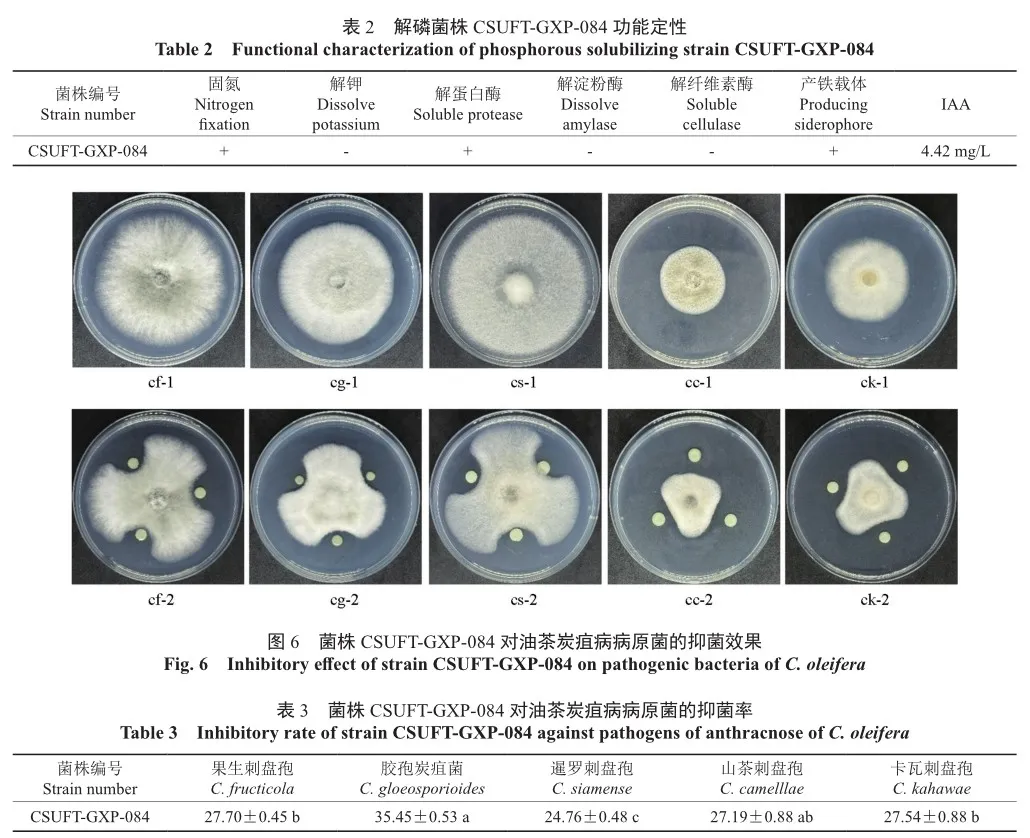
将解磷菌株与油茶炭疽病的主要致病病原菌果生刺盘孢Colletotrichum fructicola、胶孢炭疽菌Colletotrichum gloeosporioides、暹罗刺盘孢Colletotrichum siamense、山茶刺盘孢Colletotrichum camelllae、卡瓦刺盘孢Colletotrichum kahawae进行平板抑菌试验后计算抑菌率:抑菌率=(D- d)/ D×100%。
1.8 菌株的耐盐性测定
配置盐浓度分别为0、1%、3%、5%、7%的 LB液体培养基,菌液接种量为1%,以不接种菌液的LB液体培养基为对照,30 ℃,180 r/min振荡培养24 h后测定OD600值。
1.9 不同氮源、碳源不同磷酸钙添加量对菌株解磷能力的影响
以PKO无机磷液体培养基(氮源为硫酸铵)为基础,后分别以葡萄糖、淀粉、蔗糖为碳源;以PKO无机磷液体培养基(碳源为葡萄糖)为基础分别以硫酸铵、氯化铵、硝酸铵为氮源,接种量1%,以不接种为对照,30 ℃,180 r/min培养5 d,分别测定溶液中有效磷含量[11]及pH值。
以PKO无机磷液体培养基为基础,分别添加2、4、6、8、10、12 g/L Ca3(PO4)2为磷源,按1%的接种量,以不接种为对照,于30 ℃、180 r/min振荡培养5 d,测定菌液中的有效磷含量及pH值。
1.10 施用方式对叶片酶活性、土壤酶活性和磷含量的影响
分别用菌株发酵液(含菌量为108 CFU/ mL)对盆栽油茶进行叶面喷施(PY)与灌根(GG)两种处理,不施加菌液(CK)为对照,采用格锐思植物酶活试剂盒测定叶片过氧化物酶(POD)、多酚氧化酶(PPO)、苯丙氨酸解氨酶(PAL)活性。
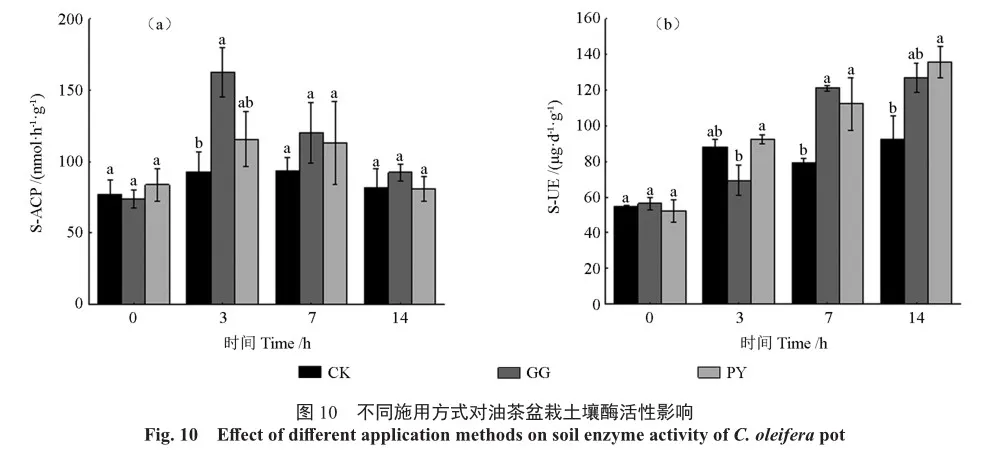
研究表明,在不施磷水平下施用解磷菌剂,土壤的酶活性高于施磷水平[12],本研究使用格锐思土壤酶活试剂盒测定解磷菌处理过后的土壤酸性磷酸酶(S-ACP)、土壤脲酶(S-UE)活性,使用碳酸氢钠提取-钼锑抗比色法[13]测定土壤有效磷含量。
1.11 数据分析
数据采用Excel 2016和SPSS 26.0软件统计分析,用MEGA11和Origin软件作图。
2 结果与分析
2.1 根际解磷菌的筛选及解磷能力测定
根据菌株D/d的值初步筛选10株代表菌株,其D/d值在1.13~3.67之间,其培养液中有效磷含量在13.10~60.35 mg/L之间(表1)。其中菌株CSUFT-GXP-084的D/d值及可溶性磷含量分别为3.67、60.35 mg/L,综合解磷菌株的定性及定量指标后选择菌株CSUFT-GXP-084作进一步研究。

2.2 菌株的微生物学鉴定
2.2.1 形态学鉴定
菌株CSUFT-GXP-084,在LB固体培养基上培养48 h后菌落呈黄色圆润饱满不透明状,表面湿润有光泽,边缘光滑整齐,凸起状,菌落黏稠易挑起,背面平整光滑无褶皱,菌落伴有糯米香味,为革兰氏阴性菌(图2)。

2.2.2 基于16S rDNA基因系列测定的系统发育树构建
经PCR扩增后得到菌株CSUFT-GXP-084的16 S rDNA序列全长为1 438 bp,将该序列在NCBI数据库进行同源性比对,利用MEGA11软件Neighbor-Joining法构建系统发育树(图3),结果显示,该菌株序列与北澳伯克霍尔德氏菌Burkholderia territorii同源性最高,其相似度达99%,故可确定菌株CSUFT-GXP-084为北澳伯克霍尔德氏菌。
2.3 菌株生长曲线测定
菌株CSUFT-GXP-084在0~4 h内为生长延缓期,此时菌株繁殖生长速度慢,OD600值上升幅度较小;4~14 h内菌株处于对数生长期,培养基里菌株繁殖生长速度快;14 h后菌株处于生长稳定期(图4)。
2.4 菌株促生能力测定
根据试验结果可知,CSUFT-GXP-084不仅具有较强解磷能力,还具有固氮、解蛋白酶、产铁载体(图5)以及分泌IAA的能力,菌株分泌IAA含量为4.42 mg/L(表2)。
2.5 菌株对油茶炭疽病的抑菌谱测定
根据实验结果可知(图6),CSUFT-GXP-084对油茶炭疽病病原菌C. fructicola、C. gloeosporioides、C. siamense、C. camelllae、C. kahawae的生长均有抑制作用,抑菌率在24.76%~35.45%(表3)。
2.6 菌株的耐盐性测定


菌株的OD600值随着NaCl含量的增加而减小。菌株CSUFT-GXP-084的耐盐性范围在0~3%,在此范围内生长良好,在NaCl浓度为5%时, OD600值增长不明显,菌株的生长受到了极大的抑制,当NaCl浓度为7 %时,OD600值不增长,菌株的生长完全受到了抑制(图7)。
2.7 不同氮源、碳源及不同磷酸钙添加量对菌株解磷能力的影响
不同的氮碳源对解磷菌解磷能力的影响有显著差异,以硫酸铵、氯化铵、硝酸铵为氮源下菌株CSUFT-GXP-084培养液中的有效磷含量分别为57.50、43.19和19.79 mg/L,培养液pH分别为6.56、6.46和9.47,结果表明菌株CSUFT-GXP-084的最适解磷氮源为硫酸铵(图8a)。
当碳源为葡萄糖和蔗糖时,培养液中的有效磷含量分别为54.99 mg/L、59.72 mg/L,其培养液的pH分别为7.05、6.43,说明葡萄糖和蔗糖有利于菌株解磷;以淀粉为碳源的菌株培养液中的有效磷含量为35.82 mg/L,pH值为10.27,菌株的解磷能力明显降低。研究结果显示最适CSUFTGXP-084解磷的碳源为蔗糖(图8b)。

当添加2 g/L的磷酸钙时,菌株的解磷能力最强(图9),发酵液中的有效磷含量为62.29 mg/L,此时培养液中的pH值为6.91,而当磷酸钙的添加量为4 g/L时抑制的菌株的解磷能力,发酵液中的有效磷含量下降到35.15 mg/L,随着磷酸钙含量的增加,菌株培养液中的有效磷含量降低,而发酵液的pH值则升高,说明高磷酸钙含量,会抑制菌株的产酸能力,从而使菌株的解磷能力降低。
2.8 不同施用方式对叶片酶活性、土壤酶活性和磷含量的影响
将解磷菌株发酵液通过灌根和叶面喷施2种方式处理盆栽油茶后均对油茶叶片酶活性产生了影响(表4)。在灌根处理中,接种后的第14天,叶片PAL活性急剧升高;叶片的POD活性在第5天时达最大值;叶片的PPO活性在第7天达到最大值。



在叶片喷施处理后第1天叶片的PAL活性已经显著升高,处理后的14天内仍然持续升高;叶片的POD活性在第5天时达最大值,后开始降低;叶片的PPO活性在第7天时达最大值,后开始急剧下降。灌根与叶面喷施2种方式均能提高油茶叶片的酶活性,但叶面喷施的效果显著高于灌根处理的效果。
施加解磷菌发酵液对油茶盆栽土壤酸性磷酸酶活性(图10a)和土壤脲酶活性(图10b)都产生了显著的影响,通过灌根和叶面喷施CSUFTGXP-084发酵液对土壤的酸性磷酸酶活性均有提高,灌根处理后,盆栽土壤的酸性磷酸酶活性在第3天升至162.504 mol/h/g,较CK提升约1.75倍;叶面喷施后第3天,土壤酸性磷酸酶活性为115.860 mol/h/g,较CK提升约1.24倍,灌根处理下的土壤酸性磷酸酶活性变化较叶面喷施处理显著;灌根和叶面喷施处理均不同程度上提高了土壤脲酶的活性,在施加解磷菌菌液后第14天时,灌根处理和叶面喷施处理的土壤脲酶分别升至126.993、135.828 μg/d/g,分别较CK提升了约1.37倍和1.47倍,灌根处理下的土壤脲酶活性变化和叶面喷施处理下土壤脲酶变化不显著。
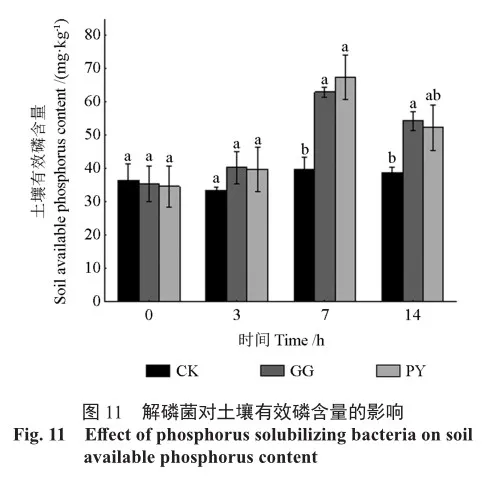
在施加解磷菌第3天时,土壤的有效磷含量较CK已经有明显升高,第7天时灌根和叶面喷施处理的土壤有效磷含量分别为63.016、67.449 mg/kg,较CK分别提升了1.58倍、1.70倍,此时灌根和叶面喷施处理后的土壤有效磷含量达最大值,在处理后的第14天,2种处理土壤有效磷含量开始下降(图11),说明解磷菌能够把土壤中的难溶性磷转化为可溶性磷。
3 讨 论
根际是“植物的第二基因组”,富集于根际的微生物群落复杂多样,与植物的生长和健康密切相关[14]。本研究从油茶根际土壤中分离筛选得到一株高效解磷菌CSUFT-GXP-084,经鉴定为北澳伯克霍尔德氏菌Burkholderia territorii,该解磷菌培养液中的有效磷含量为60.35 mg/L。据报道,土壤中的磷素主要以无机磷形态存在,其中Ca-P是主要成分之一,戴沈艳等[15]、陈岩岩等[16]筛选得到的解磷伯克霍尔德氏菌在以磷酸钙为磷源的培养液中可溶性磷含量分别为20.67、75.98 mg/L;杨豆等[17]筛选得到的拉塔伯克霍尔德菌在以磷酸钙为磷源的培养液中的有效磷含量为65.67 mg/L,以磷酸氢钙为磷源的培养液中的有效磷含量为480.00 mg/L,以植酸钙为磷源的培养液中的有效磷含量为82.00 mg/L。说明解磷菌的解磷能力不仅取决于解磷菌本身,还与磷的存在形式密切相关。
根际解磷细菌是一类能够促进植物生长的有益根际细菌,能通过固氮、溶磷、解钾、水解酶类、分泌植物激素和拮抗病原微生物来促进植物的生长发育[18-20],王晓念等[21]从金桂根际土壤中筛选得到的解磷菌对金桂插穗的成活以及移栽苗的生长有明显的促进作用。本试验结果表明解磷菌株CSUFT-GXP-084除具有解磷能力,还具有固氮、解蛋白酶、产铁载体以及分泌IAA的能力,除此之外,还能抑制油茶炭疽病病原菌的生长。菌株解磷能力的大小受胁迫因子的制约[22],高盐浓度会抑制菌株的生长从而导致菌株解磷能力的下降[23],王君等[24]分离筛选得到的解磷菌株可耐受6 %的NaCl浓度。Zhu等[25]分离出解磷菌能够耐受20%的高浓度NaCl。本研究中菌株CSUFTGXP-084的盐耐受浓度为0~5%,且在0~3%范围内生长良好,盐浓度为7%时菌株不生长。低含量的磷酸钙有利于菌株CSUFT-GXP-084解磷,高含量的磷酸钙会抑制菌株对难溶性磷的溶解,这与詹亚斌等[11]研究结果一致。菌株CSUFTGXP-084随着氮、碳源的不同而表现出不同的解磷能力,最利于菌株CSUFT-GXP-084解磷的氮、碳源分是硫酸铵和蔗糖。这与刘小玉等[26]的研究结果一致。不同的碳氮源能够引起菌株产酸能力的变化,进而影响菌株的解磷能力。
苯丙氨酸解氨酶(PAL)活性可作为植物抗逆境能力的一个生理指标;多酚氧化酶(PPO)能提高植物的抗病能力;过氧化物酶(POD)是植物体内清除活性氧的保护酶之一[27]。李晓晓等[28]在玉米苗期施用解磷菌后玉米苗期植株的防御酶活性升高。目前的研究中关于解磷菌剂在油茶上的施用是否会对油茶叶片防御酶活性产生影响的研究甚少。根据本试验结果可知施用CSUFT-GXP-084解磷菌剂引起了油茶叶片PAL、PPO以及POD三种防御酶活性的变化,说明施用的解磷菌剂能够激发油茶的防御酶活性,提高油茶抗病性。
研究土壤酸性磷酸酶活性能更好地了解其对植物产生的影响,土壤脲酶活性可表征土壤的氮素情况。本研究将解磷菌发酵液施用在盆栽油茶上之后,土壤中的脲酶以及酸性磷酸酶活性显著提高,这与刘广超等[29]的研究结果一致。利用解磷细菌溶解磷化合物的特性可以提高土壤有效磷含量[30],苏辉兰等[31]在对盆栽油麦菜施加解磷菌剂后使土壤有效磷提升了9.96 %。根据本研究结果可知,在未施磷水平下解磷菌可以将土壤中的难溶性磷溶解,从而使土壤中的有效磷含量升高。试验结果表明不同处理方式对盆栽油茶苗均起到了不同程度的作用,灌根处理对土壤酶活性影响较大,叶面喷施处理对叶片酶活影响较大。
本研究仅对解磷菌溶解磷酸钙的能力进行了研究,确定了解磷菌在固定培养条件下的最适碳氮源,在解磷菌的解磷特性方面的研究较局限,后续可进一步探究其对磷酸铝、磷酸铁等难溶性磷的溶解能力以及研究解磷菌解磷效果最适的培养温度以及pH条件;在进行油茶盆栽试验时用灌根或叶面喷施的单一处理方式研究解磷菌对油茶的影响,后续可将灌根和叶面喷施结合处理后研究其对油茶的影响,或将解磷菌研制为菌剂或菌肥,进一步研究菌株对油茶苗的形态生长如株高和地径等方面的影响。
4 结 论
本研究从油茶根际土壤分离筛选得到一株高效解磷细菌CSUFT-GXP-084,该菌在无机磷培养基上的D/d值为3.67,其培养液中的有效磷含量为60.35 mg/L,为革兰氏阴性菌,细胞呈短杆状,菌落呈黄色圆润饱满不透明,表面湿润有光泽,边缘光滑整齐,凸起状,菌落黏稠易挑起,背面平整光滑无褶皱菌落伴有糯米香味,后鉴定为北澳伯克霍尔德氏菌Burkholderia territorii。
CSUFT-GXP-084菌株除具有良好的解磷效果外,还具有固氮、解蛋白酶、产铁载体的能力,分泌IAA含量为4.42 mg/L,该菌株除具有促生能力之外,还能抑制油茶炭疽病的5种病原菌的生长。菌株CSUFT-GXP-084盐耐受范围在0~5 %,属于耐盐解磷菌,其最适菌株发挥解磷能力的氮、碳源分别为硫酸铵和蔗糖,最适磷酸钙添加量为2 g/L。
将解磷菌CSUFT-GXP-084的发酵液分别以灌根和叶面喷施的方式处理盆栽油茶后,油茶叶片的PAL、PPO、POD活性都有显著提升,土壤中的脲酶以及酸性磷酸酶活性较CK明显提高,灌根处理对土壤酶活性影响较大,叶面喷施处理对叶片酶活影响较大。灌根和叶面喷施处理后土壤有效磷含量分别较CK分别提升了1.58倍、1.70倍。
参考文献:
[1] 秦利均,杨永柱,杨星勇.土壤溶磷微生物溶磷、解磷机制研究进展[J].生命科学研究,2019,23(1):59-64,86. QIN L J, YANG Y Z, YANG X Y, et al. Advances in mechanisms of soil phosphorus solubilization and dissolution by phosphate solubilizing microorganisms[J]. Life Science Research, 2019,23(1):59-64,86.
[2] 戴佩彬.模拟条件下磷肥配施有机肥对土壤磷素转化迁移及水稻吸收利用的影响[D].杭州:浙江大学,2016. DAI P B. Effects of combined application of phosphorus fertilizer with organic manure on soil phosphorus transformation and phosphorus absorption and utilization by rice plants under simulated condition[D]. Hangzhou: Zhejiang University,2016.
[3] VASSILEV N, VASSILEVA M. Biotechnological solubilization of rock phosphate on media containing agro-industrial wastes[J]. Applied Microbiology and Biotechnology,2003,61(5-6):435-440.
[4] PAUL E A. Soil microbiology, ecology, and biochemistry in perspective[C]//Soil Microbiology, Ecology and Biochemistry[M]. Academic Press,2007:3-24.
[5] 纪国翡,李梦珂,卢念,等.磷胁迫下苹果砧木根系分泌物差异对磷吸收的影响[J].果树学报,2023,40(11):2359-2370. JI G F, LI M K, LU N, et al. Effects of root exudation of apple rootstocks on phosphorus acquisition efficiency under low phosphorus[J]. Journal of Fruit Science,2023,40(11):2359-2370.
[6] BILLAH M, KHAN M, BANO A, et al. Phosphorus and phosphate solubilizing bacteria: keys for sustainable agriculture[J]. Geomicrobiology Journal,2019,36(10):904-916.
[7] ALORI E T, GLICK B R, BABALOLA O O. Microbial phosphorus solubilization and its potential for use in sustainable agriculture[J]. Frontiers in Microbiology,2017,8:971.
[8] TIAN J, GE F, ZHANG D, et al. Roles of phosphate solubilizing microorganisms from managing soil phosphorus deficiency to mediating biogeochemical P cycle[J]. Biology,2021,10(2):158.
[9] 张英.西藏阿里高寒草原四种牧草根际促生菌资源筛选及促生机理研究[D].兰州:甘肃农业大学,2013. ZHANG Y. Screening plant growth promoting rhizobacteria resources and their promotion mechanisms from rhizosphere of four forages in Ali Alpine grassland of Xizang[D]. Lanzhou: Gansu Agricultural University,2013.
[10] 李培根,要雅倩,宋吉祥,等.马铃薯根际产IAA芽孢杆菌的分离鉴定及促生效果研究[J].生物技术通报,2020,36(9): 109-116. LI P G, YAO Y Q, SONG J X, et al. Isolation and identification of IAA-producing Bacillus sp on potato rhizosphere and its growthpromoting effect[J]. Biotechnology Bulletin,2020,36(9):109-116.
[11] 詹亚斌,张磊,丁晓艳,等.一株堆肥高效解磷菌的筛选、鉴定及其溶磷特性[J].科学技术与工程,2022,22(3):960-966. ZHAN Y B, ZHANG L, DING X Y, et al. Isolation, identification and its phosphate-solubilizing capacity of phosphate-solubilizing bacterial strain from compost[J]. Science Technology and Engineering,2022,22(3):960-966.
[12] 李正昀,王舒,张扬,等.施加解磷菌剂对油茶根际微生物和土壤酶活性的影响[J].西北林学院学报,2018,33(1):188-192. LI Z Y, WANG S, ZHANG Y, et al. Effects of different phosphatesolubilizing bacteria microorganism and enzyme activities of Camellia oleifera[J]. Journal of Northwest Forestry University, 2018,33(1):188-192.
[13] 任奕蒙.弱酸性土壤有效磷测定中两种检测方法的对比[J].山西化工,2023,43(4):79-80,93. REN Y M. Comparison of two detection methods in determination of available phosphorus in weak acidic soil[J]. Shanxi Chemical Industry,2023,43(4):79-80,93.
[14] 张艺灿,刘凤之,王海波.根际溶磷微生物促生机制研究进展[J].中国土壤与肥料,2020(2):1-9. ZHANG Y C, LIU F Z, WANG H B. Research progress on plant-growth-promoting mechanisms of phosphate-solubilizing rhizosphere microbes[J]. Soil and Fertilizer Sciences in China, 2020(2):1-9.
[15] 戴沈艳,申卫收,贺云举,等.一株高效解磷细菌的筛选及其在红壤性水稻土中的施用效果[J].应用与环境生物学报, 2011,17(5):678-683. DAI S Y, SHEN W S, HE Y J, et al. Screening of efficient phosphate-solubilizing bacterial strain and its application in red paddy soil to rice cultivation [J]. Chinese Journal of Applied and Environmental Biology,2011,17(5):678-683.
[16] 陈岩岩,叶项宇,常肖锐,等.板栗根际高效解磷菌的筛选[J].经济林研究,2021,39(2):132-139. CHEN Y Y, YE X Y, CHANG X R, et al. Screening of highly efficient phosphate-solubilizing bacteria of Castanea mollissima rhizosphere[J]. Non-wood Forest Research,2021,39(2):132-139.
[17] 杨豆,李广强,吕永财,等.毛竹根系解磷细菌的解磷条件和解磷特性[J].经济林研究,2021,39(2):115-122. YANG D, LI G Q, LYU Y C, et al. Phosphate-solubilizing characteristic and conditions of a phosphate solubilizing bacteria Burkholderia lata from Phyllostachys edulis root[J]. Non-wood Forest Research,2021,39(2):115-122.
[18] 李海云,蒋永梅,姚拓,等.蔬菜作物根际促生菌分离筛选、鉴定及促生特性测定[J].植物保护学报,2018,45(4):836-845. LI H Y, JIANG Y M, YAO T, et al. Isolation, screening, identification and growth promoting characteristics of plant growth promoting rhizobacteria of vegetable crops[J]. Journal of Plant Protection,2018,45(4):836-845.
[19] 马白鸽,魏喜红,孟祥佳,等.伯克霍尔德氏菌在植物病害生物防治中的研究进展[J].农业研究与应用,2023,36(3):1-8. MA B G, WEI X H, MENG X J, et al. Advancements in study on Burkholderia for plant disease biocontrol[J]. Agricultural Research and Application,2023,36(3):1-8.
[20] 张珂飞,钟永嘉,孙丽莉,等.植物有益伯克霍尔德氏菌的研究进展及其在农业中的应用[J].微生物学报,2021,61(8):2205-2218. ZHANG K F, ZHONG Y J, SUN L L, et al. Plant-associated beneficial Burkholderia[J]. Acta Microbiologica Sinica,2021, 61(8):2205-2218.
[21] 王晓念,甘丽萍,陈代平,等.金桂根际土壤解磷菌对金桂幼苗生长及其内源激素的影响[J].经济林研究,2022,40(2): 215-224. WANG X N, GAN L P, CHEN D P. et al. Effects of phosphate solubilizing bacteria in rhizosphere soil on seedlings growth and endogenous hormones of Osmanthus fragrans[J]. Non-wood Forest Research,2022,40(2):215-224.
[22] 冯瑞章,姚拓,周万海,等.不同生存环境和磷酸盐对4株溶磷菌溶磷能力的影响[J].应用与环境生物学报,2009,15(6): 856-860. FENG R Z, YAO T, ZHOU W H, et al. Effects of different habitats and insoluble phosphates solubilizing activity of four phosphate solubilizing bacteria[J]. Chinese Journal of Applied and Environmental Biology,2009,15(6):856-860.
[23] 赵龙飞,徐亚军,曹冬建,等.溶磷性大豆根瘤内生菌的筛选、抗性及系统发育和促生[J].生态学报,2015,35(13):4425-4435. ZHAO L F, XU Y J, CAO D J, et al. Screening, resistance, phylogeny and growth promoting of phosphorus solubilizing bacteria isolated from soybean root nodules[J]. Acta Ecologica Sinica,2015,35(13):4425-4435.
[24] 王君,范延辉,尚帅,等.一株根际解磷菌的筛选鉴定及溶磷促生作用[J].中国土壤与肥料,2022(6):195-203. WANG J, FAN Y H, SHANG S, et al. Isolation and identification of a rhizosphere phosphate-solubilizing strain and its plant growth promotion[J]. Soil and Fertilizer Sciences in China,2022(6): 195-203.
[25] ZHU F L, QU L Y, HONG X G, et al. Isolation and characterization of a phosphate-solubilizing halophilic bacterium Kushneria sp. YCWA18 from Daqiao Saltern on the coast of Yellow Sea of China[J]. Evidence-based Complementary and Alternative Medicine: eCAM,2011,2011615032.
[26] 刘小玉,付登强,贾效成,等.油茶根际土壤解磷菌的筛选、鉴定及培养条件[J].西南农业学报,2016,29(11):2637-2642. LIU X Y, FU D Q, JIA X C, et al. Isolation, identification and culture condition of phosphate-solubilizing bacteria derived from camellia rhizosphere soil[J]. Southwest China Journal of Agricultural Sciences,2016,29(11):2637-2642.
[27] RAY H, DOUCHES D S, HAMMERSCHMIDT R. Transformation of potato with cucumber peroxidase: expression and disease response[J]. Physiological and Molecular Plant Pathology,1998,53(2):93-103.
[28] 李晓晓,薛枫.解磷菌PW-512菌剂对玉米苗期防御酶活性的影响[J].天津农业科学,2014,20(5):23-26. LI X X, XUE F. Effect of the PW-512 bacterial reagent on the defensive enzyme in maize seedling stage[J]. Tianjin Agricultural Sciences,2014,20(5):23-26.
[29] 刘广超,叶青,车永梅,等.烟草根际高效解磷菌的筛选鉴定及促生作用研究[J].生物技术通报,2022,38(8):179-187. LIU G C, YE Q, CHE Y M, et al. Screening and identification of highefficiency phosphate solubilizing bacteria in tobacco rhizosphere and its growth-promoting effects[J]. Biotechnology Bulletin, 2022,38(8):179-187.
[30] 陈晓琳,刘洁莹,宋艳琦,等.高效解磷根瘤菌菌株的分离筛选及对花榈木苗木生长的影响[J].中南林业科技大学学报, 2022,42(4):76-82,92. CHEN X L, LIU J Y, SONG Y Q, et al. Isolation and screening of efficient phosphorus solubilizing Rhizobium strains and their effects on the growth of Ormosia henryi seedlings[J]. Journal of Central South University of Forestry Technology,2022,42(4): 76-82,92.
[31] 苏辉兰,余炳锋,廖彩凤,等.解磷菌对油麦菜的促生作用[J].湖南农业科学,2023(3):31-35. SU H L, YU B F, LIAO C F, et al. Effects of phosphatesolubilizing microorganisms on the growth of lettuce (Lactuca sativa var. longifoliaf)[J]. Hunan Agricultural Sciences,2023(3): 31-35.
[本文编校:吴 彬]

