巧用“守恒法” 助力高中化学解题

摘" 要:化学作为一门自然科学类学科,融合了生物学、物理学、地理学等内容,是一门非常重要的基础学科.在化学教学中,守恒法是最基本的化学解题方法,它包含许多内容,如质量守恒、元素守恒、电子守恒等,渗透高中化学学科的全部内容.近年来,高考化学试题中与化学守恒相关的题较多,考查方式也丰富多彩,因此,本文以真实的化学题为例,主要研究守恒法在高中化学中的应用.
关键词:高中化学;守恒法;解题
中图分类号:G632""" 文献标识码:A""" 文章编号:1008-0333(2024)22-0139-03
收稿日期:2024-05-05
作者简介:柴改凤(1978.9—),女,陕西省商洛人,本科,中学一级教师,从事高中化学教学研究.
在高中化学教学中,教师不仅要重视培养学生逻辑思考能力和思维能力,提高学生的化学学科素养,还应该要求学生掌握丰富的化学知识和解题方法.其中,守恒法是学生必须掌握的基础解题方法,教师要引导学生深入理解和应用,切实提高学生的化学解题效率.1" 守恒法
守恒法是高中化学解题中一种重要的解题方法,其原理是化学反应前后,某些物理量和化学量的始态和终态保持不变[1].运用化学守恒法,不必考虑过程,也不考虑途径,只需分析化学变化中某些物理量和化学量的初始状态、最终状态,进而达到简化解题过程,加快解题效率的作用.守恒法一般可以分为质量守恒、元素守恒、电子守恒、电荷守恒等内容.
2" 守恒法在高中化学解题中的应用
2.1" 质量守恒
化学反应是指旧分子破裂,变为原子,原子重新组合成新分子的过程.通常来说,判断一个反应是否为化学反应的方法是看反应是否生成新的分子.质量守恒就存在于化学反应中,它是指在化学反应前后,反应物与生成物的总质量保持不变[2].高中化学试题中,质量守恒原理是解决各类化学问题的重要依据.
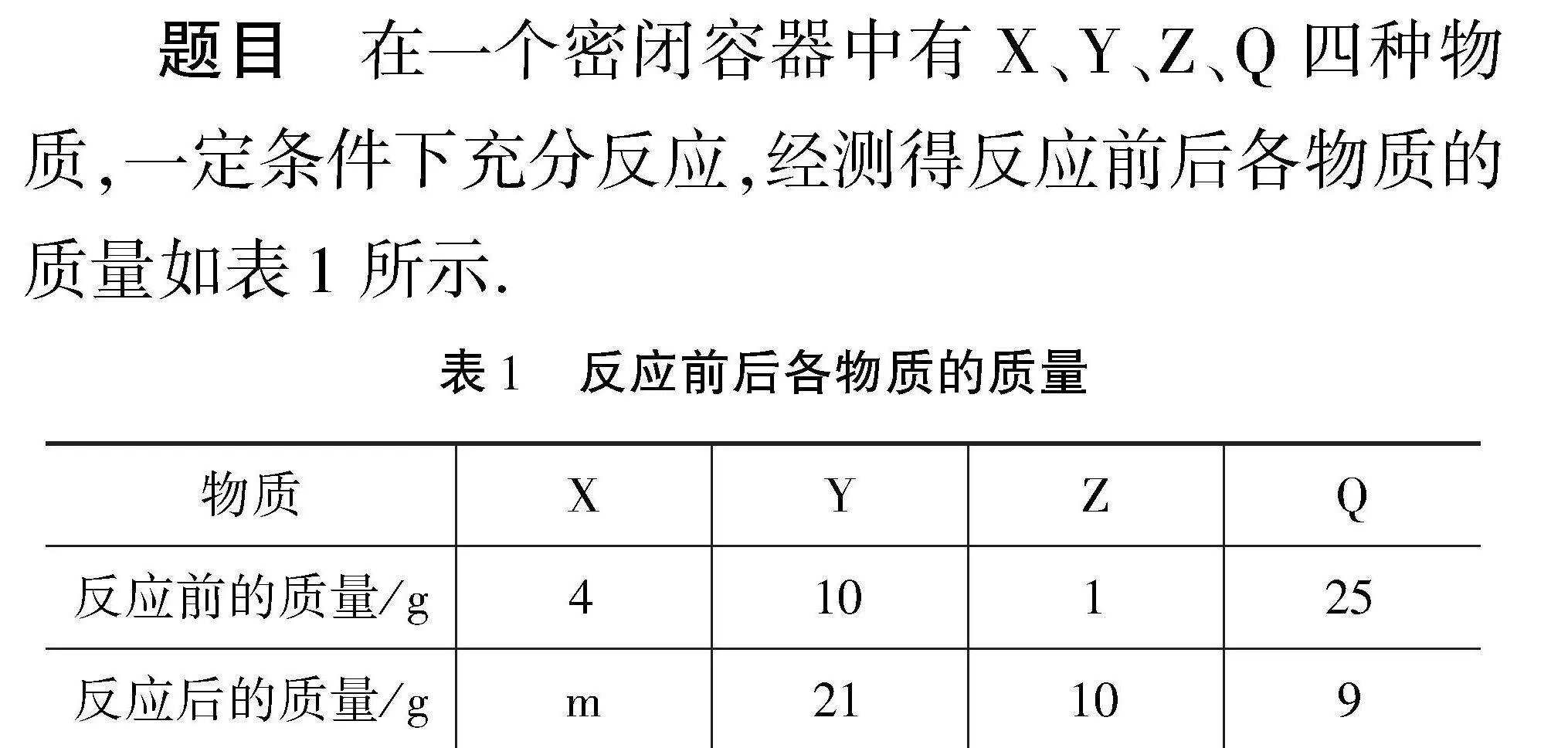
题目" 在一个密闭容器中有X、Y、Z、Q四种物质,一定条件下充分反应,经测得反应前后各物质的质量如表1所示.
表1" 反应前后各物质的质量
物质XYZQ反应前的质量/g410125反应后的质量/gm
21109
下列说法中不正确的是(" ).
A.该化学反应为分解反应
B.该化学反应中,参加反应的X、Q质量比为1∶4.
C.m为0
D.若Q为O2,该反应为氧化还原反应
思路分析" 根据质量守恒可知,化学反应前后物质的总质量保持不变,求出待测值m,然后根据四种物质反应前后的质量变化,判断出反应物和生成物,最后对选项中含有的特殊条件展开分析.
解析" 根据题意,由质量守恒定理可知,4 g+10 g+1 g+25 g=m g+21 g+10 g+9 g,求得m=0,选项C正确.已知化学反应前后,某物质质量减少,则为反应物;某物质质量增加,则为生成物;某物质质量保持不变,可能是催化剂.观察表格可以看出,X、Q化学反应前后质量减少,为反应物,Y、Z化学反应前后质量增加,为生成物,所以该化学方程的符号表达方式为:X+Q→Y+Z.分解反应是指由一种物质生成两种或两种以上的物质,所以该化学反应不是分解反应,选项A错误.接着分析剩余的两个选项.选项B,求参加反应的X、Q质量,即求X、Q反应前后的质量差值,参加反应的X质量:4 g-0 g=4 g,参加反应的Q质量:25 g-9 g=16 g,所以,参加反应的X、Q质量比为1∶4,选项B正确.选项D,若Q为O2,则化学反应方程式的表达方式为X+O2→Y+Z,任何物质与O2的反应一定是氧化反应,选项D正确.综上,答案为A.
2.2" 元素守恒
元素守恒又叫物料守恒,是溶液中重要的守恒关系之一,它是指化学反应前后各物质的元素种类未发生变化,各元素原子的个数也不变.依据元素守恒解化学题时,要先找到反应前后粒子的对应关系,再通过守恒关系计算出结果.
题目" 取一定量的氧化铁和氧化铜的混合物,加入9.8%的稀硫酸充分反应.反应结束后,消耗稀硫酸共100 g,求原混合物中氧元素的质量是g.
思路分析" 本题已知量较少,需要深度挖掘题目中蕴含的守恒关系.解此题时,学生先列出两个化学方程式,通过观察分析化学方程式,可以看出硫酸中的氧元素和氧化铁、氧化铜的氢元素结合生成了水,也就是说硫酸中氢元素的质量等于生成物水中氢元素的质量.生成物水中的氧元素的质量全部来源于氧化铁、氧化铜的氧元素质量.要想求原混合物中氧元素的质量,可通过求出生成物水中的氧元素的质量;想知道生成物水中氧元素的质量,可通过求出生成物水中氢元素的质量;想计算出生成物水中氢元素的质量,则可以转换成求硫酸中氢元素的质量.
解析" 根据题意,两个化学方程式为Fe2O3+3H2SO4Fe2(SO4)3+3H2O、CuO+H2SO4CuSO4+H2O,通过分析可以知道,氧化铁、氧化铜中氧元素的质量就是生成物水中氧元素的质量,硫酸中氢元素的质量等于生成物水中氢元素的质量.已知,化合物中各元素质量比=各元素的相对原子质量×原子个数之比,所以水中氢元素与氧元素的质量之比是1∶8,则m(H)=100 g×9.8%×298=0.2 g,氧元素的质量是氢元素质量的8倍,可求得氧元素的质量为1.6 g.
2.3" 电子守恒
遵循电子守恒的前提是掌握氧化还原反应,其特点是,在反应过程中,氧化剂得到电子总数等于还原剂失去电子总数.解题时,需要先找出哪个是氧化剂、还原剂,并根据其物质的量以及每mol的得失电子量,再通过列等式计算.
题目" 向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO和Cu(NO3)2.在所得溶液中加入1 mol/L的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完全沉淀,积淀质量为39.2 g.以下相关说法不正确的选项是(" ).
A.Cu与Cu2O的物质的量之比为2∶1
B.硝酸的物质的量浓度为2.6 mol/L
C.产生的NO在标准情况下的体积为4.48 L
D.Cu、Cu2O与硝酸反应后剩余的HNO3为0.2 mol
思路分析" 先写出化学反应方程式,然后分析氧化还原反应过程中的顺序,遵循强者优先原则然后利用电子守恒等守恒定理,根据选项依次分析解决问题.
解析" 由题意,可写出化学方程式2Cu+Cu2O+10HNO34Cu(NO3)2+2NO+5H2O,NaOH+HNO3NaNO3+H2O,Cu(NO3)2+2NaOHCu(OH)2↓+2NaNO3,最终溶液呈中性,所以此时溶液中的溶质为NaNO3,可知,n(NaNO3)=n(NaOH)=1.0 mol/L×1.0 L=1 mol;沉淀物为Cu(OH)2,可知,n[Cu(OH)2]为39.2 g98 g/mol=0.4 mol.已知,化学反应前后,铜元素守恒,所以n(Cu)+2n(Cu2O)=n[Cu(OH)2]=0.4 mol.A选项中,设Cu的物质的量为x mol,Cu2O的物质的量为y mol,根据刚刚的铜元素守恒,x+2y=0.4;根据质量,64x+144y=27.2,联立x+2y=0.464x+144y=27.2,解得x=0.2y=0.1,所以Cu与Cu2O的物质的量之比为2∶1,选项A正确.B选项中,已知,Cu、Cu2O与硝酸反应时,Cu、Cu2O为还原剂,失去电子,硝酸为氧化剂,得到电子,根据电子守恒可知,2n(Cu)+2n(Cu2O)=3n(NO),所以3n(NO)=2×0.2+2×0.1=0.6 mol,解得n(NO)=0.2 mol;氮元素守恒,可知n(HNO3)=n(NO)+n(NaNO3),所以n(HNO3)=0.2 mol+1 mol=1.2 mol.已知硝酸的物质的量以及原硝酸溶液的体积,可知原硝酸溶液的浓度为1.2 mol0.5 L=2.4 mol/L,B错误.C选项中,根据前面计算,n(NO)=0.2 mol,所以产生的NO在标准情况下的体积为0.2 mol×22.4 L/mol=4.48 L,C正确
.D选项中,加入NaOH溶液后,根据化学反应的强度,NaOH会先和剩余的硝酸反应,再和Cu(NO3)2反应,设Cu、Cu2O与硝酸反应后剩余的HNO3为a mol,a(HNO3)+2n[Cu(NO3)2]=
n(NaNO3),所以a(HNO3)=n(NaNO3)-2n[Cu(NO3)2]=1 mol-2×
0.4 mol=0.2 mol,D正确.综上,答案为B.
2.4" 电荷守恒
电荷守恒是指在化学反应前后,反应物的电荷总数与生成物的电荷总数相等.近年来,高中化学试题中电荷守恒的内容越来越频繁,是考试的热点,它多应用在离子反应、化学方程配平等,要求高中生必须掌握.
题目" 50 mL 1 mol/L的CH3COOH与100 mL的氢氧化钠溶液混合,混合后所得溶液的pH=7,对此,关于该溶液中离子浓度的大小关系说法不正确的是(" ).
A.c(Na+)=c(CH3COO-)
B.c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
C.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
D.100 mL氢氧化钠溶液浓度为0.5 mol/L
思路分析" 本题是高中化学试题中常见的一种考试题型,根据理解题意,可知考查的是溶液中离子浓度的问题,需要用到电荷守恒.解本题时,先将化学离子反应方程式写出来,再根据溶液酸碱度,判断酸碱离子浓度的大小关系,并以此推断出其他离子浓度的大小关系.
解析" 由题意知,H++OH-H2O,pH=7,所以c(H+)=c(OH-).结合电荷守恒,可知,c(Na+)=c(CH3COO-),A正确;pH=7,溶液呈中性,B正确;已知,溶液中遵循电荷守恒,离子所带正电荷和离子所带的负电荷相等,C正确
;已知,CH3COOH为弱酸,NaOH为强碱,因为pH=7,所以氢氧化钠溶液的浓度应该小于0.5 mol/L,D不正确.综上,答案为D.
3" 结束语
综上所述,守恒法是常见的化学解题方法之一,学生要深度学习和理解其概念、内涵,明确守恒法的重要性及意义,能够学以致用[3].在高中化学解题中,教师要重视守恒法本质以及应用的教学,引导学生思考和分析,鼓励其运用守恒法解决较为复杂的化学问题,不断提高化学解题效率,
为学生未来的化学学习打下坚实的基础.
参考文献:
[1]
李明玉.例析“守恒法”在高中化学解题中的应用[J].广东教育(高中版),2023(07):57-59.
[2] 蔡中岩.守恒法在高中化学教学中的应用研究[J].中学课程辅导,2023(19):3-5.
[3] 葛厚胜.新课标背景下守恒法在高中化学解题中的应用技巧[J].新课程导学,2023(08):95-98.
[责任编辑:季春阳]

