醒脑静对脑缺血再灌注损伤大鼠的脑保护作用研究

【摘要】目的 探讨醒脑静在大鼠脑缺血再灌注损伤模型中的脑保护效果及其作用机制,评估醒脑静对大鼠脑缺血再灌注后的神经功能、炎症反应及神经元损伤的影响。方法 选取健康成年Sprague Dawley(SD)大鼠60只,根据随机数字表法分为假手术组(20只)、模型组(20只)及醒脑静组(20只)。醒脑静组大鼠灌胃给药醒脑静3 mL/kg体质量,1次/d,连续给药5 d,给予假手术组和模型组大鼠灌胃等体积纯净水。末次给药后30 min用线栓法建立大鼠脑缺血再灌注损伤模型。3组大鼠均术后饲养至再灌注72 h。比较再灌注24 h和72 h 3组大鼠横木行走实验评分、神经功能评分及血清神经元特异性烯醇化酶(NSE)、白细胞介素-6(IL-6)、白细胞介素-10
(IL-10)水平,以及再灌注72 h 3组大鼠脑组织病理形态学。结果 与再灌注24 h比,再灌注72 h醒脑静组大鼠横木行走实验评分升高,神经功能评分降低,再灌注24、72 h,与手术组比,模型组和醒脑静组大鼠横木行走实验评分均降低,神经功能评分均升高,与模型组比,醒脑静组大鼠横木行走实验评分均升高,神经功能评分均降低(均Plt;0.05);与再灌注24 h比,再灌注72 h模型组与醒脑静组大鼠血清NSE、IL-6及IL-10水平均降低,再灌注24、72 h,与假手术组比,模型组和醒脑静组大鼠血清NSE、IL-6及IL-10水平均升高,与模型组比,醒脑静组大鼠血清NSE、IL-6及IL-10水平均降低(均Plt;0.05);与假手术组比,再灌注72 h模型组和醒脑静组大鼠脑组织病理形态学出现明显改变,脑组织结构不完整,神经元出现坏死现象,与模型组比,醒脑静组大鼠的脑组织病理形态学变化相对较轻,脑组织结构相对完整,神经元坏死相对较少。结论 醒脑静在大鼠脑缺血再灌损伤中具有显著的脑保护作用,能够保护大鼠脑组织结构的完整性,调节炎症反应,减轻神经元损伤,进而改善其神经功能和运动功能。
【关键词】醒脑静 ; 脑缺血再灌注损伤 ; 脑保护 ; 神经功能评分
【中图分类号】R749.05 【文献标识码】A 【文章编号】2096-3718.2024.15.0024.04
DOI:10.3969/j.issn.2096-3718.2024.15.008
脑缺血再灌注损伤是在脑血流中断后恢复血流供应过程中,脑组织因再灌注引起的损伤,其病理机制复杂,涉及多种生物学过程,包括氧化应激、炎症反应、细胞凋亡、钙超载、血脑屏障破坏等[1]。动物实验是研究脑缺血再灌注损伤机制和治疗方法的重要手段。大鼠因其脑结构和功能与人类相似,因此,常通过线栓法建立大鼠脑缺血再灌注损伤模型,模拟人类脑缺血再灌注损伤过程,研究其病理机制和潜在治疗方法。中医理论认为脑缺血再灌注损伤属于“中风”范畴,其病机主要为气血瘀滞、痰热内闭、神明失养[2]。醒脑静是一种中药复方制剂,主要成分包括麝香、郁金、栀子、冰片等,具有清热解毒、活血化瘀、镇静安神等功效[3]。现代药理学研究表明,醒脑静具有抗炎、抗氧化、抗凋亡等多种药理作用,能增强血脑屏障的通透性,减轻脑水肿,改善脑缺血再灌注损伤的病理状态,具有潜在的治疗价值[4]。基于此,本研究旨在探讨醒脑静在大鼠脑缺血再灌注损伤中的脑保护效果及其作用机制,通过行为学评估、血清指标检测及脑组织病理学观察,系统评价醒脑静的脑保护作用,并探讨其可能的作用机制,现报道如下。
1 材料与方法
1.1 实验动物 60只Sprague Dawley(SD)大鼠[上海斯莱克实验动物有限责任公司,生产许可证号:SCXK(沪)2022-0004],体质量250~300 g,平均(277.47±13.59) g;大鼠周龄11~12周,平均(11.50±0.50)周。饲养于右江民族医学院实验动物中心,室温22~25 ℃,相对湿度40%~70%,采用12 h昼夜循环照明系统,大鼠均自由进食、饮水。本研究经右江民族医学院附属医院动物医学伦理委员会批准(编号:2023102702)。
1.2 主要试剂与仪器 醒脑静注射液(河南天地药业股份有限公司,国药准字Z41020664,规格:10 mL/支),缓冲生理盐水(北京生物制品研究所有限责任公司,国药准字S10870001,规格:1.5 mL/支),水合氯醛/糖浆组合包装[特丰制药有限公司,国药准字H20210012,规格:水合氯醛浓缩液0.671 g∶0.5 g/糖浆4.5 mL],发光二极管荧光显微镜(徕卡显微系统德国有限公司,型号:DM2500)。
1.3 研究方法
1.3.1 动物分组和干预 取健康成年SD大鼠60只,按照随机数字表法分为假手术组(20只)、模型组(20只)
及醒脑静组(20只)。醒脑静组大鼠灌胃给药醒脑静3 mg/kg体质量,每天灌胃给药1次,连续给药5 d,给予假手术组和模型组大鼠等体积纯净水。末次给药后30 min造模。
1.3.2 大脑中动脉栓塞(MCAO)大鼠模型构建 造模前1 d禁食不禁水,假手术组大鼠实施假手术,未实现脑缺血后的再灌注,模型组和醒脑静组大鼠均实施手术,实现脑缺血后的再灌注。延大鼠颈部正中作一10~15 mm切口,分离两侧颌下腺,于两侧颌下腺之间剪开筋膜,显露实验大鼠的右侧胸锁乳突肌,由玻璃分针钝性分离胸锁乳突肌与舌骨肌间的肌间隙,暴露颈总动脉,依次分离出颈总动脉、颈内动脉、颈外动脉。颈外动脉近心端穿手术丝线,依次结扎颈总动脉近心端与颈外动脉近心端,用无创动脉夹夹住颈内动脉的近心端,在颈总动脉分为颈内、颈外动脉的近端用丝线结扎,以防穿尼龙丝处的切口渗血。在颈总动脉距离颈内动脉分叉处约5 mm处造口,由此口小心地插入尼龙丝(栓线向内上方的角度插入,以防进入翼鄂动脉),长度为18~20 mm,结扎颈总动脉以固定尼龙丝和防止出血,缝合皮肤。术后注意保暖,术后的大鼠行单笼饲养,准备相对柔软的鼠粮及充足的饮用水。阻塞2 h后,轻轻拔出栓线约10 mm实现脑缺血后的再灌注。假手术组只分离颈总动脉、颈内动脉、颈外动脉,不结扎,不插线,完成后直接缝合皮肤。
1.3.3 横木行走实验 横木宽2.0 cm,长120 cm,厚1.0 cm,距离地面80 cm水平悬空放置。造模前进行横木行走训练,使大鼠全部顺利通过横木。评分标准[5]:
0分代表不能待在横木上;1分代表待在横木上不能行动;2分代表试图通过但从横木上摔下;3分代表通过横木,但损伤后肢滑落步数超过总步数的50%;4分代表滑落步数超过1次但不超过总步数的50%;5分代表仅滑落1次;6分代表顺利通过。术前训练4 d,每天1次,直至所有大鼠评分达到6分。
1.3.4 神经功能评分 采用Zea Longa评分法对大鼠进行神经功能评估[6],评分标准:0分代表无明显神经症状;1分代表不能完全伸展左侧前爪;2分代表行走时向左侧旋转;3分代表行走时向左侧倾倒;4分代表不能自主行走;5分代表死亡。
1.3.5 脑组织病理分析 ⑴组织取材:切开胸腹皮肉,充分暴露心脏,经心尖插管,剪开心耳,用缓冲生理盐水冲洗5 min,用4%多聚甲醛(0.l mol/L磷酸缓冲液,pH值7.4)心内灌注固定。大鼠尾部变硬后,开颅取全脑,冠状位取视交叉向尾端3~4 mm组织块,投入相同固定液于4 ℃固定1周,石蜡包埋后,4 ℃保存。⑵苏木精 - 伊红(HE)染色:将石蜡切片,切片厚度5 μm,将切片用不同浓度的二甲苯和乙醇脱蜡,苏木素浸泡染色25 min后用水冲洗。盐酸乙醇分化液浸泡30 s,纯净水浸泡15 min,0.5%伊红染液浸泡2 min,冲洗。乙醇梯度脱水,树脂封片,光镜下观察其组织形态的变化。
1.4 观察指标 ⑴运动功能和神经功能。分别于再灌注24 h和72 h比较3组大鼠横木行走实验评分和神经功能功能评分。⑵血清学指标。每组大鼠分别于再灌注24 h和72 h后经腹腔注射10 %水合氯醛(0.35 mL/100 g体质量),腹主动脉取血,离心(3 000~4 000 r/min,10~15 min,4 ℃)后得到上层血清,使用酶联免疫吸附实验(ELISA)检测3组大鼠血清神经元特异性烯醇化酶(NSE)、白细胞介素-6(IL-6)、白细胞介素-10(IL-10)水平。⑶脑组织病理形态。再灌注72 h比较3组大鼠脑组织病理形态学。
1.5 统计学方法 采用SPSS 26.0统计学软件分析数据,计量资料均符合正态分布且方差齐,以( x ±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。Plt;0.05为差异有统计学意义。
2 结果
2.1 3组大鼠横木行走实验评分和神经功能评分比较 与再灌注24 h比,再灌注72 h醒脑静组大鼠横木行走实验评分升高,神经功能评分降低;再灌注24、72 h,与假手术组比,模型组与醒脑静组大鼠横木行走实验评分均降低,神经功能评分均升高;与模型组比,醒脑静组大鼠横木行走实验评分均升高,神经功能评分均降低,差异均有统计学意义(均Plt;0.05),见表1。
2.2 3组大鼠血清NSE、IL-6及IL-10水平比较 与再灌注24 h比,再灌注72 h 模型组与醒脑静组大鼠血清NSE、IL-6及IL-10水平均降低;再灌注24、72 h,与假手术组比,模型组和醒脑静组大鼠血清NSE、IL-6及IL-10水平均升高;与模型组比,醒脑静组大鼠血清NSE、IL-6及IL-10水平均降低,差异均有统计学意义(均Plt;0.05),见表2。
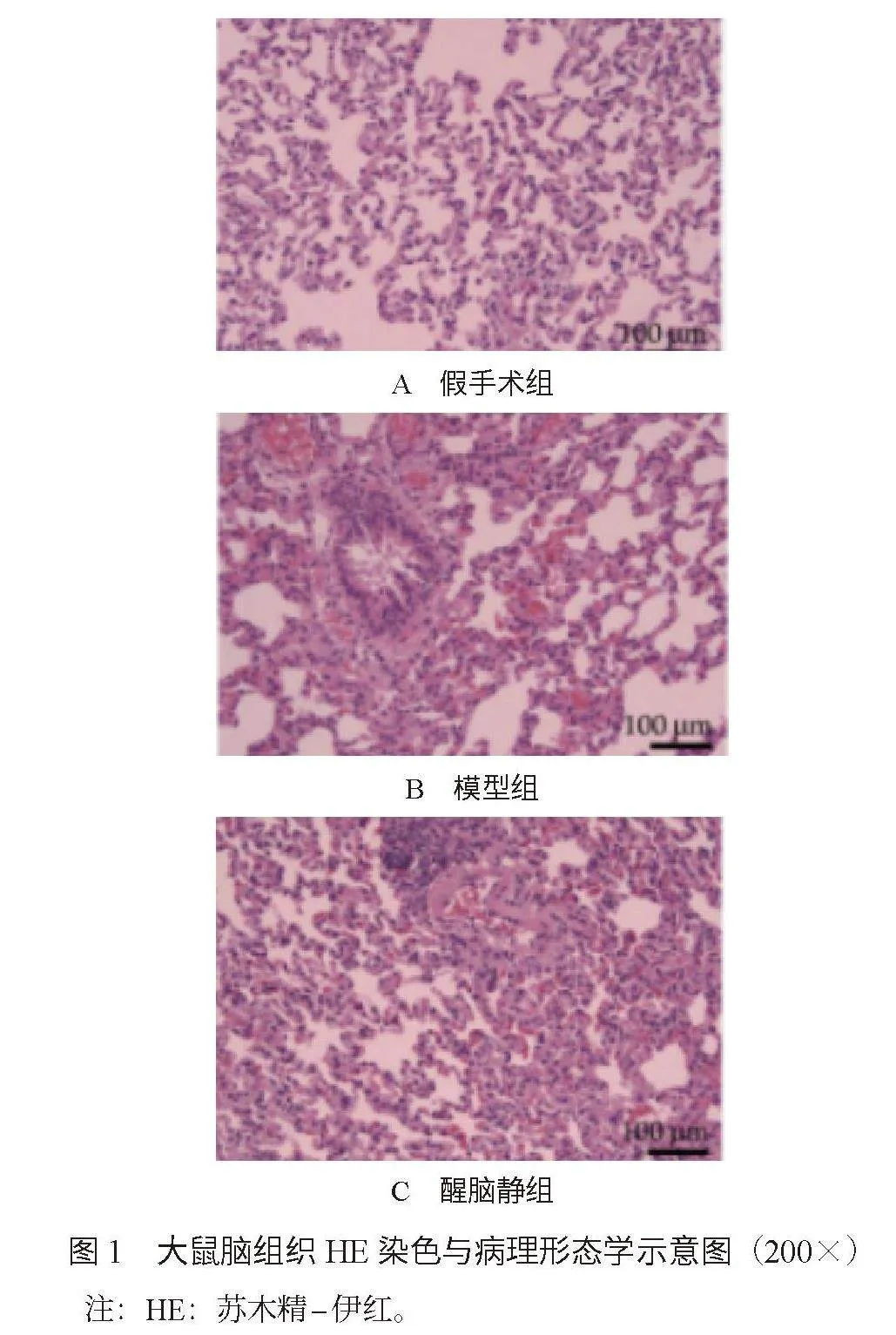
2.3 3组大鼠脑组织HE染色与病理形态学比较 再灌注72 h后,与假手术组比,模型组和醒脑静组大鼠脑组织病理形态学出现明显改变,脑组织结构不完整,神经元出现坏死现象;与模型组比,醒脑静组大鼠的脑组织病理形态学变化相对较轻,脑组织结构相对完整,神经元坏死较少,见图1。
3 讨论
脑缺血再灌注损伤是一种临床常见的造成脑损伤的原因,其发生往往与休克、心跳骤停等多种情况密切相关。在脑缺血再灌注过程中,缺血引起的脑组织损伤往往比缺血本身更严重。中医学认为脑缺血再灌注损伤属“中风”范畴,“脑髓损伤,神机失用”是病机关键。醒脑静主要由麝香、郁金、栀子、冰片配伍而成,具有保护脑组织、改善脑部血液循环、抗炎等作用。醒脑静在临床上主要用于治疗多种原因导致的脑部疾病,研究表明,醒脑静在脑缺血再灌注损伤中可能具有一定的保护作用[7-8]。
本研究中,再灌注24、72 h,与假手术组比,模型组与醒脑静组大鼠横木行走实验评分均降低,神经功能评分均升高;与模型组比,醒脑静组大鼠横木行走实验评分均升高,神经功能评分均降低。这提示醒脑静能够有效改善脑缺血再灌注损伤大鼠的平衡能力和神经功能。醒脑静具有镇静安神的作用,能够抑制脑缺血再灌注损伤引起的神经系统兴奋性,改善运动功能和神经功能。良好的血液供应对于维持神经系统的正常功能至关重要,而醒脑静具有活血化瘀的作用,可改善脑部血液循环,促进脑组织的血液供应和氧气供给,减轻脑组织损伤[9]。
在脑缺血再灌注过程中,炎性细胞浸润、炎症因子释放,会进一步加重脑组织损伤,NSE是神经元损伤的标志物,当脑组织出现急性缺血缺氧导致坏死时,大量NSE会释放;IL-6和IL-10主要由单核细胞、巨噬细胞等产生,IL-6水平可反映脑缺血损伤程度,IL-10是抗炎因子,在脑缺血早期处于应激代偿状态,可抑制炎症因子的活性。本研究中,再灌注24、72 h,与假手术组比,模型组和醒脑静组大鼠血清NSE、IL-6及IL-10水平均升高;与模型组比,醒脑静组大鼠血清NSE、IL-6及IL-10水平均降低。这提示醒脑静能够减轻炎症反应,进而降低炎症因子水平,减轻神经元损伤。醒脑静具有较好的抗炎、改善血液循环的作用,通过改善脑组织缺血缺氧状态和血脑屏障的通透性,减少炎症因子对脑组织的损伤。
本研究结果显示,与模型组比,醒脑静组大鼠的脑组织结构相对完整,神经元坏死相对较少。这提示醒脑静能够有效保护脑组织结构完整性,减轻神经元损伤。醒脑静具有抗氧化作用,能够清除再灌注过程中产生的活性氧,减轻氧化应激损伤,从而保护脑组织结构;醒脑静还具有抗凋亡作用,通过抑制脑缺血再灌注损伤引起的神经元凋亡,减轻神经元损伤,促进脑组织修复[10]。
综上,醒脑静在大鼠脑缺血再灌损伤中具有显著的脑保护作用,通过调节炎症反应,减轻神经元损伤,进而保护脑组织结构的完整性,还改善了运动功能和神经功能。未来应进一步深入研究,为醒脑静治疗脑缺血再灌损伤提供更多的科学依据。
参考文献
孙亚萍, 霍瑞卿, 赵敏菡, 等. 益气活血化浊解毒方调节脂多糖和TLR4/MyD88/MAPK信号通路减轻大鼠脑缺血再灌注损伤研究[J]. 中华中医药杂志, 2023, 38(12): 5997-6002.
张平文, 王义宣. 醒脑静注射液治疗创伤性脑出血患者的临床研究[J]. 中国临床药理学杂志, 2023, 39(23): 3351-3355.
郭金赫, 范祥. 醒脑静注射液治疗脑出血研究进展[J]. 中成药, 2021, 43(2): 450-453.
王丽琴, 孙逸坤, 王晓峰, 等. 醒脑静注射液对大鼠脑出血模型血脑屏障通透性及相关蛋白的影响[J]. 环球中医药, 2021, 14(6): 993-999.
杨奕樱, 刘杨, 刘明, 等. 淫羊藿苷对脑缺血再灌注大鼠恢复早期的神经保护作用研究[J].中药新药与临床药理, 2020, 31(6): 662-667.
卢小叶, 吕倩忆, 李棋龙, 等. Zea-longa评分与改良Garcia评分应用于针刺治疗CIRI大鼠神经功能缺损评估的研究[J]. 湖南中医药大学学报, 2021, 41(9): 1356-1360.
刘浩琦, 张涵莱, 李媛媛, 等. 基于GC-MS代谢组学的醒脑静注射液干预脑缺血再灌注大鼠模型的作用机制研究[J]. 海南医学院学报, 2022, 28(8): 572-578.
曲晓宇, 张月明, 张四喜, 等. 醒脑静注射液保护大鼠脑缺血 - 再灌注损伤及血脑屏障的作用研究[J]. 中药材 ,2018, 41(9): 2196-2200.
贾贺, 李惠勉, 刘超, 等. 醒脑静注射液对急性脑梗死患者局部脑血流、脑水肿及MMP、NSE的影响[J]. 吉林中医药, 2020, 40(9): 1202-1205.
陈欢, 司海超, 马新强, 等. 丁苯酞联合醒脑静预防颈动脉内膜剥脱术后脑高灌注综合征的疗效及对其脑氧代谢、氧化应激的影响[J]. 世界中西医结合杂志, 2023, 18(7): 1462-1465, 1475.
1 基金项目:2022年百色市科学研究与技术开发计划项目(编号:百科20224163)
作者简介:吴晓文,硕士研究生,副主任医师,研究方向:重症医学。

