加减养精种玉汤通过Rictor/mTORC2通路改善大鼠卵巢储备功能的机制研究





〔摘要〕 目的 探讨加减养精种玉汤通过雷帕霉素不敏感性伴随蛋白(rapamycin-insensitive companion of mTOR, Rictor)/哺乳动物雷帕霉素靶蛋白复合物2(mammalian targeting of rapamycin complex 2, mTORC2)通路改善大鼠卵巢储备功能的作用机制。方法 准备动情周期正常的雌性SD大鼠32只,随机选取其中8只作为空白组(等剂量生理盐水灌胃),其余SD大鼠首次腹腔注射环磷酰胺50 mg/mL后连续14 d腹腔注射8 mg/kg诱导卵巢储备功能减退(diminished ovarian reserve, DOR)模型。按随机数字表法将造模成功的24只大鼠分为模型组(等剂量生理盐水灌胃)、中药组(加减养精种玉汤3.39 g/kg灌胃)、卵泡刺激素(follicle stimulating hormone, FSH)组(FSH 0.105 mg/kg灌胃)。记录大鼠动情周期;HE染色观察左侧卵巢组织病理学变化并计算各组大鼠左侧卵巢窦卵泡数量;计算子宫、左侧卵巢系数;ELISA法测定FSH、黄体生成素(luteinizing hormone, LH)、雌二醇(estradiol, E2)、抗米勒管激素(anti-Müllerian hormone, AMH)水平;Western blot检测大鼠左侧卵巢组织Rictor、mTORC2蛋白表达水平。结果 与空白组相比,模型组动情周期次数减少(Plt;0.05);左侧卵巢成熟卵泡少;左侧卵巢指数、子宫指数、左侧卵巢窦卵泡数量均降低(Plt;0.05,Plt;0.01);血清AMH、E2降低(Plt;0.01),LH、FSH升高(Plt;0.01);左侧卵巢组织Rictor、mTORC2蛋白相对表达量升高(Plt;0.01)。与模型组比,中药组及FSH组左侧卵巢结构改善,各级卵泡数量增加;左侧卵巢指数、子宫指数、左侧卵巢窦卵泡数量均上升(Plt;0.05);血清AMH、E2升高(Plt;0.01),LH、FSH降低(Plt;0.01);左侧卵巢组织Rictor、mTORC2蛋白相对表达量降低(Plt;0.01)。结论 加减养精种玉汤能够改善激素水平、调节卵巢卵泡细胞,从而起到改善DOR的作用,其机制可能与降低Rictor/mTORC2的表达有关。
〔关键词〕 加减养精种玉汤;Rictor/mTORC2通路;卵巢储备功能;动情周期;环磷酰胺诱导
〔中图分类号〕R285.5" " " " "〔文献标志码〕A" " " " " 〔文章编号〕doi:10.3969/j.issn.1674-070X.2024.08.002
Mechanism of modified Yangjing Zhongyu Decoction improving ovarian reserve function in rats through Rictor/mTORC2 pathway
LIU Yinglian, WANG Xian, ZHANG Wenlong, YUE Wen, ZHOU Xiazhi*
School of Chinese Medicine, Hainan Medical University, Haikou, Hainan 571199, China
〔Abstract〕 Objective To explore the effects of modified Yangjing Zhongyu Decoction (MYJZYD) on improving ovarian reserve function in rats through rapamycin-insensitive companion of mTOR (Rictor)/mammalian targeting of rapamycin complex 2 (mTORC2) pathway. Methods A total of 32 female SD rats with normal estrous cycle were included, eight of which were randomly selected as blank group (receiving equal dose of normal saline), and the diminished ovarian reserve (DOR) model was induced in the remaining rats through an initial intraperitoneal injection of cyclophosphamide at 50 mg/ml followed by continuous intraperitoneal injections 8 mg/kg per day for 14 days. According to random number table method, 24 rats were divided into model group (receiving equal dose of normal saline), Chinese medicine group (receiving MYJZYD 3.39 g/kg intragastric administration), and follicle-stimulating hormone (FSH) group (receiving FSH 0.105 mg/kg intragastric administration). The estrous cycle of rats was recorded, and the histopathological changes in the left ovary were observed by HE staining. The number of antral follicles in the left ovary of rats in each group was calculated, and the coefficients of uterus and the left ovary were calculated. Serum levels of FSH, luteinizing hormone (LH), estradiol (E2), and anti-Müllerian hormone (AMH) were measured by ELISA. The expression levels of Rictor and mTORC2 proteins in the left ovarian tissue of rats were determined by Western blot. Results Compared with the blank group, the model group showed a reduction in the number of estrous cycles (Plt;0.05); the left ovarian structure was relatively disordered with fewer mature follicles; the left ovarian index, uterine index, and the number of antral follicles in the left ovary were all decreased (Plt;0.05, Plt;0.01), the serum AMH and E2 levels decreased (Plt;0.01), while serum LH and FSH levels increased (Plt;0.01). The relative expression levels of Rictor and mTORC2 proteins in the left ovarian tissue were higher (Plt;0.01). Compared with the model group, the structure of the left ovary was improved and the number of follicles at all levels was significantly lower in the Chinese medicine group and FSH group. The left ovarian index, uterine index, and the number of antral follicles in the left ovary all increased (Plt;0.05). Serum AMH and E2 levels increased (Plt;0.01), while LH and FSH levels decreased (Plt;0.01); the relative expression levels of Rictor and mTORC2 proteins in the left ovarian tissue were higher (Plt;0.01). Conclusion MYJZYD can improve hormone levels, regulate ovarian follicle cells, thus playing a role in improving DOR. Its mechanism may be related to reducing the expression of Rictor/mTORC2.
〔Keywords〕 modified Yangjing Zhongyu Decoction; Rictor/mTORC2 pathway; ovarian reserve function; estrous cycle; cyclophosphamide induction
卵巢储备功能减退(diminished ovarian reserve, DOR)是指卵巢内卵母细胞的数目减少和(或)质量降低,伴抗米勒管激素(anti-Müllerian hormone, AMH)水平下降、窦卵泡数减少、卵泡刺激素(follicle stimulating hormone, FSH)升高,表现为生育能力降低,但与年龄和月经改变无关[1]。研究表明,在DOR基础上“病欲发而有先兆”,即发展为早发性卵巢功能不全(premature ovarian insufficiency, POI),若未能尽早及时干涉则可在1~6年内进一步恶化并发展成为卵巢早衰(premature ovarian failure, POF)[2]。而近年来,该发病率逐年上升[3],DOR作为导致育龄女性发生不孕的主要致病因素,严重影响女性的生殖健康、心理健康以及生活质量。因此,采取积极措施防治DOR,预防其发展成为POI或POF至关重要。
DOR的病因尚不明确,目前仍无确切有效的方法恢复卵巢功能,西医在治疗上主要采用激素补充疗法,可改善临床症状和恢复月经周期,但慎用及禁忌证较多,且患者卵巢储备功能及生育力改善效果并不明显[4]。体外受精-胚胎移植成为有生育需求的DOR不孕患者主要的辅助生殖技术,但该类患者卵巢低反应率高,且获卵率、优胚率均低于卵巢功能正常女性,即使妊娠成功,但面临高风险的流产率[5]。中医药在调节卵巢功能方面,有独特的优势,具有增加卵巢血供、改善卵巢和子宫局部微环境的优点,并通过多系统、多靶点调节下丘脑-垂体-卵巢生殖轴,增加卵巢对促性腺激素的反应、提高卵巢组织雌激素受体含量以保护卵巢功能[6]。相比西医治疗存在的不良反应,中医治疗具有安全有效且疗效稳定的优势[7]。
中医学认为,DOR的基本病机为肾阴亏虚、精血不足,在治疗时,多以补肾阴、益精血为主[8]。养精种玉汤出自《傅青主女科·种子篇》[9],为“种子十方”的第一方,具有补血生精的功效,主治身瘦血虚不孕。原方由熟地黄、当归、白芍、山茱萸组成。经过临床医师对养精种玉汤数百年的反复实践,现已成为治疗不孕症的基础方[10]。本研究以养精种玉汤为基础方,结合临床经验加减化裁,自拟加减养精种玉汤以奏滋肾阴、益精血之效。在体外研究发现,加减养精种玉汤含药血清能有效启动原始卵泡发育[11]。本课题组在前期研究中明确了加减养精种玉汤治疗DOR的最佳浓度,发现其可能通过磷脂酰肌醇-3-羟基酶(phosphatidylinositol 3-hydroxy kinase, PI3K)/蛋白激酶B(protein kinase B, AKT)信号通路增加生长卵泡数量,改善激素水平,从而延缓卵巢衰老进程[12]。基于此,为进一步揭示加减养精种玉汤治疗DOR作用的分子机制,本研究拟从卵泡颗粒细胞雷帕霉素不敏感性伴随蛋白(rapamycin-insen⁃sitive companion of mTOR, Rictor)/哺乳动物雷帕霉素靶蛋白复合物2(ma⁃mmalian targeting of rapamycin complex" 2," mTORC2)信号通路观察加减养精种玉汤如何调节下丘脑-垂体-卵巢生殖轴平衡,进而改善卵巢功能的可能机制,为临床研究提供基础循证依据。
1 资料与方法
1.1" 实验动物
5周龄SPF级SD雌性大鼠32只,体质量160~200 g,购买自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2021-0011。按照国家标准啮齿类实验动物饲养,在(23±2) ℃恒定室温、湿度40%~45%、12 h明暗交替环境下,实验动物自由饮水、摄食。动物实验获海南医学院伦理委员会审批(伦理审批号:HYLL-2021-056),所有操作均符合《实验动物管理条件》要求。
1.2" 主要药物与试剂
加减养精种玉汤:熟地黄10 g、当归10 g、白芍10 g、山茱萸10 g、黄精20 g、葛根20 g、陈皮10 g、神曲10 g、菟丝子30 g、鸡血藤20 g、香附10 g、甘草6 g,以上药物的免煎颗粒均购自四川新绿色药业科技发展有限公司(批号:191009、2203142、2009025、2112021、2211024、2211031、2312034、2313051、2313⁃052、2317066、2412017、2413022)。雌二醇(estradiol, E2)、FSH、大鼠黄体生成素(luteinizing hormone, LH)、AMH ELISA试剂盒(上海泛柯生物科技有限公司,批号:F3450-B、F3441-B、F3499-B、F3095-B);重组Anti-Rictor抗体、Anti-mTORC2抗体(美国Abcam公司,批号:ab219950、ab109081)。注射用FSH(宁波第二激素厂,规格:100 IU,批号:200919);注射用环磷酰胺(江苏盛迪医药有限公司,规格:0.1 g,国药准字:H32020856,批号:20031825)。
1.3" 主要实验仪器
高速冷冻离心机(长沙科威实业有限公司,型号:5418R);超净工作台(苏州净化设备有限公司,型号:CW-SJ-1FD);电泳仪(上海天能科技有限公司,型号:EPS300);接触式无损定量成像仪(上海易孛特生命科学有限公司,型号:Touch lmager);石蜡切片机(英国Shandon公司,型号:KD-2508)。
1.4" 造模及分组
大鼠按随机数字表法随机分为空白组、模型组、中药组、FSH组,每组8只。除空白组外,其余各组正常动情周期的大鼠采用腹腔注射环磷酰胺造模[13]。首次负荷剂量50 mg/kg,随后每天8 mg/kg连续腹腔注射14 d以诱导DOR大鼠模型。当50%大鼠出现动情期紊乱时,视为造模成功[14]。SD大鼠给药剂量按照人与动物的药量换算法进行计算[15],FSH组灌胃剂量为0.105 mg/kg,中药组加减养精种玉汤每天灌胃剂量参考前期实验结果[12]的最佳干预浓度3.39 g/kg,空白组及模型组给予等量生理盐水灌胃,每天1次,连续给药2周。
1.5" 取材
末次给药后禁食不禁水12 h,大鼠以0.4%戊巴比妥(1 mL/100 g)腹腔注射麻醉后称取质量,腹主动脉采血、处死,于冰上迅速取子宫、左侧卵巢。全血样本以4 ℃ 12 000 r/min离心10 min(离心半径8.5 cm)后取上层血清,-80 ℃冰箱内保存,左侧卵巢采用4%多聚甲醛固定。
1.6" 检测指标
1.6.1" 器官湿重及器官系数" 取子宫、左侧卵巢,剔除表面脂肪组织,电子天平称重后参照文献[16]方法计算子宫、左侧卵巢指数。子宫指数=子宫湿重(mg)/处死前大鼠体质量(g)×100%;左侧卵巢指数=左侧卵巢湿重(mg)/处死前大鼠体质量(g)×100%。
1.6.2" HE染色观察左侧卵巢组织病理学变化" 各组取材后,用多聚甲醛固定及蔗糖脱水后置于石蜡中包埋,将包埋大鼠左侧卵巢的石蜡块切成4 μm的切片,经二甲苯和梯度乙醇常规脱蜡至水,自来水冲洗,经苏木精初染5 min和伊红复染4 min,中性树胶封片,光学显微镜下观察左侧卵巢组织形态结构。
1.6.3" ELISA检测血清激素水平" 取出各组血清样品置于冰上融化,于4 ℃离心机中12 000 r/min 离心20 min(离心半径8.5 cm),取上清液。加入FSH、LH、E2、AMH标准品1 mL至标准管中,静置10 min并充分溶解。进行2倍比稀释,配制不同浓度的标准品。加样封板后,37 ℃条件下温育90 min,加酶后洗涤,每孔加酶结合物工作液100 μL,封板后置于37 ℃烘箱中温育30 min。再次洗涤后加底物溶液,封板膜封板后置于37 ℃烘箱中温育15 min进行显色。加终止液终止反应,15 min内在450 nm波长测量各孔的吸光度(OD值),绘出标准曲线和标准方程,计算每个样本的浓度。
1.6.4" Western blot检测左侧卵巢组织Rictor和mTORC2的蛋白水平表达" 将左侧卵巢组织按照实验试剂说明书进行蛋白的提取、裂解得到组织总蛋白产物,并进行蛋白浓度测定、配胶、电泳、转膜,在5%脱脂牛奶里加入PVDF膜在室温下摇床反应1 h,加一抗Rictor(稀释比1∶500)、mTORC2(稀释比1∶1 000),放置4 ℃冰箱孵育过夜,次日用1×TBST缓冲液冲洗5 min, 反复2次后加HRP,室温轻摇1 h,冲洗10 min,反复2次;将PVDF膜浸泡于ECL中显色,最后用Image J软件对目的条带进行灰度分析,以β-actin为内参照进行比对。
1.7" 统计方法
所有实验数据采用GraphPad Prism 9.0软件分析,计量资料用“x±s”表示,多组比较采用单因素方差One-way ANOVA分析,组间多重比较采用LSD法,计数资料以“例(%)”表示,非等级技术资料用常规或矫正检验。以Plt;0.05表示差异有统计学意义。
2 结果
2.1" 加减养精种玉汤对DOR大鼠动情周期的影响
与空白组相比,模型组动情周期次数减少(Plt;0.05)。模型组动情3次、中药组4次、FSH组4次,3组间比较未见差异(Pgt;0.05)。详见表1。
2.2" 加减养精种玉汤对DOR大鼠左侧卵巢、子宫指数和左侧卵巢窦卵泡数量的影响
与空白组相比,模型组左侧卵巢指数、子宫指数、左侧卵巢窦卵泡数量均降低(Plt;0.05,Plt;0.01);与模型组相比,中药组、FSH组左侧卵巢指数、子宫指数、左侧卵巢窦卵泡数量升高(Plt;0.05)。详见表2。
2.3" 加减养精种玉汤对造模前后DOR大鼠血清激素指标的影响
与空白组相比,模型组血清AMH、E2显著降低(Plt;0.01),血清LH、FSH升高显著升高(Plt;0.01);中药组、FSH组血清AMH、E2显著高于模型组(Plt;0.01),血清LH、FSH显著低于模型组(Plt;0.01)。详见表3。
2.4" 加减养精种玉汤对DOR大鼠左侧卵巢组织病理影响
空白组大鼠左侧卵巢结构清晰,左侧卵巢内可见正常卵泡。与空白组比较,模型组大鼠左侧卵巢结构成熟卵泡少,以初级卵泡和闭锁卵泡居多;与模型组比较,中药组、FSH组大鼠各级卵泡数量明显增加,可见多个闭锁卵泡,剂量组闭锁卵泡和初级卵泡相对减少,形态接近空白组。详见图1。
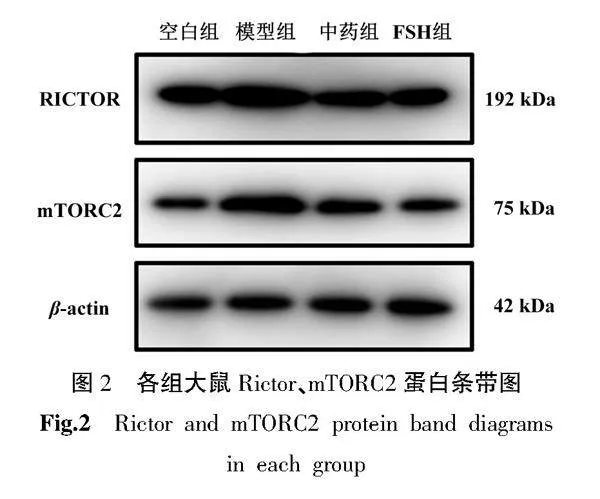
2.5" 加减养精种玉汤对DOR大鼠左侧卵巢组织Rictor和mTORC2的蛋白表达的影响
与空白组相比,模型组Rictor、mTORC2蛋白表达量显著升高(Plt;0.01);中药组、FSH组Rictor、mTORC2蛋白相对表达量显著低于模型组(Plt;0.01)。详见图2、表4。
3 讨论
养精种玉汤由熟地黄、山茱萸、白芍、当归组成,行大补肾水、养血补肝之力,对肾虚血亏的不孕症患者有显著的治疗效果。此方不特补血而纯于填精,精满则子宫易于摄精,血足则子宫易于容物,皆受孕之道也[17]。加减养精种玉汤主要由养精种玉汤化裁而来,在养精种玉汤原方基础上减熟地黄、当归、白芍、山茱萸四药的用量,并加入黄精、葛根、陈皮、神曲、菟丝子、鸡血藤、香附、甘草。其中黄精滋阴补血、补肾健脾;菟丝子补益肝肾、固精缩尿,二者相合可益气而补肾阴;香附、鸡血藤养血活血行气;陈皮、神曲、甘草可健脾益气;葛根以清热生津,诸药合用共奏滋肾阴、益精血之效。养精种玉汤现已成为治疗不孕症的基础方剂,依据其加减治疗DOR实际临床疗效较好,具有较高的研究价值[10]。
现代研究证实,养精种玉汤对治疗DOR有独特的效果,李宛静等[18-19]通过分析DOR模型大鼠RNA-m6A修饰,发现养精种玉汤能通过上调甲基转移酶3、α酮戊二酸依赖双加氧酶等水平,从而影响细胞自噬,改善激素水平、卵巢功能,起到治疗DOR的效果。李敏艳[20]通过临床试验也证明了养精种玉汤可通过改善LH、FSH水平,从而促进卵泡发育与成熟,并增强排卵作用。同时,加减养精种玉汤作为中药方剂,相较于FSH等激素补充疗法,具有成本低、毒副作用小、致癌风险小等优势,在临床治疗中,可以考虑作为FSH的替代药物进行DOR的治疗[21]。
研究结果表明,相对于模型组,中药组与FSH组的DOR大鼠AMH、E2激素水平明显增高,而LH、FSH激素水平明显降低,提示加减养精种玉汤可以有效改善DOR大鼠激素水平。同时,相对于模型组,中药组与FSH组的DOR大鼠左侧卵巢指数、子宫指数、左侧卵巢窦卵泡数量均得到改善,其中左侧卵巢指数接近空白组,并且通过病理组织观察可见中药组、FSH组的DOR的大鼠各级卵泡数量明显增加,多个闭锁卵泡,剂量组闭锁卵泡和初级卵泡相对减少,形态接近空白组,提示加减养精种玉汤可以显著的改善DOR大鼠生殖系统与左侧卵巢组织。
目前,已应用于临床的卵泡激活相关通路主要有人第10号染色体缺失的磷酸酶及张力蛋白同源的基因/PI3K/AKT通路、Hippo通路与哺乳动物雷帕霉素靶蛋白(mammalian targeting of rapamycin, mTOR)通路[22]。mTOR是一种调节细胞生长与增殖的丝氨酸/苏氨酸激酶,也是mTORC1和mTORC2的关键亚基。mTORC1参与了卵泡激活过程中颗粒细胞的活动,而mTORC2与卵泡生长发育及存活相关[23-24]。研究发现,Rictor诱导卵泡细胞大量凋亡的同时,能抑制卵泡中P13K信号通路的活性,同时能抑制mTORC2在卵子发育和成熟、卵泡凋亡闭锁、卵巢功能的表达[25]。可见,Rictor作为mTORC2中的核心组分,Rictor/mTORC2信号通路在多种细胞的增殖、代谢、凋亡等过程中都发挥重要的作用[26]。然而Rictor/mTORC2信号通路在DOR方面的研究相对较少,本项实验结果表明,模型组的Rictor、mTORC2蛋白表达量显著增高,相反,中药组的DOR大鼠Rictor、mTORC2蛋白表达量显著低于模型组,提示加减养精种玉汤可能通过降低Rictor/mTORC2信号通路的表达,从而调节卵巢卵泡细胞调亡水平及卵巢储备功能,进而改善DOR。
综上所述,加减养精种玉汤可以通过降低Rictor/mTORC2的表达,从而有效的改善DOR的生殖系统,提高AMH、E2激素水平,降低FSH、LH激素水平,增加各级卵泡细胞数量,调节卵巢卵泡细胞凋亡水平,恢复卵巢功能及形态,起到治疗DOR的作用。加减养精种玉汤作为中药复方,其多功效、多靶点、配伍协同机制还有待进一步。本研究为后续深入研究加减养精种玉汤治疗DOR提供了前期实践基础。
参考文献
[1] 卵巢储备功能减退临床诊治专家共识专家组, 中华预防医学会生育力保护分会生殖内分泌生育保护学组. 卵巢储备功能减退临床诊治专家共识[J]. 生殖医学杂志, 2022, 31(4): 425-434.
[2] 孙红燕, 孙" 莉, 施巨芳, 等. 从瘀热辨证治疗早发性卵巢功能不全疗效观察[J]. 现代中西医结合杂志, 2022, 31(2): 174-178, 197.
[3] 崔" 楠, 杨文文, 王晓甜, 等. 补肾填精中药联合克罗米芬治疗肝肾阴虚型卵巢储备功能减退相关不孕的临床研究[J]. 时珍国医国药, 2023, 34(4): 922-926.
[4] 辛喜艳, 叶" 阳, 樊瑞文, 等. 不孕症(卵巢储备功能减退)的中西医结合诊疗方案[J]. 北京中医药, 2024, 43(2): 119-123.
[5] 任苏妍, 张金枫, 李荣煌, 等. 中药复方治疗卵巢储备功能减退作用机制的研究进展[J]. 中医药学报, 2024, 52(3): 87-94.
[6] 陈锦澍, 范李想, 孙明炜, 等. 中医药干预早发性卵巢功能不全相关信号通路研究进展[J]. 中国中医基础医学杂志, 2024, 30(6): 1085-1092.
[7] 曹金翔, 吴" 洁. 早发性卵巢功能不全激素补充治疗利弊评价[J]. 中国实用妇科与产科杂志, 2020, 36(3): 227-230.
[8] 许芳熙, 刘英莲, 王春敏, 等. 养精种玉汤及其现代临床应用研究[J]. 中医研究, 2023, 36(9): 83-87.
[9] 傅" 山. 傅青主女科[M]. 肖承悰, 主编. 北京: 人民卫生出版社, 2015: 49.
[10] 朱俊平, 魏佳明, 刘瑞连, 等. 养精种玉汤的方证释义及现代研究进展[J]. 中国实验方剂学杂志, 2019, 25(23): 209-214.
[11] 李宛静, 邓蒂斯, 汪景仪, 等. 养精种玉汤调控卵巢储备功能下降模型大鼠卵巢原始卵泡启动的作用机制研究[J]. 中国中医药信息杂志, 2024, 31(4): 106-111.
[12] 岳" 雯, 刘英莲, 周夏芝, 等. 养精种玉汤调控PI3K/AKT通路改善DOR模型大鼠卵巢储备功能的机制研究[J]. 时珍国医国药, 2023, 34(2): 310-313.
[13] 王" 洋, 张" 斐, 许洁夏, 等. 三种卵巢早衰大鼠造模方法比较研究[J]. 中国中西医结合杂志, 2022, 42(10): 1225-1230.
[14] 闫" 丽, 温" 和, 唐桂毅, 等. 大鼠阴道细胞涂片不同染色方法在动情周期判定中的价值[J]. 药物评价研究, 2020, 43(1): 72-76.
[15] 赵" 伟, 孙国志. 不同种实验动物间用药量换算[J]. 畜牧兽医科技信息, 2010(5): 52-53.
[16] 林光耀, 张米佳, 叶" 涛, 等. 葆青颗粒对卵巢储备功能下降模型大鼠性激素水平和Bax、Bcl-2、VEGF的影响[J]. 中国中医基础医学杂志, 2022, 28(4): 540-544.
[17] 马晓棠, 廉" 华, 姚烨菲, 等. 经阴道三维能量多普勒超声检测评价养精种玉汤对肾亏血虚型不孕症患者子宫内膜容受性的影响[J]. 中国中医药科技, 2022, 29(4): 633-635.
[18] 李宛静, 邓蒂斯, 汪景仪, 等. 养精种玉汤对卵巢储备功能减退模型大鼠RNA-m6A修饰的影响[J]. 中国中医药信息杂志, 2023, 30(5): 109-113.
[19] 李宛静, 邓蒂斯, 汪景仪, 等. 养精种玉汤经FTO调控卵巢细胞自噬的机制研究[J]. 海峡药学, 2022, 34(10): 1-4.
[20] 李敏艳. 养精种玉汤加味联合氯米芬治疗PCOS肾阴虚证不孕症的临床观察[D]. 长沙: 湖南中医药大学, 2022.
[21] 李玉丽, 梁" 宇, 谭志强, 等. 养精种玉汤的现代研究进展[J]. 河南中医, 2020, 40(1): 149-152.
[22] 刘湛傲, 陈" 晨. 卵泡体外激活在早发性卵巢功能不全患者辅助生殖中的研究进展[J]. 基础医学与临床, 2023, 43(4): 538-546.
[23] FORD E A, BECKETT E L, ROMAN S D, et al. Advances in human primordial follicle activation and premature ovarian insufficiency[J]. Reproduction, 2020, 159(1): R15-R29.
[24] CORREIA B, SOUSA M I, RAMALHO-SANTOS J. The mTOR pathway in reproduction: From gonadal function to developmental coordination[J]. Reproduction, 2020, 159(4): R173-R188.
[25] WANG J M, GAO Q, ZHANG Q, et al. Implication of BAG5 downregulation in metabolic reprogramming of cisplatin-resistant ovarian cancer cells via mTORC2 signaling pathway[J]. Biochimica et Biophysica Acta Molecular Cell Research, 2021, 1868(9): 119076.
[26] CHEN Z G, KANG X J, WANG L P, et al. Rictor/mTORC2 pathway in oocytes regulates folliculogenesis, and its inactivation causes premature ovarian failure[J]. The Journal of Biological Chemistry, 2015, 290(10): 6387-6396.
〔收稿日期〕2024-03-23
〔基金项目〕海南省自然科学基金高层次人才项目(821RC565);海南省卫生健康科技创新联合项目(WSJK2024MS164)。
〔通信作者〕*周夏芝,女,硕士,副教授,E-mail:xiazhi08@163.com。

