理论与实践的有机结合


摘 要:高中化学电化学主要为原电池、电解池及其相关基础知识点,高考命题通常在此基础上,综合当前新型电池技术,进行题目变型,其本质上都是对基础知识的考查.为此,教师在教学过程中,针对原电池、电解池以及两者结合的题型进行针对性训练,引导学生正确区分“四极”,帮助学生熟悉各种题型的特点和解题方法,以便学生能够快速准确地完成题目的解答.
关键词:高考;高中;电化学;原理理解;解题技巧
中图分类号:G632"" 文献标识码:A"" 文章编号:1008-0333(2024)19-0123-03
收稿日期:2024-04-05
作者简介:陆月(1980.3—),女,江苏省滨海人,本科,中学一级教师,从事高中化学教学研究
高中电化学主要包括原电池和电解池的工作原理、电极反应式的书写、电解方程式的书写、电子转移的表示方法以及电化学的简单计算等内容,是氧化还原反应的进一步深化与实践应用,对于高中生化学能力要求较高.并且部分内容较为抽象,需要学生也能够充分理解[1].为确保学生能够理解、记忆并熟练运用电化学知识,教师需要帮助学生更深入理解电化学原理,并能够将其熟练运用到解题过程中.
1 原电池工作原理与解题技巧
1.1 原电池工作原理
原电池的工作原理是利用化学反应将化学能转化为电能,为自发进行的氧化还原反应.具体来说,原电池由两个电极(正极和负极)以及电解质溶液组成[2],其工作原理如图1所示.
1.2 原电池习题解题技巧
原电池是高中化学中非常重要的知识点之一,也是高考中的重点和难点.此类题目主要考查学生对原电池工作原理的掌握程度,包括能否正确判断原电池的正负极、能否正确书写电极反应式,以及能否正确判断原电池中正负离子的移动方向等.在书写电极反应式时,需要遵循书写规则和技巧,确保电子转移数和电荷守恒的准确性.
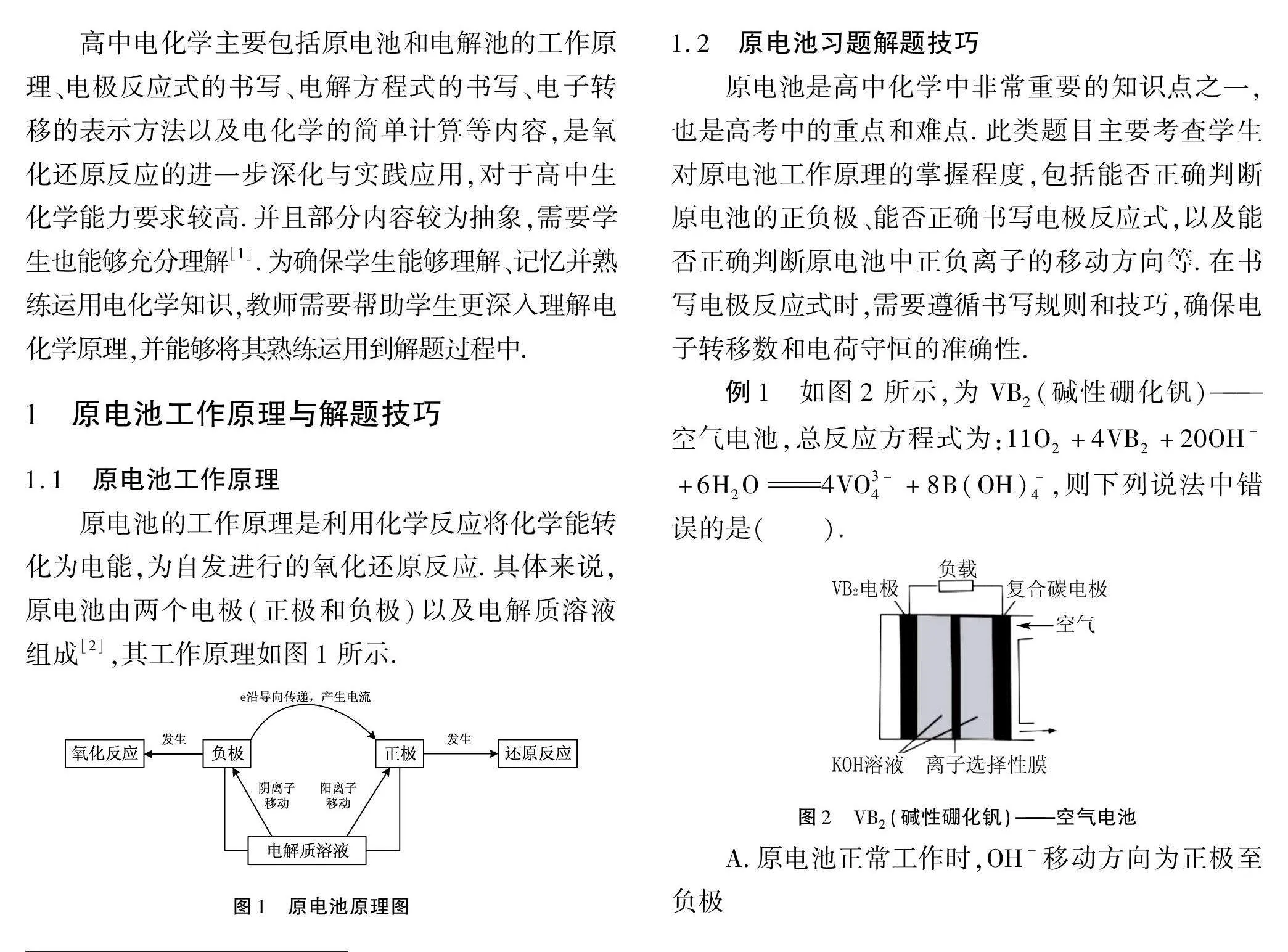
例1 如图2所示,为VB2(碱性硼化钒)——空气电池,总反应方程式为:11O2+4VB2+20OH-+6H2O4VO3-4+8B(OH)-4,则下列说法中错误的是(" ).
A.原电池正常工作时,OH-移动方向为正极至负极
B.电流方向为复合碳电极→负载→碱性硼化钒电极,电子方向相反
C.负极反应式为:
16OH-+VB2-11e-=4VO3-4+2B(OH)-4+4H2O
D.当参与反应的O2量为0.448 L时,电子转移为0.12 mol
答案:D
解析 从题干上来看,该题为原电池类型习题,而根据已知条件中总反应方程式可知,VB2(碱性硼化钒)为负极,复合碳电极为正极,A项,OH-为阴离子,移动方向为负极,正确;B项,根据原电池工作原理,电流方向为正极至负极,电子流方向为负极至正极,通过上述分析可知,VB2(碱性硼化钒)为负极,复合碳电极为正极,正确;C项,正极发生氧化反应,方程式为:2H2O+4e-4OH-,利用总反应方程式减去正极反应方程式,正确;D项,复合碳电极为正极,氧气与电子数之比为1∶4,故O2量为0.448 L时,电子转移应为0.02 mol,错误.
2 电解池工作原理与解题技巧
2.1 电解池工作原理
电解池的工作原理是利用电解作用将电能转化为化学能,即将电解质溶液中的物质进行氧化还原反应.在电解池中,电流通过外接电源和电极,使电子从负极流向正极,从而引发氧化还原反应.电解池由外接电源、电解质溶液、阴阳电极以及导线组成[3].当电解池接通外接电源后,电子从负极流向导线,再通过电解质溶液传递到正极,形成电流回路.在电极上,电子的传递导致阳离子在阴极上得到电子发生还原反应,阴离子在阳极上失去电子发生氧化反应.电解过程中,阳离子向阴极移动,并在阴极上获得电子释放出能量,从而发生还原反应;阴离子向阳极移动,并在阳极上失去电子吸收能量,从而发生氧化反应.
2.2 电解池类习题解题技巧
根据电解池工作原理,通常使用活泼金属为阳极,即元素周期表中铂以前的金属[4].而阴极发生还原反应,阴极材料一般不参与反应,因此解答此类题型时,可以从电解池阴极入手,快速判断电解池阴阳极.
例2 如图4所示,a、b极均为惰性材料,该装置主要作用为制备过氧化氢(H2O2),所用原料为去离子水与氧气(O2),忽略温度变化影响,则下列说法错误的是(" ).
A.a、b反应过程中产生与消耗的氧气(O2)摩尔比为1∶2
B.电解反应过程中,阴极室pH值下降
C.阴极反应式:4H++2O2+4e-2H2O2
D.阳极产生1 mol O2,阴极电子转移4 mol
答案:B
解析 从图中可以看出,在装置右侧,O2进入装置,生成H2O2,氧元素化合价降低,说明装置右侧发生还原反应,b极为阴极,连接电源负极;a极为阳极,连接电源正极.则阳极反应式为2H2O-4e-4H++O2,阴极反应为4H++2O2+4e-2H2O2.A项,根据阴阳极反应式可知,电子转移数相同,氧气比为1∶2,正确;B项,根据阳极反应式,生成H+,通过质子交换膜转移至左侧阴极室,则pH不变.错误;C项,根据上述分析,正确;D项,通过上述阴阳极反应式,正确.
3 原电池与电解池组合装置解题技巧
高考中,为考查学生电化学知识掌握情况,通常会以前沿电化学知识为背景,通过设置原电池与电解池组合装置类题型,考查学生解决综合问题、复杂问题的能力[5].不论题型如何变换,此类题型的基础还是电子的转移、离子的移动、电极反应等知识.在解答这类题目时,学生需要准确地识别出原电池和电解池的类型,以及各个电极的名称和功能;根据题目的描述,分析反应过程,明确各电极上发生的反应和物质的变化;综合运用所学的电化学知识,结合题目的具体情境进行分析和推理.
例3 如图5所示为新型 Zn-CO2 水介质电池,电极为选择性催化材料与金属锌.该电池在充电过程中,能够将水转化为氧气等物质,是当前解决能源污染的新型手段.根据图示结构,则下列说法不正确的是(" ).
A.充电时,正极溶液中氢离子浓度降低
B.充电式,阴极反应为Zn(OH)2-4+2e-Zn+4OH-
C.放电时,总反应式为Zn+2OH-+CO2+2H2O2Zn(OH)2-4+HCOOH
D.放电时,每产生1 mol HCOOH,则电子转移2 mol
答案:A
解析 此题型为原电池与电解池混合类题目,根据充、放电,电池的类型也发生变化.A项,充电时的电极反应式为2H2O-4e-4H++O2↑,可以看出产物中存在4H+,错误;B项,充电式,Zn(OH)2-4经过反应,被转化为Zn,正确;C项,可分别写出放电时正负极反应方程式,结合得到总反应方程式,正确.D项,根据总反应式,放电时,消耗CO2,生成HCOOH,错误.
4 电极反应式书写与解题技巧
高中电化学反应方程式书写通常
在高考中以新型电池能源案例分析题型出现,主要集中在填空题中.而高中阶段学生对于新型电池能源较为陌生,因此在书写电极反应方程式过程中,难以把握关键要点.为提高学生电极反应式书写正确率,教师需要注重引导学生正确判断题目中的正负、阴阳电极,可以从反应过程中电子的得失入手,找到电化学反应中的氧化剂、还原剂以及反应产物,从而能够轻松地完成解题,并正确书写电极反应式.
例4 新型锌——空气燃料电池中,电解质溶液为KOH,总反应式为2Zn+O2+4OH-+2H2O2Zn(OH)2-4.根据题目,完成下列问题:
(1)电源负极反应式为:.
(2)该新型电池放电过程中,内部转移了4 mol电子,则标准状况下,消耗氧气量为.
答案:(1)Zn-2e-+4OH-2Zn(OH)2-4
(2)22.4 L
解析 在题目已知条件中,给出了原电池总反应方程式,分析可知,该原电池为金属锌失去电子,通过原电池负极氧化反应,失去电子,可以判断金属锌为负极.另外,根据题目电解质溶液为KOH,呈碱性,故反应过程中不可能生成H+.经分析,可书写负极化学反应方程式为Zn-2e-+4OH-2Zn(OH)2-4.第(2)问中,根据总反应方程式可知,1 mol金属锌反应失去4 mol电子,1 mol O2反应失去4 mol电子,则在标准状况下,经换算需要消耗22.4 L O2.
5 结束语
综上所述,教师在教学过程中,需要注重引导学生加强基础知识记忆与理解,根据具体题型,分析电化学的相关知识点,通过有效引导,加强学生解决问题的思维框架构建能力,熟悉题型类别,帮助学生快速完成题型解答.
参考文献:
[1] 李行利,路小彬.建构电化学解题模型,高效突破高考习题[J].广州化工,2023,51(13):243-246.
[2] 王永波.高考电化学理论知识的解题技巧研究[J].人文之友,2019(14):167.
[3] 徐依,王海勤.高考化学电化学专题复习方法及解题策略[J].招生考试之友,2023(24):44-47.
[4] 苏莉.构建解题模型速解电化学问题[J].高中数理化,2021(23):68-69.
[5] 袁李李,朱怀义.电解原理的理解与运用[J].数理化解题研究,2021(1):100-101.
[责任编辑:季春阳]

