枣酱主要加工阶段工艺优化及其品质分析








摘要:为确定枣酱加工阶段条件(软化、浓缩、杀菌),该研究以残次骏枣为主要原料,以枣酱产品的色差和总抗氧化能力为评价指标,利用单因素试验和响应面Box-Behnken设计试验优化枣酱加工阶段条件,探究最佳加工阶段样品的品质变化。结果表明,软化阶段的最佳条件为软化温度55 ℃、料水比1∶4(g/mL)、软化时间3.15 h;浓缩阶段的最佳条件为柠檬酸添加量0.6 g和浓缩温度70 ℃;杀菌阶段的最佳条件为杀菌温度90 ℃和杀菌时间17 min。在此条件下,枣酱产品的色差为64.19,总抗氧化能力为7.22 U/L。主要加工阶段样品的总酸、维生素C、总酚、总黄酮等的含量与抗氧化能力差异显著,同时相关性分析表明可溶性固形物、维生素C、总酚、总黄酮等的含量与抗氧化能力之间具有极显著正相关关系(Plt;0.001)。基于主成分分析可将15个品质指标简化为2个主成分,累计方差贡献率达93.69%,枣酱的综合评分最高,为1.55。综上可知,该研究可为阐明枣酱加工过程中的品质变化和枣酱工业化生产提供理论参考。
关键词:枣酱;加工阶段;响应面优化;抗氧化;品质
中图分类号:TS264.24""""" 文献标志码:A """"文章编号:1000-9973(2024)10-0116-10
Optimization of Process of Jujube Sauce in Main Processing
Stages and Analysis of Its Quality
WU Zhe1 , LIU Jun1*, LOU Lei1, XING Jun1, QIN Xin-zheng2,
LU Qing-shan3, YANG Lei1, AHAT·Ahmatjan1
(1.College of Life Science and Technology, Xinjiang University, Urumqi 830017, China; 2.Institute
of Microbial Application, Xinjiang Academy of Agricultural Sciences, Urumqi 830091, China;
3.Inspection and Testing Center of Kuqa City, Kuqa 842000, China)
Abstract: In order to determine the processing stage conditions (softening, concentration and sterilization) of jujube sauce, in this study, with defective Ziziphus jujuba Mill. cv. Junzao as the main raw material, color difference and total antioxidant capacity of jujube sauce as the evaluation indexes, single factor test and response surface Box-Behnken design test are used to optimize the processing stage conditions of jujube sauce, and the quality changes of samples in the optimal processing stage are explored. The results show that the optimal conditions in the softening stage are softening temperature of 55 ℃, solid-liquid ratio of 1∶4 (g/mL) and softening time of 3.15 h. The optimal conditions in the concentration stage are citric acid addition amount of 0.6 g and concentration temperature of 70 ℃. The optimal conditions in the sterilization stage are sterilization temperature of 90 ℃ and sterilization time of 17 min. Under these conditions, the color difference of jujube sauce products is 64.19 and the total antioxidant capacity is 7.22 U/L. The content of total acids, vitamin C, total phenols, total flavonoids and the antioxidant capacity of the sample in the main processing stages are significantly different. Meanwhile, correlation analysis shows that the content of soluble solids, vitamin C, total phenols and total flavonoids are very significantly positively correlated with antioxidant capacity (Plt;0.001). Based on principal component analysis, 15 quality indexes could be simplified into 2 principal components, the cumulative variance"" contribution rate is 93.69%, and the
comprehensive score of jujube sauce is the highest of 1.55. In conclusion, this study can provide theoretical references for elucidating the quality change of jujube sauce during processing and industrial production of jujube sauce.
Key words: jujube sauce; processing stage; response surface optimization; antioxidation; quality
枣(Ziziphus jujuba Mill.)为鼠李科(Rhamnaceae)枣属(Ziziphus)多年生植物枣树的果实,具有较高的经济、生态和社会价值。枣在中国已有4 000多年的栽培历史,其种植面积超过300万公顷,年产量超过700万吨,占世界产量的98%[1]。枣在韩国、伊朗、北非、以色列、美国和中东地区也有分布[2]。此外,枣含有丰富的营养物质,包括多糖、氨基酸、抗坏血酸、三萜酸、黄酮类、酚酸和矿物成分等[3]。据研究报道,由于枣具有抗氧化[4]、抗炎[5]和抗癌[6]等多种生物活性,具有治疗不同疾病的潜力[7-9],是一种极具开发前景的保健食品原料。
果酱起源于中国,历史悠久、种类繁多、营养丰富、易消化,对人体健康有着很好的促进作用,因其价格低廉、可全年食用、风味优良等特点而成为人们喜爱的食物之一[10],其主要通过对水果进行罐装或密封以延长其保质期[11]。然而,与新鲜水果相比,加工产品(如果酱)的营养价值往往有所降低,例如,由于在加工过程中热能的输入,果酱的维生素C含量通常低于新鲜水果[12]。葡萄、蓝莓、草莓等水果常被用于生产果酱[13],进而提高各自的附加值。枣作为食品产业加工的重要原料,随着枣加工技术的快速发展,枣的深加工也成为不少企业的重点加工项目。枣除了鲜食、干制外,还能加工成种类繁多的枣类食品,枣酱就是其中之一。枣酱制品不仅提高了枣的商品价值,而且延长了果品的保存期,具有调味、健胃、开胃等功效[14]。随着时代的发展,枣酱越来越受到我国消费者的喜爱。
本研究以残次骏枣为原料,以枣酱的制作为主线,通过单因素试验和响应面试验确定主要加工阶段(软化、浓缩、杀菌)的最佳条件,通过理化指标、活性成分和抗氧化能力分析,探究主要加工阶段对枣酱品质的影响,并通过相关性分析和主成分分析对主要加工阶段的样品进行综合评价,对研发健康、方便的枣酱具有科学意义,为工业化枣酱生产和品质提高提供了重要理论和数据参考。
1 材料与方法
1.1 材料
残次骏枣:新疆美嘉食品饮料有限公司;无水柠檬酸(食品级):购自当地农贸市场。
1.2 试剂
DPPH(纯度gt;99.5%)、ABTS(纯度gt;98.0%)、福林酚试剂:上海源叶生物科技有限公司;抗坏血酸:天津市天新精细化工开发中心;维生素C测定试剂盒、总抗氧化能力(total antioxidant capacity,T-AOC)测定试剂盒:南京建成生物工程研究所;羟基自由基清除能力检测试剂盒:北京盒子手工科技有限公司;其他常规试剂均为国产分析纯。
1.3 仪器与设备
SNB-2液晶显示黏度计 上海衡平仪器仪表有限公司;LH-B55数显糖度计 杭州陆恒生物科技有限公司;CS-200精密色差仪 杭州彩谱科技有限公司;752紫外可见分光光度计 上海菁华科技仪器有限公司;Molecular Devices SpectraMax i3多功能酶标仪 美谷分子仪器(上海)有限公司;LC-8S离心机 长沙综仪生物科技有限公司;超声波清洗机 上海乔跃电子科技有限公司;RE-3000B旋转蒸发器 上海亚荣生化仪器厂;SPT203S型料理机 浙江绍兴苏泊尔生活电器有限公司。
1.4 试验方法
1.4.1 试验加工流程
原料→清洗→软化(打浆)→浓缩→装罐→杀菌→成品。
1.4.2 试验操作要点
原料:残次骏枣。
清洗:用纯净水洗净残次骏枣表面的泥沙、灰尘等,确保骏枣上没有杂质。
软化(打浆):以原料的不同倍数加水,浸泡后将原料与浸泡液进行不同加工处理,使其充分软化,将软化后的残次骏枣及其料液一同放入破壁料理机中打浆(去核、去皮渣),得到无颗粒、分布均匀、组织细腻的枣浆。
浓缩:采用真空浓缩工艺,将枣浆加入柠檬酸调配后进行浓缩,浓缩至黏稠状的酱体,浓缩终点为可溶性固形物含量达到(30.03±0.25)%。
装罐:将浓缩达标后的枣酱趁热装入已消毒的干净玻璃瓶中并密封。
杀菌:采用不同的杀菌方式进行对比,确定最佳杀菌条件,杀菌结束后将样品分段冷却至室温。
成品:检查成品的密封性,确保枣酱无渗出,得到成品。
1.4.3 单因素试验设计
通过单因素试验探究主要加工阶段(软化、浓缩、杀菌)对枣酱色差和总抗氧化能力的影响。软化阶段包括不同软化温度(35,45,55,65,75 ℃)、不同料水比(1∶2、1∶3、1∶4、1∶5、1∶6)、不同软化时间(1,2,3,4,5 h),分别固定软化温度55 ℃、料水比1∶4、软化时间3 h,其他参数保持不变,探究软化阶段对枣酱色差和总抗氧化能力的影响;真空浓缩阶段包括不同柠檬酸添加量(0.2,0.4,0.6,0.8,1.0 g)、不同浓缩温度(50,60,70,80,90 ℃),分别固定柠檬酸添加量0.6 g和浓缩温度70 ℃,其他参数保持不变,探究浓缩阶段对枣酱色差和总抗氧化能力的影响;杀菌阶段包括75 ℃杀菌(10,20,30 min)、90 ℃杀菌(10,20,30 min)、高压蒸汽灭菌(5,10,15 min),通过不同的杀菌方式探究杀菌阶段对枣酱色差和总抗氧化能力的影响。
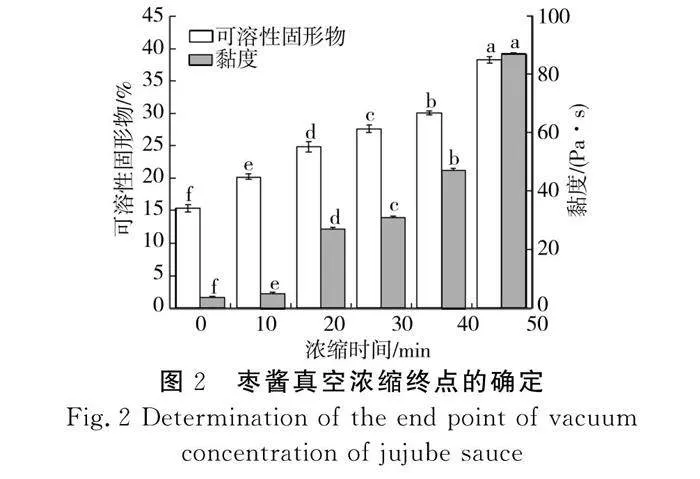
1.4.4 枣酱真空浓缩终点的确定
在温度(80 ℃)、真空度(0.095 MPa)下将枣浆浓缩,每隔10 min测定枣酱的黏度,观察浓缩过程中枣酱黏度与浓度的关系,找出枣酱浓缩过程中黏度的突变点,其对应的浓度即为枣酱浓缩终点。
1.4.5 Box-Behnken响应面试验
根据单因素试验的结果,采用Box-Behnken设计优化加工阶段条件。在上述单因素试验方差分析后的基础上,选择对枣酱色差和总抗氧化能力影响显著的因素为试验因素,以主要加工阶段枣酱的色差和总抗氧化能力为响应值,采用Design-Expert 13.0软件设计三因素三水平Box-Behnken响应面试验。对枣酱的色差和总抗氧化能力进行二次多元回归方程拟合,得到各因素与响应值之间函数关系的回归方程,根据试验生成的响应面图确定最佳的加工阶段条件,见表1。
1.4.6 理化指标、活性成分、体外抗氧化能力和微生物指标的测定
根据单因素试验及响应面试验优化结果,对残次骏枣(YZ)、软化(RH)、浓缩(NS)、杀菌(SJ)阶段的样品进行理化指标、活性成分、体外抗氧化能力和微生物指标的测定。
1.4.6.1 理化指标的测定
色差:使用色差仪对不同加工阶段样品的色泽进行测定,分别用标准黑板和标准白板校正色差仪,测定枣酱的色差[15],见式(1):
W=(ΔL)2+(Δa)2+(Δb)2。(1)
式中:W为色差;ΔL为白度值(L样品-L标准);Δa为红绿值(a样品-a标准);Δb为黄蓝值(b样品-b标准)。
水分:按照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》中的方法测定。
可溶性固形物:采用LH-B55数显糖度计进行测定。
pH值:按照GB 5009.237—2016《食品安全国家标准 食品pH值的测定》中的方法测定。
总酸:按照GB 12456—2021《食品安全国家标准 食品中总酸的测定》中的方法测定。
1.4.6.2 活性成分的测定
准确称取0.5 g不同加工阶段的样品与10.0 mL 60%乙醇充分混合,混合物用超声波处理器处理,超声时间为30 min,超声温度为50 ℃,以8 000 r/min离心10 min,收集上清液,沉淀重复步骤超声、离心2次,合并3次提取液,于4 ℃保存备用[16]。提取液用于总酚、总黄酮和抗氧化能力的测定。
维生素C:按照维生素C试剂盒说明书要求测定。
总酚:总酚含量的测定采用福林酚法,参考文献[17]并作适当修改,取50 μL样品溶液,加入0.5 mL双纯水和125 μL福林酚试剂,混合均匀,于室温下静置6 min,然后加入1.25 mL 7%的Na2CO3溶液,加双纯水稀释至3 mL,振荡均匀后在40 ℃水浴中避光反应90 min,最后用酶标仪在760 nm波长处测定其吸光值。以没食子酸浓度(0.5~15 μg/mL)为横坐标,吸光度为纵坐标,制作标准曲线Y1=0.051 6X1+0.021 3(R2=0.999),根据标准曲线方程计算样品中总酚含量,总酚含量结果以每克样品中所含的没食子酸当量(mg/g)表示。
总黄酮:总黄酮含量的测定采用AlCl3法,参考文献[18]中的方法并作适当修改。取 0.2 mL样品溶液,加入1.5 mL双纯水和90 μL 5%的NaNO2溶液,振荡均匀后于室温下反应6 min,然后加入180 μL 10%的AlCl3·6H2O溶液,静置5 min后加入0.6 mL 1 mol/L的NaOH溶液,最后加双纯水稀释至3 mL,用酶标仪于510 nm处测定其吸光值。以芦丁浓度(1~30 μg/mL)为横坐标,吸光度为纵坐标,制作标准曲线Y2=0.006X2-0.002 1(R2=0.999 1),根据标准曲线方程计算样品中总黄酮含量,总黄酮含量结果以每克样品中所含的芦丁当量(mg/g)表示。
1.4.6.3 体外抗氧化能力的测定
DPPH自由基清除能力:参考Olejar等[19]的方法并略作修改。吸取210 μL DPPH乙醇溶液(100 μmol/L)和50 μL待测样品,振荡混匀后避光反应30 min,在517 nm处测定吸光值。以抗坏血酸浓度(10~50 μg/mL)为横坐标,DPPH自由基清除率为纵坐标,绘制标准曲线Y3=1.574 4X3+1.086 9(R2=0.998 7),DPPH自由基清除能力以mg VC/g表示。DPPH自由基清除能力按式(2)计算:
D1=(1-A1-A2A0)×100%。(2)
式中:D1为DPPH自由基清除率(%);A1为样品组的吸光值(50 μL样品稀释液+210 μL DPPH溶液);A2为空白样品组的吸光值(50 μL无水乙醇+210 μL样品溶液);A0为空白组的吸光值(50 μL 无水乙醇+210 μL DPPH 溶液)。
ABTS阳离子自由基清除能力:参考Shi等[20]的方法并略作修改。配制7 mmol/L的ABTS 溶液,用无水乙醇稀释至吸光值范围为0.7±0.02备用。吸取30 μL样品稀释液和210 μL ABTS溶液,在734 nm处测定吸光值。以抗坏血酸浓度(5~35 μg/mL)为横坐标,ABTS阳离子自由基清除率为纵坐标,绘制标准曲线Y4=1.984 4X4+2.915 3(R2=0.999 2),ABTS阳离子自由基的清除能力以mg VC/g 表示。ABTS 阳离子自由基清除能力按式(3)计算:
D2=(1-A1-A2A0)×100%。(3)
式中:D2为ABTS阳离子自由基清除率(%);A1为样品组的吸光值(30 μL样品稀释液+210 μL ABTS溶液);A2为空白样品组的吸光值(30 μL无水乙醇+210 μL样品稀释液);A0为空白组的吸光值(30 μL无水乙醇+210 μL ABTS溶液)。
羟基自由基清除能力:按照羟基自由基清除能力试剂盒说明书要求测定。
总抗氧化能力:按照总抗氧化能力试剂盒说明书要求测定。
1.4.6.4 微生物指标
菌落总数:按照GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》中的方法测定。
霉菌:按照GB 4789.15—2016《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》中的方法测定。
大肠杆菌:按照GB 4789.3—2016《食品安全国家标准 食品微生物学检验 大肠菌群计数》中的方法测定。
1.5 数据统计分析
采用 SPSS 22.0、Design-Expert 10、Origin 2023和SIMCA 14.1进行数据处理和图像绘制。平行试验3次,试验结果用平均值±标准差表示,P<0.05表示有统计学显著性差异,P<0.01表示有统计学高度显著性差异,P<0.001表示有统计学极显著性差异。
2 结果与分析
2.1 不同加工阶段单因素试验结果
2.1.1 软化阶段单因素试验结果
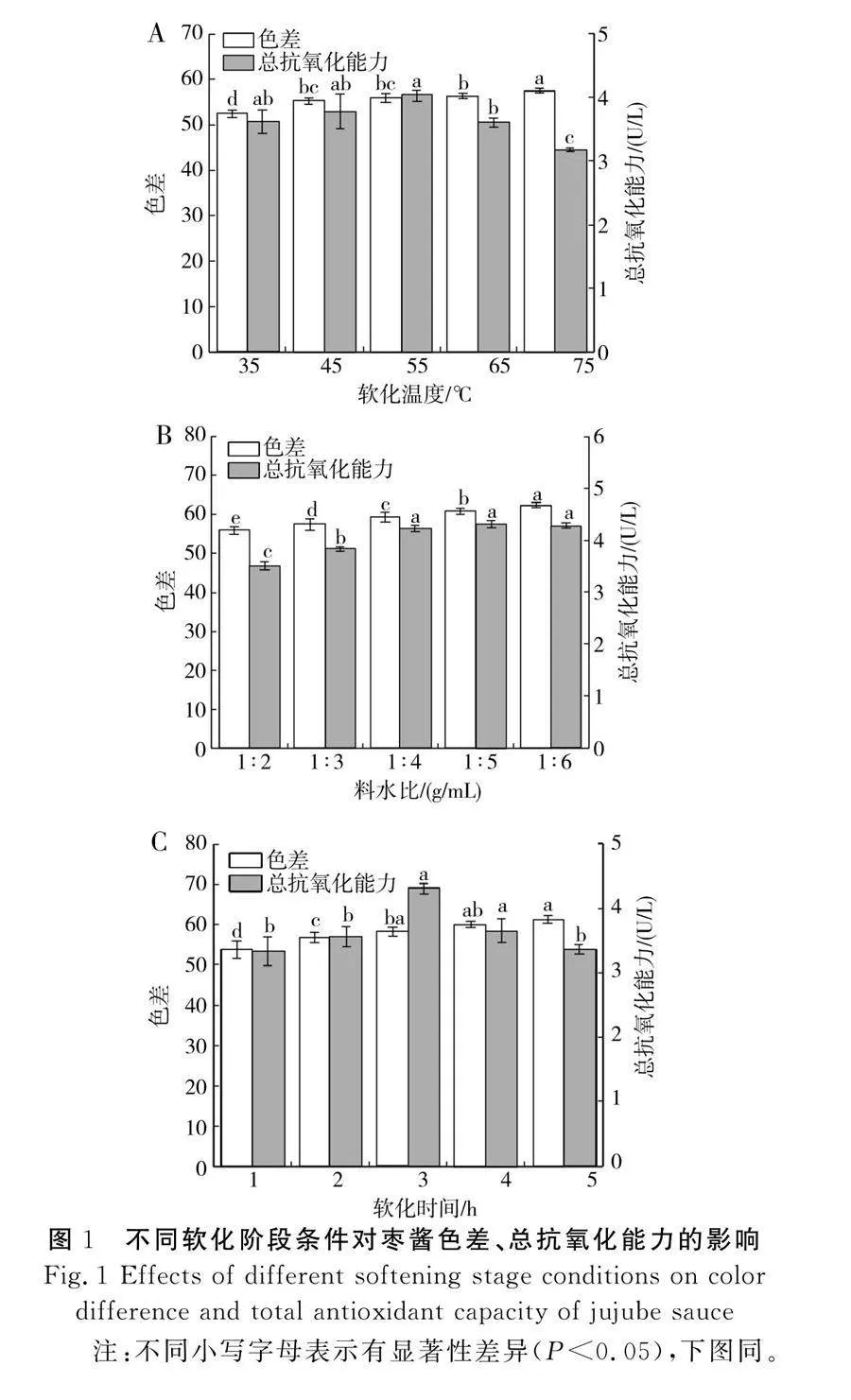
软化阶段单因素试验结果见图1,软化温度对枣酱的软化效果和品质具有非常重要的影响。
由图1中A可知,随着软化温度的升高,枣浆的色差呈现上升趋势,而总抗氧化能力呈现先升高后降低的趋势,当软化温度达到55 ℃时,枣酱的总抗氧化能力达到最大值(4.03 U/L),色差为55.81,较65 ℃和75 ℃时分别提高了12.03%和27.45%,这可能是由于温度过高,枣的组织结构被破坏,导致生物活性物质溶出并丧失,从而造成总抗氧化能力降低[21]。另外,枣酱的颜色随着软化温度的升高而逐渐加深,获得的枣酱具有较重的煮枣味,严重影响了枣酱的品质。由图1中B可知,随着料水比的增加,枣酱的总抗氧化能力呈先升高后平稳的趋势,枣酱颜色逐渐加深。料水比在1∶2~1∶4范围内,总抗氧化能力显著增加,料水比为1∶4时,枣酱的总抗氧化能力为4.22 U/L;随着料水比进一步增大到1∶6时,总抗氧化能力无显著性差异。由图1中C可知,随着软化时间的延长,枣酱的色差呈增长趋势,软化时间越长,枣酱颜色越深。当软化时间为1~3 h时,枣酱的总抗氧化能力呈增长趋势,当软化时间为3 h时,总抗氧化能力达到最大值(4.30 U/L),随着软化时间的继续增加,枣酱的总抗氧化能力呈下降趋势,原因可能是枣随着软化时间的增加而吸水膨胀,与水充分结合后,影响其内部组织状态,导致部分营养物质丧失,使得抗氧化能力有所降低。通过单因素试验确定软化温度55 ℃、料水比1∶4、软化时间3 h为最佳软化阶段条件,并进一步进行浓缩阶段探究。
2.1.2 真空浓缩终点的确定
在温度(80 ℃)、真空度(0.095 MPa)下对枣酱进行真空浓缩,并测定其黏度,通过时间变化探究枣酱浓缩过程中黏度与浓度的关系,获得枣酱浓缩终点,结果见图2。
由图2可知,随着浓缩时间的延长,可溶性固形物含量和黏度均呈现递增趋势,当浓缩时间为40 min时,枣酱的可溶性固形物含量从0 min时的15.35%逐渐上升到30.03%,其对应的黏度从3.65 Pa·s上升至47.04 Pa·s,当浓缩时间为50 min时,可溶性固形物含量为38.21%,其黏度增加了84.05%,呈显著递增趋势。因此,当枣酱的可溶性固形物含量达到(30.03±0.25)%时,枣酱达到浓缩终点。
2.1.3 浓缩阶段单因素试验结果
柠檬酸不仅可以赋予枣酱良好的糖酸比,而且可以在浓缩过程中改变和提高产品的色泽和风味,延长产品的货架期,有利于食品的保存,提高产品的稳定性。由图3中A可知,当柠檬酸添加量在0.2~0.6 g范围内时,枣酱的色差和总抗氧化能力随着柠檬酸添加量的增加逐渐增大;当柠檬酸添加量超过0.6 g时,枣酱的色差和总抗氧化能力上升缓慢并逐渐趋于稳定,这主要是由于枣酱中酸度基本达到平衡,继续添加柠檬酸对色差和总抗氧化能力没有影响。由图3中B可知,随着浓缩温度的升高,色差与总抗氧化能力呈现逐渐上升趋势,且差异显著(P<0.05),这可能是因为温度升高有利于活性成分的形成,从而有效地抑制了枣酱的氧化。当浓缩温度大于70 ℃时,枣酱的颜色逐渐加深,较大程度上影响了枣酱的色泽。通过单因素试验确定柠檬酸添加量0.6 g、浓缩温度70 ℃为最佳浓缩阶段条件,并进一步进行杀菌阶段探究。
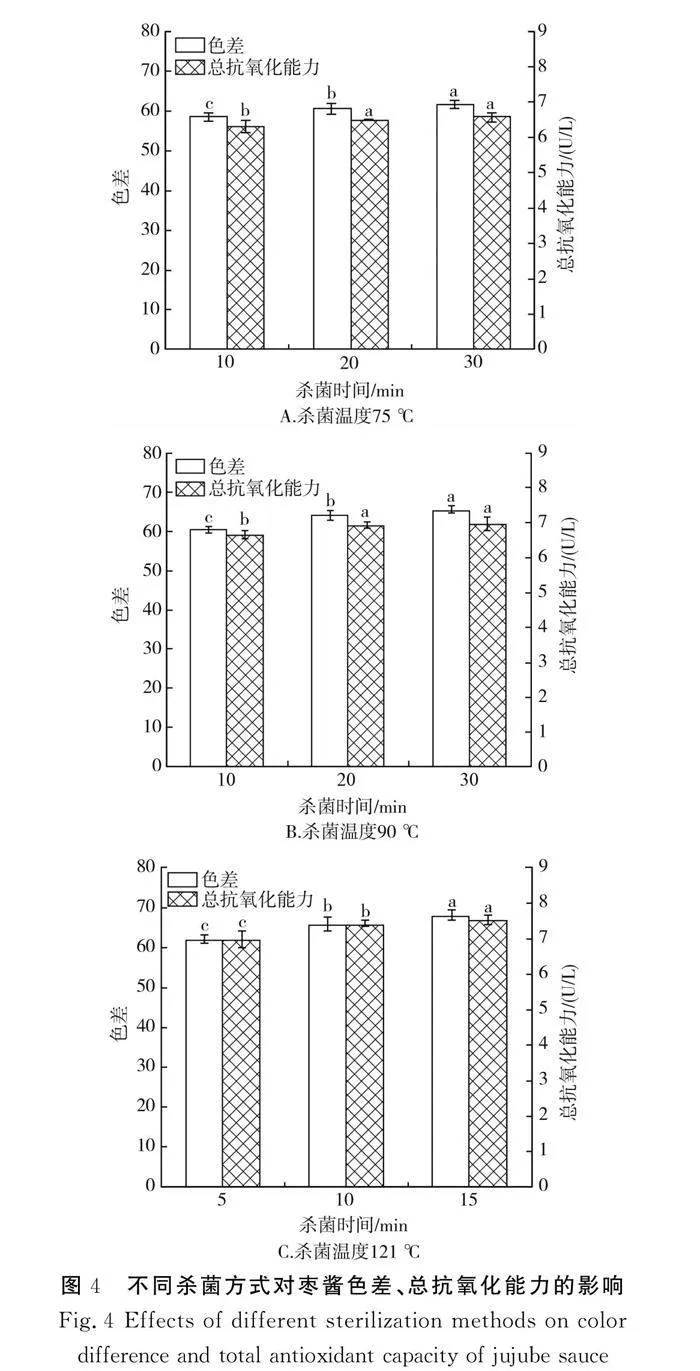
2.1.4 杀菌阶段单因素试验结果
不同杀菌阶段下枣酱单因素试验结果见图4。采用常压75 ℃与90 ℃杀菌时,随着杀菌时间的延长,枣酱的黏度不断增加,酱体组织较均匀,黏稠度适中;采用高压蒸汽杀菌(121 ℃)时,随着杀菌时间的延长,枣酱的黏度降低,酱体变稀,组织稀散[22]。由图4可知,枣酱经高压蒸汽杀菌15 min时,其总抗氧化能力显著强于其他杀菌条件,这可能是因为此条件下枣酱的物理化学反应速率加快,枣酱的氧化程度低,从而使总抗氧化能力上升,但枣酱的颜色严重褐变,较大程度上影响了枣酱的色泽。而75 ℃与90 ℃杀菌处理由于温度较低,对产品的破坏程度较小,在10~20 min时,枣酱的色差和总抗氧化能力呈增长趋势,随着杀菌时间的增加,总抗氧化能力虽略有上升,但差异不显著(P>0.05),在90 ℃杀菌20 min时,枣酱的总抗氧化能力显著大于75 ℃杀菌条件,可能是因为高温导致热敏性活性物质降解或聚合,从而使得总抗氧化能力升高。因此,选择最佳杀菌阶段条件为在杀菌温度90 ℃下杀菌20 min。
2.2 响应面试验结果
2.2.1 响应面试验设计及方差分析
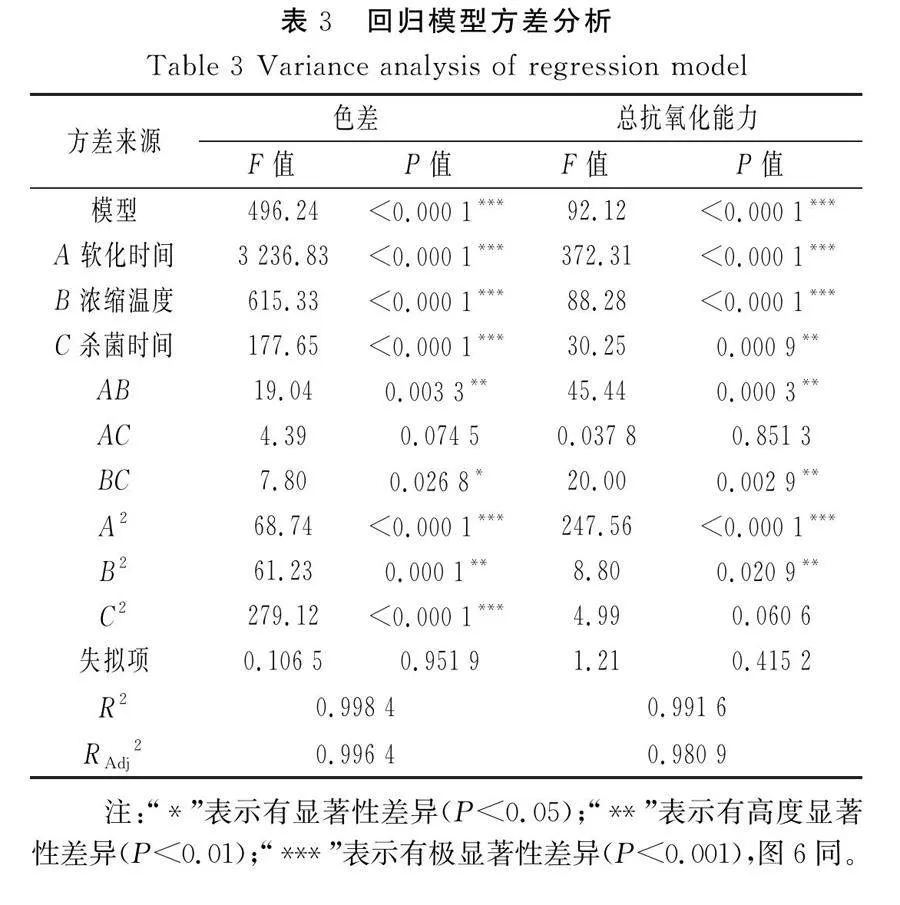
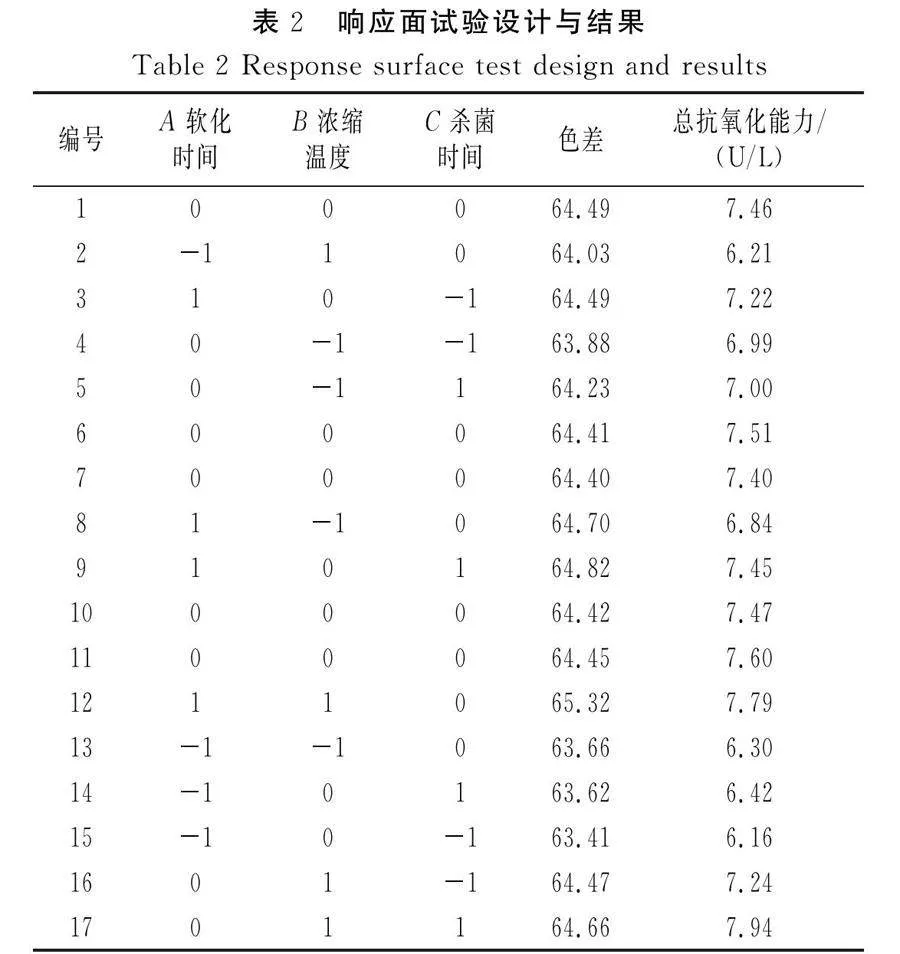
响应面试验设计与结果见表2,回归模型方差分析见表3。
利用Design-Expert 13.0软件对表2中数据进行回归方程拟合,得到各因素(A软化时间、B浓缩温度、C杀菌时间)对色差(YS)和总抗氧化能力(YT)的二次多元回归方程:
YS=64.43+0.576 3A+0.251 3B+0.135 0C+0.062 5AB+0.030 0AC-0.040 0BC-0.115 8A2+0.109 2B2-0.233 2C2;
YT=7.49+0.526 3A+0.256 3B+0.150 0C+0.260 0AB-0.007 5AC+0.172 5BC-0.591 5A2-0.111 5B2-0.084 0C2。
通过分析17组数据,发现色差和抗氧化能力之间并无明显线性关系,仅考察单一响应值过于片面。因此,通过对多个响应值进行考察,全面讨论色差与抗氧化能力的关系,并可有效筛选出具有高抗氧化能力且色差适中的工艺条件。由表3可知,2个因素模型的Plt;0.000 1,说明该模型适合并具有显著性;失拟项的Pgt;0.05,不显著,表明模型的拟合度良好;总决定系数R2和模型调整系数RAdj2均接近1,表明试验值与预测值具有高度的相关性,该模型的相关度较好。由响应面试验结果可知软化时间(A)是对2个响应值影响最大的因素,浓缩温度(B)和杀菌时间(C)的影响相对较小。
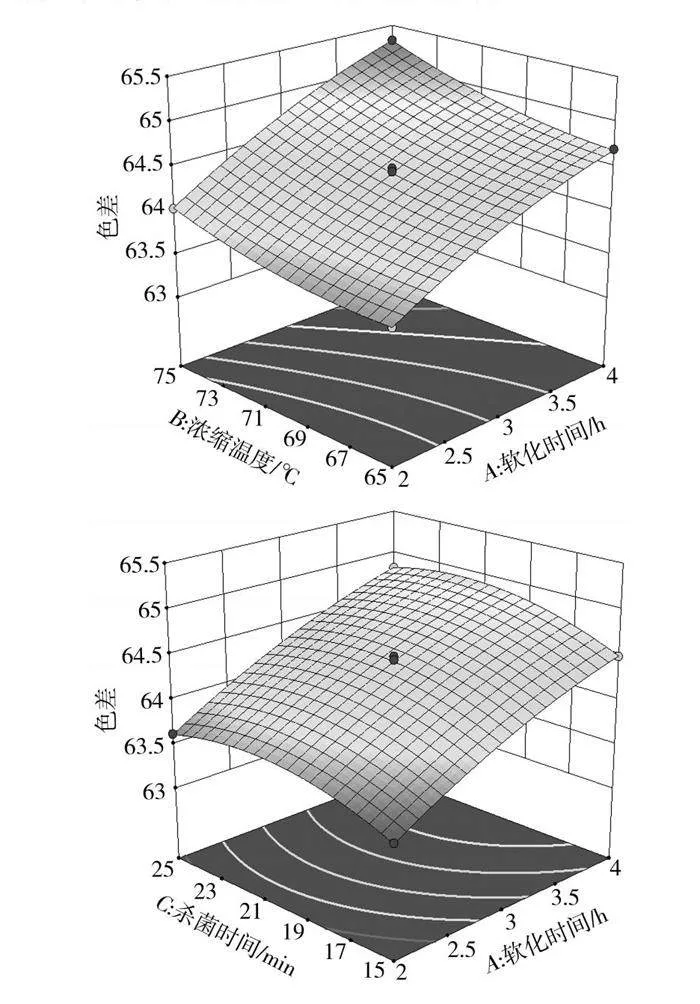
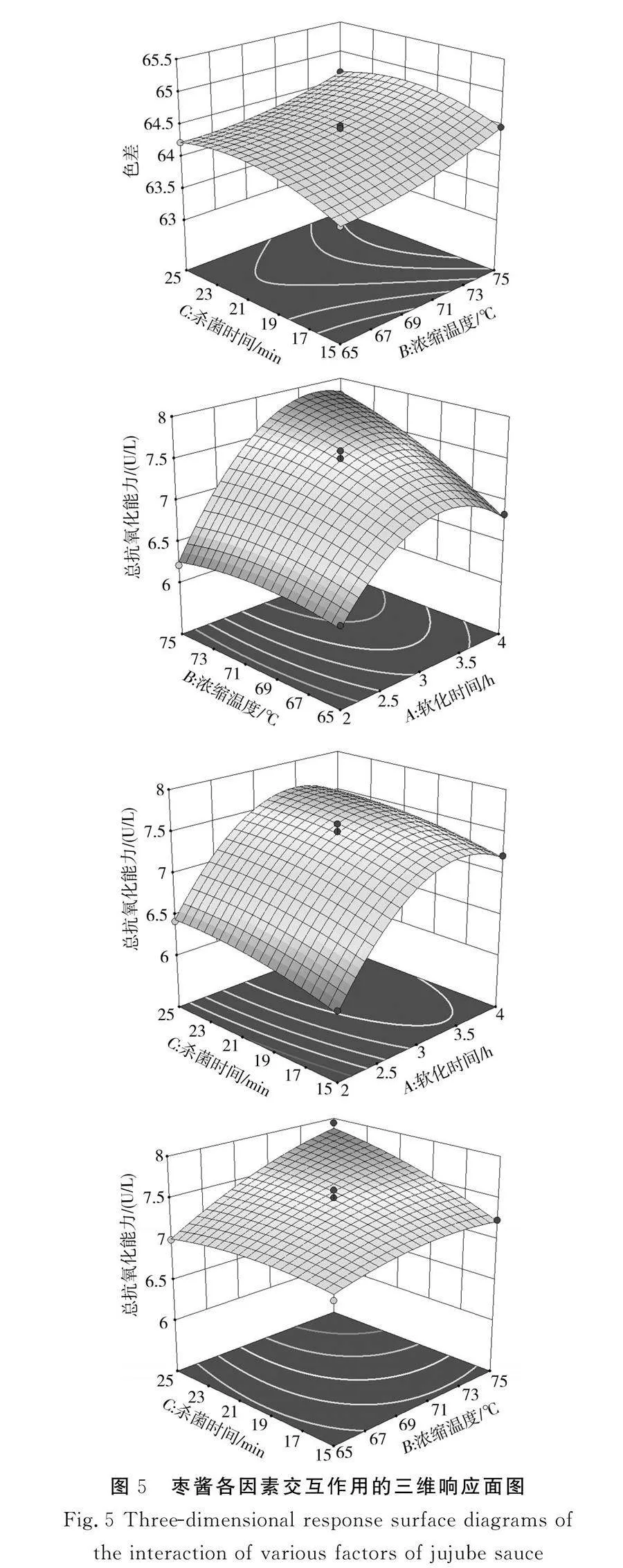
2.2.2 响应面各因素交互作用结果与分析
各因素交互作用的三维响应图见图5。根据回归方程建立响应曲面图,进而分析软化时间、浓缩温度、杀菌时间对枣酱产品品质的影响,响应曲面的陡峭程度说明响应值随影响因素的变化情况,曲面越陡峭说明因素对枣酱产品品质的影响越大。
2.2.3 验证试验结果
高总抗氧化能力是本次枣酱工艺优化研究的主要目标,故本试验提取工艺首先需保证较高的总抗氧化能力,其次应具有适当的色差。根据回归模型分析,通过Design-Expert 13.0软件优化后的最佳工艺条件为软化时间3.14 h、浓缩温度69.72 ℃、杀菌时间17.47 min,在该条件下,理论预计色差为64.36,总抗氧化能力为7.44 U/L,在验证试验中,考虑实际条件,将操作工艺参数调整为软化时间3.15 h、浓缩温度70 ℃、杀菌时间17 min,做3组平行试验。对回归模型最佳工艺优化条件进行验证试验,枣酱的色差为64.19,总抗氧化能力为7.22 U/L,最后测定的色差和总抗氧化能力与预测值无显著性差异,说明本次枣酱工艺优化的方法和模型可行,所建模型适用于枣酱的生产工艺条件。
2.3 理化指标测定结果
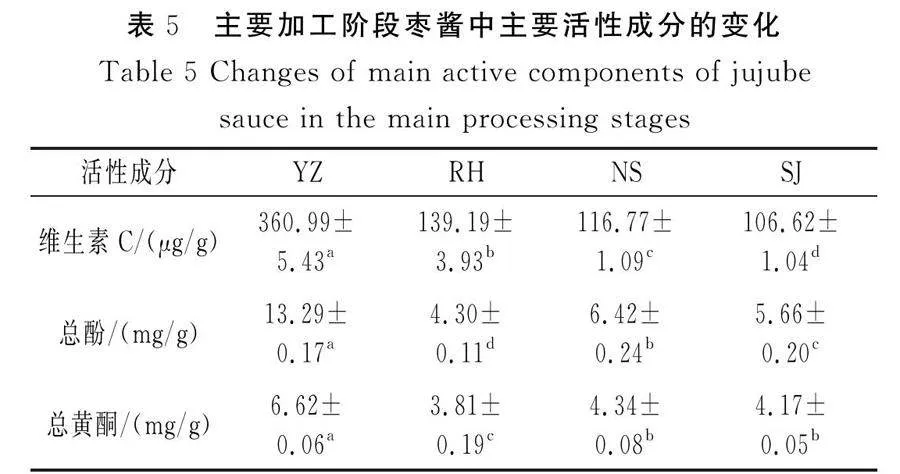
不同加工阶段枣酱中理化指标的变化见表4。
色差是反映加工处理对果蔬品质影响的重要指标。不同加工阶段对枣酱的色差均有影响,与YZ相比,整个加工过程中色差持续增大(P<0.05),SJ的色差显著增加,这是由于在加热过程中枣中醛糖类物质与氨基化合物反应,发生美拉德反应,产生类黑素,导致枣酱褐变,色泽变深。RH的水分含量显著高于其他加工阶段,而NS和SJ的水分含量差异不显著,说明在此加工阶段温度对水分含量的影响较小。可溶性固形物主要指液体或者流体食品中所有溶解于水的化合物的总称,其中包括糖、维生素、矿物质等[23]。YZ的可溶性固形物含量显著高于其他加工阶段的可溶性固形物含量,其主要原因是此过程中残次骏枣以1∶4的比例进行了软化打浆,降低了RH的可溶性固形物含量,而NS和SJ显著高于RH(P<0.05),造成差异的原因主要是经真空浓缩使枣浆脱水,导致可溶性固形物含量升高。与YZ相比,NS和SJ的总酸含量显著提高,这可能是由于柠檬酸的添加使其产生了更多有机酸,丰富了枣酱的酸味,而RH的总酸含量显著降低了87.03%,主要原因是RH在恒定的温度下影响了其酸度。对于pH值,在枣酱加工过程中pH值呈下降趋势,其中YZ的pH值最高,SJ的pH值最低,主要是由于YZ的总酸含量较少,SJ的总酸含量较多。
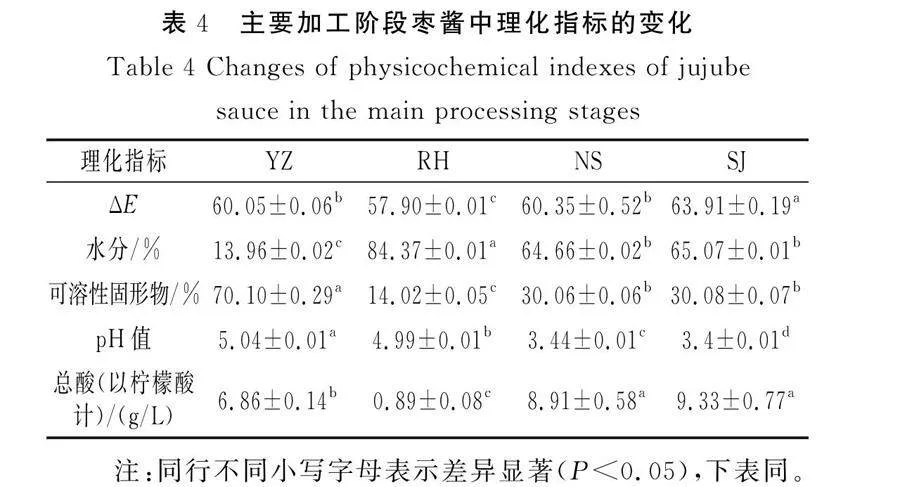
2.4 主要活性成分测定结果
由表5可知,与YZ相比,RH、NS和SJ的维生素C含量显著下降(P<0.05),这是由于维生素C很容易被氧化,而且经过不同加工阶段处理,会对植物的细胞壁结构和分子之间的相互作用造成破坏,导致维生素C含量降低。研究表明,酚类物质在高水分条件下容易被氧化[24],RH的水分含量较高,导致总酚含量下降,而NS和SJ由于高温和压力变化使得酚类化合物分解和分子结构改变,导致总酚含量较低[25]。YZ的总黄酮含量显著高于其他加工阶段的样品,与YZ相比,RH的总黄酮含量下降42.45%,而浓缩与杀菌阶段总黄酮含量差异不显著,这可能是由于在高温无氧条件下,黄酮类物质空间结构发生变化或质构类型倒置,从而引起总黄酮含量发生变化[26]。
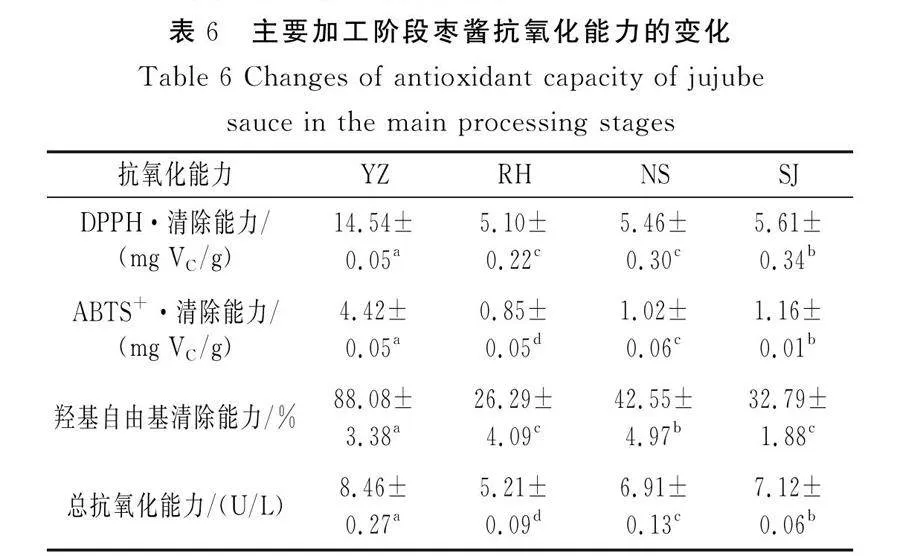
2.5 体外抗氧化能力测定结果
由表6可知,RH、NS、SJ的加工温度和时间各不相同,加工产生的抗氧化物质也有所不同[27]。与YZ相比,RH、NS、SJ的枣酱抗氧化能力显著下降,其中DPPH·清除能力下降61.41%~64.92%,ABTS+·清除能力下降73.75%~80.76%,总抗氧化能力下降15.83%~38.41%。而对于羟基自由基清除能力,NS与RH、SJ相比显著提高22.93%~38.21%,对比YZ显著降低51.69%,这可能是由于加工过程中温度、压力、pH值均易造成组织基质发生改变,导致活性成分发生降解或失活,从而抗氧化能力减弱[28]。
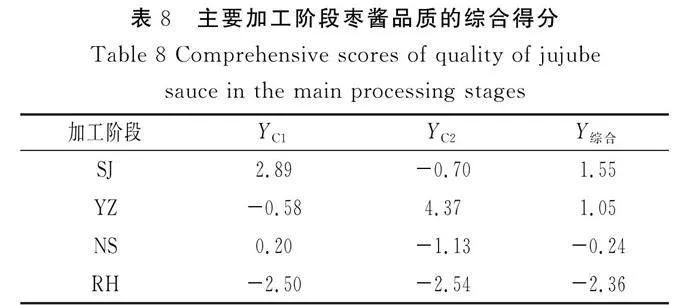
2.6 微生物指标
残次骏枣(YZ)、软化(RH)、浓缩(NS)、杀菌(SJ)阶段样品的微生物指标见表7。
由表7可知,杀菌后的样品较未杀菌的样品各菌落数明显减少,表明杀菌效果较好。在杀菌试验过程中观察到,霉菌和大肠杆菌在计数平板上均无菌落生长,菌落总数<10 CFU/g,表明枣酱产品中此3种菌符合国家标准,可用于后期的生产或销售。
2.7 主要加工阶段枣酱理化指标、活性成分及抗氧化能力的相关性分析
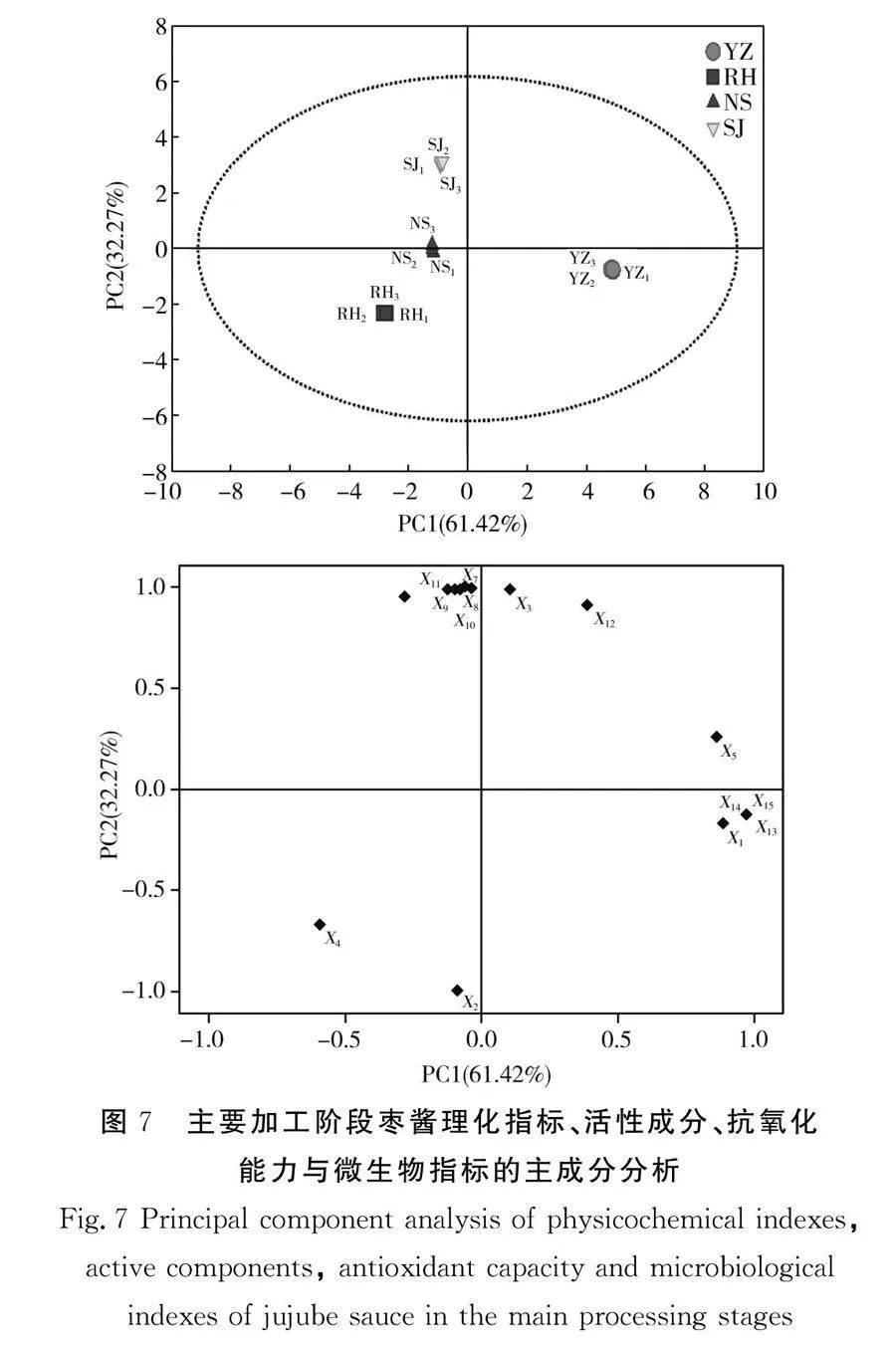
将残次骏枣、软化阶段、浓缩阶段和杀菌阶段样品的理化指标、活性成分和抗氧化能力进行相关性分析,结果见图6。
由图6可知,主要加工阶段枣酱样品的可溶性固形物、维生素C、总酚、总黄酮等的含量与其抗氧化能力之间具有高度正相关关系,说明通过对主要加工阶段进行优化,能够有效保持或提升枣酱样品中的可溶性固形物、维生素C、总酚、总黄酮等的含量,同时也可保证最终枣酱产品抗氧化能力的保持或提升,此方式适用于枣酱的生产加工。
2.8 主要加工阶段枣酱理化指标、活性成分、抗氧化能力和微生物指标的主成分分析
主成分分析通过降维可将多指标转化为少数综合性指标,这些综合性指标能够保留原有指标的大部分信息,且彼此间不相关,该方法比单一评价更快捷、准确,同时可避免性状间的相关性对评价结果造成影响[29]。
食品微生物检测是保障食品安全的重要手段[30],根据食品评价要求,以微生物指标为主要评价指标,采用SIMCA 14.1和SPSS 23.0软件对色泽(X1)、水分(X2)、可溶性固形物(X3)、pH值(X4)、总酸(X5)、维生素C(X6)、总酚(X7)、总黄酮(X8)、DPPH·清除能力(X9)、ABTS+·清除能力(X10)、羟基自由基清除能力(X11)、总抗氧化能力(X12)、菌落总数(X13)、霉菌(X14)、大肠杆菌(X15)进行主成分分析,结果见图7。
由图7可知,第一主成分和第二主成分的贡献率分别为61.42%和32.27%,累计贡献率达到93.69%,即这两个主成分能反映主要加工阶段枣酱的15项品质性状指标的大部分信息,因此可以选取这两个主成分作为不同加工阶段处理枣酱品质性状的综合评价指标。其中,第一主成分中贡献率最大的是菌落总数和大肠杆菌,第二主成分中贡献率最大的是总酚和可溶性固形物。
对各评价指标原始数据进行标准化处理,根据标准化后的各指标与因子载荷矩阵计算主成分1、主成分2的得分,计算公式见式(4)和式(5)。
YC1=0.398X1-0.041X2+0.047 8X3-0.226X4+0.386X5-0.126X6-0.018X7-0.026X8-0.042X9-0.056X10-0.034X11+0.169X12+0.435X13+0.435X14+0.435X15。(4)
YC2=-0.055X1-0.327X2+0.327X3-0.220X4+0.085X5+0.314X6+0.328X7+0.329X8+0.326X9+0.324X10+0.326X11+0.301X12-0.040X13-0.040X14-0.040X15。(5)
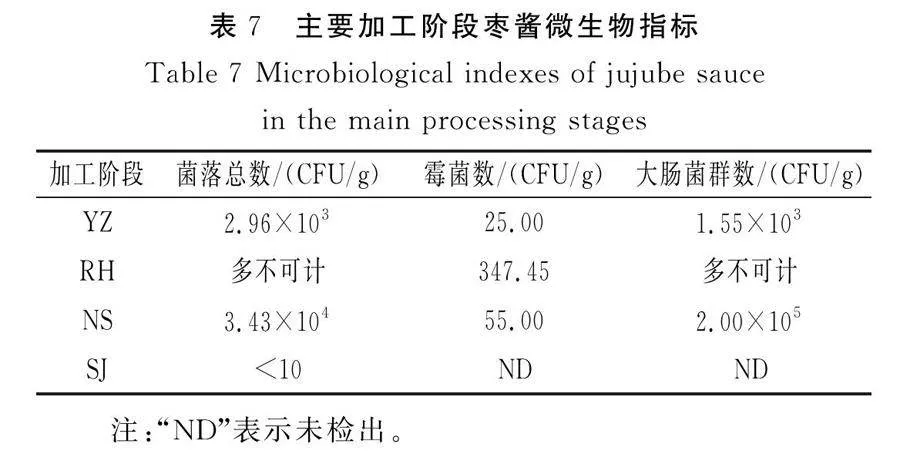
以两个主成分对应的方差相对贡献率为权重,将不同加工阶段的枣酱主成分得分和相应的权重进行线性加权求和,计算主要加工阶段的枣酱的综合得分并排序,结果见表8。
由表8可知,枣酱品质的综合得分最高,其次为残次骏枣、浓缩样品、软化样品,说明不同加工阶段对枣酱的品质有不同的影响,随着加工阶段的进行,最后得到的杀菌成品的综合得分较高,可见该杀菌阶段枣酱的品质最优。
3 结论
本研究通过单因素试验确定影响枣酱加工阶段的3个影响因素,对其进一步进行响应面试验,确定了枣酱的最佳加工阶段条件。试验得到软化阶段的最佳条件为软化温度55 ℃、料水比1∶4(g/mL)、软化时间3.15 h;浓缩阶段的最佳条件为柠檬酸添加量0.6 g和浓缩温度70 ℃;杀菌阶段的最佳条件为杀菌温度90 ℃和杀菌时间17 min。在此条件下,枣酱产品的色差为64.19,总抗氧化能力为7.22 U/L。根据优化后的加工阶段条件进行理化指标、活性成分和抗氧化能力试验,发现枣酱产品可以较好地保留其营养成分和色泽,抗氧化能力较高。经Pearson Correlation Test进行相关性分析,结果表明可溶性固形物含量、维生素C含量、总酚含量、总黄酮含量与抗氧化能力之间具有极显著正相关关系(P<0.001)。主成分分析结果显示第一主成分和第二主成分的贡献率分别为61.42%和32.27%,累计方差贡献率达到93.69%,其中,第一主成分中贡献率最大的是菌落总数和大肠杆菌,第二主成分中贡献率最大的是总酚和可溶性固形物,枣酱的综合评分最高。本研究在提高枣酱产品抗氧化能力的同时保证了其品质,适用于后期枣酱的工业化生产,对开发方便枣酱产品提供了理论参考和数据支持。
参考文献:
[1]SHEN D B, KOU X H, WU C E, et al. Cocktail enzyme-assisted alkaline extraction and identification of jujube peel pigments[J].Food Chemistry,2021,357(26):129747.
[2]LIU M T,WANG J R,WANG L L,et al.The historical and current research progress on jujube—a superfruit for the future[J].Horticulture Research,2020,7(1):119.
[3]DOU J F, KOU X H, WU C E, et al. Recent advances and development of postharvest management research for fresh jujube fruit: a review[J].Scientia Horticulturae,2023,310:111769.
[4]LIN X M, LIU K S, YIN S, et al. A novel pectic polysaccharide of jujube pomace: structural analysis and intracellular antioxidant activities[J].Antioxidants,2020,9(2):127.
[5]ZHAN R, XIA L, SHAO J H, et al. Polysaccharide isolated from Chinese jujube fruit (Zizyphus jujuba cv. Junzao) exerts anti-inflammatory effects through MAPK signaling[J].Journal of Functional Foods,2018,40:461-470.
[6]WU Z, LI H, WANG Y D, et al.Optimization extraction, structural features and antitumor activity of polysaccharides from Z. jujuba cv. Ruoqiangzao seeds[J].International Journal of Biological Macromolecules,2019,135:1151-1161.
[7]JI X L, HOU C Y, GAO Y G, et al. Metagenomic analysis of gut microbiota modulatory effects of jujube (Ziziphus jujuba Mill.) polysaccharides in a colorectal cancer mouse model[J].Food amp; Function,2020,11(1):163-173.
[8]WANG L Y, JING N, LIU X R, et al. Nurturing and modulating gut microbiota with jujube powder to enhance anti-PD-L1 efficiency against murine colon cancer[J].Journal of Functional Foods,2020,64:103647.
[9]BAO T, HAO X, SHISHIR M R I, et al. Cold plasma: an emerging pretreatment technology for the drying of jujube slices[J].Food Chemistry,2021,337:127783.
[10]张新,张瑞,李喜宏,等.多维低糖保健枣酱加工技术研究[J].中国调味品,2018,43(5):98-101,126.
[11]GARCA-MARTNEZ E,RUIZ-DIAZ G,MARTNEZ-MONZ J, et al. Jam manufacture with osmodehydrated fruit[J].Food Research International,2002,35(2-3):301-306.
[12]JAWAHEER B, GOBURDHUN D, RUGGOO A. Effect of processing and storage of guava into jam and juice on the ascorbic acid content[J].Plant Foods for Human Nutrition,2003,58(3):1-12.
[13]NAEEM M M, FAIRULNIZAL M M, NORHAYATI M, et al. The nutritional composition of fruit jams in the Malaysian market[J].Journal of the Saudi Society of Agricultural Sciences,2017,16(1):89-96.
[14]SHINWARI K J, RAO P S. Stability of bioactive compounds in fruit jam and jelly during processing and storage: a review[J].Trends in Food Science amp; Technology,2018,75:181-193.
[15]汪经邦,李沛韵,谢晶,等.不同贮藏温度对暗纹东方鲀水分迁移、质构和色泽的影响及其货架期预测[J].食品与发酵工业,2020,46(6):73-81.
[16]ZHANG Y, SUN X, VIDYARTHI S K, et al. Active components and antioxidant activity of thirty-seven varieties of Chinese jujube fruits (Ziziphus jujuba Mill.)[J].International Journal of Food Properties,2021,24(1):1479-1494.
[17]BERKANI F, SERRALHEIRO M L, DAHMOUNE F, et al. Ultrasound assisted extraction of phenolic compounds from a jujube by-product with valuable bioactivities[J].Processes,2020,8(11):1441.
[18]LIU X M, LIU Y, SHAN C H, et al. Effects of five extraction methods on total content, composition, and stability of flavonoids in jujube[J].Food Chemistry:X,2022,14(18):100287.
[19]OLEJAR K J, FEDRIZZI B, KILMARTIN P A.Influence of harvesting technique and maceration process on aroma and phenolic attributes of Sauvignon blanc wine[J].Food Chemistry,2015,183(19):181-189.
[20]SHI Q Q, ZHANG Z, SU J J, et al. Comparative analysis of pigments, phenolics, and antioxidant activity of Chinese jujube (Ziziphus jujuba Mill.) during fruit development[J].Molecules,2018,23(8):1917.
[21]狄建兵,郝利平,张培宜,等.不同热处理对枣转红及其干制的影响[J].山西农业大学学报(自然科学版),2011,31(6):541-544.
[22]雷免花.低糖红枣黑木耳复合果酱加工工艺研究[D].咸阳:西北农林科技大学,2019.
[23]崔洋,冷思琦,高梓淇,等.不同加工工艺对豆浆理化指标及风味品质的影响[J].食品工业,2022,43(10):47-50.
[24]张杰,党斌,张文刚,等.不同加工方式对体外模拟胃肠消化黑青稞酚类物质含量及抗氧化活性的影响[J].食品科学,2022,43(21):78-86.
[25]SHARMA P, GUJRAL H S, SINGH B. Antioxidant activity of barley as affected by extrusion cooking[J].Food Chemistry,2012,131(4):1406-1413.
[26]冀晓龙.杀菌方式对鲜枣汁品质及抗氧化活性的影响研究[D].咸阳:西北农林科技大学,2014.
[27]张燕飞.热加工过程中紫色茄子花青素的降解机制和抗氧化能力研究[D].南昌:南昌大学,2020.
[28]张碧莹,唐玲,张静,等.不同加工方式对甘薯汁品质及抗氧化活性的影响[J].食品与发酵工业,2017,43(12):157-163.
[29]杨银爱,韩延超,牛犇,等.不同成熟度莲子鲜食品质评价[J].食品科学,2022,43(15):44-51.
[30]邵明娟.食品微生物检验培养基质量控制路径探析[J].食品安全导刊,2023(7):56-58.
收稿日期:2024-04-24
基金项目:“十三五”国家重点研发计划专项(2021YFD1100603)
作者简介:吴喆(1998—),男,硕士研究生,研究方向:食品工程。
*通信作者:刘军(1972—),男,副教授,博士,研究方向:食品功效与产业化。

