微生物发酵法制备核酸酶P1及其性质和应用
摘要:核酸酶P1又名5′-磷酸二酯酶,是酶法制备5′-核苷酸的关键酶类。文章对核酸酶P1的结构、性质、发酵工艺及其在食品领域的应用进行了总结,并对其未来的发展方向进行了展望。
关键词:核酸酶P1;性质;发酵;固定化;应用
中图分类号:TS201.25""""" 文献标志码:A"""" 文章编号:1000-9973(2024)10-0216-05
Preparation of Nuclease P1 by Microbial Fermentation Method and
Its Properties and Application
HU Yang1,2, WAN Ji-lin1, HOU Sha1*, WU Chang-zheng1, TONG Xing3
(1.Guangdong Haitian Innovation Technology Co., Ltd., Foshan 528000, China;
2.Tiandian (Guangdong) Biotechnology Co., Ltd., Foshan 528200, China;
3.Foshan Haitian Flavoring amp; Food Co., Ltd., Foshan 528000, China)
Abstract: Nuclease P1 is also known as 5'-phosphodiesterase. It is the key enzyme for the preparation of 5'-nucleotides by enzymatic method. In this paper, the structure, properties, fermentation technology and application of nuclease P1 in food field are summarized, and its future development direction is prospected.
Key words: nuclease P1; properties; fermentation; immobilization; application
核酸酶P1(EC3.1.30.1)又名5′-磷酸二酯酶,它是一种胞外酶,由Kuninaka等[1]首次从桔青霉中分离鉴定出来。核酸酶P1可作用于RNA和热变性的DNA,从3′-羟基末端连续切割,水解产生5′-核苷酸。5′-核苷酸是一类“超级”食品助鲜剂,它能够与氨基酸类物质发挥协同增效作用,使食物的鲜味增加数倍;还能够起到突出食物的主味、抑制酸味、腥味和苦味等异味的效果,在食品和调味品中广泛应用[2]。5′-核苷酸和核酸酶P1被报道应用于菇类调味品、酵母抽提物和酱油等产品的加工中。柴洋洋等[3]利用核酸酶P1促进茶树菇中呈味核苷酸的释放,制成了茶树菇鲜味剂。徐耀文等[4]用抽提酶和核酸酶分步酶解啤酒废酵母,制备了高核苷酸的酵母抽提物,其中呈味核苷酸(I+G)含量达到10%~12%。周尚庭等[5]在酱油后期生产中添加I+G型酵母抽提物,弥补了无添加酱油中5′-呈味核苷酸的缺失,使无添加酱油的鲜味和口感得到提升。赵悦等[6]在酱油制曲中添加核酸酶进行辅助发酵,研究发现,添加大曲质量0.3%的核酸酶能够提高酱油发酵的原料利用率并改善酱油的风味。核酸酶P1通常被用于酶解核酸等原料生产5′-核苷酸,或直接应用于食品和调味品的深加工中,是一种重要的食品加工用酶。它可通过微生物发酵法制备,也可从植物和动物组织中提取,但从规模化生产和经济性方面考虑,微生物发酵法制备核酸酶P1是目前最具优势的生产途径。本文基于现有的研究对核酸酶P1的结构、性质、生产和应用进行了总结。
1 核酸酶P1的结构及酶学性质
核酸酶P1是一种含锌金属酶,其等电点为4.5,分子量约为44 000 Da,每分子酶中含有17%的糖。Kazuhiko等[7]研究了其一级结构,发现核酸酶P1由270个氨基酸残基组成,且含有较多的疏水性氨基酸。富含疏水性氨基酸使酶具有较优的耐热和抗变形性质。Fujimoto等[8]测定其二级结构,得到核酸酶P1的二级结构中α-螺旋占29%~31%,β-折叠占6%,无规则卷曲占63%。富含α-螺旋结构使核酸酶P1在蛋白变性剂存在的条件下仍能保持稳定。一些学者通过X射线衍射技术研究得到核酸酶P1的活性中心含有3个锌离子,其中单核锌位(Zn3)是酶的催化活性中心,双核锌位(Zn1和Zn2)仅是酶的辅助催化位点,起到维持结构功能的作用[9-10]。
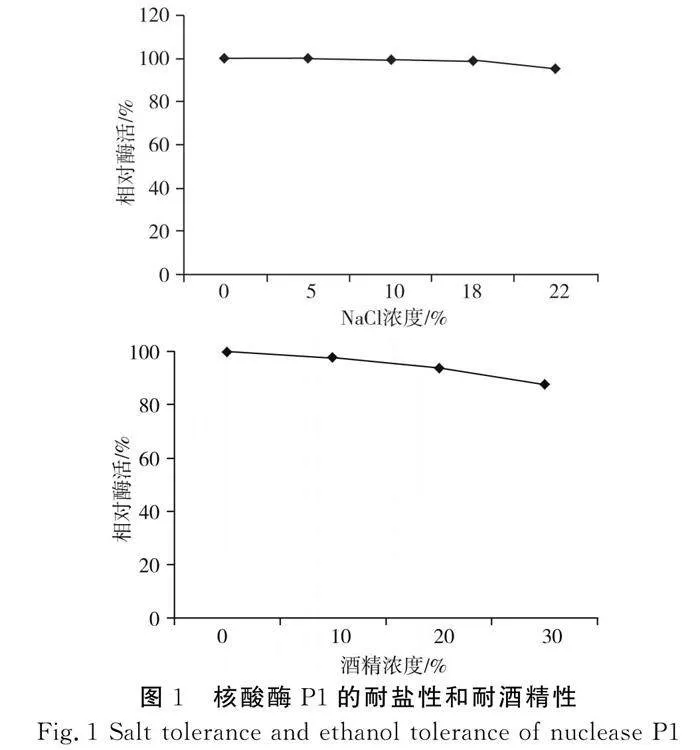
邵帅[11]研究了核酸酶P1的部分酶学性质,发现其最适反应温度为65 ℃,较一般的酶蛋白更高;最适反应pH值为6.0,且在pH值5.5~7.5时酶活力较高;同时还研究了金属离子对核酸酶P1水解酵母RNA的影响,研究表明,在10-6~10-3 mol/L的浓度下,Zn2+和Mn2+对反应有显著的促进作用,低浓度的Fe2+也表现出激活作用;而Fe3+、Pb2+和Cu2+ 3种离子随着浓度的增加均表现出抑制作用增强。除这些常见的酶学性质外,笔者基于扩大核酸酶应用范围考虑,筛选出了耐盐、耐酒精的核酸酶P1,其经5%~22%的NaCl和10%~30%的酒精处理后仍能保留85%以上的相对酶活,此为文献和专利中首次报道,详细的耐盐和耐酒精特性见图1[12]。
Zn2+是核酸酶P1的活性中心金属离子,对于维持核酸酶P1的结构和功能起着重要作用。研究表明,核酸酶P1的Zn2位离子可被CoCl2的Co(Ⅱ)取代,这会对核酸酶P1的催化活性产生影响[13]。Rokugawa等[14]研究锌在核酸酶P1中发挥的作用时发现,当去除酶中的1个锌时,其水解RNA的活性下降了50%,热稳定性也急速下降。Gangadhara等[15]研究了变性剂尿素和盐酸胍对核酸酶P1酶活力的影响,结果表明,在0.05 mol/L盐酸胍或1 mol/L尿素存在的条件下,核酸酶P1的酶活力分别提升了3倍和3.9倍,并且在金属离子Cu2+和Co2+存在的条件下,尿素和盐酸胍仍能不同程度地增强核酸酶P1的活力。
2 核酸酶P1的发酵菌种及其选育
2.1 核酸酶P1的发酵菌种
目前报道的用于发酵生产核酸酶P1的天然菌种主要是桔青霉,其也是GB 2760—2024中规定的用于生产核酸酶的微生物来源。Okado等[16]通过体内和体外的标准毒理学实验评估了桔青霉来源的核酸酶P1在食品中使用是安全的。另外,也有一些通过基因工程构建使核酸酶P1在大肠杆菌、黑曲霉和酵母等中表达和发酵的研究。陈筱仪等[17]以黑曲霉Bdel4为宿主菌,通过将目的基因的拷贝数增加至9个,提高了核酸酶的表达水平,构建出一株适合工业化生产应用的菌株。王亚楠[18]构建了核酸酶的表达载体,将其首次成功在大肠杆菌中表达,获得的重组核酸酶具有优良的热稳定性和高比活力;同时以毕赤酵母为表达载体,也获得了能够高效表达重组核酸酶的菌株。
2.2 核酸酶P1发酵菌种的选育
为获得产酶量高、性状和稳定性好的工业菌种,发酵行业中通常会采用诱变的方式对生产菌种进行选育。诱变育种是通过采用紫外线、微波、X射线等物理方式或氯化锂、烷化剂、亚硝酸等化学诱变剂来改变微生物的遗传物质,再结合高效的筛选方法从大量的突变菌种中选出目标菌种。
缺乏自主知识产权、产酶水平高的工业菌种一直是限制国内核酸酶生产企业发展的一个重要因素,国内的学者和企业在选育高产核酸酶的菌种方面做了很多研究。田利飞等[19]通过土壤初筛,再依次采用不同剂量的紫外线、微波和LiCl进行复合诱变,获得一株产酶水平达360.7 U/mL的突变株,其产酶水平较原始菌株提高了183.3%。近年来,一些新兴的诱变方法如常压室温等离子体(ARTP)和离子束诱变也常用于菌种选育。梁剑光等[20]运用ARTP诱变,结合菌落形态变化、发酵初筛和复筛,筛选获得了3株高产酶菌株,其中CK-3-9的产酶活力达到1 232 U/mL,经中试生产验证达到工业化的要求。李兆飞等[21]先对氯化锂和离子束的最佳诱变条件进行探索,确定氯化锂诱变浓度为1.4%,离子束注量为10 keV、1.5×1015 ions/cm2;而后进行复合诱变,筛选出一株高产、稳定的突变株L-I-4-f,其在摇瓶中的发酵水平达到1 166 U/mL。同时,也有学者研究菌种的高效筛选方法。郑美娟等[22]通过对甲苯胺蓝浓度、RNA浓度等进行优化,建立了甲苯胺蓝-RNA(TB-RNA)平板筛选方法,经验证,核酸酶P1的酶活力与酶解圈的直径呈正相关,可将此方法应用于产核酸酶P1菌株的高效筛选。
3 核酸酶P1的发酵及分离纯化工艺
3.1 核酸酶P1的发酵工艺
目前报道的核酸酶P1的发酵工艺主要有固态发酵法、液态发酵法和固定化细胞培养法。核酸酶的固态发酵主要是以麸皮等农作物为发酵原料,具有设备投资少、发酵周期短、生产成本低等优点。庞宗文等[23]优化了桔青霉固态发酵产核酸酶P1的工艺,获得的最佳条件为以麸皮为发酵基料,料水比采用1∶0.9,补加4%的蔗糖作为碳源,在30 ℃下培养72 h,此条件下发酵酶活力可达到5 783.41 U/g干基。但因固态发酵过程的控制较粗放,生产量难以放大,此方法在工业化生产中较少应用。
液态发酵法主要有分批发酵、连续发酵和补料分批发酵3种类型,其发酵条件易于控制且发酵量大、占地面积小,因此液态发酵法是工业化生产核酸酶P1的主流方法。固定化细胞是利用物理吸附或截留等方法将微生物细胞固定在合适的载体上进行重复使用,进一步提高发酵性能和降低生产成本,一些学者尝试以此技术改进核酸酶P1的发酵生产。Zhao等[24]构建了以活性炭过滤海绵为载体的固定化发酵系统,并在气升式发酵罐中对比了游离细胞发酵、重复分批固定化发酵和半连续固定化发酵下的发酵性能,结果表明,半连续固定化发酵下核酸酶P1的产率达到8.76 U/(mL·h),较重复分批发酵和游离细胞发酵分别提高了33.3%和80.2%。宋威等[25]以聚乙烯醇、明胶和琼脂分别与海藻酸钠混合制成桔青霉固定化发酵的载体,从复合载体的产酶性能、传质和机械性能、重复发酵性能等方面进行评估,确定海藻酸钠和聚乙烯醇以1∶2混合时,固定化细胞的性能最佳;进行了20个周期的发酵,发酵的酶活力稳定保持在468.3~501.4 U/mL之间。
3.2 核酸酶P1液态发酵优化及发酵动力学
采用液态发酵法生产核酸酶P1是目前工业化生产中常用的方法,如何提高核酸酶P1的产量一直是其研究的重点。许多学者围绕发酵培养基的优化、环境参数的调控和发酵动力学开展了很多研究,以期为核酸酶P1的工业化生产提供指导。梁剑光等[26]优化了核酸酶P1的发酵工艺,获得的最佳工艺为接种种龄为24 h的种子、接种量10%、发酵温度26 ℃、初始pH值6.50;进一步研究了影响发酵的因素,发现锌离子在接种前添加最好,其最佳添加量为0.2 g/L;几种表面活性剂都可促进产酶,添加0.2%的吐温-80可使产酶量增加30%;另外,还发现植酸类物质和核酸类物质都对发酵产酶有一定的抑制作用。梁新乐等[27]优化了核酸酶P1发酵培养基的碳源、氮源,筛选出有显著影响的因素为葡萄糖、可溶性淀粉和玉米浆干粉;并进一步通过响应面分析得到三者添加量分别为30.89,42.46,11.60 g/L时发酵的水平更高,预测得到核酸酶P1的产量为1 687.16 U/mL,实际的产量为1 672.6 U/mL,表明优化的参数具有参考价值。喻晨等[28]采用响应面法优化了核酸酶P1的发酵培养基,实验表明,显著影响发酵的几种成分为硫酸锌、酵母粉和复合磷酸盐,最终优化得到的配方为葡萄糖4%、酵母粉0.681%、黄豆饼粉0.45%、玉米浆0.4%、硫酸锌0.042%、氯化钙0.06%、硫酸镁0.06%、磷酸二氢钾0.034%、磷酸氢二钾0.034%,此配方下发酵的酶活力达563 U/mL,较原配方提高了64%。
田吕明等[29]对桔青霉发酵生产核酸酶P1的动力学进行了系统的研究,建立了菌体生长、产物生成和底物消耗的动力学模型。模型显示桔青霉的生长呈典型的S形曲线,产酶与菌体的生长呈部分偶联型;从底物的消耗模型来看,推荐采用分批补料的措施来提高发酵的水平。廖明义等[30]用30 L的发酵罐进行发酵,也建立了几种动力学模型;底物消耗的动力学曲线较好地反映了发酵中氮素的消耗情况,底物氮素随着菌体的生长和产酶快速消耗,而后,随着达到生长稳定期及伴随产酶速率下降,底物的消耗量也逐渐减小,最后趋于稳定。对发酵动力学的研究能够帮助了解核酸酶P1的发酵规律,进而实现对发酵过程的预测和优化,对于指导生产具有重要的意义。
3.3 核酸酶P1的分离纯化
发酵液中含有一定量的杂蛋白、糖类、色素等杂质,为了进一步研究酶学性质和应用,通常需要采用一定的分离纯化手段对酶进行纯化。李明等[31]采用活性炭脱色、硫酸铵分级沉淀、脱盐、凝胶层析等纯化手段处理核酸酶P1的发酵浓缩液,得到了核酸酶P1的纯组分,酶的纯化倍数为8.48倍,比活力达到33 967 U/mg。田淑芳[32]先在70 ℃下加热核酸酶P1的粗酶液10~20 min,以除去热不稳定的蛋白质,然后用30%和85%的硫酸铵进行分级沉淀除去杂蛋白,再经脱盐浓缩、葡聚糖凝胶过滤和离子交换层析得到了核酸酶P1的单一组分。通过多步骤、精细化地纯化可得到酶的纯组分,但这些分离纯化的方式通常处理规模较小、产率较低、成本较高,限制了其在工业中的应用。徐礼鹏等[33]研究了工业化级别的超滤膜在纯化5′-磷酸二酯酶中的应用,优化后选取截留分子量为13 ku的超滤膜,在膜运行温度30 ℃、膜表面流量20 LPM、膜前压0.8 MPa的条件下处理,酶的比活力达到3 018.9 U/mg,较纯化前提升了21.2倍,酶活回收率为80.8%,适合于工业化应用。Chen等[34]采用双水相体系纯化核酸酶P1,对双水相体系的组成和条件进行优化,得出在pH 5.0下使用14%的聚乙二醇3000和20%的鸟苷酸二钠组成的双水相混合液进行萃取,再用超滤膜对上层液相进行分离,即可得到纯化的核酸酶P1,酶回收率达到82.4%,纯化倍数达到3.59倍。双水相萃取的操作条件温和、易于放大和连续操作,适于大规模纯化生物大分子。
4 核酸酶P1的应用
4.1 核酸酶P1游离或固定化水解制备5′-核苷酸
5′-核苷酸在食品、农业和医药等领域用途广泛,酶法生产核苷酸具有绿色、安全、高效等优点,因此利用核酸酶P1酶解是目前生产5′-核苷酸的主要方法。许多学者针对核酸酶P1水解条件的优化、酶的固定化等方面开展研究,以期提高核酸酶P1的水解效率和降低核苷酸的生产成本,从而获得高质量的5′-核苷酸产品。王端好等[35]优化了核酸酶P1水解酵母核糖核酸生产5′-核苷酸的工艺条件,得出在核糖核酸浓度7.5 g/L、水解温度54 ℃、初始pH值5下水解2 h,核糖核酸的水解率最高。采用固定化酶技术将酶固定在合适的载体上,提高酶制剂在应用中的稳定性并能够使其重复利用,这也是实现核苷酸高效生产的一种方法。Huang等[36]合成了活化的多孔聚苯乙烯-二乙烯基苯树脂载体,并用刀豆蛋白A修饰,发现以改性的多孔载体固定化核酸酶P1,其耐酸性、热稳定性、重复使用性和降解效率都显著提高;在经过9批次重复反应后,酶的活性仅损失7%。王天赐[37]优化了核酸酶P1的固定化工艺,选择AER1树脂为固定化载体,最终确定固定化条件为酶量2.2 mL(3 644.6 U/mL)、戊二醛含量0.25%、交联1.5 h、吸附10 h、pH值5.1,此条件下得到的固定化酶的酸碱稳定性和储存稳定性(4 ℃下)大幅提升;同时,还研究了固定化核酸酶P1用于生产5′-核苷酸的最佳工艺,得到在RNA浓度7%、温度70 ℃、pH值6.5下反应4 h,RNA的水解量最高,达到48.3 g/L。何林姣等[38]以氨基树脂固定化核酸酶P1并设计了核苷酸水解的柱连续反应器,在酶和载体的质量比为3∶20、酶浓度为0.8 g/L、酶液pH值为6.0的条件下固定10 h,获得了耐酸性、耐热性提升的固定化核酸酶P1;另外,还提供了一种工业化连续生产5′-核苷酸的方法,使用柱连续反应器,设定反应温度为60 ℃、进料流量为0.75 mL/min,实现了累计120 h产物核苷酸的浓度在30 g/L以上。
4.2 核酸酶P1在食品领域的应用
核酸酶P1能够特异性地水解RNA和热变性的DNA产生5′-核苷酸,在食品中应用,一方面可使酵母、食用菌等的鲜味和风味提升,增加产品的价值;另一方面,水解产生的5′-核苷酸可添加至婴幼儿配方食品和功能保健食品中起到特殊的营养和功效作用。李顺峰等[39]优化了5′-磷酸二酯酶酶解香菇煮菇水的工艺,结果表明,香菇煮菇水经适度酶解后,其中的5′-AMP和5′-GMP含量显著增加,等效鲜味含量(EUC)较酶解前提升了1.59倍。安晶晶等[40]利用5′-磷酸二酯酶酶解香菇打浆料制备的香菇风味基料中5′-IMP和5′-GMP的含量达到30.01 mg/g,较未经酶处理的基料中的鲜味核苷酸含量提高了3倍。酵母中的核糖核酸含量达8%~10%,面包酵母和啤酒酵母可作为开发5′-核苷酸产品的首选,其中啤酒废酵母作为啤酒厂的副产物之一,为充分利用其价值,可将啤酒废酵母中的核糖核酸提取出来,用核酸酶P1水解制备5′-核苷酸,另外,提取后的组分还可用作饲料和培养微生物的氮源。
核苷酸在调节婴幼儿的免疫功能、促进身体生长、提高记忆力和改善肠道菌群等方面起着重要的作用[41]。我国将5′-核苷酸列为食品营养强化剂,允许5′-单磷酸胞苷、5′-单磷酸尿苷、5′-单磷酸腺苷、5′-肌苷酸二钠、5′-鸟苷酸二钠、5′-尿苷酸二钠和5′-胞苷酸二钠几种形式的核苷酸以0.12~0.58 g/kg的使用量添加至婴幼儿配方食品中。高丽芳等[42]通过小鼠实验探讨了外源性5′-核苷酸的保肝作用,发现经口给予5′-核苷酸的受试组较模型对照组小鼠的血清转氨酶活性降低、肝细胞坏死程度减轻,表明外源性5′-核苷酸对小鼠的非酒精性肝损伤具有潜在的保护作用。鲍雷等[43]研究了5′-核苷酸对酒精引起的大鼠结肠功能损伤的修复效果,结果表明,外源性5′-核苷酸能够有效修复酒精导致的大鼠结肠的病理性改变,并能够调节肠道的菌群,从而改善大鼠的结肠损伤。另外,还有一些研究报道了外源性5′-核苷酸具有增强免疫功能、抗感染、促进生长发育、促进细胞增殖和分化等生理功能[44],这些研究推进了核苷酸在保健和功能性食品中的应用。
5 展望
目前,全球核苷酸的市场需求已达万吨级别并持续增加;呈味核苷酸在调味品领域的应用也推进了调味品向多样、高档、健康等方向发展。核酸酶P1能够水解核酸产生具有功能特性和呈味特性的5′-核苷酸,在推进核苷酸工业化和调味品产业发展中起着重要的作用。
在我国,生产核酸酶P1的厂家不多,因缺乏优质的工业化发酵菌株和对发酵机理的研究不够深入,核酸酶P1的生产成本和应用成本都较高。因此,在菌株开发方面,一方面需要进一步研究高通量的筛选方法,从自然界丰富的微生物资源中筛选出无害、发酵性能优越、遗传稳定性好的产核酸酶P1的菌株;另一方面,可借助基因工程技术对菌株代谢和编码核酸酶P1的基因进行深入研究,从分子水平上进行改造,达到提高产酶水平、水解效率和水解特异性等目的。在核酸酶P1的发酵方面,进一步的研究需要着重在产业化水平上,对菌株的生长和产物生成的动力学进行更充分的研究,掌握影响发酵的关键因素,使菌株生长、产物生成和产物的稳定性达到平衡,从而降低核酸酶P1的生产和应用成本。
调味品的开发已由基本调味料和使用味精单质的时代向复合、天然、高度加工的调味品时代发展 [45]。目前已有一些研究将核酸酶P1应用于菇类调味料和酱油产品中,但其应用的范围还不广泛,关于应用的研究还不够深入。许多海产品、肉类原料中也含有丰富的核酸,可加强核酸酶P1在这些原料中的应用研究,开发出具有特殊风味、营养健康的调味品。另外,可基于酶工程技术和生物发酵技术对核酸酶P1直接应用于原料的水解或与酱等产品的发酵同步进行水解的条件和机理进行更充分的研究,使核酸酶P1能够更好地发挥催化作用,提升调味品产品的风味和品质。
参考文献:
[1]KUNINAKA A, KIBI M, YOSHINO H, et al. Studies on 5'-phosphodiesterase in microorganisms. Part II.Properties and application of Penicillium citrinum 5'-phosphodiesterase[J].Agricultural and Biological Chemistry,1961,25(9):693-701.
[2]陈皓,付雪蓉,钮成拓,等.高核糖核酸酵母选育的研究进展[J].中国调味品,2022,47(1):206-210.
[3]柴洋洋,王雨萱,艾凯,等.茶树菇呈味物质的提取及鲜味剂的研究[J].中国调味品,2020,45(3):5-10.
[4]徐耀文,马信亮,王丹萍.利用啤酒废酵母制备高核酸酵母抽提物的应用研究[J].中国调味品,2013,38(7):47-49,53.
[5]周尚庭,李沛,郭辉.谷氨酰胺酶和酵母抽提物对无添加酱油的品质提升研究[J].中国调味品,2016,41(5):45-50.
[6]赵悦,丁婷婷,张梦丽,等.核酸酶在酱油酿造上的应用研究[J].中国调味品,2023,48(8):6-11.
[7]KAZUHIKO M, SUSUMU T, GABOR D, et al. Primary structure of nuclease P1 from Penicillium citrinum[J].The FEBS Journal,1991,200(3):651-661.
[8]FUJIMOTO M, KUNINAKA A, YOSHINO H.Secondary structure of nuclease P1[J].Agricultural and Biological Chemistry,1975,39(11):2145-2148.
[9]VOLBEBA A, LAHM A, SAKIYAMA F, et al.Crystal structure of Penicillium citrinum P1 nuclease at 2.8 A resolution[J].The EMBO Journal,1991,10(7):1607-1618.
[10]ROMIER C, DOMINGUEZ R, LAHM A, et al. Recognition of single-stranded DNA by nuclease P1: high resolution crystal structures of complexes with substrate analogs[J].Proteins,1998,32(4):414-424.
[11]邵帅.5′-磷酸二酯酶产生菌的筛选[D].济南:齐鲁工业大学,2011.
[12]胡洋,侯莎,童星,等.一株产核酸酶P1的橘青霉及其应用:中国,202211270813.3[P].2023-03-21.
[13]郑学仿,郭明,王静云,等.核酸酶P1活性中心金属离子与氯化钴(Ⅱ)相互作用[J].无机化学学报,2003,19(4):377-380.
[14]ROKUGAWA K, FUJIMOTO M, KUNINAKA A, et al. The role of zinc atoms in nuclease P1[J].Agricultural and Biological Chemistry,1980,44(8):1987-1988.
[15]GANGADHARA B N, KUMAR P R, PRAKASH V. Enhancement of nuclease P1 activity in low concentration of denaturants[J].Enzyme and Microbial Technology,2008,43(4-5):336-342.
[16]OKADO N, HASEGAWA K, MIZUHASHI F, et al. Safety evaluation of nuclease P1 from Penicillium citrinum[J].Food and Chemical Toxicology,2016,88:21-31.
[17]陈筱仪,王斌,潘力.18S rDNA介导的桔青霉核酸酶P1表达载体的构建及表达分析[J].现代食品科技,2019,35(6):145-153.
[18]王亚楠.核酸酶P1在大肠杆菌和毕赤酵母中的表达、纯化及活性分析[D].咸阳:西北农林科技大学,2012.
[19]田利飞,涂璇,龚大春,等.高产核酸酶菌株的分离、筛选与诱变育种[J].中国农学通报,2012,28(15):158-162.
[20]梁剑光,顾秋忆,秦修东,等.利用常压室温等离子体(ARTP)诱变选育高产核酸酶P1菌株[J].食品工业科技,2015,36(21):183-186.
[21]李兆飞,姚鹃,余华顺,等.氯化锂-离子束复合诱变核酸酶P1高产菌株研究[J].食品科技,2013,38(12):2-4.
[22]郑美娟,郭金玲,田毅红,等.桔青霉产核酸酶P1菌种高效选育方法研究[J].化学与生物工程,2018,35(2):33-37.
[23]庞宗文,李才,丁猛,等.桔青霉高产核酸酶P1的固态发酵条件研究[J].现代食品科技,2012,28(7):806-809.
[24]ZHAO N, REN H F, LI Z J, et al. Enhancement of nuclease P1 production by Penicillium citrinum YL104 immobilized on activated carbon filter sponge[J].Applied Microbiology amp; Biotechnology,2015,99(3):1145-1153.
[25]宋威,张芹,李欢庆,等.复合载体固定化细胞发酵生产核酸酶P1的对比研究[J].河南工业大学学报:自然科学版,2008,29(3):51-54.
[26]梁剑光,黄鹏,徐正军.桔青霉发酵法生产核酸酶P1工艺条件及影响因素研究[J].中国酿造,2007(11):27-30.
[27]梁新乐,黄莹莹,张虹,等.响应面法优化桔青霉F-5-5核酸酶P1发酵培养基碳氮源[J].核农学报,2011,25(1):57-61.
[28]喻晨,张亚雄,赵劼,等.响应面法优化桔青霉产核酸酶P1培养基[J].食品科学,2011,32(17):283-286.
[29]田吕明,叶炜,赵劫,等.桔青霉摇瓶发酵生产核酸酶P1的动力学研究[J].工业微生物,2012,42(2):38-42.
[30]廖明义,陈雯莉.桔青霉发酵制备核酸酶P1的发酵动力学研究[J].食品工业科技,2012,33(3):180-182.
[31]李明,余华顺,喻晨,等.桔青霉产核酸酶P1酶分离纯化及其酶学性质[J].食品工业科技,2021,42(7):90-94.
[32]田淑芳.核酸酶P1的分离纯化及作为工具酶的研究[D].武汉:武汉科技大学,2020.
[33]徐礼鹏,吴正奇,万端极.超滤膜纯化麦芽根中5′-磷酸二酯酶的工艺研究[J].食品科技,2013,38(5):241-243.
[34]CHEN X C, HUANG X Q, TANG Y W, et al. Efficient purification of nuclease P1 from Penicillium citrinum using polyethylene glycol/disodium guanosine monophosphate aqueous two-phase system[J].Applied Biochemistry and Biotechnology,2021,193(11):3753-3764.
[35]王端好,王震,蒋丹丹.水解核糖核酸生产5′-核苷酸的条件优化及初步鉴定[J].粮食与油脂,2022,35(10):102-105.
[36]HUANG J S, ZHUANG W, WEI C, et al. Concanavalin A induced orientation immobilization of nuclease P1: the effect of lectin agglutination[J].Process Biochemistry,2018,64:160-169.
[37]王天赐.核酸酶P1固定化研究[D].武汉:武汉科技大学,2022.
[38]何林姣,刘晓静,黄金莎,等.氨基树脂表面活化提高固定化核酸酶P1连续催化性能[J].化工学报,2016,67(9):3850-3860.
[39]李顺峰,刘丽娜,王安建,等.香菇煮菇水5′-磷酸二酯酶酶解增鲜技术[J].河南农业科学,2021,50(2):167-172.
[40]安晶晶,王成涛,张小溪,等.5′-磷酸二酯酶强化香菇风味基料中鲜味成分[J].北京工商大学学报:自然科学版,2012,30(3):35-38.
[41]HAWKES J S, GIBSON R A, ROBERTON D, et al. Effect of dietary nucleotide supplementation on growth and immune function in term infants: a randomized controlled trial[J].European Journal of Clinical Nutrition,2006,60(2):254-264.
[42]高丽芳,罗葵,崔淑香.外源性核苷酸对小鼠非酒精性肝损伤保护作用初探[J].首都医科大学学报,2016,37(3):356-359.
[43]鲍雷,肖杨,蔡夏夏,等.5′-核苷酸对慢性酒精中毒诱导大鼠结肠功能损伤的影响[J].食品工业科技,2017,38(14):299-303.
[44]DING T, SONG G, LIU X R, et al. Nucleotides as optimal candidates for essential nutrients in living organisms: a review[J].Journal of Functional Foods,2021,82:1-8.
[45]沈浥.调味品中呈味核苷酸的研究进展和我国标准化现状[J].中国调味品,2017,42(1):177-180.
收稿日期:2024-03-17
基金项目:佛山市博士后科研基金项目(A-1906)
作者简介:胡洋(1995—),女,硕士,研究方向:食品生物发酵。
*通信作者:侯莎(1986—),女,高级工程师,博士后,研究方向:食品生物发酵。

