复合香辛料精油对大黄鱼中生物胺影响研究



摘要:目的:通过对天然香辛料精油复合有效控制大黄鱼中生物胺的累积。方法:首先以0.1%、0.5%、1.0% 3种浓度对大蒜、姜、肉桂、迷迭香、丁香、葱精油初筛得出较优条件,再以初筛各香辛料精油的较优添加量为梯度中心进行单因素实验确定4种香辛料精油的适配浓度,最后以组胺、腐胺、尸胺的相对含量均值为响应值进行响应面组合实验。结果:得出最优配比为肉桂精油0.493%、迷迭香精油0.058%、丁香精油0.060%、大蒜精油0.937%,此时相对含量均值预测值为62.289%。结论:实验证明了大黄鱼中添加复合香辛料精油可以有效抑制生物胺的产生,延缓大黄鱼的品质劣变。
关键词:生物胺;香辛料;水产品
中图分类号:TS225.3 """""文献标志码:A """"文章编号:1000-9973(2024)10-0014-05
Study on Effect of Compound Spice Essential Oils on Biogenic
Amines in Pseudosciaena crocea
LUAN Li-ning1, YANG Cong-fa1,2*, LYU Fu-yun3
(1.College of Ocean Food and Biological Engineering, Jiangsu Ocean University, Lianyungang 222005,
China; 2.Institute of Marine Resources Development in Jiangsu Province, Lianyungang 222000,
China; 3.Lianyungang Comprehensive Inspection and Testing Center for Quality and
Technology, Lianyungang 222005, China)
Abstract: Objective: Effectively control the accumulation of biogenic amines in Pseudosciaena crocea by compounding natural spice essential oils. Methods: Firstly, three concentrations of 0.1%, 0.5% and 1.0% are used to preliminarily screen the essential oils of garlic, ginger, cinnamon, rosemary, clove and onion to obtain the optimal conditions. Secondly, single factor experiment is conducted with the optimal addition amount of each spice essential oil as the gradient center to determine the appropriate concentrations of the four spice essential oils. Finally, response surface combination experiment is conducted with the average relative content of histamine, putrescine and cadaverine as the response values. Results: The optimal ratio is obtained to be 0.493% cinnamon essential oil, 0.058%" rosemary essential oil, 0.060% clove essential oil and 0.937% garlic essential oil. The predicted mean value of relative content at this time is 62.289%. Conclusion: In this experiment, it is proven that adding compound spice essential oils into Pseudosciaena crocea can effectively inhibit the production of biogenic amines and delay the quality deterioration of Pseudosciaena crocea.
Key words: biognic amines; spice; aquatic products
生物胺(BAs)是具有脂肪族、芳香族或杂环结构的含氮小分子化合物[1],由各自的游离氨基酸前体脱羧而成[2]。常见的生物胺有酪胺、组胺、腐胺、尸胺[3],这些生物胺在细胞生长分化和基因调控中起关键作用,是激素[4]、生物碱[5]、核酸[6]或蛋白质[7]合成的前体物质。然而当生物胺摄入过量时会出现中毒症状[8],严重时甚至危害人的生命健康。
香辛料是一类含有辛辣成分、有机酸和刺激性挥发油的天然植物材料,安全、无毒、可降解,具有特殊的香味,有抑菌、防腐和抗氧化[9]的功能。研究表明,添加香辛料或其提取物可以减少肉制品中生物胺的形成,因此葱、生姜、大蒜、丁香、肉桂、迷迭香等[10]香辛料被广泛用于原料和产品的保鲜。到目前为止,大多研究都集中在香辛料提取物在体外和体内的抗氧化和抗菌性能[11]方面,对水产品中生物胺的天然植物提取物抑制作用的研究较少。为此,本文通过筛选几种常见香辛料,再对其精油提取物进行复配,研究其对水产品中生物胺组分的抑制效果,从而得出一种能够有效抑制水产品中生物胺的天然香辛料精油复合配方。
1 材料和方法
1.1 仪器和试剂
主要仪器:S433D氨基酸分析仪 赛卡姆(北京)科学仪器有限公司;BSP-250生化培养箱 上海博迅医疗生物仪器股份有限公司;Kjeltec 8100自动凯氏定氮仪 福斯华(北京)科贸有限公司;Multi Reax 545-10000-05-1多点涡旋振荡器 海道尔夫仪器设备(上海)有限公司。
主要试剂:5-磺基水杨酸(以下简称磺基水杨酸,分析纯):美国默克公司;乙腈(色谱纯):北京迈瑞达科技有限公司;羧甲基纤维素钠(食品级)、柠檬酸、硼酸、EDTA、乙酸钾、乙酸(均为分析纯):广东光华科技股份有限公司;茚三酮(分析纯):赛卡姆(北京)科学仪器有限公司;香辛料精油:天津市春合科技开发有限公司。
标准品:组胺盐酸盐标准品(纯度99%)、腐胺盐酸盐标准品(纯度95%):国药集团化学试剂有限公司;酪胺盐酸盐标准品(纯度98%)、尸胺盐酸盐标准品(纯度98%)、章鱼胺盐酸盐标准品(纯度98%)、尸胺盐酸盐标准品(纯度98%):上海阿拉丁生化科技股份有限公司;精胺盐酸盐标准品(纯度99.5%):日本Sigma公司;亚精胺盐酸盐标准品(纯度98%):上海麦克林生化科技股份有限公司。
1.2 实验方法
1.2.1 样品预处理
选用的样品大黄鱼购于连云港市家得福超市。通过HM100刀式研磨仪将其打成泥状,混合样品,每份20 g分装于无菌袋内,置于-18 ℃低温保存箱内。
1.2.2 实验步骤
样品制备:准确称取2 g样品,加入5 mL 10%磺基水杨酸振荡。在脂肪含量较高的样品中加入与水杨酸等体积的正己烷振荡脱脂后[12],静置分层。取水相10 000 r/min冷冻离心15 min,通过0.22 μm滤膜后上机检测。
香辛料初筛:香辛料精油用乳化剂羧甲基纤维素钠[13]溶解于超纯水中,按0.1%、0.5%、1.0%(质量比)加入样品中,混匀后于25 ℃常温贮藏24 h检测生物胺含量。
单因素分析:筛选后的4种香辛料以初筛最优浓度为梯度中心进行单因素实验,步骤参考初筛流程。
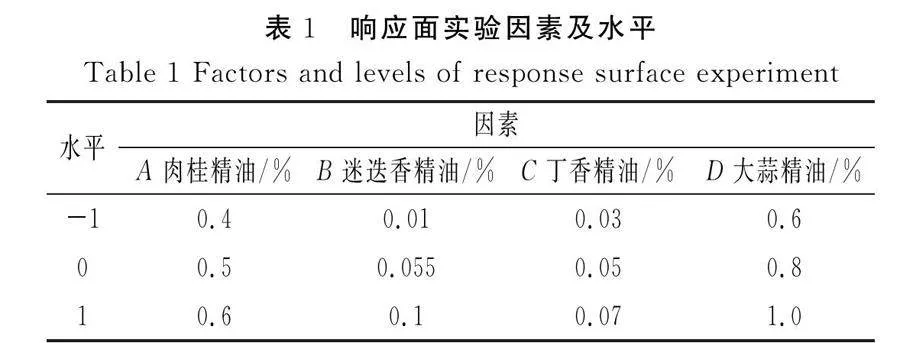
响应面实验设计:利用Box-Behnken实验设计,以4种香辛料精油的不同添加量为考察因素,以与空白对照品各生物胺组分含量的相对百分比均值作为响应值,建立回归模型分析得到最佳配比质量分数(添加量)。
响应面实验因素及水平见表1。
1.2.3 试剂配制
生物胺标准溶液的配制参考GB 5009.208—2016《食品安全国家标准 食品中生物胺的测定》[14]。
1.2.4 色谱检测条件
色谱柱:S-433D钾系统 LCA K17/K柱(4.6 mm×30 mm,5 μm),赛卡姆(北京)科学仪器有限公司。
流动相:柠檬酸钾液A1,柠檬酸钾液B1,再生液:KOH,清洗液:40%的甲醇水溶液,柱温:70 ℃。
衍生反应系统:衍生液为茚三酮溶液;衍生剂茚三酮溶液衍生从0 min开始到38 min衍生终止,38 min后为清洗液的冲洗时间;反应过程控制反应温度为130 ℃;流动相流速为0.5 mL/min。检测器:可见光检测器,检测波长570 nm。
2 结果与分析
2.1 香辛料筛选
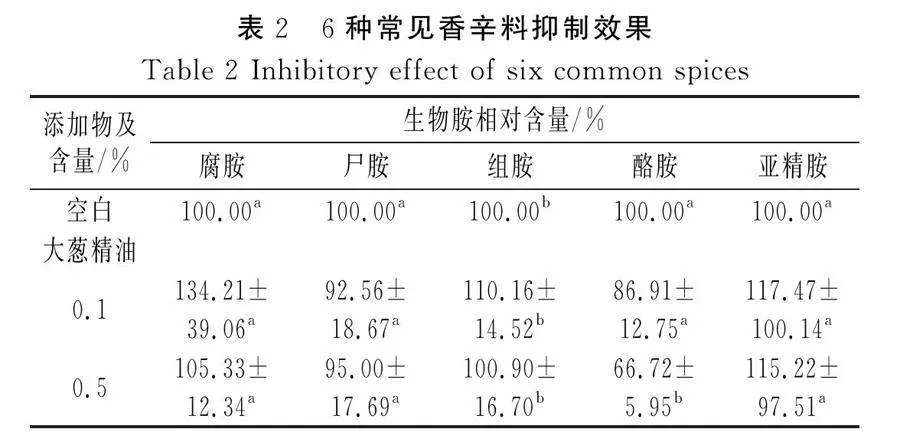
为研究香辛料对大黄鱼中生物胺的影响,添加不同浓度(0.1%、0.5%、1.0%)的大葱、迷迭香、生姜、大蒜、肉桂和丁香6种香辛料的精油提取物,6种常见香辛料抑制效果见表2。
由表2可知,用大蒜精油处理的样品对生物胺的抑制作用最明显。腐胺、尸胺、组胺、酪胺和亚精胺相对含量分别降低了11.2%、18.4%、11.7%、30.9%和17.4%(抑制百分比值由表2中的每种生物胺的相对含量计算)。大蒜精油对生物胺产生的抑制作用与其浓度成比例增加。与大蒜精油相比,测试的其他香辛料精油在降低酪胺含量方面均具有明显效果。
实验发现0.5%肉桂精油对降低腐胺含量效果最优,同时0.5%的肉桂精油相较其他浓度对生物胺的抑制效果较好,故将0.5%作为肉桂浓度单因素梯度中心。0.1%丁香精油对降低组胺含量效果较好,同时0.1%的丁香精油相较其他浓度抑制效果较好,故将0.1%作为丁香精油浓度单因素梯度中心。迷迭香精油对生物胺的抑制效果在初筛的3种浓度中未体现出,但其浓度越高对生物胺组分的促进效果越明显,在之后的单因素实验中会对0.1%以下的浓度进行探究,进一步研究迷迭香精油低浓度对生物胺的影响作用。本次初筛中3种浓度的姜精油对生物胺的抑制效果差异不大,可在下一步的单因素实验中进一步研究其他浓度的影响。目前国内对生物胺的限量标准只有组胺,欧洲国家对食品中酪胺含量同样有限制标准,但几种香辛料精油对酪胺均有明显的抑制效果且几种香辛料精油的抑制作用差异不大,因此在本次实验中对酪胺的抑制作用不纳入考察范围,在水产品的贮藏周期中腐胺和尸胺与产品腐败变质呈现正相关,但腐胺和尸胺的含量随着腐败变质剧烈变化程度远超其他组分的含量。综上所述,本次实验将考察对象确定为组胺、腐胺、尸胺3种组分的相对含量均值,均值越小表明抑制效果越好。
2.2 单因素实验
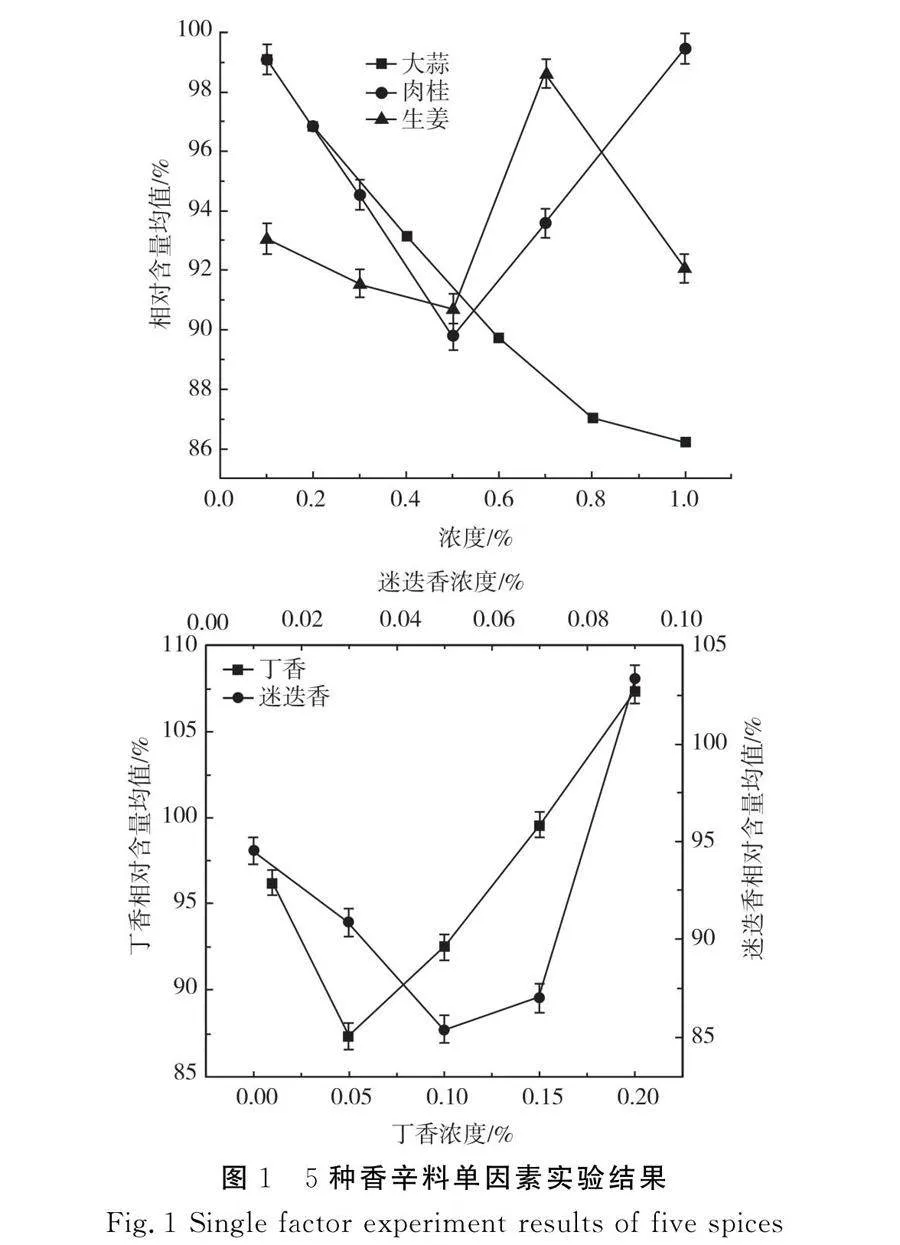
5种香辛料精油不同添加量对响应值的影响见图1。
由图1可知,大蒜精油添加量与响应值呈负相关,添加量小于0.8%的变化值趋近于成比例变化,但添加量由0.8%增大到1.0%时其响应值变化较小,表明在大蒜精油添加量达到0.8%时已经可以获得较好的抑制效果,考虑到大蒜精油的风味因素,故将0.8%作为大蒜精油因素的零水平值,肉桂精油和丁香精油分别在0.5%和0.05%时出现明显转折,因此将这两个浓度确定为各自零水平值。生姜精油在梯度内出现两次转折,转折点前后变化幅度明显不同,具体的机制不明,同时生姜精油的抑制效果相对于其他香辛料精油较弱并且生姜精油对风味的影响较大,综合考虑,不将生姜精油纳入复配范围。本次实验的迷迭香精油在选取的梯度中出现转折,但由0.05%增加至0.07%的变化幅度较小,推测转折点应在两者之间,故将0.055%作为迷迭香精油的零水平值。
2.3 响应面组合实验
实验选取肉桂精油(A)、迷迭香精油(B)、丁香精油(C)、大蒜精油(D)4个因素为变量,使用Design-Expert 13.0软件,进行四因素三水平实验,研究对相对含量均值(Y)的影响。响应面实验设计及结果见表3。
2.3.1 回归模型和显著性分析
利用软件 Design-Expert 13.0进行多元线性回归分析,建立相对含量均值(Y)对肉桂精油(A)、迷迭香精油(B)、丁香精油(C)、大蒜精油(D)的二次回归方程:Y=62.69-0.273A-0.361B-1.43C-1.96D-0.848AB+2.72AC+0.351AD+0.556BC-0.205BD-0.322CD+3.06A2+4.06B2+2.48C2+1.57D2。
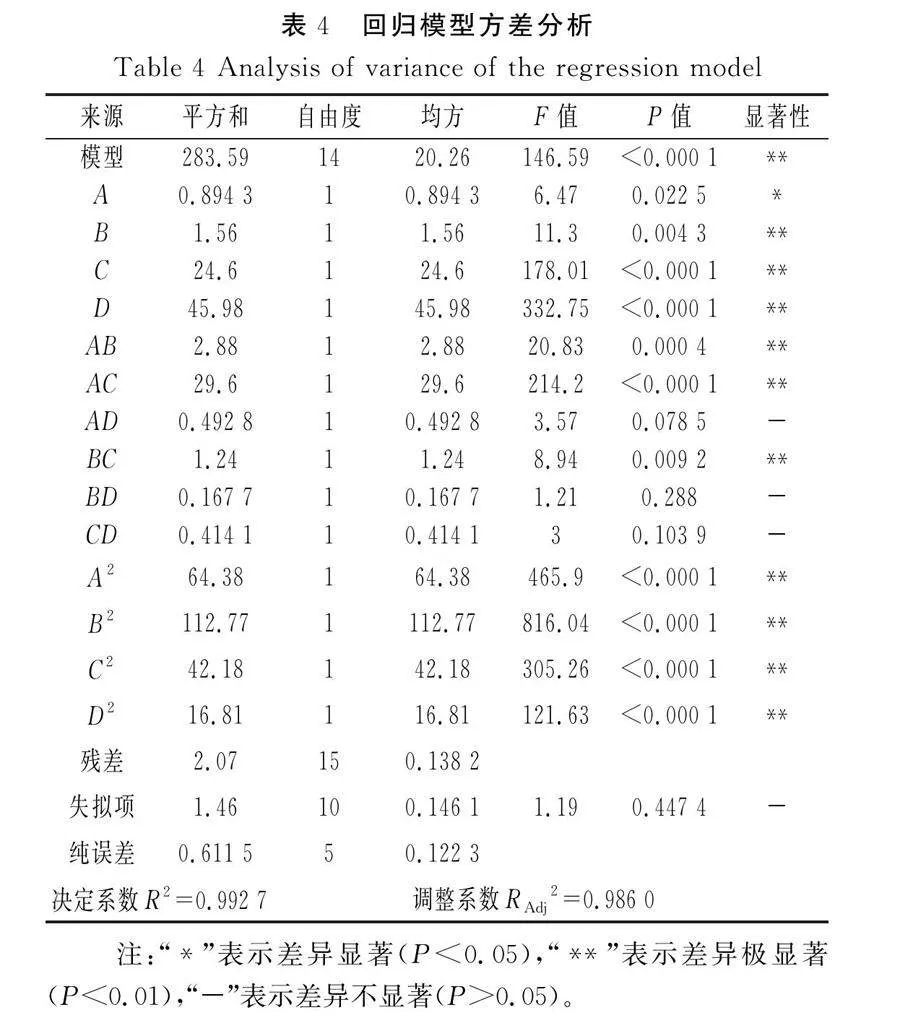
回归模型方差分析结果见表4。
由表4可知,模型的F=146.59(P<0.01),达到极显著,表明模型有意义[15];失拟项的F=1.19,P=0.447 4>0.05,失拟项不显著,说明不确定因素的影响较小[16],能够真实拟合[17]。模型的决定系数R2=0.992 7,说明回归模型效果较好[18];调整系数RAdj2=0.986 0,说明模型的可信度较高[19]。其中B、C、D的影响均极显著(P<0.01),A的影响显著(P<0.05),二次项的影响均极显著(P<0.01),交互项除AD、BD、CD的影响不显著外其余均极显著(P<0.01),可知大蒜精油与其他香辛料精油的交互作用较弱。根据F值可知4种香辛料精油对抑制效果的顺序为大蒜精油(D)>丁香精油(C)>迷迭香精油(B)>肉桂精油(A),这也与初筛及单因素实验结果一致。根据软件预测出最佳配比为肉桂精油0.493%、迷迭香精油0.058%、丁香精油0.06%、大蒜精油0.937%,此时相对含量均值预测值为62.289%。
2.3.2 响应曲面和等高线图分析
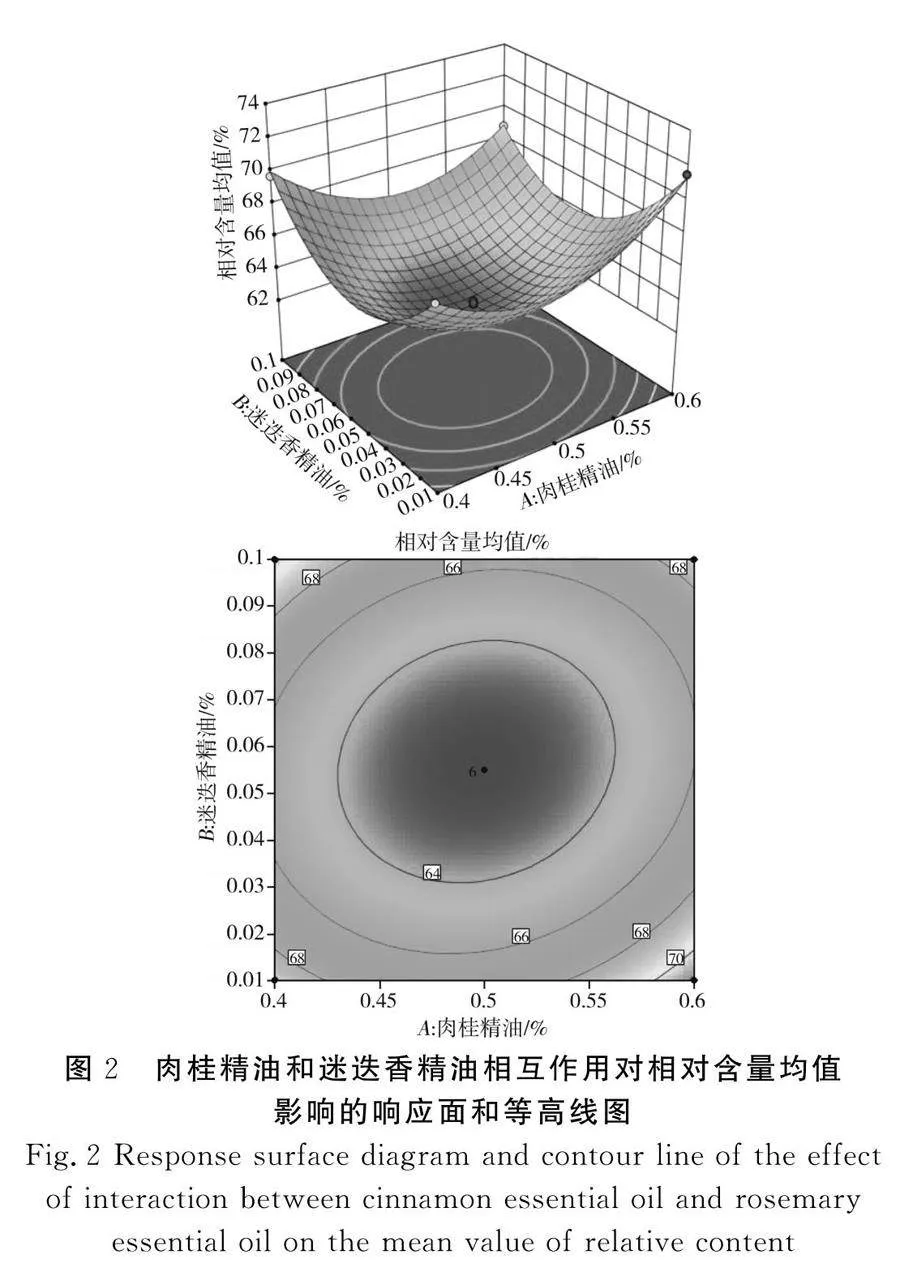
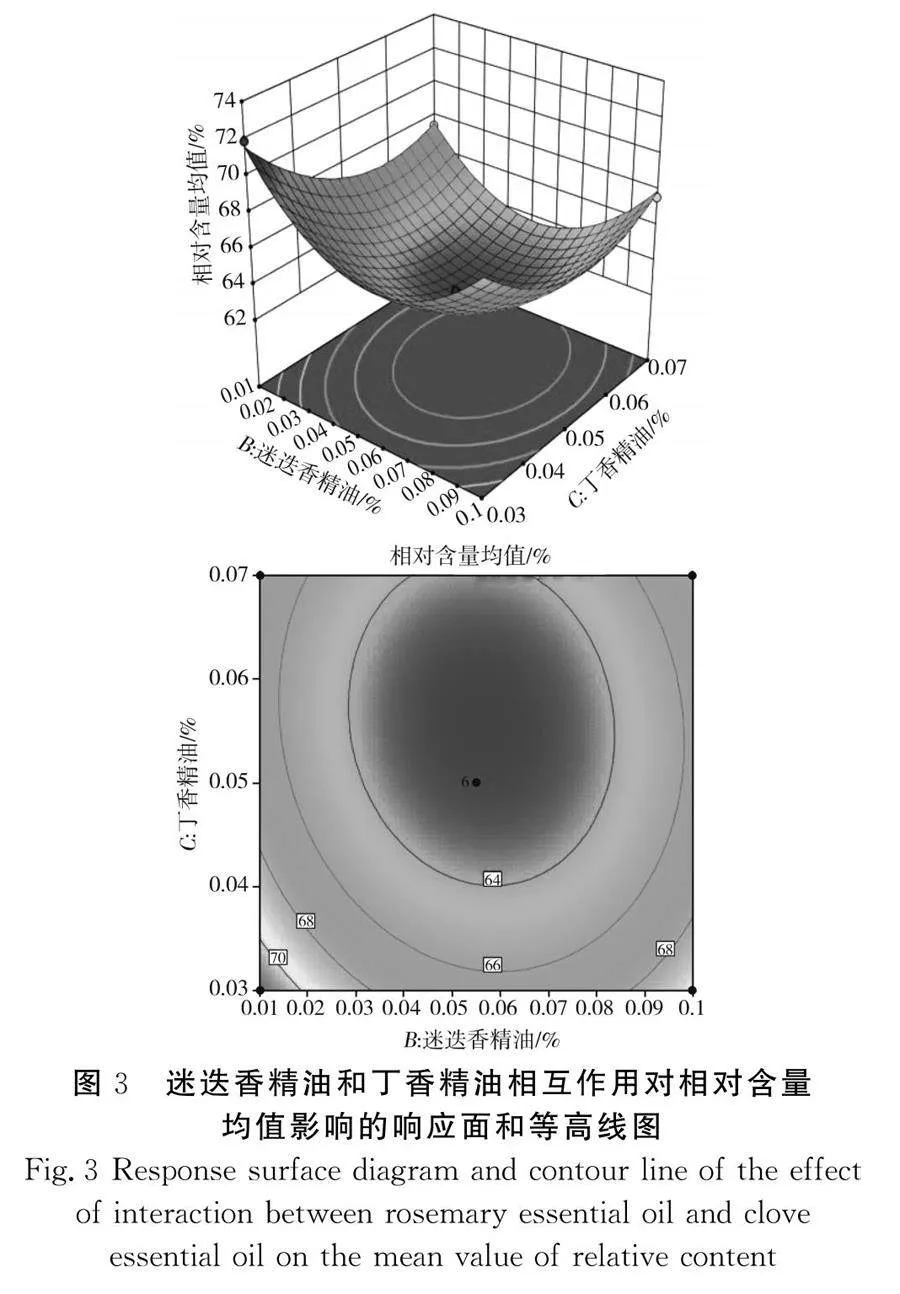
响应面实验结果见图2~图4。
本次实验获得的曲面弯曲度大,说明几种香辛料精油对响应值的影响较大,等高线图趋近椭圆形说明影响因素之间的交互作用显著[20],这也与回归模型分析结果吻合。
3 结论
初筛实验表明几种天然香辛料对酪胺组分均有明显抑制作用,大葱对组胺、腐胺、尸胺、亚精胺有不同程度的促进作用,其他产物在适当浓度下对生物胺组分均有抑制效果,单因素实验结果表明,选中的5种香辛料对组胺、腐胺、尸胺均有一定的抑制效果。响应面实验得到由4种香辛料组合的最优浓度配比为肉桂精油0.493%、迷迭香精油0.058%、丁香精油0.060%、大蒜精油0.937%,此时相对含量均值预测值为62.289%。
参考文献:
[1]ABUHLEGA T, ALI M R. Biogenic amines in fish: prevention and reduction[J].Journal of Food Processing and Preservation,2022,46(10):431-450.
[2]LUO Q Q, SHI R Y, GONG P F, et al. Biogenic amines in Huangjiu (Chinese rice wine):formation, hazard, detection, and reduction[J].LWT-Food Science and Technology,2022,168(2):113952.
[3]KALAC P. Health effects and occurrence of dietary polyamines:a review for the period 2005-mid 2013[J].Food Chemistry,2014,161:27-39.
[4]BULUSHI I A, POOLE S, DEETH H C, et al. Biogenic amines in fish: roles in intoxication, spoilage, and nitrosamine formation—a review[J].Critical Reviews in Food Science and Nutrition,2009,49(4):369-377.
[5]KIM M K, MAH J H, HWANG H J. Biogenic amine formation and bacterial contribution in fish, squid and shellfish[J].Food Chemistry,2009,116(1):87-95.
[6]PRIYA E R, KALA K, RAVICHANDRAN S, et al. Variation of amino acids in the muscle of crab Portunus sanguinolentus during storage[J].Asian Journal of Biochemistry,2015,10(5):237-241.
[7]VIDAL-CAROU M C, IZQUIERDO-PULIDO M L, MARTN-MORRO M, et al. Histamine and tyramine in meat products: relationship with meat spoilage[J].Food Chemistry,1990,37(4):239-249.
[8]LIB B, LU S L. The importance of amine-degrading enzymes on the biogenic amine degradation in fermented foods: a review[J].Process Biochemistry,2020,99(4):331-339.
[9]SUN Q X, ZHAO X X, CHEN H S, et al. Impact of spice extracts on the formation of biogenic amines and the physicochemical, microbiological and sensory quality of dry sausage[J].Food Control,2018,92:190-200.
[10]ZOGUL F, KULEY E, KENAR M. Effects of rosemary and sage tea extract on biogenic amines formation of sardine (Sardina pilchardus) fillets[J].International Journal of Food Science amp; Technology,2011,46(4):761-766.
[11]HOUICHER A, BENSID A, REGENSTEIN J M, et al. Control of biogenic amine production and bacterial growth in fish and seafood products using phytochemicals as biopreservatives:a review[J].Food Bioscience,2021,39(2):100807.
[12]李欣欣,梁玉树,刘尚群,等.柱后衍生阳离子交换色谱法测定动物源性饲料原料及饲料中的生物胺[J].饲料研究,2022,45(1):124-129.
[13]李磊,崔丽伟,张冉,等.3种香辛料精油在牛排涂膜保鲜中的应用研究[J].食品科技,2019,44(2):138-142,151.
[14]国家卫生和计划生育委员会,国家食品药品监督管理总局.食品安全国家标准 食品中生物胺的测定:GB 5009.208—2016[S].北京:中国标准出版社,2016.
[15]倪晓莹,邢军,刘军,等.响应面法优化核桃巴旦木复合酱料制备工艺[J].中国调味品,2023,48(6):125-131.
[16]陈昌威,李苏,张梦雪,等.响应面法优化即食风味青螺加工工艺[J].中国调味品,2023,48(5):110-117.
[17]刘有华,王倩楠,皮乔木,等.响应面法优化聚磷菌P6-1除磷条件研究[J].江苏海洋大学学报(自然科学版),2020,29(3):13-18.
[18]李苏,陈昌威,付靖雯,等.条浒苔多糖酶解物制备工艺优化及体外降血脂活性研究[J].江苏海洋大学学报(自然科学版),2022,31(4):18-27.
[19]陈科奇,朱海,郑梦泽,等.D-对羟基苯甘氨酸合成酶重组菌的高密度发酵工艺[J].江苏海洋大学学报(自然科学版),2022,31(1):57-65.
[20]李冉冉,李洪军,贺稚非.响应面法优化丹磺酰氯衍生生物胺的衍生条件[J].食品与发酵工业,2019,45(17):136-143.
收稿日期:2024-03-25
基金项目:江苏省海洋资源开发研究院开放课题(HKK201617);江苏省市场监管局科技计划项目(KJ21125123)
作者简介:栾立宁(1998—),男,硕士,研究方向:食品质量与检测。
*通信作者:杨从发(1965—),男,副教授,博士,研究方向:功能食品的研发与检测。

