新生儿肺炎合并多重耐药菌感染的影响因素分析

[摘要]目的探讨新生儿肺炎合并多重耐药菌(MDRO)感染的影响因素,为MDRO感染的防治提供依据。方法选取2018年6月至2023年6月首都儿科研究所附属儿童医院收治的211例新生儿肺炎患儿为研究对象,根据入院后3天内是否发生MDRO感染分为感染组(n=40)和未感染组(n=171)。查阅两组患儿的电子病例档案,获取一般资料及实验室资料,采用单因素、多因素Logistic回归分析研究新生儿肺炎合并MDRO感染的影响因素。结果单因素分析结果显示,感染组早产、出生体重<2 500g、肠外营养、机械通气、联合使用抗菌药物种类≥3种、抗菌药物使用时间>7天占比高于未感染组,差异有统计学意义(χ2值介于3.917~8.268之间,P<0.05);多因素Logistic回归分析结果显示,早产、出生体重<2 500g、肠外营养、机械通气、联合使用抗菌药物≥3种、使用抗菌药物时间>7天是新生儿肺炎合并MDRO感染的危险因素(OR值介于4.305~9.010之间,P<0.05);根据Logistic回归模型获得新生儿肺炎发生MDRO感染的预测概率P,绘制受试者工作特征曲线,结果显示,该模型预测新生儿肺炎合并MDRO感染的曲线下面积为0.817,95%CI为0.749~0.884,P<0.001。结论早产、出生体重<2 500g、肠外营养、机械通气、联合使用抗菌药物≥3种、使用抗菌药物时间>7天均是新生儿肺炎合并MDRO感染的危险因素,且根据上述影响因素构建的风险模型对新生儿肺炎合并MDRO感染具有良好的预测价值,可为MDRO感染的预测提供依据。
[关键词]新生儿;肺炎;多重耐药菌感染;影响因素;预测模型
Doi:10.3969/j.issn.1673-5293.2024.12.006
[中图分类号]R174.1[文献标识码]A" "[文章编号]1673-5293(2024)12-0042-06
[Abstract] Objective To explore the influencing factors of neonatal pneumonia combined with multiple drug resistant organisms (MDRO) infection and provide a basis for the prevention and treatment of MDRO infection. Methods A total of 211 neonatal pneumonia patients admitted to the Childrens Hospital Affiliated to Capital Institute of Pediatrics from June 2018 to June 2023 were selected as the research subjects.According to whether MDRO infection occurred within 3 days after admission,they were divided into infection group (n=40) and noninfection group (n=171).The electronic medical records of the two groups of children were consulted to obtain general and laboratory data.Univariate and multivariate Logistic regression analysis were used to study the influencing factors of neonatal pneumonia combined with MDRO infection. Results The results of univariate analysis showed that the incidence of premature birth,birth weight <2 500g,parenteral nutrition,mechanical ventilation,combined use of ≥3 types of antibiotics,and use of antibiotics for >7 days in the infection group was higher than that in the noninfection group,and the difference was statistically significant (χ2=3.9178.268,P<0.05).The results of multivariate Logistic regression analysis showed that premature birth,birth weight <2 500g,parenteral nutrition,mechanical ventilation,combined use of ≥3 types of antibiotics,and use of antibiotics for >7 days were risk factors for neonatal pneumonia combined with MDRO infection (OR=4.3059.010,P<0.05).The predicted probability P of neonatal pneumonia with MDRO infection was obtained according to the Logistic regression model,and the receiver operating characteristic curve was drawn.The results showed that the area under the curve of the model for predicting neonatal pneumonia combined with MDRO infection was 0.817,with a 95%CI of 0.749 to 0.884,P<0.001. Conclusion Premature birth,birth weight <2 500g,parenteral nutrition,mechanical ventilation,combined use of ≥3 antibiotics,and use of antibiotics for >7 days are risk factors for neonatal pneumonia combined with MDRO infection.The risk model constructed based on the above influencing factors has a good predictive value for neonatal pneumonia combined with MDRO infection,which can provide a basis for the prediction of MDRO infection.
[Key words] neonate;pneumonia;multidrugresistant bacterial infection;influencing factors;prediction model
新生儿肺炎是新生儿时期常见的一种呼吸道疾病,是指新生儿在宫内、分娩过程中或出生后因感染细菌、病毒等,引起的肺部炎症病理性改变[1]。近年来,随着广谱抗生素在新生儿肺炎中的广泛使用,细菌的耐药性逐渐增强,甚至还出现了多重耐药菌(multiple drug resistant organisms,MDRO)感染现象[2]。而MDRO感染的出现不仅会增加临床治疗难度,还会延长新生儿肺炎患儿的住院时间,威胁其生命健康[34]。因此,探讨新生儿肺炎合并MDRO感染的影响因素,对预防MDRO感染的发生具有重要意义。基于此,本研究对211例新生儿肺炎患儿病例资料展开回顾性分析,旨在探讨新生儿肺炎合并MDRO感染的影响因素,以期为MDRO感染的防治工作提供一定参考。
1资料与方法
1.1研究对象
选取2018年6月至2023年6月首都儿科研究所附属儿童医院收治的211例新生儿肺炎患儿为研究对象,根据入院后3天内是否发生MDRO感染分为感染组(n=40)和未感染组(n=171)。纳入标准:①符合《实用新生儿学》(第5版)中新生儿细菌感染性肺炎的诊断标准[5];②日龄1~28天;③病历资料完整。排除标准:①合并其他感染性疾病,可能影响病原菌培养结果;②MDRO定植但未感染;③MDRO菌株标本被污染。所有研究对象的监护人均知情同意自愿参与研究。
1.2研究方法
1.2.1 MDRO感染判定方法
入院后3天内,采用吸痰管吸取患儿呼吸道痰液,置于无菌杯中,痰标本于0.5~1.0小时内送入微生物实验室进行检验。细菌分离与培养参照《全国临床检验操作规程》(第4版)进行[6],采用细菌鉴定卡和药敏卡片进行细菌鉴定和药敏试验,药敏试验结果参照相关标准判读[7]。质控菌株为肺炎克雷伯菌ATCC10031、金黄色葡萄球菌ATCC25923等,细菌鉴定卡和药敏卡片均购自北京威泰科生物技术有限公司。新生儿肺炎是否合并MDRO感染参照《MDR、XDR、PDR多重耐药菌暂行标准定义国际专家建议》判定[8]。
1.2.2基线资料收集
入组时,由经过统一培训的工作人员对符合研究条件的新生儿进行基线资料收集,主要包括一般资料和实验室资料,上述资料均来源于新生儿的电子病历档案。其中一般资料包括新生儿性别、出生胎龄、出生体重、早产、出生后5min Apgar评分[9]、机械通气、肠外营养、住院时间、抗菌药物使用情况等;实验室资料包括超敏C反应蛋白、降钙素原等。资料中超敏C反应蛋白采用散射比浊法检测,试剂盒购自北京中科执信医疗设备有限公司;降钙素原采用电化学发光法检测,试剂盒购自北京中科执信医疗设备有限公司。
1.3统计学方法
采用SPSS 25.0软件分析数据,计量资料用均数±标准差(x-±s)表示,组间比较行t检验;计数资料用例数(n)和百分比(%)表示,行χ2检验;采用Logistic回归模型分析影响因素;根据影响因素构建风险模型,绘制受试者工作特征(receiver operating characteristic,ROC)曲线检验该模型的预测效能。所有检验均为双侧,检验水准α=0.05。
2结果
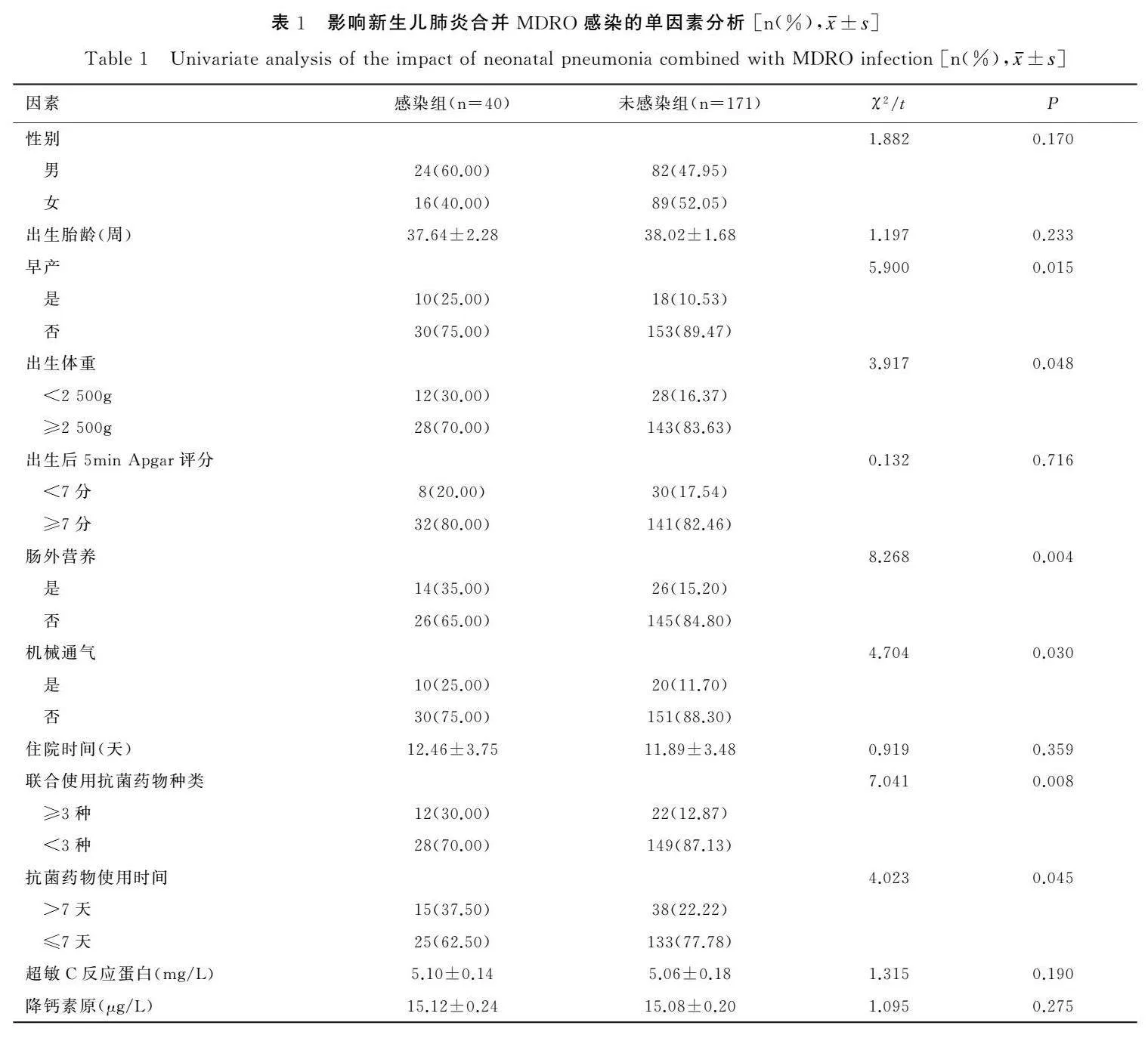
2.1单因素分析新生儿肺炎合并MDRO感染的影响因素
单因素分析结果显示,感染组早产、出生体重<2 500g、肠外营养、机械通气、联合使用抗菌药物种类≥3种、抗菌药物使用时间>7天占比高于未感染组,差异有统计学意义(χ2值介于3.917~8.268之间,P<0.05);两组其他资料比较,差异无统计学意义(P>0.05),见表1。
2.2多因素分析新生儿肺炎合并MDRO感染的影响因素
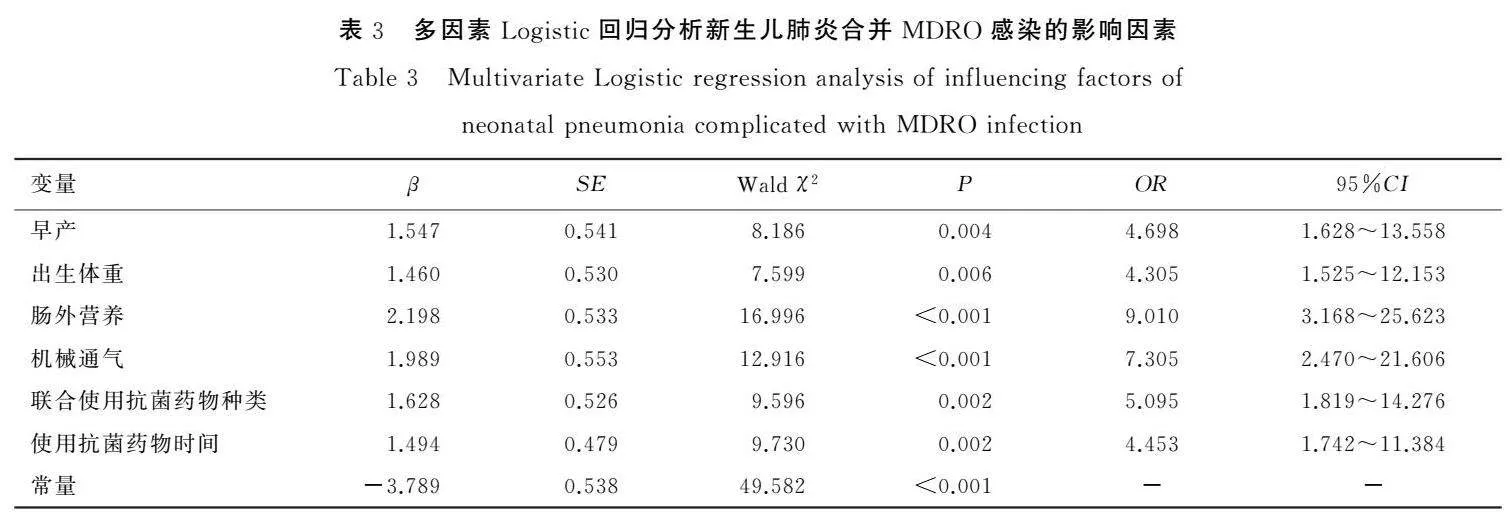
以新生儿肺炎是否合并MDRO感染作为因变量,以表1中对比差异有统计学意义的资料作为自变量(变量赋值及说明见表2),进行多因素Logistic回归分析,结果显示早产、出生体重<2 500g、肠外营养、机械通气、联合使用抗菌药物≥3种、使用抗菌药物时间>7天是新生儿肺炎合并MDRO感染的危险因素(OR值介于4.305~9.010之间,P<0.05),见表3。
2.3影响因素构建的风险模型对新生儿肺炎合并MDRO感染的预测效力
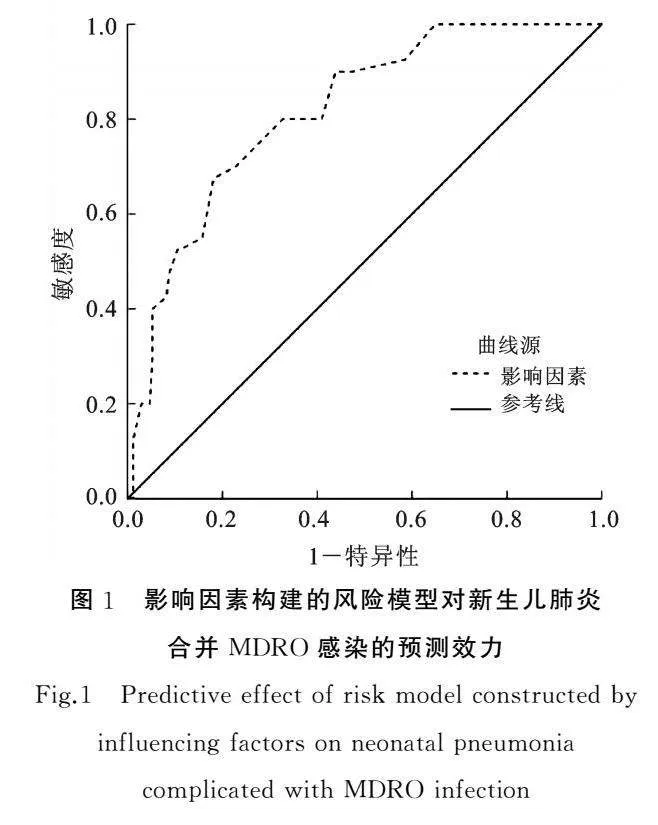
根据Logistic回归模型筛选出的6个独立危险因素构建风险模型,采用Logistic二元回归拟合,获得新生儿肺炎发生MDRO感染的预测概率P,绘制受试者工作特征曲线,结果显示,该模型预测新生儿肺炎合并MDRO感染的曲线下面积为0.817,95%CI为0.749~0.884,P<0.001,见图1。
3讨论
3.1新生儿肺炎MDRO感染现状
新生儿免疫系统在出生时尚未完全发育,对细菌和其他病原体的防御能力较弱,容易受到细菌侵袭引发肺炎,而MDRO感染引起的肺炎治疗更为棘手,会进一步增加临床治疗难度,并引发呼吸衰竭、肺动脉高压等严重并发症,危及患儿生命安全,给家庭带来痛苦和经济负担[1012]。本研究结果显示,211例新生儿肺炎患儿中,合并MDRO感染的概率为18.96%。可见新生儿肺炎合并MDRO感染的概率较高,积极防治MDRO感染迫在眉睫。为此,有必要对新生儿肺炎合并MDRO感染的影响因素进行探析,以预防MDRO感染的发生。
3.2早产、出生体重及肠外营养对新生儿肺炎合并MDRO感染的影响
本研究结果显示,早产、出生体重<2 500g、肠外营养均是新生儿肺炎合并MDRO感染的危险因素。这是因为早产儿和低体质量新生儿的器官功能发育尚不健全,容易受到细菌侵袭,引发MDRO感染[13]。此外,部分新生儿由于出生后胃肠道功能发育不成熟,往往不能耐受肠内营养,需要通过肠外营养的方式来为机体提供能量[14]。但肠外营养会破坏肠道菌群,引起肠道菌群紊乱和免疫系统失衡,导致大量病原微生物入侵,增加MDRO感染风险[1516]。康茹等[17]根据肠道菌群紊乱情况将135例呼吸道感染患儿分为菌群失调组和非菌群失调组,发现菌群失调组辅助性T细胞17占比明显升高、调节性T细胞比例明显降低,提示肠道菌群紊乱与呼吸道感染性疾病的发生发展过程有关。由此可见,肠外营养很可能通过破坏新生儿肺炎患儿肠道菌群、引起免疫系统失衡的方式加速MDRO感染的出现和发展。
3.3机械通气对新生儿肺炎合并MDRO感染的影响
多项研究表明,侵入性医疗操作也是MDRO感染发生的重要原因[1819]。而本研究结果显示,感染组机械通气占比明显高于未感染组,且经多因素分析证实,机械通气可对新生儿肺炎患儿MDRO感染的发生产生影响。分析其原因:机械通气作为一项侵入性医疗操作,会为细菌进入呼吸道提供入侵路径,为细菌滋生、定植提供条件,从而导致新生儿肺炎合并MDRO感染的概率显著升高[20]。此外,机械通气还会破坏新生儿的呼吸道防御功能,导致呼吸道正常的防御机制受损,如纤毛功能减退、黏液清除能力降低等,此时周围环境中的多重耐药菌会通过易位或自身感染的方式促进MDRO感染的发生[21]。因此,机械通气可对新生儿肺炎合并MDRO感染产生影响。
3.4抗菌药使用情况对新生儿肺炎合并MDRO感染的影响
新生儿肺炎患儿常需使用抗生素进行抗菌治疗,但抗生素的不规范应用也会成为诱发MDRO感染的重要原因[22]。本次研究结果显示,感染组联合使用抗菌药物≥3种、使用抗菌药物时间>7天占比明显高于未感染组,与梁武华等[23]、张毅等[24]研究结果相符。分析其原因,联合使用抗菌药物≥3种会破坏新生儿体内的微生态环境,打破微生态平衡,引起呼吸道内细菌定植,致使呼吸道菌群失调,增加MDRO感染概率。而使用抗菌药物时间>7天会导致细菌产生耐药性,增加耐药菌株数量,最终诱发MDRO感染[2526]。最后,本研究根据Logistic回归模型筛选出6个影响因素构建风险预测模型,采用Logistic二元回归进行拟合,得到新生儿肺炎发生MDRO感染的预测概率,绘制受试者工作特征曲线,结果显示,该模型预测新生儿肺炎合并MDRO感染的曲线下面积为0.817,95%CI为0.749~0.884。提示今后临床可将该模型用于新生儿肺炎合并MDRO感染的预测中,以此来识别高MDRO感染风险的新生儿肺炎患儿。
此外,针对上述影响因素,建议临床应加强对早产儿和出生体重<2 500g新生儿的管理,减少不必要的机械通气、肠外营养等治疗方法,尽可能降低新生儿肺炎合并MDRO感染的概率。同时医院还应定期对医师和药师进行抗菌药物专业知识培训,指导医师和药师为新生儿肺炎患儿合理选择抗菌药物,尽量避免长疗程、反复给药或联合使用抗菌药物,以预防MDRO感染的发生。但本研究尚存在一些不足之处,如既往研究已经证实,胎龄、住院时间等也与MDRO感染的发生有关[2728]。但本研究中感染组和未感染组在上述指标方面对比并无显著性差异,考虑可能与本研究为单中心研究、样本量较少有关。此外,本研究作为一项回顾性研究,在收集资料时可能会受到调查者记忆偏倚的影响,降低数据的准确性和可靠性。上述不足之处还有待后续多中心、前瞻性研究加以验证。
综上,新生儿肺炎合并MDRO感染的危险因素为早产、出生体重<2 500g、肠外营养、机械通气、联合使用抗菌药物≥3种和使用抗菌药物时间>7天,且根据上述因素构建的风险模型可用于预测新生儿肺炎合并MDRO感染的发生风险。
[参考文献]
[1]Kumar C S,Subramanian S,Murki S,et al.Predictors of mortality in neonatal pneumonia:an INCLEN childhood pneumonia study[J].Indian Pediatr,2021,58(11):10401045.
[2]Sy C L,Chen P Y,Cheng C W,et al.Recommendations and guidelines for the treatment of infections due to multidrug resistant organisms[J].J Microbiol Immunol Infect,2022,55(3):359386.
[3]Wattal C,Kler N,Oberoi J K,et al.Neonatal sepsis:mortality and morbidity in neonatal sepsis due to multidrugresistant (MDR) organisms:part 1[J].Indian J Pediatr,2020,87(2):117121.
[4]Kernéis S,Lucet J C.Controlling the diffusion of multidrugresistant organisms in intensive care units[J].Semin Respir Crit Care Med,2019,40(4):558568.
[5]邵肖梅,叶鸿瑁,丘小汕.实用新生儿学[M].5版.北京:人民卫生出版社,2019:169,582588.
[6]尚红,王毓三,申子瑜.全国临床检验操作规范(第4版)[M].北京:人民卫生出版社,2015:575625.
[7]许宏涛,张秀珍.2004年美国临床实验室标准化委员会药敏试验判断标准[J].中国临床药理学杂志,2005,21(4):318320.
[8]李春辉,吴安华.MDR、XDR、PDR多重耐药菌暂行标准定义——国际专家建议[J].中国感染控制杂志,2014,13(1):6264.
[9]Bartman T,Bapat R,Martin E M,et al.Apgar score at 5 minutes is associated with mortality in extremely preterm infants even after transfer to an all referral NICU[J].Am J Perinatol,2015,32(13):12681272.
[10]Chiusaroli L,Liberati C,Caseti M,et al.Therapeutic options and outcomes for the treatment of neonates and preterms with gramnegative multidrugresistant bacteria:a systematic review[J].Antibiotics (Basel),2022,11(8):1088.
[11]Chen X,Pan D,Chen Y.The drug resistance of multidrugresistant bacterial organisms in pediatric pneumonia patients[J].Am J Transl Res,2021,13(4):33093315.
[12]Hadic' D,Skokic' F,Brkic' S,et al.Epidemiology of neonatal sepsis caused by multidrug resistant pathogens in a neonatal intensive care unit level 3[J].Med Glas (Zenica),2020,17(2):375382.
[13]KstlinGille N,Hrtel C,Haug C,et al.Epidemiology of early and late onset neonatal sepsis in very low birthweight infants:data from the german neonatal network[J].Pediatr Infect Dis J,2021,40(3):255259.
[14]Robinson D T,Calkins K L,Chen Y,et al.Guidelines for parenteral nutrition in preterm infants:the American society for parenteral and enteral nutrition[J].JPEN J Parenter Enteral Nutr,2023,47(7):830858.
[15]Ronan V,Yeasin R,Claud E C.Childhood development and the microbiomethe intestinal microbiota in maintenance of health and development of disease during childhood development[J].Gastroenterology,2021,160(2):495506.
[16]Wuethrich I,W Pelzer B,Khodamoradi Y,et al.The role of the human gut microbiota in colonization and infection with multidrugresistant bacteria[J].Gut Microbes,2021,13(1):113.
[17]康茹,孟改利,周雪红.呼吸道感染患儿肠道菌群紊乱与Th17/Treg及其分泌炎性细胞因子免疫平衡的相关性研究[J].现代检验医学杂志,2021,36(6):95100.
[18]Havens T N,Rosen D A,RiveraSpoljaric K.Airway multidrugresistant organisms in a population of tracheostomy and chronic ventilatordependent children at a tertiary care pediatric hospital[J].Pediatr Pulmonol,2023,58(1):2634.
[19]Nohl A,Hamsen U,Jensen K O,et al.Incidence,impact and risk factors for multidrugresistant organisms (MDRO) in patients with major trauma:a European multicenter cohort study[J].Eur J Trauma Emerg Surg,2022,48(1):659665.
[20]Alriyami A,Kiger J R,Hooven T A.Ventilatorassociated pneumonia in the neonatal intensive care unit[J].Neoreviews,2022,23(7):e448e461.
[21]Han Y,Zhang J,Zhang H Z,et al.Multidrugresistant organisms in intensive care units and logistic analysis of risk factors[J].World J Clin Cases,2022,10(6):17951805.
[22]Murray M T,Beauchemin M P,Neu N,et al.Prior antibiotic use and acquisition of multidrugresistant organisms in hospitalized children:a systematic review[J].Infect Control Hosp Epidemiol,2019,40(10):11071115.
[23]梁武华,梁敏煜,周海燕.玉林市2017—2019年新生儿呼吸道细菌感染分布及多重耐药菌耐药调查[J].中南医学科学杂志,2022,50(4):560563.
[24]张毅,范圆圆,尧亮华.新生儿多重耐药性肺炎病原菌的耐药性及相关危险因素分析[J].中国病原生物学杂志,2020,15(11):13401343.
[25]Lamba V,Dsouza S,Carafa C,et al.Standardizing the approach to late onset sepsis in neonates through antimicrobial stewardship:a quality improvement initiative[J].J Perinatol,2020,40(9):14331440.
[26]Bubser C,Liese J,SernaHiguita L M,et al.Impact of early antibiotic exposure on the risk of colonization with potential pathogens in very preterm infants:a retrospective cohort analysis[J].Antimicrob Resist Infect Control,2022,11(1):72.
[27]王品品,常晶,王广州,等.新生儿重症监护室医院获得性感染病原菌监测及多重耐药相关影响因素[J].儿科药学杂志,2021,27(9):1518.
[28]卢蔚薇,赖宇涛,童雅婵,等.新生儿重症监护病房多重耐药菌反复感染的危险因素分析[J].传染病信息,2023,36(3):243247.
[专业责任编辑:艾婷]
[中文编辑:郭乐倩;英文编辑:牛惠]
[收稿日期]2024-01-11
[基金项目]北京市自然科学基金项目(L202022)
[作者简介]崔燕华(1974—),女,副主任医师,主要从事新生儿肺炎相关疾病研究。
[通讯作者]杨颖,副主任护师。

