基于总胆红素和白蛋白比值的新生儿急性胆红素脑病预测模型





[摘要]目的构建和验证结合总胆红素和白蛋白比值(B/A)的预测模型,以预测高胆红素血症新生儿发生急性胆红素脑病(ABE)的风险。方法选取2015年1月至2022年12月期间在黄河三门峡医院住院的535例高胆红素血症新生儿为研究对象,根据有无ABE的发生,将患儿分为ABE新生儿(n=96)和无ABE新生儿(n=439)两组。比较两组新生儿人口统计学特征、病理信息及入院检查结果等,受试者工作特征(ROC)曲线分析各变量预测ABE发生的能力。单因素和多因素Logistic回归分析评估急性胆红素脑病的影响因素,并进一步构建列线图模型。采用ROC曲线、校正曲线评估模型的效能,采用临床决策曲线(DCA)评估模型的临床实用价值。结果多因素Logistic回归分析显示,母龄、白细胞计数、总胆红素、B/A、高敏C反应蛋白(CRP)是新生儿胆红素脑病的独立危险因素(aOR值分别为2.548、3.640、1.236、6.289、1.680,Plt;0.05),白蛋白是新生儿胆红素脑病的独立保护因素(aOR=0.456,Plt;0.05);进一步构建了基于母亲年龄、白细胞计数、B/A、CRP共4个变量的ABE发生风险的列线图,模型C指数为0.879,曲线下面积(AUC)为0.899(95%CI:0.869~0.930),且校准曲线显示模型具有较好的辨别能力;DCA显示模型在实际临床工作中使得患者有更多获益。结论B/A是高胆红素血症新生儿发生ABE的独立影响因素和有效预测指标,构建的包含B/A的列线图,具有良好预测能力。
[关键词]急性胆红素脑病;危险因素;列线图;总胆红素与白蛋白比值
Doi:10.3969/j.issn.1673-5293.2024.12.005
[中图分类号]R174.1[文献标识码]A" [文章编号]1673-5293(2024)12-0034-08
[Abstract] Objective To construct and validate a prediction model based on ratio of total bilirubin to albumin (B/A) to predict risk of acute bilirubin encephalopathy (ABE) in neonates with hyperbilirubinemia. Methods A total of 535 neonates with hyperbilirubinemia who hospitalized in Yellow River Sanmenxia Hospital from January 2015 to December 2022 were selected as research subjects.According to whether ABE occurred,the neonates were divided into two groups:ABE neonate group (n=96) and ABEfree neonate group (n=439).Demographic characteristics,pathological information and admission examination results of the neonates were compared between the two groups.Receiver operating characteristic (ROC) curve was use to analyze predictive value of each variable for occurrence of ABE.Univariate and multivariate Logistic regression analyses were used to evaluate influencing factors of ABE,and then a nomogram model was constructed.ROC curve and calibration curve were used to evaluate efficacy of the model,and decision curve analysis (DCA) was used to evaluate clinical practical value of the model. Results Multivariate Logistic regression analysis showed that maternal age,neonates white blood cell count(WBC),total bilirubin,B/A ratio,hypersensitive Creactive protein (hsCRP) were independent risk factors for occurrence of ABE [adjusted odds ratio (aOR) values were 2.548,3.640,1.236,6.289 and 1.680 respectively,all Plt;0.05],and albumin was a protective factor for occurrence of ABE (aOR=0.456,Plt;0.05).Then a nomogram of risk of ABE occurrence based on a total of 4 variables including maternal age,neonates WBC,B/A ratio and hsCRP was constructed.The Cindex of the model was 0.879,the AUC was 0.899 (95%CI:0.8690.930),and the calibration curve showed that the model had good discrimination ability.The DCA showed that the model benefited to the neonates more in actual clinical work. Conclusion B/A ratio is an independent factor and an effective predictor of ABE in neonates with hyperbilirubinemia.
[Key words] acute bilirubin encephalopathy;risk factor;nomogram;total bilirubin to albumin ratio
高胆红素血症是新生儿的常见疾病,发生于超过84%的晚期早产儿和足月新生儿[1]。虽然大多数患者在2周龄时消退,但仍有部分患者会出现严重的并发症。急性胆红素脑病(acute bilirubin encephalopathy,ABE)是高胆红素血症的严重并发症,患有ABE中期或晚期的婴儿发生死亡或慢性胆红素脑病(核黄疸)的风险较高。
美国儿科学会(American Academy of Pediatrics,AAP)针对新生儿预防胆红素脑病的指南是基于血清总胆红素(total serum bilirubin,TSB)水平制定的[2]。然而,胆红素的神经毒性被认为主要由不与白蛋白结合的非结合胆红素(称为游离或未结合胆红素)决定,而不是TSB[34],因此,TSB对胆红素神经毒性的预测能力较差。
一些研究人员将总胆红素与白蛋白相结合(total serum bilirubin/albuin,B/A)用来预测ABE发生,结果表明B/A比值在预测高胆红素血症新生儿患者的并发症和预后中起重要作用[57]。但目前国内仍然缺乏TSB与其他临床预测因子联合应用预测ABE的相关研究。列线图预测模型作为一种用于预测个体特定结果的统计工具,本质是回归模型的可视化,被认为能够准确地帮助临床医生进行临床决策[8],已广泛应用于临床研究中[910]。因此,本研究的目的是发现具有预测性的临床因素,然后与其他有价值的变量相结合,构建和验证列线图模型,以预测高胆红素新生儿发生ABE的风险。
1资料与方法
1.1研究对象
选取2015年1月至2022年12月期间在黄河三门峡医院住院的535例高胆红素血症新生儿为研究对象,根据有无ABE的发生,将患儿分为ABE新生儿(n=96)和无ABE新生儿(n=439)两组。纳入标准为:①入院日龄≤28d;②病史资料完整可靠。排除标准:
①排除内环境紊乱、围产期窒息、宫内感染、染色体异常等造成的神经系统异常;
②患颅内感染、缺氧缺血性脑病、先天性颅脑畸形等;③数据不完整:人口统计学特征、实验室检查、临床相关变量的任何变量缺失。本研究获得黄河三门峡医院伦理委员会的批准(伦理审查号:2023临伦审第20230108013)。
根据患儿入院24h内的病例记录,采用胆红素诱导神经功能障碍方案(bilirubininduced neurological dysfunction score,BIND评分)评估患儿的精神状态、肌张力、哭闹情况。总BIND评分在1~3之间表明胆红素的毒性很微弱,通常是可逆的;4~6分被认为是中度但可能可逆的ABE;7~9分提示严重ABE,可能导致核黄疸并引起长期后遗症。在本研究中,ABE定义为BIND≥4,即中度及以上评分。所有患儿均进行BIND评分并筛选出中重度ABE。
1.2资料搜集
从我院医院信息系统(hospital information system,HIS)和实验室信息系统(laboratory information system,LIS)等数据库平台中提取了与以下变量相关的数据:①患儿人口统计学特征:胎龄、性别、分娩类型、胎膜早破、新生儿窒息、出生体重等;②母亲人口统计学特征:母亲年龄、妊娠期高血压疾病、妊娠期糖尿病、宫内窘迫等;③实验室指标(入院最近一次检查):血红蛋白(hemoglobin,Hb)、红细胞计数、白细胞计数、高敏C反应蛋白(hypersensitive Creactive protein,CRP)、TSB、白蛋白(albuin,ALB)、B/A。
本研究脓毒症要求为具有脓毒症临床症状且血培养结果呈阳性的新生儿病例。新生儿窒息定义为具有以下3个特征:①脐动脉表现出严重的代谢性酸中毒(pHlt;7);②Apgar评分lt;4;③神经系统后遗症和(或)多器官功能障碍。其中新生儿出生体重、白细胞、红细胞、白蛋白和血红蛋白等的正常值参照实用新生儿学(第五版)诊断标准。
1.3统计学方法
采用R 4.2.0软件、SPSS 26.0对数据进行统计学分析。列线图的开发和验证使用“rms”R包进行,决策曲线分析(decision curve analysis,DCA)使用“rmda”R包进行。Plt;0.05被认为差异具有统计学意义。
符合正态分布的连续变量以均值±标准差(x-±s)表示,组间比较采用t检验;非正态分布数据采用中位数及四分位间距M(Q1~Q3)表示,组间比较采用MannWhitney U test;计数资料用例数(n)和百分比(%)表示,组间比较采用χ2检验。将筛选出来具有差异的单因素变量,进行受试者工作特征(receiver operating characteristic,ROC)曲线分析,并计算曲线下面积(area under the curve,AUC)。使用单因素和多因素Logistic回归分析来评估急性胆红素脑病的影响因素。
根据多因素Logistic回归分析结果,进一步构建列线图。使用一致性指数(C指数)、ROC曲线(AUC为0.5~lt;0.7具有低等可信度,0.7~0.9具有中等可信度,>0.9具有高等可信度)来评估列线图的性能。绘制校准曲线以确定校准,并且校准曲线通过500次自举重采样进行验证,从而减少过度拟合偏差。
2结果
2.1两组新生儿一般资料比较
研究期间我院确诊高胆红素血症患者住院患儿604例,排除数据不完整33例、颅内感染8例、缺氧缺血性脑病16例、染色体异常4例、先天性颅脑畸形2 例、电解质紊乱2例、宫内感染4例,最终535例患儿进入本文分析,其中男310例,女225例;胆红素脑病患儿96例,无胆红素脑病患儿439例。
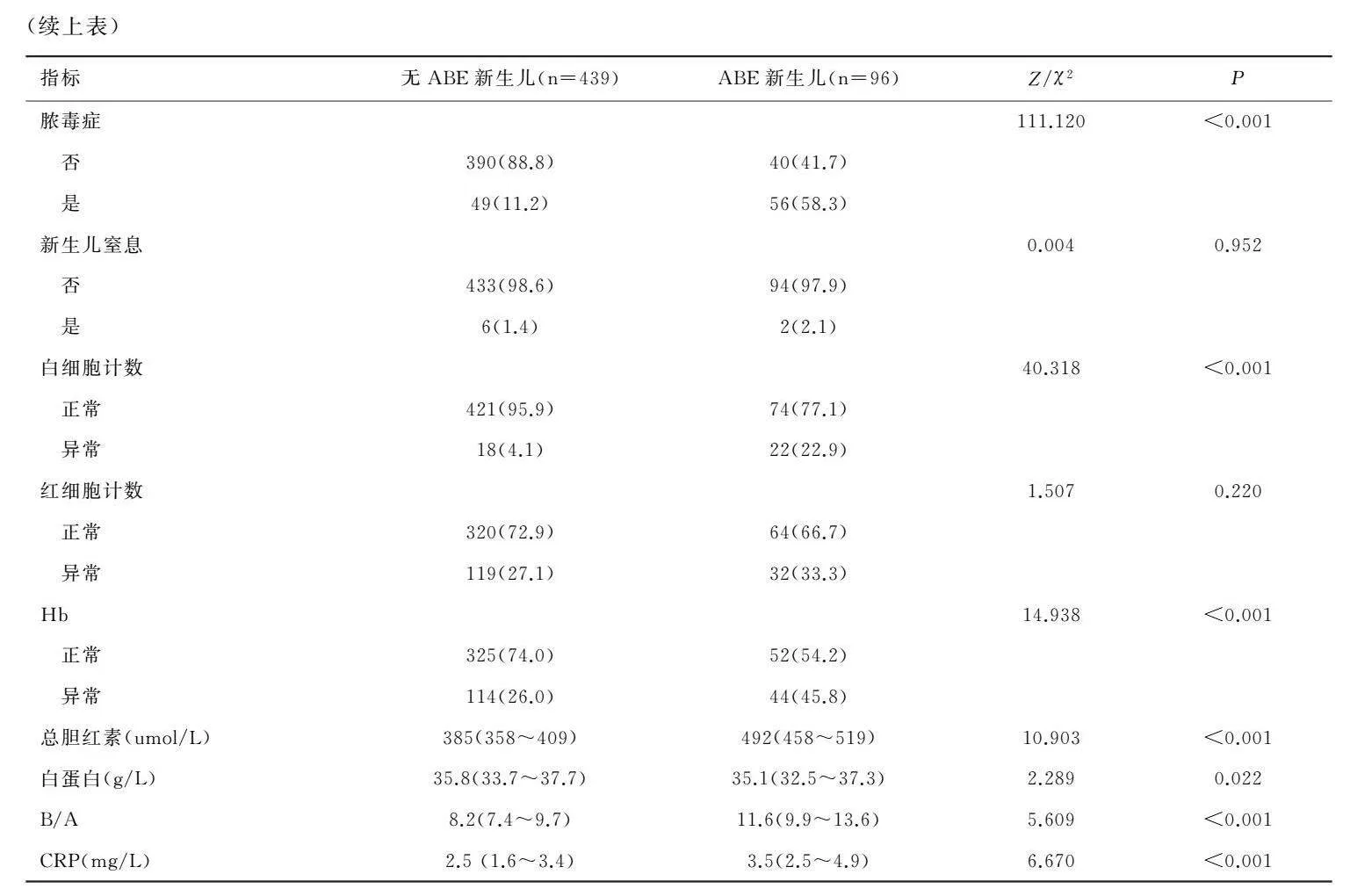
与无胆红素脑病组相比,胆红素脑病组的胎龄更小,母龄更大,脓毒症、白细胞计数异常、血红蛋白异常比例更高,总胆红素、B/A、CRP水平更高,体重、白蛋白水平更低,差异具有统计学意义(Z/χ2值介于1.938~111.120之间,P<0.05);其余指标差异无统计学意义(Pgt;0.05),见表1。
2.2 ROC曲线分析
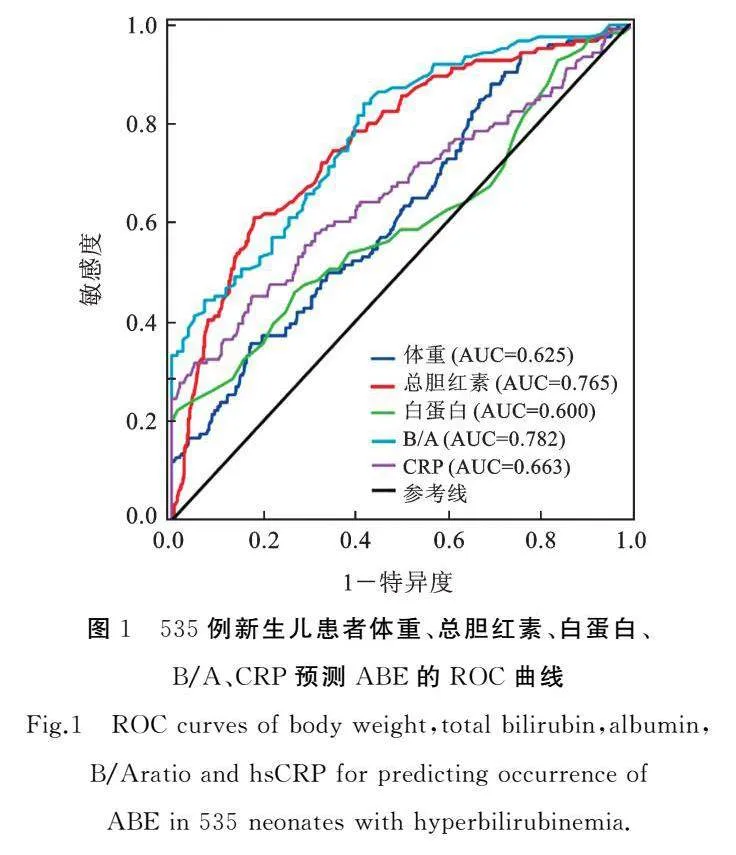
通过ROC曲线分析计算出体重、总胆红素、白蛋白、B/A、CRP等连续变量的最佳截断值,其AUC分别为0.625、0.765、0.600、0.782、0.663,见图1及表2。
2.3构建基于Nomogram的新生儿胆红素脑病临床预测模型
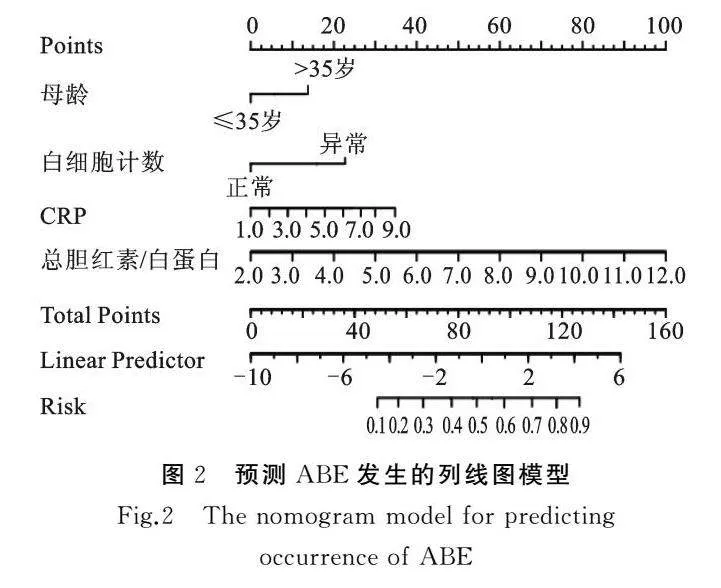
单因素Logistic回归分析显示,胎龄、母龄、脓毒症、白细胞计数、血红蛋白、体重、总胆红素、白蛋白、B/A、CRP是新生儿胆红素脑病的影响因素;进一步多因素Logistic回归分析显示,母龄、白细胞计数、总胆红素、B/A、CRP是新生儿胆红素脑病的独立危险因素(aOR值分别为2.548、3.640、1.236、6.289、1.680,Plt;0.05),白蛋白是新生儿胆红素脑病的独立保护因素(aOR=0.456,Plt;0.05),见表3。其中B/A为总胆红素与白蛋白比值,考虑模型的简洁性及防止模型出现过拟合情况,总胆红素与白蛋白未被纳入模型中。取其中与预后关联最紧密的临床因素,进一步构建了基于母龄、白细胞计数、B/A、CRP共4个变量的新生儿胆红素脑病发生风险的列线图预测模型(图2)。通过将每个变量的分数相加得到总分,可从列线图中得到相应的风险概率。
2.4列线图模型的验证
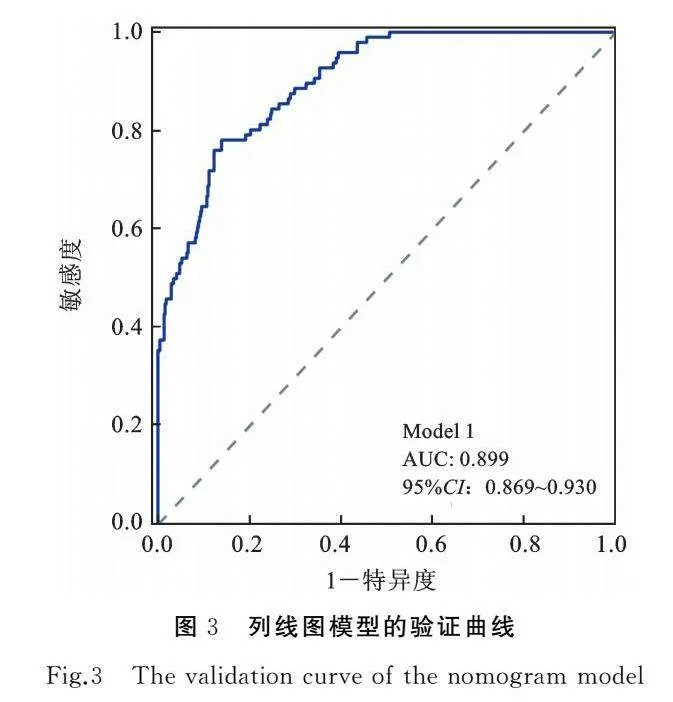
本研究的列线图模型C指数为0.879(C指数越接近1代表列线图的可信性越高),绘制模型ROC曲线,计算AUC为0.899(95%CI:0.869~0.930),见图3。构建校准曲线,评估模型的准确性,明确模型有无过拟合现象,结果显示构建的模型具有较好的辨别能力,见图4。
2.5列线图的临床获益分析
进一步评估包含B/A比值的列线图预后模型是否可以使高胆红素新生儿患者在临床实践中受益。列线图的DCA评估了患者的净受益(净受益率越大,预后模型的预测能力越好),结果表明基于包含B/A比值的列线图预测模型在实际临床工作中使得患者有更多获益,见图5。
3讨论
本研究分析表明母亲年龄、白细胞计数、总胆红素、白蛋白、B/A比值、CRP是高胆红素新生儿发生胆红素脑病的独立影响因素,我们构建并验证了B/A比值联合母龄、白细胞计数、CRP的列线图预测模型,基于这4个预测因子的列线图模型的AUC值为0.899,表明我们构建的模型具有较好的精确性,校准曲线和DCA也表明列线图具有良好的诊断性能。这种可视化的列线图作为一种简便的工具,有助于识别胆红素脑病高风险的个体,帮助医生进行临床决策。
3.1 B/A比值与胆红素脑病发生的关系
肝脏是一种免疫学复杂的器官,在炎症中起关键作用,胆红素水平是肝功能障碍的代表标志物[11]。白蛋白是胆红素转移到肝脏的载体[12],白蛋白具有多个结合位点,能够与胆红素结合,形成胆红素白蛋白复合物,从而增加胆红素在血液中的溶解度,便于在体内运输。当白蛋白含量降低或胆红素产生过多,可能导致胆红素与白蛋白的结合能力下降,未结合的胆红素增多,容易透过血脑屏障引发胆红素脑病等疾病。低白蛋白血症(足月新生儿血清白蛋白lt;3.0g/dL,早产新生儿lt;2.5g/dL)是胆红素神经毒性的危险因素,因为低血清白蛋白水平可能通过降低胆红素白蛋白结合能力来增加胆红素脑病的风险[13]。此外,低白蛋白血症已被证明是死亡率、发病率增加及住院时间延长的独立危险因素。
虽然高胆红素血症和低白蛋白血症常见于新生儿患者,但很少有研究关注B/A比值[1315]。有研究报告,B/A比值可更好地估计血浆游离胆红素值,B/A比值越大,游离胆红素水平越高,更易与神经细胞膜结合损伤细胞[16]。因此,B/A比值不仅反映体内胆红素水平,也能反映白蛋白水平,而且B/A比值在临床实践中容易计算,这表明它可能是高胆红素血症新生儿患神经系统损伤潜在的临床预测指标。
既往的研究尝试使用血液学指标联合影像学研究预测ABE[7,17],然而预测效果不尽人意[1819]。最近的一项研究报道了一种预测模型,该模型包括三个因素(TSB、B/A比值和脓毒症)来评估ABE的风险[20],但该模型研究结果需要进一步的临床验证。此外,该预测模型得到的分数不能直接转换为预测概率,临床实用性较为局限。
在本研究中,我们进行了胆红素脑病单因素ROC曲线分析,研究显示B/A比值的AUC值高于总胆红素(0.782 vs. 0.765),表明B/A拥有更好的早产儿胆红素神经毒性风险预测能力。在既往的报道中,血清B/A比值有望作为新生儿胆红素脑病和神经系统功能障碍的预测指标[7,2122]。还有研究表明,TSB水平与胆红素神经毒性相关性差,不是神经系统结局的敏感或特异性预测指标[2324]。
本研究单因素及多因素Logistic回归分析表明B/A是胆红素脑病的独立危险因素,且B/A比TSB更能预测ABE。因此,临床上不仅要关注总胆红素值,还要加强B/A值的动态监测,及早采取干预措施更好地预防胆红素脑病的发生。
3.2白细胞与胆红素脑病发生的关系
白细胞水平异常被认为是黄疸发生的重要原因[25],我们的研究结果表明它也是ABE的独立危险因素。白细胞水平异常多与感染有关,感染可导致红细胞破坏,结合胆红素摄取减少,肝脏限速酶活性抑制,黄疸严重程度增加。同时感染引起的血脑屏障通透性增加也进一步加重了胆红素的神经毒性作用。
Zhang等[20]报道脓毒症是ABE的危险因素,但在本研究中ABE与非ABE新生儿之间没有显著差异,这可能与血培养阳性率低有关。既往的研究中脓毒症被定义为白细胞异常、C反应蛋白阳性或血培养阳性。在本研究中,脓毒症被定义为新生儿同时具有脓毒症的临床症状和血培养结果阳性。在临床上,脓毒症并不能很好地预测ABE,因为它需要很长时间才能通过血培养得到证实。我们的结果提示,ABE的真正危险因素可能是白细胞水平异常,而不是脓毒症。
3.3母龄与胆红素脑病发生的关系
到目前为止,研究新生儿ABE与母亲年龄之间关联的研究非常少。但高龄孕妇被认为是多种新生儿疾病的危险因素,高龄孕妇可能会因身体机能下降、孕期并发症增多等原因,增加新生儿出现各种健康问题的风险,高龄孕妇可能更容易出现妊娠期糖尿病、高血压等疾病,这些情况可能影响胎儿的宫内环境,间接增加新生儿胆红素代谢异常的概率。其他因素如溶血性疾病、早产、窒息和感染都可能导致ABE的存在[2]。
此外,CRP包括在目前的列线图模型中。列线图中这些变量的组合提高了模型的预测准确性,进一步肯定了这些变量在预测新生儿急性胆红素脑病方面起到了关键作用。
然而,本研究仍存在一些局限性。首先是列线图模型是基于单个中心的回顾性研究构建的。因此,有必要进行前瞻性多中心研究以验证本研究结果。其次,纳入研究的患者数量相对较少,这可能导致统计能力有限。在未来的研究中,我们将增加样本量以验证我们的预测模型。
本研究构建并验证了B/A比值及其他临床因素的列线图,以预测新生儿胆红素脑病的发生风险。构建的这种可视化列线图预测模型在预测新生儿胆红素脑病方面显示出了较好的准确性,并拥有卓越的临床获益,能指导医生进行临床决策。
[参考文献]
[1]Vidavalur R,Devapatla S.Trends in hospitalizations of newborns with hyperbilirubinemia and kernicterus in United States:an epidemiological study [J].J Matern Fetal Neonatal Med,2022,35(25):77017706.
[2]Kemper A R,Newman T B,Slaughter J L,et al.Clinical Practice Guideline Revision:Management of Hyperbilirubinemia in the Newborn Infant with 35 or More Weeks of Gestation [J].Pediatrics,2022,150(3):e2022058859.
[3]Hegyi T,Kleinfeld A.Neonatal hyperbilirubinemia and the role of unbound bilirubin [J].J Matern Fetal Neonatal Med,2022,35(25):92019207.
[4]Cayabyab R,Ramanathan R.High unbound bilirubin for age:a neurotoxin with major effects on the developing brain [J].Pediatr Res,2019,85(2):183190.
[5]Amin S B,Wang H,Laroia N,et al.Unbound Bilirubin and Auditory Neuropathy Spectrum Disorder in Late Preterm and Term Infants with Severe Jaundice [J].J Pediatr,2016,173:8489.
[6]Morioka I,Nakamura H,Koda T,et al.Serum unbound bilirubin as a predictor for clinical kernicterus in extremely low birth weight infants at a late age in the neonatal intensive care unit [J].Brain Dev,2015,37(8):753757.
[7]Iskander I,Gamaleldin R,El Houchi S,et al.Serum bilirubin and bilirubin/albumin ratio as a predictor of bilirubin encephalopathy [J].Pediatrics,2014,134(5):e1330e1339.
[8]Chen T,Xu L,Ye L,et al.A new nomogram for recurrencefree survival prediction of gastrointestinal stromal tumors:Comparison with current risk classification methods [J].Eur J Surg Oncol,2019,45(6):11091114.
[9]Balachandran V P,Gonen M,Smith J J,et al.Nomograms in oncology:more than meets the eye [J].Lancet Oncol,2015,16(4):e173e180.
[10]Park S Y.Nomogram:An analogue tool to deliver digital knowledge [J].J Thorac Cardiovasc Surg,2018,155(4):1793.
[11]Strnad P,Tacke F,Koch A,et al.Liverguardian,modifier and target of sepsis [J].Nat Rev Gastroenterol Hepatol,2017,14(1):5566.
[12]Amin S B.Bilirubin Binding Capacity in the Preterm Neonate [J].Clin Perinatol,2016,43(2):241257.
[13]Watchko J F,Spitzer A R,Clark R H.Prevalence of Hypoalbuminemia and Elevated Bilirubin/Albumin Ratio in a Large Cohort of Infants in the Neonatal Intensive Care Unit [J].J Pediatr,2017,188:280286.
[14]Leite H P,Rodrigues da Silva A V,de Oliveira Iglesias S B,et al.Serum Albumin Is an Independent Predictor of Clinical Outcomes in Critically Ill Children [J].Pediatr Crit Care Med,2016,17(2):e50 e57.
[15]Choi J S,Chung K S,Lee E H,et al.The role of bilirubin to albumin ratio as a predictor for mortality in critically ill patients without existing liver or biliary tract disease [J].Acute Crit Care,2020,35(1):2430.
[16]Donneborg M L,Hansen B M,Petersen J P,et al.An update on unconjugated neonatal hyperbilirubinaemia in Denmark [J].Ugeskr Laeger,2020,182(14a):V11190671.
[17]Liu Z,Ji B,Zhang Y,et al.Machine Learning Assisted MRI Characterization for Diagnosis of Neonatal Acute Bilirubin Encephalopathy [J].Front Neurol,2019,10:1018.
[18]Ebbesen F,Bjerre J V,Vandborg P K.Relation between serum bilirubin levels ≥450μmol/L and bilirubin encephalopathy: a Danish populationbased study [J].Acta Paediatr,2012,101(4):384389.
[19]Kuzniewicz M W,Wickremasinghe A C,Wu Y W,et al.Incidence,etiology,and outcomes of hazardous hyperbilirubinemia in newborns [J].Pediatrics,2014,134(3):504509.
[20]Zhang F,Chen L,Shang S,et al.A clinical prediction rule for acute bilirubin encephalopathy in neonates with extreme hyperbilirubinemia:A retrospective cohort study [J].Medicine (Baltimore),2020,99(9):e19364.
[21]Ardakani S B,Dana V G,Ziaee V,et al.Bilirubin/Albumin ratio for predicting acute bilirubininduced neurologic dysfunction [J].Iran J Pediatr,2011,21(1):2832.
[22]Hulzebos C V,Dijk P H,van Imhoff D E,et al.The bilirubin albumin ratio in the management of hyperbil irubinemia in preterm infants to improve neurodevel opmental outcome:a randomized controlled trial — BARTrial[J].PLoS One,2014,9(6):e99466.
[23]LetamendiaRichard E,Ammar R B,Tridente A,et al.Relationship between transcutaneous bilirubin and circulating unbound bilirubin in jaundiced neonates [J].Early Hum Dev,2016,103:235239.
[24]Wang J,Guo G,Li A,et al.Challenges of phototherapy for neonatal hyperbilirubinemia (Review)[J].Exp Ther Med,2021,21(3):231.
[25]Mishra J P,Mishra J,Padhi R K,et al.Hematological profile in neonatal jaundice [J].J Basic Clin Physiol Pharmacol,2014,25(2):225228.
[专业责任编辑:艾婷]
[中文编辑:郭乐倩;英文编辑:杨周岐]
[收稿日期]2023-11-27
[作者简介]王双双(1986—),女,主治医师,主要从事新生儿疾病研究。
[通讯作者]那利,副主任医师。

