Graves 病患者应用甲巯咪唑导致反应性浆细胞增多症1 例报告及文献复习


[摘 要] 目的:探讨Graves病 (GD) 患者应用甲巯咪唑 (MMI) 治疗后出现粒细胞缺乏症和反应性浆细胞增多症(RP) 的临床表现和实验室检查结果,为临床医生鉴别诊断RP 和多发性骨髓瘤(MM) 提供依据。方法:分析1例GD粒细胞缺乏症并发RP患者的临床表现、实验室检查和诊治过程,并进行文献复习。结果:患者有GD和腹腔感染病史,入院查血常规白细胞计数明显降低且伴有中性粒细胞缺乏,涂片复检见可疑浆细胞。骨髓细胞学检查,骨髓浆细胞百分率为33%,外周血浆细胞百分率为4%;血清免疫球蛋白多克隆性增生;血清免疫固定电泳阴性;流式细胞学分析,浆细胞免疫表型正常。结合病史和实验室检验结果,基本排除MM 可能,符合RP 的诊断。考虑中性粒细胞缺乏与用药有关,暂停MMI,给予粒细胞集落刺激因子升高白细胞数,控制腹腔感染后进行GD 专科治疗。患者预后良好,6个月后随访复查血常规正常。结论:GD患者出现粒细胞缺乏症并发RP在临床上较为罕见,血清免疫固定电泳、血细胞形态学和细胞免疫表型分析有助于明确诊断。积极治疗RP 原发疾病后,患者预后良好。
[关键词] 甲巯咪唑; Graves 病; 浆细胞; 粒细胞缺乏症; 诊断
[中图分类号] R736. 1 [文献标志码] B
毒性弥漫性甲状腺肿又称Graves 病(Graves’ disease, GD), 是全球范围内甲状腺功能亢进最常见的病因,女性的累积终身患病风险为3. 0%, 男性为0. 5% [1]。该病特点是存在促甲状腺激素(thyroid stimulating hormone, TSH) 受体抗体,导致甲状腺激素异常升高[2]。临床治疗方法主要包括服用抗甲状腺药物、131I 治疗和甲状腺切除术[3]。目前我国以抗甲状腺药物作为治疗GD 的首选方法。甲巯咪唑(methimazole, MMI) 是最常用的抗甲状腺药物,虽然临床应用广泛,但其不良反应却不容忽视[4-5]。粒细胞缺乏症是MMI 引起的罕见并发症,发病率为0. 1%~0. 5%,通常在治疗开始后90 d 之内发生[6-8]。患者表现为发热和并发感染,出现原有感染的并发症,严重者会引起感染性休克而危及生命[9]。反应性浆细胞增多症(reactive plasmacytosis,RP) 是由原发疾病引起的骨髓浆细胞增多,常继发于感染、自身免疫性疾病和恶性肿瘤等疾病。RP 的诊断标准为骨髓浆细胞百分率≥3%,一般浆细胞百分率lt;10%,极少数浆细胞百分率gt;20%。本文作者报道1 例应用MMI后出现粒细胞缺乏症和RP 的GD 患者。该患者骨髓浆细胞百分率gt;30%,临床较罕见,目前国内外文献报道[10-14] 较少。本文作者探讨该患者的临床表现、实验室检验结果和诊疗过程,并进行相关文献复习,为该类患者的临床诊疗提供依据。
1 临床资料
1. 1 一般资料 患者,女性,49岁。2022年 4月因心悸、多汗4 个月,间断发热、腹痛3 个月入院。4 个月前出现心悸、多汗、多食和易饥, 伴随消瘦,约半年内体质量减轻10 kg,于当地医院检测甲状腺功能, 三碘甲状腺原氨酸(triiodothyronine,T3) 和四碘甲状腺原氨酸(tetraiodothyronine,T4) 水平升高,TSH 水平降低,甲状腺自身抗体阳性(具体数值不详), 诊断为GD, 给予20 mgMMI 治疗,每日2 次口服。3 个月前因间断发热和腹痛就诊于当地医院, 诊断为“ 阑尾周围脓肿”;查血常规, 中性粒细胞减少; 暂停MMI, 给予抗感染和对症支持治疗后好转出院。2 周前再次发热和腹痛, 体温最高达39 ℃, 当地医院给予对症治疗未见明显好转。入院查体: 体温38. 4 ℃, 脉搏125 min-1,呼吸23 min-1,血压120/70 mmHg,体质量指数为16 kg·m-2。患者呈慢性消耗性病容,双眼球突出。甲状腺Ⅰ度肿大,质地稍软,无压痛,可闻及血管杂音。双手震颤征阳性。双肺呼吸音清,无明显干湿啰音。心律齐,第一心音亢进。腹软,右下腹轻压痛,无反跳痛和肌紧张。
1. 2 甲状腺功能检查 患者入院甲状腺功能检查结果显示: TSH 0. 008 mIU·L-1 (正常值0. 372~4. 940 mIU·L-1),游离T3 5. 95 pmol·L-1 (正常值3. 1~6. 7 pmol·L-1), 游离T4 9. 2 pmol·L-1(正常值12. 0~22. 0 pmol·L-1),抗甲状腺微粒体抗体50. 5% (正常值0%~25%),抗甲状腺过氧化物酶抗体68. 7 IU·mL-1 (正常值0~34. 0 IU·mL-1),TSH抗体20. 53 IU·L-1(正常值0. 10~1. 75 IU·L-1)。
1. 3 血清蛋白电泳 肝功能检查白蛋白20. 51 g·L-1(正常值35. 00~52. 00 g·L-1), 球蛋白46. 9 g·L-1(正常值20. 0~35. 0 g·L-1)。血清蛋白电泳谱图:γ-球蛋白区可见1 个基底较宽的高峰。见图1。
1. 4 免疫球蛋白定量检测和血清免疫固定电泳 患者入院时免疫球蛋白定量检测结果显示:免疫球蛋白G 36. 00 g·L-1 (正常值7. 51~15. 60 g·L-1),免疫球蛋白A 6. 37 g·L-1 (正常值0. 82~4. 53 g·L-1),免疫球蛋白M 3. 74 g·L-1 (正常值0. 46~3. 04 g·L-1),补体C3 0. 65 g·L-1 (正常值0. 79~1. 52 g·L-1),补体C4 0. 12 g·L-1 (正常值0. 16~0. 38 g·L-1),KAP 轻链 3 440 mg · dL-1 ( 正常值629~1 350 mg·dL-1),LAM 轻链 1 730 mg·dL-1 ( 正常值313~723 mg·dL-1), 免疫球蛋白E 360 g·L-1(正常值lt;165 g·L-1)。血清免疫固定电泳阴性。见图2。
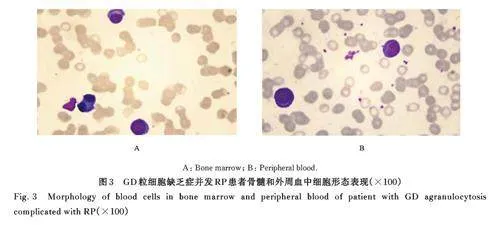
1. 5 血常规和骨髓细胞学检查 患者入院时血常规结果显示: 白细胞计数1. 04 ×109 L-1 [正常值(4. 00~10. 00) ×109 L-1],中性粒细胞绝对值计数0. 04×109 L-1 [正常值(2. 00~7. 00) ×109 L-1],血红蛋白78 g·L-1,血小板计数363×109 L-1 [正常值(100~300) ×109 L-1]。外周血涂片发现可疑浆细胞。
骨髓细胞学检查示骨髓增生欠活跃,中性粒细胞百分率明显降低, 浆细胞百分率为33%, 以成熟浆细胞为主,可见双核浆细胞。外周血计数浆细胞百分率为4%。见图3。
入院第4 天复查血常规和骨髓细胞学检查,血常规结果显示:白细胞计数0. 93×109 L-1,中性粒细胞绝对值计数0. 02×109 L-1, 血红蛋白72 g·L-1,血小板计数352×109 L-1。复查骨髓细胞学结果显示:骨髓增生活跃,可见胞浆颗粒增粗的幼稚粒细胞,考虑粒细胞集落刺激因子治疗后改变,浆细胞百分率约为20%。外周血浆细胞百分率约为4%。见图4。
1. 6 流式细胞学检查 入院第 4天对骨髓标本进行流式细胞学检查, 共检测12 种CD 分子, 包括CD81、CD28、CD200、CD27、CD138、CD19、CD38、CD45、CD20、CD56、Kappa 和Lambda。细胞免疫表型为部分表达CD38、CD138, CD19、CD81 和CD27, 不表达CD56、CD28、CD20 及CD200, Kappa/Lambda 轻链呈多克隆表达, 提示为正常浆细胞。
1. 7 临床诊治和随访 患者有 GD病史,曾采用抗甲状腺药物治疗。入院血常规提示中性粒细胞缺乏,考虑与用药有关,暂停MMI 治疗。患者存在发热和腹痛, 腹部电子计算机断层扫描(computed tomography,CT) 提示:回肠远端及右半结肠弥漫改变,考虑炎性肠病可能性大;回肠末端肠壁后缘改变,不除外局部穿孔;回盲部周围系膜内渗出,伴局限性腹膜炎;小肠不全梗阻;回结肠系膜多发淋巴结轻度增大。目前患者腹腔复杂感染,同时存在粒细胞缺乏症,给予粒细胞集落刺激因子治疗,待白细胞水平恢复后择期手术。外周血涂片镜检见可疑浆细胞,需明确浆细胞来源。血清免疫固定电泳结果阴性,提示无单克隆免疫球蛋白增生。血清免疫球蛋白定量检测显示:IgG、IgA、IgM 和IgE 升高,考虑增生的浆细胞为多克隆免疫球蛋白来源。骨髓细胞学检查显示:浆细胞百分率明显升高,以成熟浆细胞为主,结合病史和腹腔感染情况, 考虑RP 可能性大。患者胸腹部CT 未见明显骨质破坏。流式细胞术检测显示:增生的浆细胞无异常免疫表型,基本排除MM,符合RP 的诊断。该患者积极控制腹腔感染后进行GD 专科治疗,预后良好。6 个月后复查显示:全血细胞计数结果恢复正常,白细胞计数5. 71×109 L-1,中性粒细胞绝对值计数2. 98×109 L-1, 红细胞计数5. 01×109 L-1, 血红蛋白129 g·L-1, 血小板计数214×109 L-1。
2 讨 论
GD 患者采用抗甲状腺药物导致粒细胞缺乏症与用药剂量、治疗持续时间和患者特征有关。MMI 治疗剂量在30~60 mg·d-1 时,粒细胞缺乏症的发生率为1. 0% [15], 治疗剂量达到120 mg·d-1时, 粒细胞缺乏症的发生率升至8% [16]。KAMITANI 等[17]研究显示:GD 患者应用抗甲状腺药物的72 d 内易出现粒细胞缺乏症,此后6 年内粒细胞缺乏症发病率逐渐降低。NAKAMURA 等[18]分析754 例应用抗甲状腺药物引起粒细胞缺乏症的患者,发现女性粒细胞缺乏症发生率是男性的6. 3倍。此外, 高龄也是粒细胞缺乏症的危险因素, 研究[19] 显示:40 岁以上患者应用MMI 后,发生粒细胞缺乏症的风险是40 岁以下患者的6. 4 倍。
抗甲状腺药物引起粒细胞缺乏症的病理生理学原因目前主要有以下2 种假说:其一是体内药物被中性粒细胞氧化并转化为活性物质,诱导免疫反应发生。免疫反应由作用于早期粒细胞发育的髓过氧化物酶介导,导致粒细胞成熟受阻[6];其二是免疫机制介导,GD 患者体内存在抗中性粒细胞胞浆的循环抗体,对粒细胞内的特定颗粒产生反应,诱发粒细胞缺乏症[20]。此外, 个体基因型也可影响粒细胞缺乏症的发生, 研究[21-22] 显示: 人类白细胞抗原(human leukocyte antigen,HLA)-B*38:02 和HLA-DRB1*08:03 基因单倍型是粒细胞缺乏症发生的危险因素。
该GD 患者采用MMI 治疗1 个月后出现粒细胞缺乏症,随后发生腹腔感染引起RP。临床中粒细胞缺乏症并发RP 患者较为罕见。对于骨髓浆细胞百分率gt;20% 的RP 患者, 要与MM 进行鉴别诊断。首先,二者的发病原因不同,RP 是继发于感染、自身免疫性疾病和恶性肿瘤等疾病的反应性骨髓浆细胞增多,浆细胞本质是良性;MM 是以骨髓内浆细胞单克隆性增生为特征, 分泌单克隆免疫球蛋白或轻链。其次,二者的发病年龄有所不同,RP 可见于不同年龄患者, 40 岁以下患者发生RP的可能性更大;MM 的发病人群以中老年为主。再次,二者发热和贫血的原因不同[23-24]。MM 患者的发热由异常增生的单克隆免疫球蛋白抑制正常多克隆免疫球蛋白合成而发生感染引起发热,贫血由骨髓异常增生的浆细胞抑制红细胞增生导致,而且血清大量单克隆免疫球蛋白从尿液排出,引发肾功能损害,导致红细胞生成素减少,加重贫血。RP 患者的发热和贫血由感染性疾病、自身免疫性疾病及恶性肿瘤等原发性疾病导致。MM 患者多伴随骨痛和病理性骨折,在RP 患者中比较少见[25]。
在临床工作中,仅通过患者的临床表现进行鉴别诊断存在一定难度,需结合实验室检查结果进行综合分析。MM 异常增生的单克隆免疫球蛋白在免疫固定电泳中会出现特异性条带,而RP 的免疫球蛋白为多克隆性增生,免疫固定电泳阴性。此外,细胞形态学分析也是鉴别二者的重要方法。MM 患者骨髓中浆细胞多呈局灶性增生, 表现为成簇分布,浆细胞体积较大,形态较不规则,可见伪足,胞浆丰富,空泡较多,有时可出现少量火焰状浆细胞,80% 以上患者骨髓可见不成熟浆细胞;而RP患者骨髓浆细胞多散在分布,细胞大小中等,形态较规则,胞浆量中等,染灰蓝色,细胞核较小且偏位,多为成熟浆细胞,极少出现幼稚浆细胞。在外周血涂片中, 约30% 的MM 患者可见浆细胞, 而RP 患者外周血出现浆细胞的概率仅为3%。二者在红细胞形态方面也存在差异, 78% 的MM 患者可见红细胞缗钱状排列,只有7% 的RP 患者可见类似改变[26-27]。对于浆细胞形态不典型的病例,可采用流式细胞学方法检测细胞免疫表型,从分子层面进行鉴别诊断。MM 患者浆细胞异常表达CD56,RP 患者浆细胞CD56 基本阴性。随着检验技术的不断发展,实验室查结果有可能为临床提供更多有价值的诊断依据[28]。
综上所述,部分GD 患者在采用抗甲状腺药物后可出现粒细胞缺乏症。当患者存在原发感染时,粒细胞缺乏症会加重感染症状。由于骨髓细胞受到抑制,患者发生RP 时浆细胞百分率增高比较明显,临床诊断易与MM 混淆。对于该类患者应结合患者病史和实验室检验结果明确诊断,并给予以针对性治疗。
利益冲突声明:所有作者声明不存在利益冲突。
作者贡献声明:李时孟、齐新和林思彤参与论文选题及病例分析,李时孟和伞湘雯参与文献查阅和论文撰写, 金玲参与论文审校。
[参考文献]
[1] SMITH TJ HL. Graves’ Disease[J]. N Engl J Med,
2016, 375(16):1552-1565.
[2] CONSTANTINESCU S M, HOSPEL J,
DAUMERIE C, et al. Significance of thyroperoxidase
and thyroglobulin antibodies in medically treated Graves’
disease[J]. Eur Thyroid J, 2023, ETJ-23-0193.
[3] HOANG T D, STOCKER D J, CHOU E L, et al.
2022 update on clinical management of Graves disease
and thyroid eye disease[J]. Endocrinol Metab Clin North
Am, 2022, 51(2): 287-304.
[4] 沈 维, 朱 远, 刘 昭, 等. 药物难治性Graves 病
131I 治疗疗效分析[J]. 标记免疫分析与临床, 2023, 30(9):
1454-1460.
[5] LI P, WANG W, YAN M Q, et al. Different doses of
methimazole treatment of children and adolescents with
Graves’ disease: a clinical study based on 161 cases of
outpatients[J]. BMC Endocr Disord, 2023, 23(1): 233.
[6] VICENTE N, CARDOSO L, BARROS L, et al.
Antithyroid drug-induced agranulocytosis: state of the
art on diagnosis and management[J]. Drugs R D, 2017,
17(1): 91-96.
[7] CHAUDHRY L A , MAUZEN K F , BA-ESSA E ,
et al. Antithyroid drug induced a granulocytosis: what
still we need to learn?[J]. Pan Afr Med J, 2016, 23: 27.
[8] XIAO F, LI C Y, YOU L S, et al. Massive
plasmacytosis with severe marrow suppression induced
by methimazole in Graves’ disease patients: case report
and literature review[J]. Int J Clin Exp Med, 2014,
7(10): 3605-3608.
[9] BREIER D V, RENDO P, GONZALEZ J, et al.
Massive plasmocytosis due to methimazole-induced bone
marrow toxicity[J]. Am J Hematol, 2001, 67(4):
259-261.
[10]YAMAMOTO A, KATAYAMA Y, TOMIYAMA
K, et al. Methimazole-induced aplastic anemia caused by
hypocellular bone marrow with plasmacytosis [J].
Thyroid, 2004, 14(3): 231-235.
[11]OH E J, CHAE H J, PARK Y J, et al.
Agranulocytosis, plasmacytosis, and thrombocytosis
due to methimazole-induced bone marrow toxicity[J].
Am J Hematol, 2007, 82(6): 500.
[12]KHINE A, DHILLON K, JO L, et al. Two cases of
methimazole-induced agranulocytosis with their risk
factors[J]. AACE Clin Case Rep, 2022, 8(2): 82-84.
[13]YANG J, ZHU Y J, ZHONG J J, et al. Characteristics
of antithyroid drug-induced agranulocytosis in patients
with hyperthyroidism : a retrospective analysis of
114 cases in a single institution in China involving
9 690 patients referred for radioiodine treatment over
15 years[J]. Thyroid, 2016, 26(5): 627-633.
[14]GARCÍA GÓMEZ C, NAVARRO E, ALCÁZAR V,
et al. Therapeutic management and long-term outcome of
hyperthyroidism in patients with antithyroid-induced
agranulocytosis: a retrospective, multicenter study[J].
J Clin Med, 2023, 12(20): 6556.
[15]MEYER-GESSNER M, BENKER G,
LEDERBOGEN S, et al. Antithyroid drug-induced
agranulocytosis: clinical experience with ten patients
treated at one institution and review of the literature[J].
J Endocrinol Invest, 1994, 17(1): 29-36.
[16]WIBERG J J, NUTTALL F Q. Methimazole toxicity
from high doses[J]. Ann Intern Med, 1972, 77(3):
414-416.
[17]KAMITANI F, NISHIOKA Y, KOIZUMI M, et al.
Antithyroid drug-induced leukopenia and G-CSF
administration: a long-term cohort study[J]. Sci Rep,
2023, 13(1): 19336.
[18]NAKAMURA H , MIYAUCHI A , MIYAWAKI N ,
et al. Analysis of 754 cases of antithyroid drug-induced
agranulocytosis over 30 years in Japan [J]. J Clin
Endocrinol Metab, 2013, 98(12): 4776-4783.
[19]COOPER D S. Agranulocytosis associated with
antithyroid drugs[J]. Ann Intern Med, 1983, 98(1): 26.
[20]AKAMIZU T, OZAKI S, HIRATANI H, et al. Druginduced
neutropenia associated with anti-neutrophil
cytoplasmic antibodies (ANCA): possible involvement
of complement in granulocyte cytotoxicity[J]. Clin Exp
Immunol, 2002, 127(1): 92-98.
[21]CHEN P L, SHIH S R, WANG P W, et al. Genetic
determinants of antithyroid drug-induced agranulocytosis
by human leukocyte antigen genotyping and genomewide
association study[J]. Nat Commun, 2015, 6:
7633.
[22]CHEUNG C L, SING C W, TANG C S, et al. HLAB*
38: 02: 01 predicts carbimazole/methimazole-induced
agranulocytosis[J]. Clin Pharmacol Ther, 2016, 99(5):
555-561.
[23]ZHANG J J, YAN X J, LI Y, et al. Reactive
plasmacytosis mimicking multiple myeloma associated
with SFTS virus infection: a report of two cases and
literature review[J]. BMC Infect Dis, 2018, 18(1): 528.
[24]ABRAMSON H N. Immunotherapy of multiple
myeloma: current status as prologue to the future[J].
Int J Mol Sci, 2023, 24(21): 15674.
[25]ZHONG W H, ZHANG X Y, ZHAO M, et al.
Advancements in nanotechnology for the diagnosis and
treatment of multiple myeloma[J]. Biomater Sci, 2020,
8(17): 4692-4711.
[26]李景岗. 多发性骨髓瘤与反应性浆细胞增多症临床表现
及细胞形态学鉴别[J]. 吉林医学, 2012, 33(6):
1172-1173.
[27]杨 红. 多发性骨髓瘤与反应性浆细胞增多症细胞形
态学的探讨[J]. 中国实用医药, 2015, 10(20): 22-23.
[28]郭慧霞, 王立茹, 邢嘉屿, 等. 达雷妥尤单抗治疗多发
性骨髓瘤致乙肝病毒再激活1例报告并文献复习[J].
中国实用内科杂志, 2024, 44(7): 614-616.

