纳米甲壳素的分散性及其对再生纤维素膜的增强性能研究




摘要: 将纳米甲壳素与纤维素复合可解决再生纤维素制品力学性能偏低的问题,但因复合过程纳米颗粒易团聚限制了其增强效果。为提升分散效果,本文研究了纳米甲壳素在水(H2O)、四乙基氢氧化铵水溶液(TEAOH/H2O)、不同质量分数尿素水溶液(Urea/H2O)、二甲基亚砜(DMSO)等试剂中的分散性,发现DMSO对纳米甲壳素的分散相对更优。将不同质量分数纳米甲壳素/DMSO添加到纤维素/TEAOH/H2O溶液中制备得到再生纤维素复合膜,并对复合膜的结构、形貌、力学性能进行表征。结果表明,当纳米甲壳素添加量为9%时,复合膜力学性能最佳,断裂强度和断裂伸长率较空白样增长54%和150%;9%纳米甲壳素的添加有助于复合膜引入酰胺基团和提高结晶度,且纳米甲壳素在复合膜中总体分散较均匀,无明显聚集现象。
关键词: 纳米甲壳素;二甲基亚砜;分散性;四乙基氢氧化铵;再生纤维素复合膜
中图分类号: TS102.51
文献标志码: A
文章编号: 10017003(2024)12期数0088起始页码08篇页数
DOI: 10.3969/j.issn.1001-7003.2024.12期数.009(篇序)
近年来,高结晶度、高强度的纳米甲壳素(Nano-Chitin,NC)因具备良好的可再生性、生物降解性、生物相容性等诸多优良特性而备受瞩目。此外,因其化学结构与纤维素结构相似,常被用于增强纤维素复合材料的机械性能,如纤维素复合薄膜[1]、纤维素复合纤维[2]、纤维素复合水凝胶[3]等。纳米甲壳素的增强作用与其在复合材料中的均匀分散性密切相关。当纳米填料均匀分散在聚合物基体中时,它们会形成纠缠网络,在微观和宏观层面上呈现均匀的分散体,这有助于延长复合材料的使用寿命;当纳米填料分散性差而团聚时,在聚合物基体内引入应力点并减小表面积,最终导致复合材料机械性能的降低[4]。
因此,复合过程中必须保证纳米甲壳素的均匀分散,但未经表面改性的纳米甲壳素常常受到pH值、离子强度、温度和浓度的影响[5],容易发生团聚而影响后续应用。为了减少纳米甲壳素的团聚,研究人员常采用表面改性引入带电基团或接枝长链聚合物,通过静电互斥或空间位阻效应提高其分散性,如引入羧基、吸附十六烷基三甲基溴化铵等[6-7]。但化学改性过程中可能会破坏纳米甲壳素的优良性能,且操作较复杂。
相比之下,利用适宜的分散剂分散纳米甲壳素操作更简单、高效。水是最常见的分散剂之一,由于纳米甲壳素表面氨基或羧基等离子基团的解离,其可以在水中形成稳定的分散体[8]。然而,当纳米甲壳素水分散液质量分数达到0.5%~0.6%时,水分散液中的纳米甲壳素会发生严重聚集[9]。已有研究显示,在水溶液中添加7 M尿素,可以有效延缓甲壳素离子衍生物的聚集[10];尿素能够实现高浓度纳米材料(即原始氮化硼纳米片、石墨烯纳米板和碳纳米管)在纤维素水溶液中的均匀分散和长期稳定[11];此外,具有羧酸钠基团的TEMPO氧化纳米纤维素可以利用有机溶剂(二甲基亚砜等)进行纳米级分散[12]。但在目前的研究中,关于尿素、二甲基亚砜对纳米甲壳素悬浮液的分散性研究仍相对较少。
为了进一步研究纳米甲壳素的分散剂对其分散性及对再生纤维素薄膜的增强作用,本文首先通过透光率、浊度测试、离心沉降实验探究了纳米甲壳素在水(H2O)、四乙基氢氧化铵水溶液(TEAOH/H2O)、不同质量分数尿素水溶液(Urea/H2O)、二甲基亚砜(DMSO)等试剂中的分散性,选取相对最优的分散剂用于分散纳米甲壳素。随后,选取季铵碱体系中的四乙基氢氧化铵水溶液(TEAOH/H2O)为纤维素溶剂,其可实现室温下高效快捷地溶解纤维素且溶解度较高。将不同质量分数纳米甲壳素/分散剂添加到纤维素溶液中制备再生纤维素复合膜,通过改变纳米甲壳素添加量研究对复合膜力学性能的增强作用,对促进再生纤维素复合膜材料的研究与发展、拓宽其应用范畴有重要意义。
1 实 验
1.1 试剂与仪器
聚合度504棉浆粕(山东英力实业有限公司),2,2,6,6-四甲基哌啶-1-氧化物(TEMPO)(上海麦克林生化科技有限公司),甲壳素、溴化钠(NaBr)(上海百灵威化学技术有限公司),含有效氯>5%次氯酸钠溶液(NaClO)、尿素(Urea)、氢氧化钠(NaOH)、无水硫酸钠(Na2SO4)、浓硫酸(H2SO4)(国药集团化学试剂有限公司),25%四乙基氢氧化铵水溶液(TEAOH/H2O)(上海阿拉丁生化科技股份有限公司),二甲基亚砜(DMSO)(上海泰坦科技股份有限公司)。以上试剂均为分析纯,所用溶液使用去离子水配置。
DS-L30型超声波清洗机(上海生析超声仪器有限公司),TG16-W型台式离心机(上海卢湘仪离心机仪器有限公司),RV3FLEX型旋转蒸发仪(德国艾卡公司),TB100型浊度计(上海般特仪器有限公司),TU-1810型紫外分光光度计(北京普析通用仪器有限责任公司),SU8100型场发射扫描电子显微镜、SDD型电制冷能谱仪(日本日立株式会社),MIT-1TN型电子万能试验机(常州三丰仪器科技有限公司),Nicolet is10型傅里叶红外光谱仪(美国赛默飞世尔科技有限公司),BruckerD8型X射线衍射仪(德国布鲁克AXS有限公司)。
1.2 实验样品制备
纳米甲壳素水分散液的制备:根据Fan等[13]的研究方法制备纳米甲壳素,称取1.0 g甲壳素、0.016 gTEMPO、0.1 gNaBr,100 g水,室温下充分搅拌混合后,逐滴滴加一定量的NaClO溶液,氧化反应过程中通过滴加NaOH溶液维持混合溶液pH值为10左右,6 h后反应结束。将甲壳素离心洗涤至中性后分散在适量去离子水中,超声处理30 min,获得质量分数为0.2%的纳米甲壳素水分散液,其中纳米甲壳素标记为NC。
纳米甲壳素/分散剂的制备:取15 gNC水分散液分散在6 gDMSO中,超声分散混合均匀,旋蒸去除所有水分,获得质量分数为0.5%的NC/DMSO悬浮液。再分别称取15 gNC水分散液分散在6 g的H2O、35%TEAOH/H2O、20%Urea/H2O、25%Urea/H2O、30%Urea/H2O中,旋蒸去除部分水分,使得NC质量占悬浮液总质量的0.5%,最终制得质量分数为0.5%的NC/分散剂悬浮液。
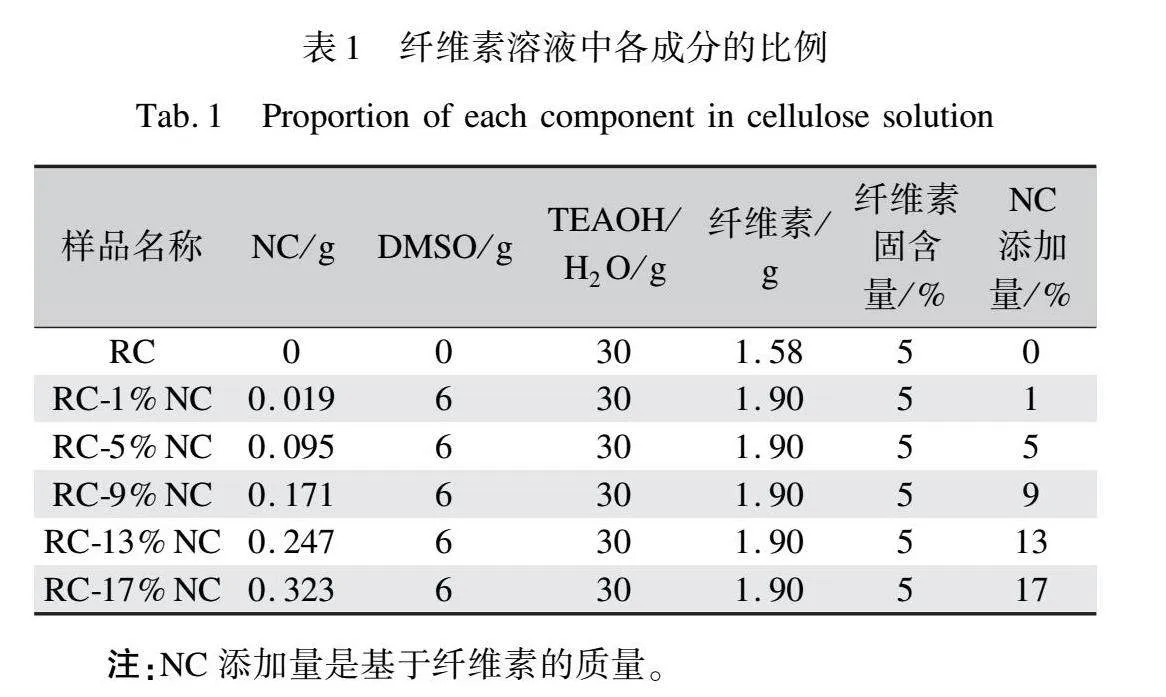
再生纤维素膜及复合膜的制备:称取1.9 g纤维素加入30 gTEAOH/H2O(35%),室温下机械搅拌15 min,将不同混合比例的NC/DMSO悬浮液与纤维素溶液混合,具体混合比例如表1所示,机械搅拌20 min使NC分散均匀。混合溶液静置脱泡后,在室温条件下倒入聚四氟乙烯模具中铺膜,浸入10%H2SO4/20%Na2SO4凝固浴中再生后,去离子水反复洗涤,室温条件下自然风干24 h,即得到固含量为5%的再生纤维素膜与复合膜,分别标记为RC、RC-1%NC、RC-5%NC、RC-9%NC、RC-13%NC、RC-17%NC。
1.3 测试与表征
1.3.1 浊度测试
利用TB100型浊度计进行NC/分散剂悬浮液浊度测试,将浊度计调零与校准后进行测试,每个样品设置3组平行样,测试取平均值。6种分散剂的浊度值在0~0.28 NTU,排除原料中的杂质及配置过程的污染,浊度值近似为0 NTU。
1.3.2 透光率测试
利用TU-1810型紫外可见分光光度计进行NC/分散剂悬浮液透光率测试,以分散剂为参考背景扫描,依次对NC/分散剂悬浮液进行透光性扫描。每个样品设置3组平行样,测试取平均值。
1.3.3 离心沉降实验
利用TG16-WS型台式离心机将NC/分散剂经过8 000 r/min离心5 min,收集下层沉淀,烘干后称重。
1.3.4 傅里叶红外光谱(FTIR)表征
利用Nicolet is10型傅里叶红外光谱测试仪对NC、甲壳素、再生纤维素膜及复合膜进行测试,测试范围从4 000~500 cm-1,分辨率为2 cm-1。
1.3.5 X射线衍射(XRD)表征
利用BruckerD8型X射线衍射仪对NC、甲壳素、再生纤维素膜及复合膜进行测试,扫描2θ角度范围从5°至50°,扫描速度3°/min。使用Jade软件处理XRD图谱,并计算各特征衍射面的衍射峰面积,根据下式求得结晶度值(CrI)。
CrI/%=FKFK+FA×100(1)
式中:FK表示结晶区面积;FA表示非结晶区面积。
1.3.6 扫描电子显微镜、能谱仪(SEM、EDS)表征
利用SU8100型冷场发射扫描电子显微镜对NC的形貌进行表征:将质量分数0.01%纳米甲壳素水分散液滴在单晶硅片上,60 ℃烘干、喷金后观察,NC的长度和宽度利用Image J软件通过计数至少500个纳米纤维测量;
利用SU8100型冷场发射扫描电子显微镜对再生纤维素膜及复合膜表面、断面的形貌进行表征:制样时采用液氮对薄膜脆断,将表面与断面喷金后观察;
利用SDD型电制冷能谱仪对复合膜中氮元素的分布与含量进行表征:扫描选定区域获得元素Mapping图,并进行EDS能谱观察,重点标记氮元素。
1.3.7 力学性能测试
利用MIT-1TN型电子万能试验机测定再生膜干态、湿态下的力学性能,测试前将再生膜在恒温恒湿箱中预调湿24 h。测定干态强度时,将试样裁剪至40 mm×10 mm,夹持距离设置为20 mm,拉伸速度设置为20 mm/min;测定湿态强度时,将复合膜裁剪至40 mm×10 mm后,浸入去离子水中10 min,擦去表面水分后迅速在万能试验机上进行拉伸测试。每个样
品设置5组平行样,取其平均值。
2 结果与分析
2.1 纳米甲壳素的结构表征
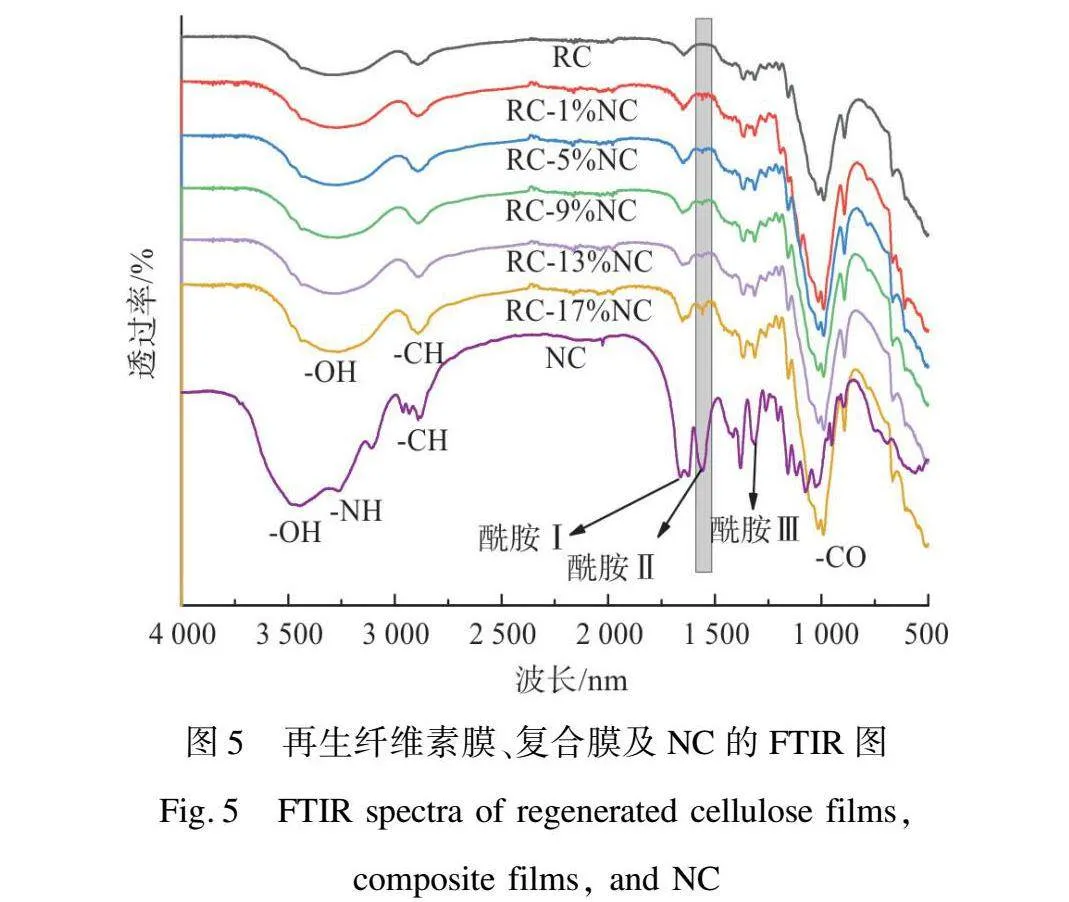
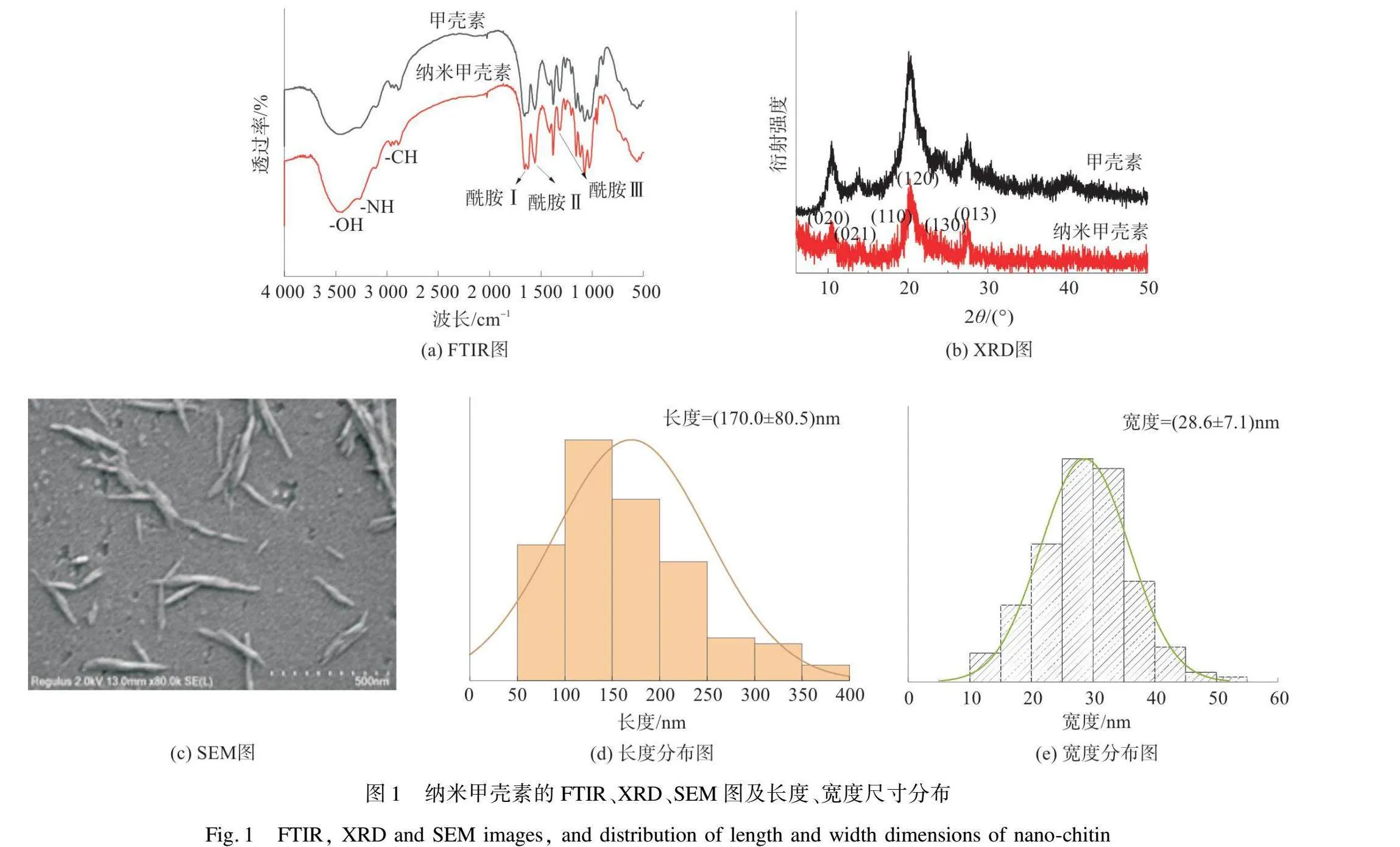
由图1(a)FTIR图可知,纳米甲壳素的光谱与原始甲壳素粉末的光谱基本吻合,—OH的伸缩振动吸收峰(3 442 cm-1)、—NH的伸缩振动吸收峰(3 257 cm-1)、—CH的伸缩振动吸收峰(2 932 cm-1和2 876 cm-1)。此外,1 660 cm-1和1 622 cm-1处特征吸收峰与α-甲壳素乙酰胺基团的酰胺Ⅰ区相关,1 556 cm-1处吸收峰与酰胺Ⅱ区相关,1 315 cm-1处吸收峰与酰胺Ⅲ区相关[14]。
由图1(b)XRD图可知,NC在2θ=9.4°、12.7°、19.3°、20.8°、23.2°、26.2°处有明显的甲壳素特征衍射峰,分别对应着(020)(021)(110)(120)(130)和(013)晶面。NC结晶度约为70%,甲壳素结晶度约为38%,这说明氧化去除非晶区的过程中并未严重破坏结晶区,使得NC保持了高结晶度状态。由图1(c)的SEM图可知,NC呈现短棒状,长度为(1700±80.5)nm,宽度为(28.6±7.1)nm。
2.2 纳米甲壳素在不同分散剂中的分散性
2.2.1 透光率、浊度测试
纳米甲壳素的分散性主要指是纳米甲壳素在介质(如气体、液体或固体)中分布的均匀程度及这种分布状态随时间的
变化情况。纳米甲壳素在分散剂中均匀分散的状态有助于降低团聚现象,对于后续充分利用其优异的物理化学性能至关重要,本文首先采用透光率、浊度作为评价指标,分析纳米甲壳素在不同分散剂中分布的均匀程度。
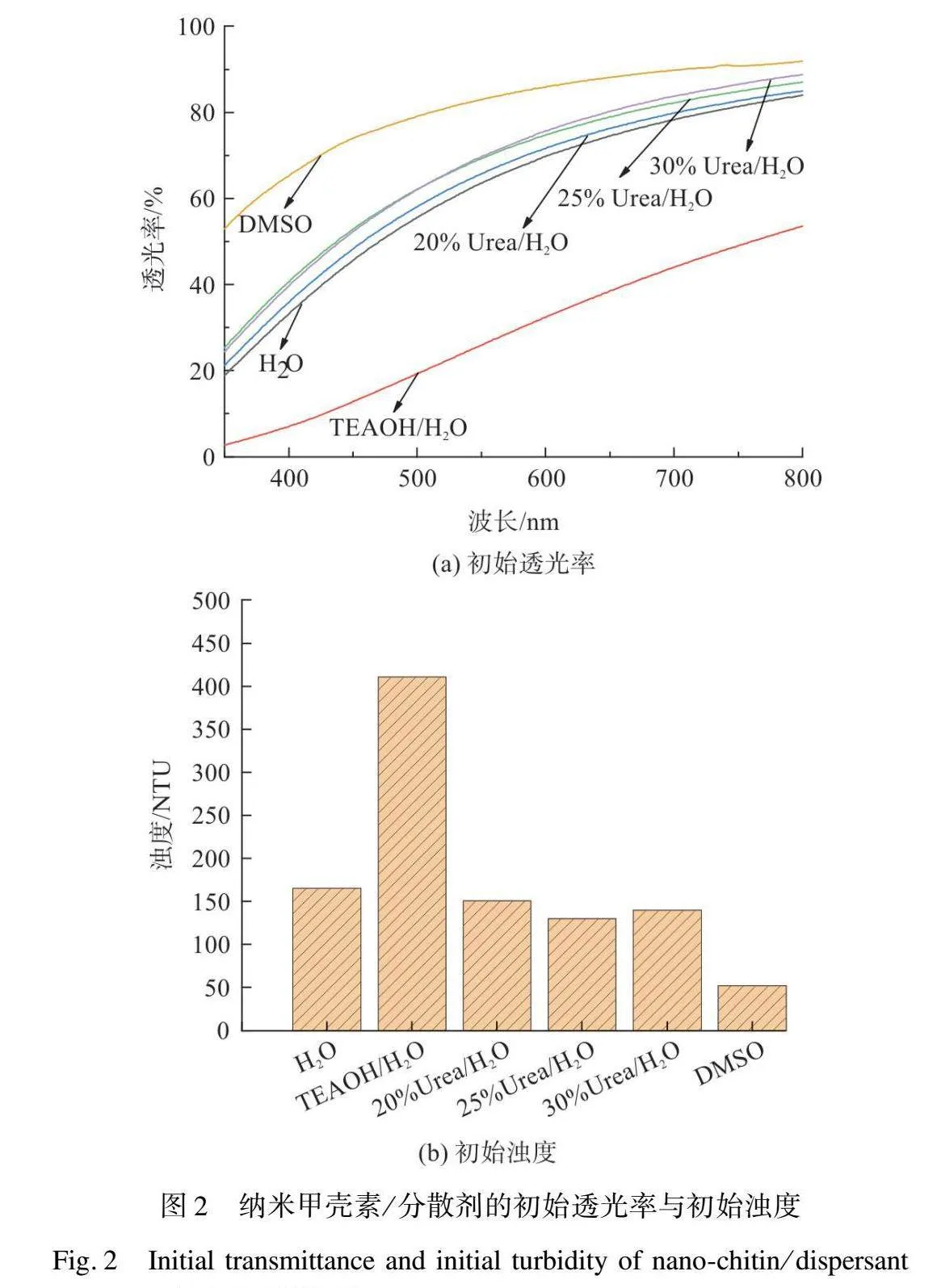
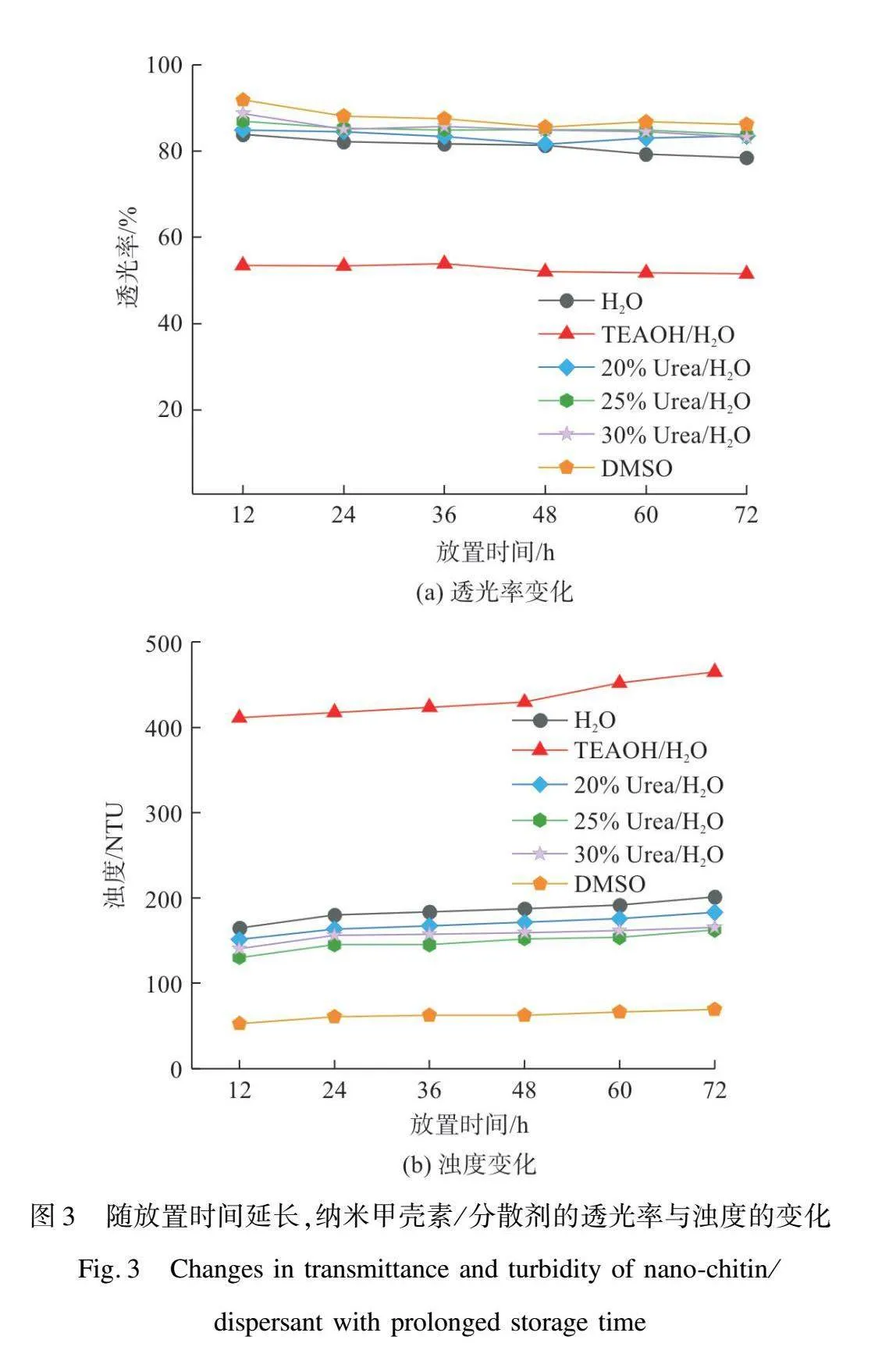
图2为NC在H2O、TEAOH/H2O、20%Urea/H2O、25%Urea/H2O、30%Urea/H2O、DMSO中形成的悬浮液在波长800 nm处的初始透光率与初始浊度。由图2(a)可知,当分散剂为DMSO时,透光率可达92%,浊度值为52 NTU,表明NC在DMSO中呈良好分散的状态。图3为随放置时间延长,NC/分散剂悬浮液透光率与浊度的变化情况。随着放置时间的延长,NC/DMSO悬浮液的透光率仍保持较高水平(90%~92%),浊度保持在50 NTU左右,说明NC在DMSO中具有较好的分散性。而当分散剂为H2O、TEAOH/H2O、20%Urea/H2O、25%Urea/H2O、30%Urea/H2O时,透光率分别为84%、54%、85%、87%、89%,浊度分别为164.7、411.1、1512、1301、140.4 NTU。由此可见,其他分散剂对NC的分散情况远不如DMSO。
2.2.2 离心沉降测试
分散性不仅涉及物质在空间上的分布状态,还与时间因素密切相关,以考察物质能否长时间保持其分散状态,即分散稳定性。为了能够有效地评估纳米甲壳素在溶剂中的分散稳定性,最简单的方法之一是静置沉降法,可以直接观测到纳米甲壳素的分散状态。但由于其耗时较长、进程缓慢,并且实验结果难以进行精确量化,本文采用离心沉降法加快沉降过程,作为分析颗粒在溶剂中分散稳定性的一个辅助手段。
纳米甲壳素/分散剂离心前、后的实物如图4所示,NC/H2O、NC/TEAOH/H2O、NC/Urea/H2O、NC/DMSO高速离心后的沉降率分别为9.6%、95.6%、0%、0%。经过高速离心后,NC/H2O、NC/TEAOH/H2O中的NC团聚形成细小沉淀,少部分沉淀悬浮在上清液中,这导致NC/H2O、NC/TEAOH/H2O透光率的明显下降;NC/Urea/H2O未产生明显的沉淀,但透光率明显下降,这可能是由于在离心作用下上层清液中的NC也发生一定程度的聚集;NC/DMSO不仅没有出现明显的团聚和沉降现象,而且透光率也几乎没有变化,这说明NC在DMSO中分散的最稳定,Urea/H2O次之,H2O、TEAOH/H2O最差。分析认为,具体的分散机理是:在水溶液中,由于重复单元(不仅是N-乙酰基-d-氨基葡萄糖)之间的氢键和疏水相互作用的组合,甲壳素离子衍生物可能会发生聚集现象,而Urea恰好可以破坏甲壳素之间的氢键并且削弱水溶液中的疏水相互作用,有助于抑制甲壳素的聚集[10],从而提高NC的分散稳定性;在有机溶剂DMSO中,DMSO的化学结构、介电常数和黏度可能对NC的静电排斥、渗透效应有一定的影响[12],从而对于NC的分散性也产生影响。
2.3 纳米甲壳素添加量对复合膜结构与性能的影响
2.3.1 复合膜化学结构分析
图5为再生纤维素膜、复合膜及NC的FTIR图。对比再生纤维素膜与复合膜的FTIR图,两者具有相似的吸收峰,3 440、2 910、1 632 cm-1吸收峰分别为纤维素的—OH拉伸振动吸收峰、—CH的拉伸振动吸收峰、吸附水中—OH的弯曲振动吸收峰[15]。唯一不同的是,复合膜在1 550 cm-1附近出现较弱的吸收峰,该峰隶属于甲壳素酰胺Ⅱ,随着NC添加量的增加,该特征峰的强度逐渐增强。
2.3.2 复合膜结晶结构分析
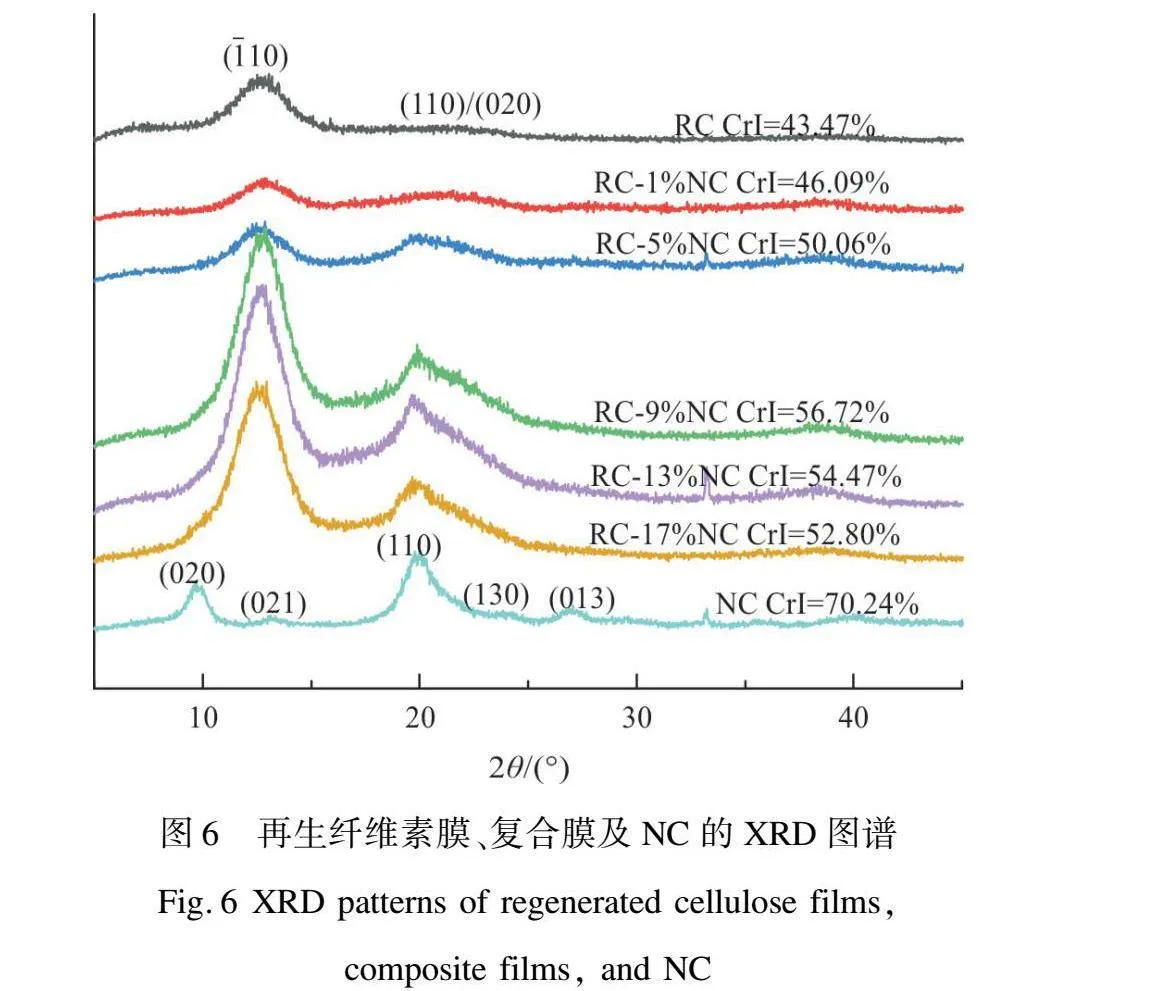
图6为再生纤维素膜、复合膜及NC的XRD图谱。再生纤维膜表现出明显的纤维素Ⅱ晶体结构,在2θ=12.2°、22.1°处有明显的衍射峰,分别对应着(110)和(110)/(020)重叠晶面,复合膜与再生纤维素膜的XRD特征峰位置基本一致,但衍射峰强度有明显的波动。当NC添加量为1%、5%时,复合膜(110)/(020)重叠晶面的衍射峰强度有小幅增强;当NC添加量为9%时,随着晶面(110)、(110)/(020)重叠晶面两处的衍射峰强度的显著增强,结晶度也显著提高;然而,继续提高添加量到13%、17%,各衍射峰强度缓慢减弱,伴随着结晶度的降低。这可能是由于适量NC加入有助于诱导纤维素基体结晶,使复合膜结晶度有所提高,而一旦NC过量可能会产生聚集,其与纤维素分子之间的相互作用对分子结构排列产生一定影响,从而导致结晶度的下降。
2.3.3 复合膜形貌结构分析及元素分析
图7为再生纤维素膜与复合膜的表面、断面SEM图。由图7(a~d)可见,再生纤维素膜的表面呈现相对平滑的形态,适量NC的添加(1%、9%)增加了复合膜表面的粗糙度和不均匀性,但整体看来没有明显缺陷、较为平整。由图7(e~h)可见,再生纤维素膜的断面结构无明显孔隙,总体较平整;当NC添加量为9%时,复合膜的断面结构呈现更加致密、均匀的结构,这有利于复合膜力学性能的增强;当添加量增加至17%时,复合膜断面出现明显的分层,这可能是因为基体溶液是黏度较高的黏稠液体,纳米甲壳素含量过高时易分散不匀、粒子部分团聚,从而造成复合膜的均匀性有所下降[16]。
图8为复合膜中的氮元素EDS扫描图。由图8可见,复合膜中存在微量的氮元素表明了NC的存在,其中复合膜RC-1%NC、RC-9%NC、RC-17%NC表面的氮元素含量分别为76%、8.7%、9.6%,断面的氮元素含量分别为5.6%、7.2%、8.1%,这表明NC更倾向于分布在复合膜的表面。在1%NC添加量条件下,氮元素分散较稀疏,随着NC添加量的增加(9%、17%),氮元素分散更加紧密,同时呈现相对均匀的分布,这表明NC在复合膜中相对分散较均匀,表面分布稍多一些。但当添加量过大(17%)时,有轻微聚集现象,与SEM的分析结果相一致。
2.3.4 复合膜力学性能分析
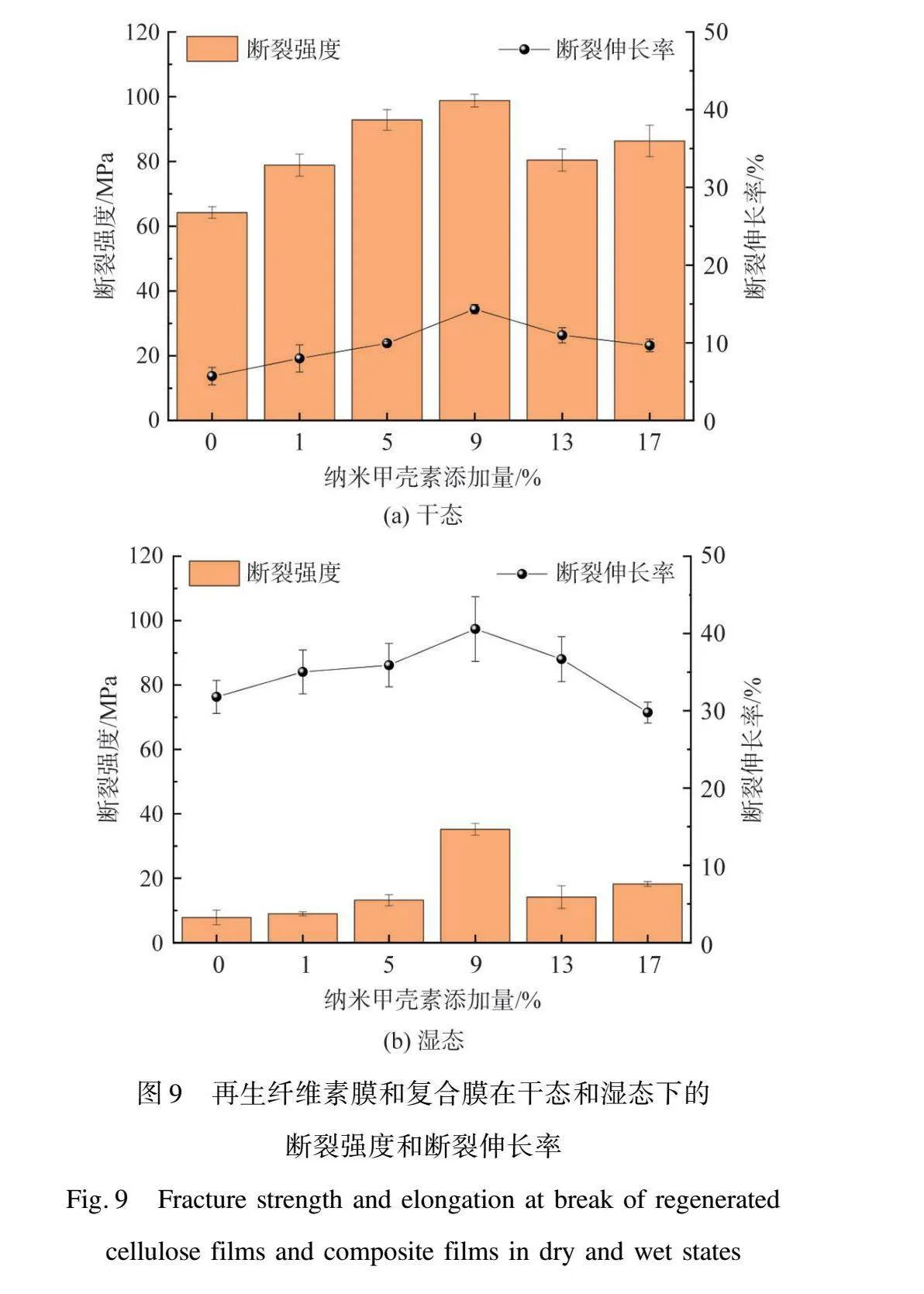
图9为再生纤维素膜和复合膜在干态和湿态下的断裂强度和断裂伸长率。由图9(a)可见,干态下固含量为5%的纯再生纤维素膜力学性能较差,断裂强度仅为64.2 MPa,断裂伸长率只有5.7%。添加NC后力学性能显著提高,当添加量为9%时,干态下复合膜断裂强度达到最大值98.8 MPa,断裂伸长率达14.3%。此外,由图9(b)可见,适量NC的添加一定程度上也增强了复合膜的湿强度。当添加量为1%~9%时,由于NC和纤维素基体间的强相互作用及良好的界面性质,使得应力能够实现从弱的纤维素基体到强NC的有效转移[17],同时又因为结晶度及表面、断面均匀性的提高,所以在NC添加量较低时就能极大地提高复合膜的力学性能。但当NC添加量大于9%,逐渐增加至13%、17%时,断裂强度和断裂伸长率轻微下降,这可能是因为NC发生团聚造成薄膜均匀性有所下降,从而导致力学性能下降。
3 结 论
本文通过透光率、浊度测试、离心沉降实验等探究了NC在H2O、TEAOH/H2O、20%Urea/H2O、25%Urea/H2O、30%Urea/H2O、DMSO六种分散剂中的分散性,并考察了NC添加量对复合膜的化学结构、结晶结构、微观形貌、力学性能的影响,发现并得出以下结论:
1) TEMPO氧化法制备的NC在DMSO中的分散性最好,0.5%NC/DMSO悬浮液在800 nm处的初始透光率可达91.9%,放置72 h后仍有86.2%,浊度维持在52.5~69.0 NTU水平,且经高速离心后无明显沉淀。
2) FTIR谱图显示,随着NC添加量的增加,复合膜中出现隶属于甲壳素酰胺Ⅱ键的红外特征吸收峰且强度逐渐增强;XRD谱图显示,添加适量NC有助于提高复合膜的结晶度;SEM、EDS图显示,NC添加量为9%时,NC在复合膜中总体分散较均匀,无明显聚集现象。
3) 适量NC的加入有助于改善复合膜的力学性能,当NC添加量为9%时,再生纤维素复合膜力学性能最佳,干态下其断裂强度为98.8 MPa,断裂伸长率为14.3%,显著高于空白样(64.2 MPa,5.7%)。
参考文献:
[1]徐龙, 刘云, 吴志强, 等. 南极磷虾甲壳素纳米晶须的制备与应用[J]. 功能材料, 2023, 54(6): 6021-6027.
XU L, LIU Y, WU Z Q, et al. Preparation and application of chitin nano-whiskers derived from Antarctic krill[J]. Journal of Functional Materials, 2023, 54(6): 6021-6027.
[2]CHEN J, LIU J, YUAN T, et al. Comparison of cellulose and chitin nanocrystals for reinforcing regenerated cellulose fibers[J]. Journal of Applied Polymer Science, 2017, 134(22): 44880.
[3]LIU L, CHEN H, ZOU Y, et al. Zwitterionic chitin nanocrystals mediated composite and self-assembly with cellulose nanofibrils[J]. International Journal of Biological Macromolecules, 2022, 223: 108-119.
[4]SHARMA A, MANDAL T, GOSWAMI S. Dispersibility and stability studies of cellulose nanofibers: Implications for nanocomposite preparation[J]. Journal of Polymers and the Environment, 2021(29): 1516-1525.
[5]WIJESENA R N, TISSERA N D, RATHNAYAKA V W S G, et al. Colloidal stability of chitin nanofibers in aqueous systems: Effect of pH, ionic strength, temperature & concentration[J]. Carbohydrate Polymers, 2020(235): 116024.
[6]WANG Q, YAN X X, et al. Fabrication and characterization of chitin nanofibers through esterification and ultrasound treatment[J]. Carbohydrate Polymers Scientific & Technological Aspects of Industrially Important Polysaccharides, 2018, 180: 81-87.
[7]SHANG Z, AN X Y, SETA F T, et al. Improving dispersion stability of hydrochloric acid hydrolyzed cellulose nano-crystals[J]. Carbohydrate Polymers, 2019(222): 115037.
[8]JUNJI N, TSUGUYUKI S, AKIRA L, et al. Simple freeze-drying procedure for producing nanocellulose aerogel-containing, high-performance air filters[J]. ACS Applied Materials & Interfaces, 2015, 7(35): 19809-19815.
[9]LIN N, ZHAO S S, GAN L, et al. Preparation of fungus-derived chitin nanocrystals and their dispersion stability evaluation in aqueous media[J]. Carbohydrate Polymers, 2017(173): 610-618.
[10]PHILIPPOVA O E, KORCHAGUNA E V, VOLKOV E V, et al. Aggregation of some water-soluble derivatives of chitin in aqueous solutions: Role of the degree of acetylation and effect of hydrogen bond breaker[J]. Carbohydrate Polymers, 2012, 87(1): 687-694.
[11]WU K, LIU D Y, GONG F, et al. Addressing the challenge of fabricating a high content regenerated cellulose/nanomaterial composite: The magical effect of urea[J]. Green Chemistry, 2020, 22(13): 4121-4127.
[12]OKITA Y, FUJISAWA S, SAITO T, et al. TEMPO-oxidized cellulose nanofibrils dispersed in organic solvents[J]. Biomacromolecules, 2011, 12(2): 518-522.
[13]FAN Y M, SAITO T, ISOGAI A, et al. Chitin nanocrystals prepared by TEMPO-mediated oxidation of alpha-chitin[J]. Biomacromolecules, 2008, 9(1): 192-198.
[14]NGASOTTER S, XAVIER K A M, PORAYIL L, et al. Optimized high-yield synthesis of chitin nanocrystals from shrimp shell chitin by steam explosion[J]. Carbohydrate Polymers, 2023(316): 121040.
[15]周逸, 魏洁, 吕妍妍, 等. 竹浆纤维素纳米纤维对硝化纤维素膜的增强作用[J]. 含能材料, 2019, 27(8): 671-678.
ZHOU Y, WEI J, L Y Y, et al. Enhancement of nitrocellulose by bamboo pulp cellulose nanofibers[J]. Chinese Journal of Energy Materials, 2019, 27(8): 671-678.
[16]周可可. 基于溶解再生工艺纤维素包装膜的制备与研究[D]. 无锡: 江南大学, 2020.
ZHOU K K. Preparation and Research of Cellulose Packaging Film Based on Dissolution and Regeneration Process[D]. Wuxi: Jiangnan University, 2020.
[17]ZHAO J Q, HE X, WANG Y R, et al. Reinforcement of all-cellulose nanocomposite films using native cellulose nanofibrils[J]. Carbohydrate Polymers, 2014(104): 143-150.
Study on the dispersibility of nano-chitin and its enhancement performance onregenerated cellulose films
ZHANG Chi, WANG Xiangrong
PENG Weifang, WANG Wencong
(College of Textile Science and Engineering, Jiangnan University, Wuxi 214122, China)
Abstract: Nano-chitin is a nanoscale material derived from natural polysaccharide chitin, and has various excellent properties such as biocompatibility, biodegradability and high specific surface area. This makes it have broad application potential in various fields such as biomedicine, food, cosmetics, environmental protection, textiles and packaging. However, one of major challenges for the nano-chitin is its poor dispersibility. Due to the high specific surface area and surface activity of nanoparticles, they are prone to agglomerate in solution and form larger aggregates, which limits their uniform distribution in composite materials and hinders their reinforcement effect. The aggregation of nano-chitin can lead to the deterioration in composite materials properties, such as mechanical strength, optical properties and antibacterial effects. To improve the dispersibility of nano-chitin, the following strategies are usually adopted: increasing surface charge or introducing hydrophilic groups through chemical modification can enhance the stability of nanoparticles in aqueous media; adding appropriate dispersants or surfactants can help stabilize nanoparticles and prevent aggregation; utilizing the cavitation effect of ultrasound can disrupt the attraction between particles and promote the uniform dispersion of nano-chitin in solution. Almong these strategies, using dispersants to disperse nano-chitin is relatively simpl and efficient. Therefore, a suitable dispersant DMSO (dimethyl sulfoxide) was selected in this article for uniform dispersion of nano-chitin, and then the enhancement effect of nano-chitin on regenerated cellulose films was further studied.
To improve the dispersion effect of nano-chitin, firstly a series of techniques such as transmittance, turbidity testing and centrifugal sedimentation experiments were adopted to investigate the dispersibility of nano-chitin in water (H2O), tetraethylammonium hydroxide aqueous solution (TEAOH/H2O), urea aqueous solution of different mass fractions (Urea/H2O), and dimethyl sulfoxide (DMSO). It was found that DMSO had a relatively good ability to disperse nano-chitin. The initial transmittance of 0.5% nano-chitin/DMSO suspension at 800 nm could reach 91.9% and it still maintained 86.2% after 72 hours. The turbidity remained at the level of 52.569.0 NTU and there was no obvious precipitation after high-speed centrifugation. Therefore, DMSO was selected as the nano-chitin dispersant and different mass fractions of nano-chitin/DMSO were added to cellulose/TEAOH/H2O solution to prepare regenerated cellulose composite films. The structure, morphology and mechanical properties of the composite films were characterized. The results showed that the mechanical properties of the composite films were optimal and the fracture strength and elongation at break increased by 54% and 150% compared to the pure cellulose films, when the amount of nano-chitin added was 9%. The addition of 9% nano-chitin helped to introduce amide groups and improveed crystallinity in the composite films. The surface and cross-sectional structure of the composite films were dense and homogenous without obvious lamination and pores, and nano-chitin was generally evenly dispersed in the composite film without obvious aggregation.
This study improves the dispersion and aggregation problems of nano-chitin in the preparation of regenerated cellulose films and significantly enhances the comprehensive performance of regenerated cellulose composite films by using DMSO as a dispersion medium. This study helpes to expand the application fields of nano-chitin in high value-added materials and has important theoretical value and application prospects. Future research will further explore the effects of different additives on the dispersion of nano-chitin and the properties of composite materials with the aim of developing regenerated cellulose composite materials with better performance.
Key words: nano-chitin; dimethyl sulfoxide; dispersibility; tetraethyl ammonium hydroxide; regenerated cellulose composite films

