长基因间非蛋白编码RNA 472对阿尔茨海默病神经元铁死亡的作用机制研究

【摘要】目的 探究长基因间非蛋白编码RNA 472(LINC00472)对阿尔茨海默病(AD)神经元铁死亡的作用机制,为临床治疗提供参考。方法 选取雄性昆明种小鼠30只,随机分为空白组、模型组、模型+加药组,各10只。空白组小鼠腹腔注射等量的生理盐水和灌胃等量的双蒸水,模型组小鼠灌胃人β淀粉样蛋白1-42(Aβ1-42)5 mg/kg(双蒸水配制)建立AD模型,模型+加药组小鼠在模型组基础上腹腔注射环磷酸腺苷(cAMP)筛选出的抑制LINC00472靶向药物。比较3组小鼠迷宫测试结果,脑组织炎症因子水平、β淀粉样蛋白(Aβ)mRNA水平、微管相关蛋白(tau)mRNA水平、谷胱甘肽过氧化物酶4(GPX4)mRNA水平、甲基转移酶3(METTL3)水平、凋亡信号调节激酶1(ASK1)水平及3组小鼠的Aβ、tau、GPX4免疫组化检测结果。结果 空白组、模型+加药组小鼠Y形迷宫觅食时间、莫里斯水迷宫(MWM)逃逸时间均短于模型组,且空白组均短于模型+加药组;空白组、模型+加药组小鼠MWM有效区域停留时间均长于模型组,且空白组长于模型+加药组(均P<0.05)。空白组、模型+加药组小鼠白细胞介素-6(IL-6)、单核细胞趋化蛋白(MCP-1)、白细胞介素-1β(IL-1β)、Aβ mRNA、tau mRNA、METT3 mRNA、ASK1水平均低于模型组,且空白组均低于模型+加药组;空白组、模型+加药组小鼠GPX4 mRNA水平均高于模型组,且空白组高于模型+加药组(均P<0.05)。模型组小鼠海马体Aβ1-42沉积增加,模型+加药组Aβ1-42表达水平低于模型组;模型组小鼠海马体tau磷酸化增加,模型+加药组海马体tau磷酸化程度低于模型组;模型组小鼠海马体GPX4表达减少,模型+加药组海马体GPX4表达高于模型组。结论 LINC00472抑制有助于减轻神经炎症,减少Aβ沉积、tau磷酸化,并提高GPX4表达,进而通过抑制AD神经元铁死亡改善神经功能,且AD神经元铁死亡的作用机制与METT3/ASK1通路有关。
【关键词】长基因间非蛋白编码 RNA 472;阿尔茨海默病;铁死亡
【中图分类号】R322.8 【文献标识码】A 【文章编号】2096-2665.2024.21.0001.05
DOI:10.3969/j.issn.2096-2665.2024.21.001
阿尔茨海默病(Alzheimer's disease, AD)是常见的神经退行性疾病,其发病原因和机制目前尚不明确,与遗传、环境、年龄增长等有关,可出现进行性加重性认知功能障碍与行为损害、记忆和学习能力受损,该病患者脑内的斑块、小胶质细胞、缠结神经元中可观察到铁沉积现象[1-2]。铁死亡是非凋亡性程序性细胞死亡,其特征为铁依赖性的脂质氢过氧化物累积到致死水平,是AD病理生理学的主要过程[3]。除铁死亡外,脑组织还易受到神经炎症的影响,铁滞留可触发AD中的小胶质细胞活化和白细胞介素产生,加剧淀粉样β蛋白(Aβ)沉积和微管相关蛋白(tau)磷酸化。有研究表明,铁死亡抑制剂在卒中疾病动物模型中具有保护神经元、恢复认知功能的作用[4]。长基因间非蛋白编码RNA 472(LINC00472)与铁死亡密切相关,其在多种肿瘤中的表达研究较多,但关于其在AD中的表达及作用机制相关研究较少。基于此,本研究探究LINC00472对AD神经元铁死亡的作用机制,现报道如下。
1 材料与方法
1.1 实验材料 选取雄性昆明种小鼠30只[购于上海杰思捷实验动物有限公司,动物生产许可证号: SCXK(沪)2020-0004], 3月龄,体质量300~400 g。适应性喂养1周后,随机分为空白组、模型组、模型+加药组,各10只。
空白组小鼠腹腔注射等量的生理盐水和灌胃等量的双蒸水;模型组小鼠灌胃人β淀粉样蛋白1-42(Aβ1-42)5 mg/kg(双蒸水配制)建立AD模型;模型+加药组小鼠在模型组基础上腹腔注射环磷酸腺苷(cAMP)筛选出的抑制LINC00472靶向药物,在造模成功1周后连续灌胃给药8周。 3组小鼠均于末次给药后进行迷宫实验,取脑组织,置于-80 ℃环境保存待测。研究过程遵循国际通行的动物福利和伦理准则。
1.2 研究方法 ⑴迷宫实验。 Y形迷宫由3个臂组成,包括1个起始臂和2个目标臂(每个臂的尺寸为30 cm×6 cm×30 cm)。训练小鼠3 d后进行测试。小鼠在正式测试前禁食12 h。第41天,在2个目标臂之一放置食物,将小鼠分别放置在起始臂末端,用摄像机记录每只小鼠的运动轨迹和寻找食物所用的时间,并使用
ANY-maze动物行为分析软件进行分析。
第43天使用莫里斯水迷宫(MWM)评估小鼠的空间记忆和导航能力,训练和正式测试均使用MT-200水迷宫视频跟踪分析系统进行。水槽被分成4个象限,向水槽中添加二氧化钛使水变浑浊。训练小鼠放入水中后有60 s内到达平台,并在平台上停留20 s。若有60 s内未找到平台,则手动带小鼠到平台上并停留20 s。共训练
3天。第46天和第47天分别在盲测条件下进行导航测试和探索试验,记录小鼠找到平台所用时间和(或)通过有效区域的时间。
⑵酶联免疫吸附试验(ELISA)。取小鼠脑组织,裂解、研磨,低速离心后取上清液,使用ELISA检测白细胞介素-6(IL-6)、单核细胞趋化蛋白1(MCP-1)、白细胞介素-1β(IL-1β)水平。
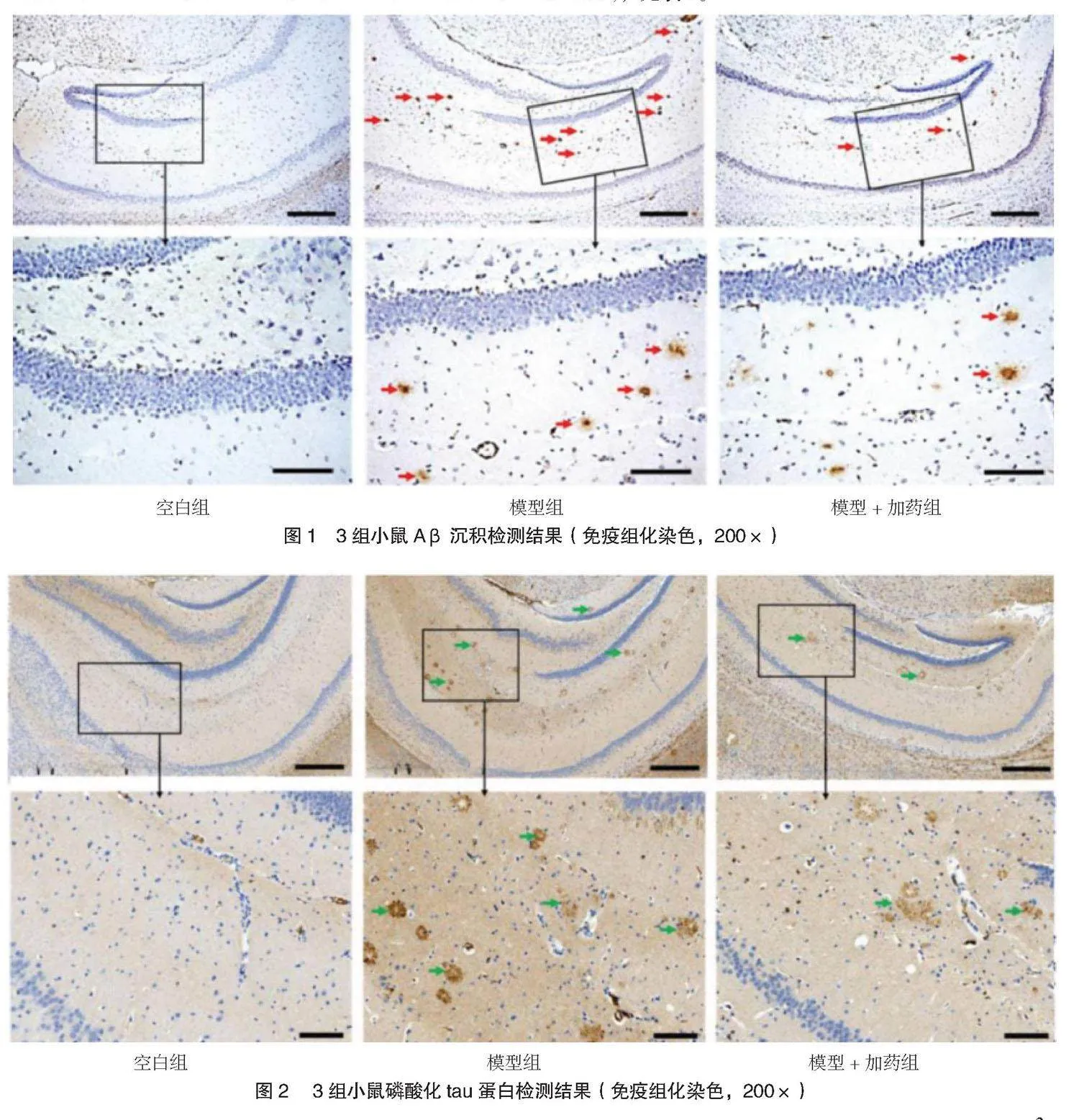
⑶免疫组化染色。干燥载玻片,并用二甲苯和乙醇脱蜡。用柠檬酸缓冲液在100 ℃下进行载玻片表位检索,煮沸30 min,用3%过氧化氢孵育。切片用5%的牛血清白蛋白(BSA)阻断,然后用Aβ、tau、谷胱甘肽过氧化物酶4(GPX4)一抗(均购自和光纯药工业有限公司)孵育过夜。最后,加入山羊抗兔二抗孵育,并用3,3'-二氨基联苯胺(购自赛默飞世尔科技)染色。在反应结束时,用Harris苏木精进行反染色。用95%和100%乙醇和二甲苯洗涤脱水后,用永久贴载介质覆盖组织切片,在共聚焦显微镜下观察免疫组化染色情况。
⑷RNA分离和定量反转录PCR(qRT-PCR)。取大鼠脑组织在1 mL 组织裂解缓冲液中裂解,于冰浴状态下在玻璃研磨机中研磨成匀浆,然后4 ℃裂解30 min,离心20 min。成骨细胞使用1 mL 组织裂解缓冲液裂解后离心,使用TRIzol试剂提取总RNA,并使用Hifair Ⅲ第一链cDNA合成Super Mix转录成cDNA。使用Hieff qPCR SYBR Green Master Mix(购自赛默飞世尔科技)行定量实时PCR。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参基因,根据2-ΔΔCt方法计算Aβ、tau、GPX4 mRNA表达水平。
⑸蛋白质印迹分析。取大鼠脑组织在1 mL组织裂解
缓冲液中裂解,于冰浴状态下在玻璃研磨机中研磨成匀浆,然后4 ℃裂解30 min,离心20 min。成骨细胞使用1 mL 组织裂解缓冲液裂解后离心,使用补充了1%苯基甲基磺酰氟的放射免疫沉淀测定(RIPA)缓冲液提取成骨细胞的蛋白质并转移到聚偏二氟乙烯(PVDF膜)上,用脱脂奶粉(5%)在含有0.05%Tween-20(TBST)的Tris缓冲盐溶液中封闭。然后,将PVDF膜分别与甲基转移酶
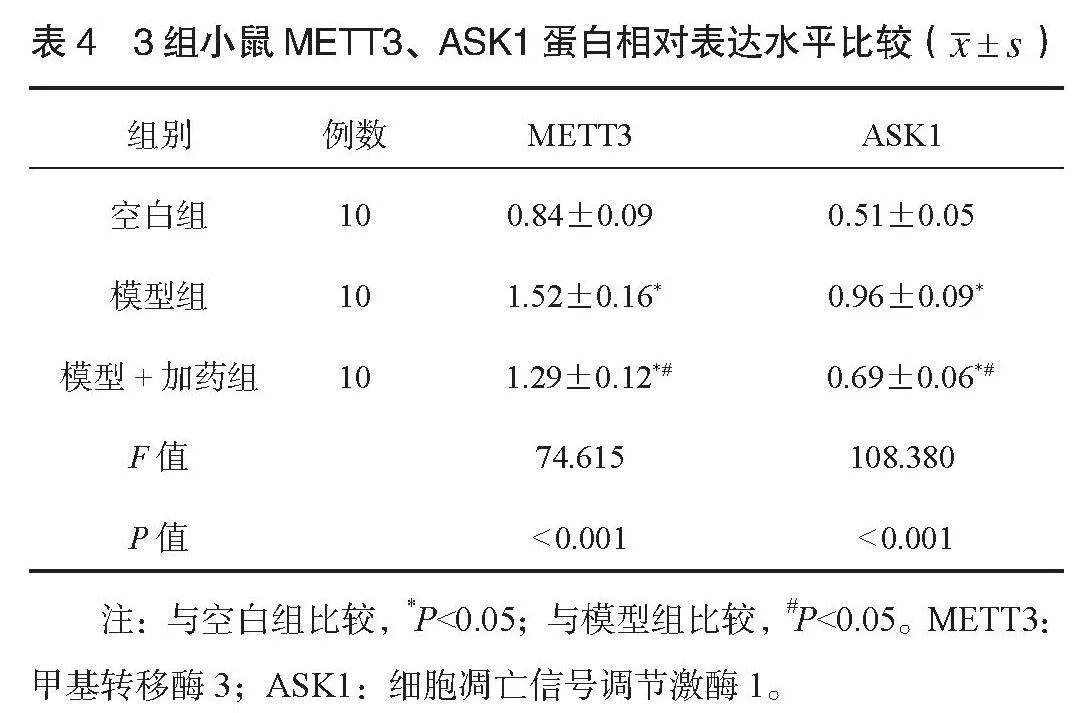
3(METTL3)、细胞凋亡信号调节激酶1(ASK1)、β-肌动蛋白(β-actin)(购自和光纯药工业有限公司)在室温下过夜。用TBST洗涤后,将PVDF膜与二抗IgG,在室温下孵育2 h。将膜浸入增强型化学发光溶液。在无光条件下显影后,观察条带并拍照记录,以β-actin作为内参,使用2-ΔΔCt方法计算METT3、ASK1蛋白相对表达水平。
1.3 统计学分析 采用SPSS 21.0统计学软件进行数据分析。计量资料以(x)表示,组间比较采用独立样本t检验,多组间比较使用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 3组小鼠迷宫实验结果比较 空白组、模型+加药组小鼠Y形迷宫觅食时间、 MWM逃逸时间均短于模型组,且空白组短于模型+加药组;空白组、模型+加药组小鼠MWM有效区域停留时间均长于模型组,且空白组长于模型+加药组,差异均有统计学意义(均P<0.05),
见表1。
2.2 3组小鼠脑组织炎症因子水平比较 空白组、模型+加药组小鼠IL-6、 MCP-1、 IL-1β水平均低于模型组,且空白组均低于模型+加药组,差异均有统计学意义(P<0.05),见表2。
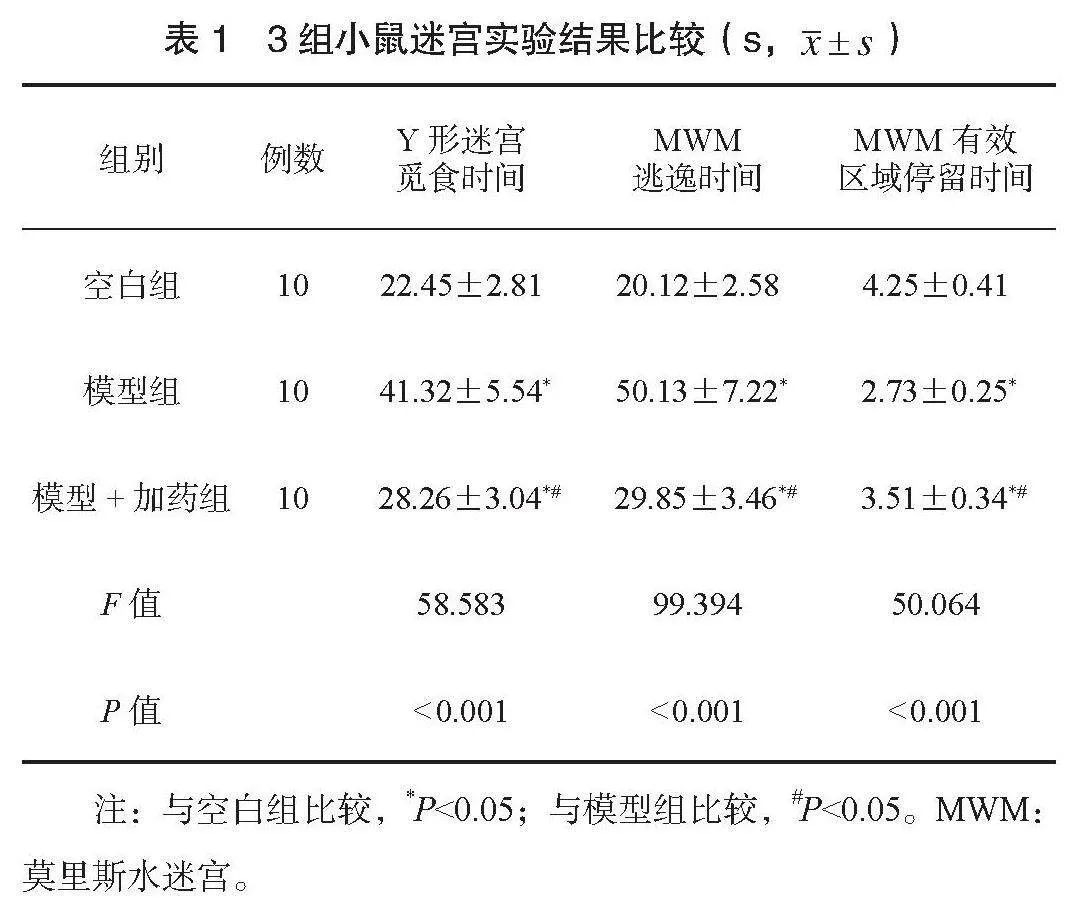
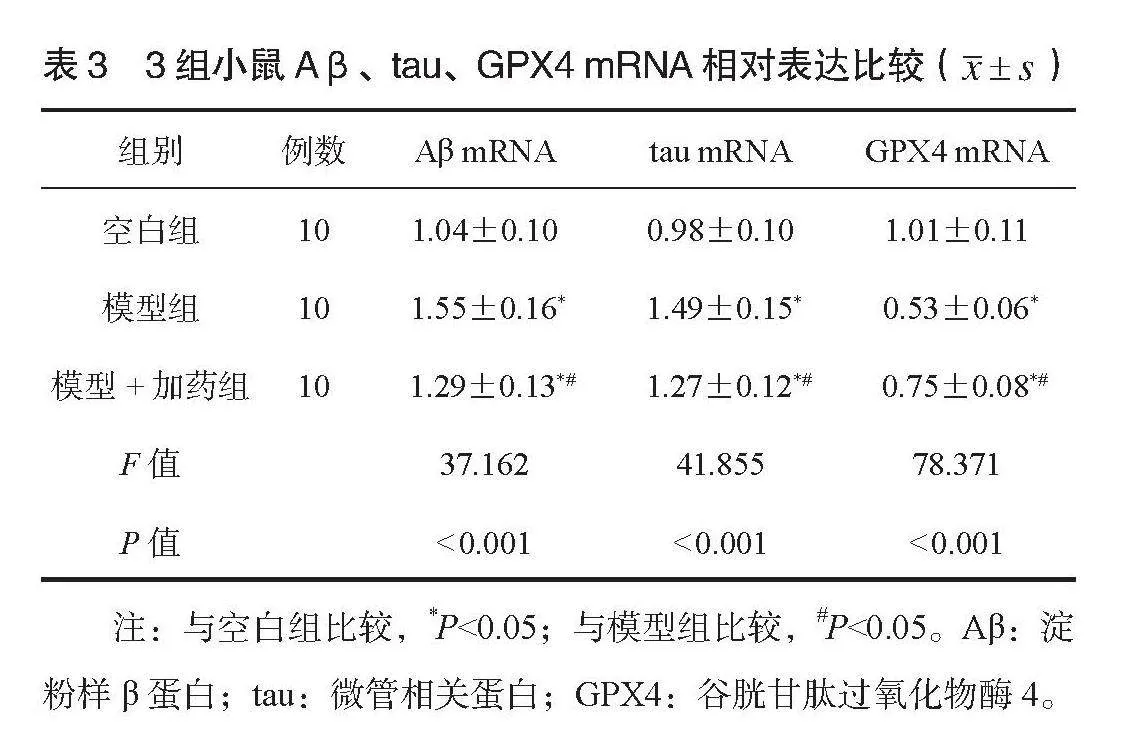
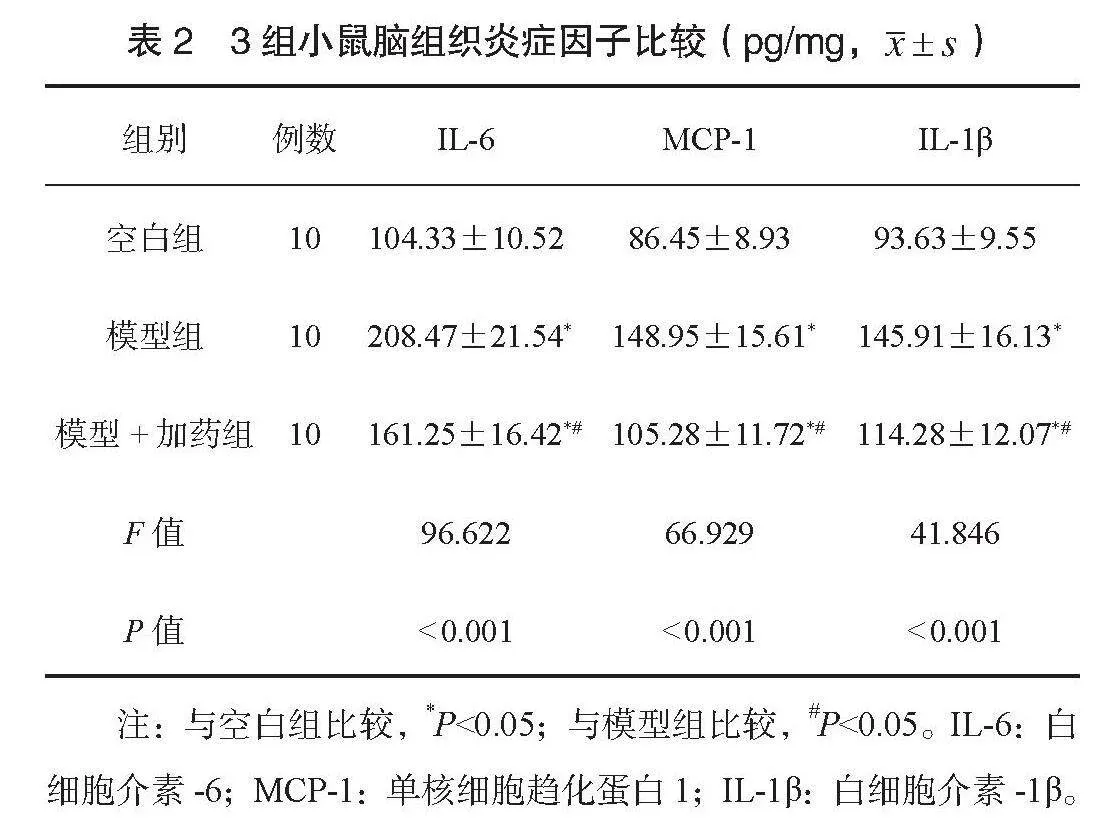
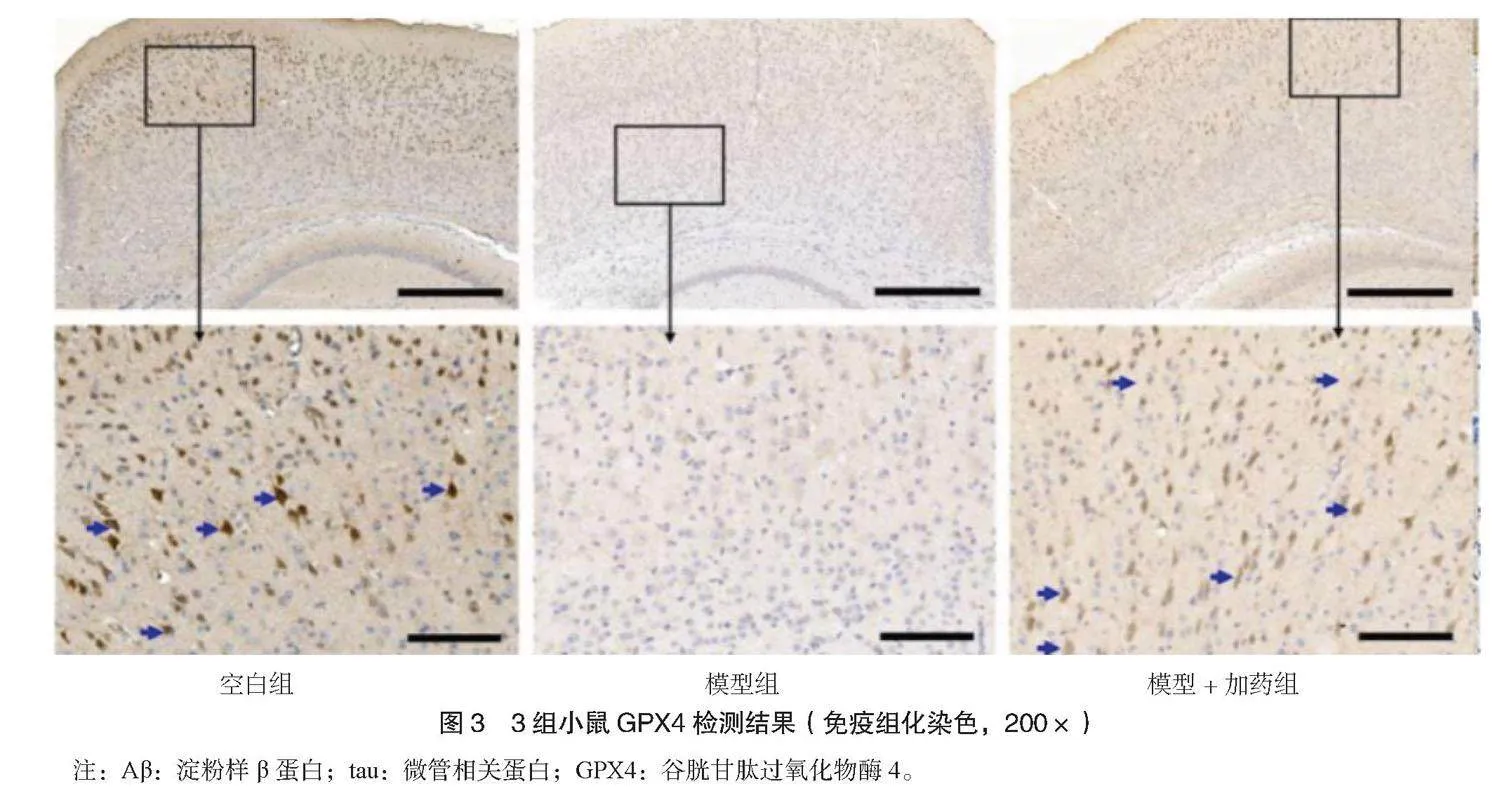
2.3 3组小鼠脑组织Aβ、tau、GPX4免疫组化检测结果 模型组小鼠海马体Aβ1-42沉积增加,模型+加药组Aβ1-42低于模型组,见图1;模型组小鼠海马体tau磷酸化增加,模型+加药组海马体tau磷酸化低于模型组,见图2;模型组小鼠海马体GPX4表达减少,模型+加药组海马体GPX4表达高于模型组,见图3。
2.4 3组小鼠Aβ、 tau、 GPX4 mRNA相对表达水平比较 空白组、模型+加药组小鼠Aβ、 tau mRNA水平均低于模型组,且空白组均低于模型+加药组;空白组、模型+加药组小鼠GPX4 mRNA水平均高于模型组,且空白组高于模型+加药组,差异均有统计学意义(均P<0.05),见表3。
2.5 3组小鼠METT3、 ASK1蛋白相对表达比较 空白组、模型+加药组小鼠METT3、 ASK1蛋白表达水平均低于模型组,且空白组均低于模型+加药组,差异均有统计学意义(P<0.05),见表4。 3组小鼠METT3、 ASK1蛋白免疫印迹情况,见图4。
3 讨论
铁死亡是一种非凋亡性的细胞死亡形式,其在形态学、生化、遗传学上均不同于其他形式的细胞死亡(如凋亡、坏死、自噬),铁过载可在体内诱导铁死亡,而铁螯合剂可预防铁死亡[5]。铁死亡可见于各种神经系统疾病相关的神经元细胞死亡中,如出血性卒中、缺血性卒中、帕金森病、亨廷顿病等,并伴有脂质过氧化、线粒体功能障碍及GPX4减少[6]。
脑铁过载与AD等神经退行性疾病的病理机制相关,然而其潜在机制尚不明确。此外,铁死亡抑制剂已在卒中疾病动物模型中被证明可保护神经元、恢复认知功能,且敲除小鼠的 GPX4可直接导致年龄依赖性的神经退行性变化和严重的神经元丢失[7]。考虑AD 中过量铁的积累会导致脑内活性氧(ROS)的产生显著增加,因此,铁死亡可能与 AD 的神经元丢失和认知障碍有关。
Aβ、tau、GPX4是铁死亡及铁过载的重要反映指标。Aβ前体蛋白(APP)是一种1型跨膜糖蛋白,是Aβ生成的关键前体,可先被α-分泌酶或β-分泌酶切割,然后再被γ-分泌酶切割。在健康状态下,α-分泌酶首先切割APP,即处于非淀粉样变性途径。然而,APP首先被β-分泌酶切割,可产生具有神经毒性的40~42个氨基酸的淀粉样蛋白(淀粉样变性途径)。而弗林蛋白酶在介导α-分泌酶或
β-分泌酶的蛋白酶解活化率方面起关键作用,其浓度与
α-分泌酶活性呈正相关,与β-分泌酶活性呈负相关。胞内铁浓度过高可通过减少弗林蛋白酶,增强β分泌酶活性,从而增加淀粉样变性途径的Aβ生成。此外,APP mRNA是5'-非翻译区(5'-UTR)编码铁反应元件(IRE),该元件与胞内铁含量密切相关。当胞内铁浓度升高时,5'-UTR mRNA中的IRE上调APP的翻译,从而增加APP蛋白的数量,并促进Aβ的生成。铁还能直接与Aβ的His6、His13、His14氨基酸残基结合,从而增强Aβ的神经毒性[8]。
在APP/PS1小鼠AD模型中,亚微米分辨率的X线显微镜技术显示,淀粉样斑块形态与铁直接相关[9]。铁可通过诱导激酶影响蛋白磷酸酶 2A活性,促进tau过度磷酸化,还可通过tau蛋白中的铁结合基序引起过度磷酸化的 au聚集[10]。GPX4通过将膜脂质氢过氧化物还原为脂质醇来抑制脂质过氧化,被认为是铁死亡的中枢调节器。GPX4的敲除可诱导脊髓运动神经元的铁死亡,从而导致成年小鼠迅速瘫痪和死亡。有研究表明,铁死亡通过敲除前脑神经元GPX4,引发海马神经变性中的主要细胞死亡,这与认知障碍的发生发展直接相关。此外,铁沉积和肽-血红素复合物的形成与Aβ和tau相互作用,可产生涉及铁死亡途径的ROS[11]。
本研究结果显示,空白组、模型+加药组小鼠Y形迷宫觅食时间、MWM逃逸时间均短于模型组,且空白组短
于模型+加药组;空白组、模型+加药组小鼠MWM有效区域停留时间均长于模型组,且空白组长于模型+加药组,提示小鼠神经功能改善。且免疫组化及PCR实验证实,在AD小鼠中Aβ、tau表达增加,GPX4表达减少,LINC00472抑制则逆转其变化,表明LINC00472抑制有助于通过减少AD小鼠神经细胞铁死亡改善其神经功能。
ASK1是各种依赖于ros的细胞死亡过程中的关键调节因子,不仅参与氧化铝纳米颗粒诱导的海马神经元铁凋亡的调控,还能通过ASK1-p38 mapk通路,在冷应激诱导的铁凋亡中发挥重要作用[12]。有研究表明,ASK1参与多种ros依赖性细胞死亡过程,作为多个信号级联的枢纽[13]。本研究结果显示,空白组、模型+加药组METT3、ASK1蛋白表达低于模型组,空白组低于模型+加药组,推测LINC00472抑制可能是通过METT3/ASK1通路介导进而抑制AD小鼠神经细胞铁死亡。
综上所述,LINC00472抑制有助于抑制神经炎症,减少Aβ沉积、tau磷酸化,并提高GPX4表达,通过抑制铁死亡改善神经功能,且对阿尔茨海默病神经元铁死亡的作用机制与METT3/ASK1通路有关。
参考文献
张平,季晖,胡庆华.阿尔茨海默症的临床治疗和天然来源潜在药物的研究进展[J].药学学报, 2022, 57(7): 1954-1961.
林小玲,柯维强,唐文军,等.大黄酚对Aβ1-42致阿尔茨海默症大鼠学习记忆及海马CA1区组织JNK通路的影响[J].中成药, 2022, 44(6): 1977-1981.
张朋飞,章立华,华东. Triapine通过ROS/GSH/GPX4轴诱导A549细胞铁死亡[J].中国药理学通报, 2023, 39(5): 833-838.
廖钟玲,林秀苗,王洁琼,等.中药治疗缺血性脑卒中铁死亡机制的研究进展[J].中西医结合心脑血管病杂志, 2023, 21(12): 2230-2233.
ZHANG G, ZHANG Y, SHEN Y, et al. The potential role of ferroptosis in Alzheimer’s disease[J]. Journal of Alzheimers Disease, 2021, 80(3): 907-925.
冷萧如,叶宇航,胡霞敏.铁死亡在缺血性脑卒中的作用[J].生命的化学, 2023, 43(9): 1337-1345.
李赛菲,冯卫生,袁培培,等.熟地黄通过抑制自噬和铁死亡改善缺血性脑卒中大鼠神经功能损伤[J].中国实验方剂学杂志, kk29Kyi4pgBzMebjbaeVFQ==2024(8): 6-33.
黄健,安红伟,曹诗杰.铁死亡与阿尔茨海默病的研究进展[J].中国病理生理杂志, 2021(11): 2088-2093.
郭少博,朱文慧,白宇,等.冰菖散通过Nrf2/HO-1信号通路改善APP/PS1阿尔茨海默病小鼠铁死亡及认知功能障碍的研究[J].南京中医药大学学报, 2024, 40(6): 598-607.
于放,马晶莹,马旺然,等.脂氧合酶在铁死亡驱动阿尔茨海默病中作用的研究进展[J].实用心脑肺血管病杂志, 2022, 30(12): 128-132.
蔡雅文,柴玉慧,缪明星,等.细胞焦亡介导的阿尔兹海默症发病机制研究进展[J].中国药学杂志, 2021, 56(21): 1701-1705.
袁美玲,张云,汪光云,等.通窍活血汤含药脑脊液调控ASK1/MKK4/JNK信号通路对OGD/R损伤HT22细胞的保护作用[J].中国中药杂志, 2022, 47(19): 10.
OGIER J M, GAO Y, DUNNE E M ,et al. ASK1 is a novel molecular target for preventing aminoglycoside-induced hair cell death[J].Journal of Molecular Medicine, 2022, 100(5): 797-813.
1基金项目:2022年度黑龙江省省属本科高校基本科研业务费科学技术研究项目(编号:2022-KYYWF-0815)
作者简介:林萍,硕士研究生,副主任医师,研究方向:神经内科疾病的诊疗。

