菜芙蓉花黄酮微胶囊的制备工艺及其贮藏稳定性




摘 要:为提高菜芙蓉花黄酮的贮藏稳定性,扩展其应用范围,以菜芙蓉花黄酮提取液为芯材、β-环糊精为壁材,采用超声辅助包埋-冷冻干燥法制备菜芙蓉花黄酮微胶囊,通过单因素和响应面试验确定微胶囊制备工艺参数,利用扫描电镜、红外光谱和抗氧化活性对其进行表征,并考察不同温度、湿度、光照和氧气贮藏条件对菜芙蓉花黄酮微胶囊保留率的影响。结果表明:黄酮微胶囊最佳制备工艺为超声功率210 W、超声温度56 ℃、超声时间40 min、芯壁比1.6 mL∶1 g,在此条件下制备的微胶囊的黄酮包埋率为96.89%;制备的微胶囊呈无定型玻璃状,红外光谱分析显示菜芙蓉花黄酮被壁材包裹,具有较好的抗氧化能力。微胶囊化能够有效提高菜芙蓉花黄酮的稳定性,可为新型食品天然抗氧化剂的开发应用提供理论依据。
关键词:食品添加剂技术;菜芙蓉;黄酮微胶囊;超声辅助包埋;贮藏稳定性
中图分类号:TS202.1
文献标识码:A
DOI:10.7535/hbkd.2024yx05006
Preparation process and storage stability of Abelmoschus
Manihot (L.) medic flowers flavonoids microcapsules
ZHAO Dou,YANG Shengnan,LIU Nannan,QIU Yan
(College of Food Science and Biology, Hebei University of Science and Technology, Shijiazhuang, Hebei 050018, China)
Abstract:In order to improve the storage stability and extend the application range of the Abelmoschus Manihot (L.) medic flowers flavonoids(AMF), A.Manihot flowers flavonoids microcapsules (AMFM) were prepared by ultrasonic-assisted embedding-freeze drying method with the flavonoids extracts of AMF as core material and β-cyclodextrin as wall material. The preparation parameters of microcapsules were determined by single factor and response surface test, and AMFM was characterized by scanning electron microscopy, infrared spectroscopy and antioxidant activities. The effects of different storage conditions of temperature, humidity, light and oxygen on the retention rate of the microcapsules were investigated. The results show that the optimal preparation process of AMFM is ultrasonic power of 210 W, ultrasonic temperature of 56 ℃, ultrasonic time of 40 min and core-wall ratio of 1.6 mL∶1 g. Under these conditions, the flavonoid embedding rate of microcapsules was 96.89%. The prepared microcapsules are amorphous glassy solids, and the infrared spectrum analysis shows that the AMF are embedded by the wall material. AMFM has good antioxidant capabilities and can effectively improve the stability of flavonoids. This study provides a theoretical basis for the development of AMF for the application of new food natural antioxidants.
Keywords:food additives technology; Abelmoschus Manihot(L.) medic; flavonoids microcapsules;ultrasonic-assisted embedding;storage stability
菜芙蓉(Abelmoschus Manihot (L.) medic)又称金花葵,为锦葵科秋葵属一年生草本植物,广泛分布在东欧、亚洲的温带和亚热带地区,联合国粮食及农业组织建议将其作为营养安全的顶级作物之一[1]。目前,中国人工种植菜芙蓉面积超过2万亩(1亩≈666.7 m2),广泛分布于河北、河南、山东、山西、陕西、安徽、江苏、湖南和广东等地。菜芙蓉花冠呈黄色,直径达13~16 cm,为中国典籍记载的传统药食两用资源[2],具有清热利湿、消炎镇痛之功效,内服主治五淋、水肿,外用治疗汤水烫伤,还可制作花茶和面食。现代研究表明,菜芙蓉具有解热抗炎、调节血脂、抑制肿瘤细胞生长和免疫调节等作用[3]。菜芙蓉含有黄酮类、不饱和脂肪酸、维生素E、核苷类、多糖类和长链烃类等化合物,其中总黄酮含量高达花干重的近5.6%,是目前已知植物资源中含量较高的[4]。吴正超等[5]从菜芙蓉花中分离出包括金丝桃苷、牡荆素鼠李糖苷、牡荆素、芦丁和槲皮素在内的63种黄酮类化合物。菜芙蓉花黄酮含量高且种类丰富,具有较强的抗氧化性[6]。
植物黄酮具有抗菌、抗炎和抗氧化等多种生物学活性,并具有安全、有效、不易产生耐药性的特点[7],因而越来越多的黄酮提取物被用作天然抗氧化剂[8]。但是黄酮类化合物溶解性差,易受环境中氧气、光照、温度和湿度等因素的影响而导致活性降低,限制了其应用[9]。微胶囊技术利用聚合物壁材包埋活性化合物芯材,是对环境敏感芯材的一种极具前景的保护方法。微胶囊化既能提高芯材稳定性,还可以改善生物活性物质的适口性。β-环糊精是由7个葡萄糖单元通过α-1,4糖苷键彼此相连而形成的一种环状低聚糖,其空腔被氢原子覆盖而具有疏水性,而外表面的伯羟基和仲羟基则暴露在溶剂中(亲水部分),使整个分子呈高度水溶性[10]。客体疏水分子进入空腔,通过氢键或疏水作用与环糊精相互作用,这种可逆结合实现了分子包封与控制释放[11]。李杰等[8]采用搅拌包埋-冷冻干燥方法,利用β-环糊精包埋山茱萸黄酮,包埋率为64.17%,且温度、氧气、光线等因素对微胶囊稳定性影响较大。魏姜勉[12]采用此方法制备刺槐花总黄酮微胶囊,包埋率为72.1%。
与传统方法相比,超声辅助包埋法由于超声波的空化、机械、热和化学效应,因而能大大提高包埋率[13],使得微634976974af58a2dca50330e3030b7f3胶囊的粒径更小、更均匀,而且能够更长时间地保持芯材的活性,甚至赋予芯材一些新的化学特性[14]。本研究首次采用超声辅助包埋-冷冻干燥法,以包埋率为指标,对β-环糊精包埋菜芙蓉花黄酮浓缩液制备微胶囊工艺进行优化,利用扫描电镜观察微胶囊化效果,采用红外光谱分析黄酮与β-环糊精的作用,考察其抗氧化能力,并研究温度、湿度、光照和氧气条件对微胶囊贮藏稳定性的影响,为拓宽菜芙蓉花黄酮化合物的应用空间,进一步开发新型天然抗氧化食品添加剂提供理论依据。
1 材料、仪器与方法
1.1 主要材料
菜芙蓉花,产自河北省井陉县;1,1-二苯基-2-苦基肼 (DPPH),日本和光纯化工业株式会社提供;2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS) ,上海阿拉丁生化科技股份有限公司提供;芦丁,南京奥多福生物科技有限公司提供;β-环糊精、亚硝酸钠、氢氧化钠、硝酸铝等,均为国产分析纯。
1.2 主要仪器
WFZ UV-2000型紫外可见分光光度计,尤尼柯(上海)仪器有限公司提供;Nicolet6700傅里叶变换红外光谱仪,美国赛默飞公司提供;S-4800-I扫描电镜,日本日立公司提供;KQ-300DE型超声波清洗器,昆山市超声仪器有限公司提供;MaxiVac Beta型冷冻干燥仪,基因有限公司提供。
1.3 制备方法
1.3.1 菜芙蓉花黄酮的提取
将菜芙蓉花于60 ℃烘箱中烘干至恒重,经粉碎机粉碎过80目(180 μm)筛,备用。将一定质量的菜芙蓉花粉末以料液比为1∶40(g/mL),在75%(体积分数,下同)乙醇中于75 ℃条件下提取2 h,获得提取液,再于相同条件重复提取1次。合并提取液,经减压抽滤、4 500 r/min离心、上清液减压浓缩,得到固形物含量为25.00%的黄酮浓缩液。取部分浓缩液,经冷冻干燥后得到菜芙蓉花黄酮提取物。
1.3.2 菜芙蓉花黄酮微胶囊的制备
将一定质量的β-环糊精溶于20 mL蒸馏水中,充分溶解后,加入一定体积的菜芙蓉花黄酮浓缩液搅拌均匀,在一定温度和功率下超声作用一定时间。将混合液冷冻干燥后,研磨制得菜芙蓉花黄酮微胶囊。
1)单因素试验
分别以超声功率(150、180、210、240、270 W),超声温度(30、40、50、60、70 ℃),超声时间(0.5、1.0、1.5、2.0、2.5 h)和芯壁比(黄酮浓缩液与β-环糊精的体积质量比(mL/g,下同)为3∶1、2∶1、1∶1、1∶2、1∶3)作为单因素进行试验,考察不同因素对包埋率的影响。
2)响应面优化试验
基于单因素试验结果,选取具有显著影响的芯壁比(A)、超声时间(B)、超声温度(C)3个因素作为自变量,以包埋率为响应值,采用Design Expert 10软件Box-Behnken设计3因素3水平试验,优化制备工艺。因素与水平表如表1所示。
1.3.3 扫描电镜显微观察
用毛细管蘸取少量微胶囊,使其均匀固定在沾有双面胶的载物台上,用洗耳球将余粉轻轻吹去,对样品表面进行喷金后观察其微观表面形貌,设置加速电压为5.0 kV。
1.3.4 红外光谱扫描分析
称取菜芙蓉花黄酮微胶囊6 mg,与KBr研磨充分,压片,用红外光谱仪在4 000~400 cm-1内进行扫描。
1.3.5 抗氧化性测定
1) DPPH自由基清除率测定
将微胶囊充分溶解于体积分数为60%的乙醇中,稀释配置成不同浓度的工作液。取不同浓度微胶囊溶液0.4 mL,加入0.4 mL浓度为0.2 mmol/L的DPPH-乙醇(体积分数为95%)溶液,充分混匀,于室温下进行30 min避光反应,在517 nm处测定OD值。用0.4 mL蒸馏水代替微胶囊溶液作为对照组,用0.4 mL 95%乙醇取代DPPH-乙醇作为空白组,以维生素C作为阳性对照,同系统设置3个重复,计算平均值。清除率计算方法为
DPPH自由基清除率=(1-A1-A2A0)×100% ,
式中:A1为实验组的OD值;A2为无DPPH空白组的OD值;A0为无微胶囊对照组的OD值。
2)ABTS自由基清除率测定
参照文献[15]的方法配置ABTS工作液。室温条件下,取不同浓度的微胶囊溶液0.2 mL,与0.8 mL的ABTS工作液混合,反应30 min后在734 nm处测定OD值。用0.2 mL蒸馏水代替微胶囊溶液作为对照组,以无ABTS自由基体系溶液作为空白组(按ABTS的配制比例用蒸馏水和无水乙醇代替)。以维生素C作为阳性对照,同系统设置3个重复,计算平均值。清除率计算方法为
ABTS自由基清除率=(1-A′1-A′2A′0)×100% ,
式中:A′1为实验组的OD值;A′2为无ABTS空白组的OD值;A′0为无微胶囊对照组的OD值。
1.3.6 贮藏稳定性试验
参考文献[16]的方法,设定不同温度(-20、4、30 ℃),相对湿度33%(饱和MgCl2溶液)、53%(饱和MgNO3溶液)、84%(饱和KCl溶液),光照(避光、自然光照)以及氧气(有氧、无氧)条件,探究其对菜芙蓉花黄酮微胶囊黄酮保留率的影响。在25 d贮藏期,每隔5 d取样,测定黄酮质量。以未包埋的菜芙蓉花黄酮提取物为空白对照,以黄酮保留率为指标,评价微胶囊的贮藏稳定性。
保留率=m1m2×100% ,
式中:m1为贮藏后样品的总黄酮质量,mg;m2为贮藏前样品的总黄酮质量,mg。
1.3.7 总黄酮含量测定
黄酮的基本结构包括A环和C环,以及B环和C环2个共轭体系,而芦丁具有黄酮类物质母核结构,因此芦丁通常被用作标准品测定总黄酮含量[17]。参照文献[18]方法,以芦丁为标准对照品,采用NaNO2-Al(NO3)3显色法测定总黄酮。在510 nm处测定吸光值,依据芦丁浓度X与吸光值Y的关系,得到回归方程为Y=5.457X-0.003 8(R2=0.997 7),测定样品吸光值,根据标准曲线计算总黄酮浓度。
1.3.8 包埋率测定
准确称取0.1 g微胶囊样品溶于2 mL无水乙醇中,置于涡旋混合器中振荡至完全溶解后,于8 000 r/min离心10 min,测定上清液中黄酮含量,即为微胶囊表面黄酮质量A″1。准确称取0.1 g制备的微胶囊样品,溶于2 mL体积分数为60%的乙醇中,涡旋振荡至完全溶解后,于8 000 r/min离心10 min,测定上清液中黄酮含量,即为微胶囊总黄酮质量A″0。微胶囊黄酮包埋率=(1-A″1A″0)×100%。
2 结果与分析
2.1 单因素试验
2.1.1 超声功率对菜芙蓉花微胶囊包埋率的影响
超声功率对包埋率的影响见图1。
由图1可知:当超声功率为150~210 W时,包埋率随超声功率的升高而增加,在210 W时包埋率最高达到94.31%;但当功率大于210 W时,包埋率呈现下降趋势。这可能是由于过高的功率影响了微胶囊包埋制备的反应平衡,导致包埋率降低。因此,选取适宜超声功率为210 W。
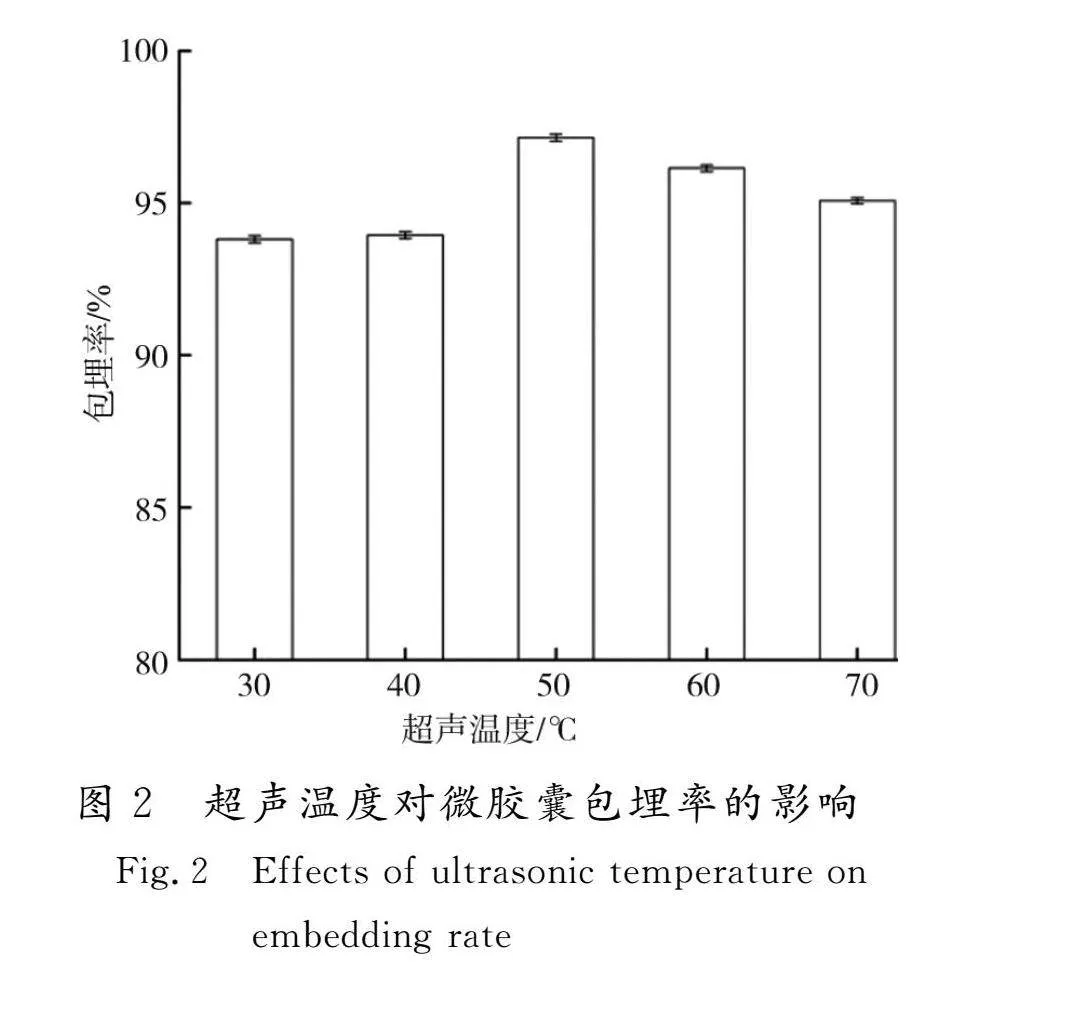
2.1.2 超声温度对菜芙蓉花微胶囊包埋率的影响
超声温度对包埋率的影响见图2。
由图2可知,随着温度的升高,菜芙蓉花黄酮包埋率呈现先上升而后下降的趋势。当温度低于50 ℃时,分子热运动不活跃,β-环糊精与黄酮分子相互作用较弱,包埋率较低;当超声温度大于50 ℃时,可能会影响包埋制备的放热过程而阻碍微胶囊的形成[19];菜芙蓉花黄酮在50 ℃时的包埋率最高,达到97.15%。
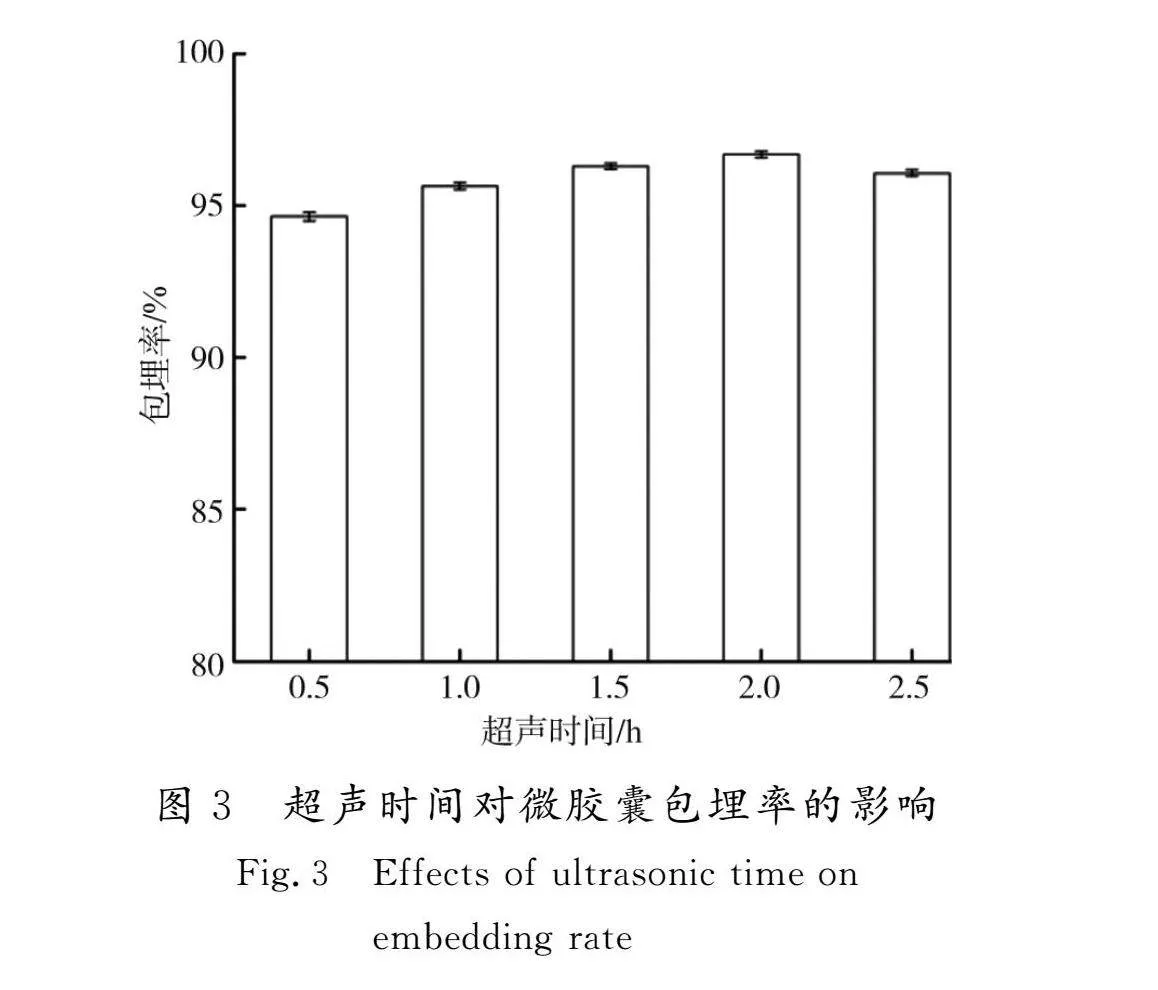
2.1.3 超声时间对菜芙蓉花微胶囊包埋率的影响
超声时间对包埋率的影响见图3。
由图3可知,随着超声时间的延长,包埋率呈现先升高后降低的趋势。微胶囊化时间在0.5~2.0 h时包埋率逐渐增加,在2.0 h时达到最高值96.69%,而后略有降低。随着包埋时间的延长,β-环糊精分子的空腔结构逐渐被黄酮分子所占据并达到饱和。继续延长包埋时间,分子热运动加剧,可能会破坏已形成的微胶囊结构,导致包埋率下降。考虑到包埋率与能量消耗等方面的因素,故选择1.5 h为最佳包埋时间。
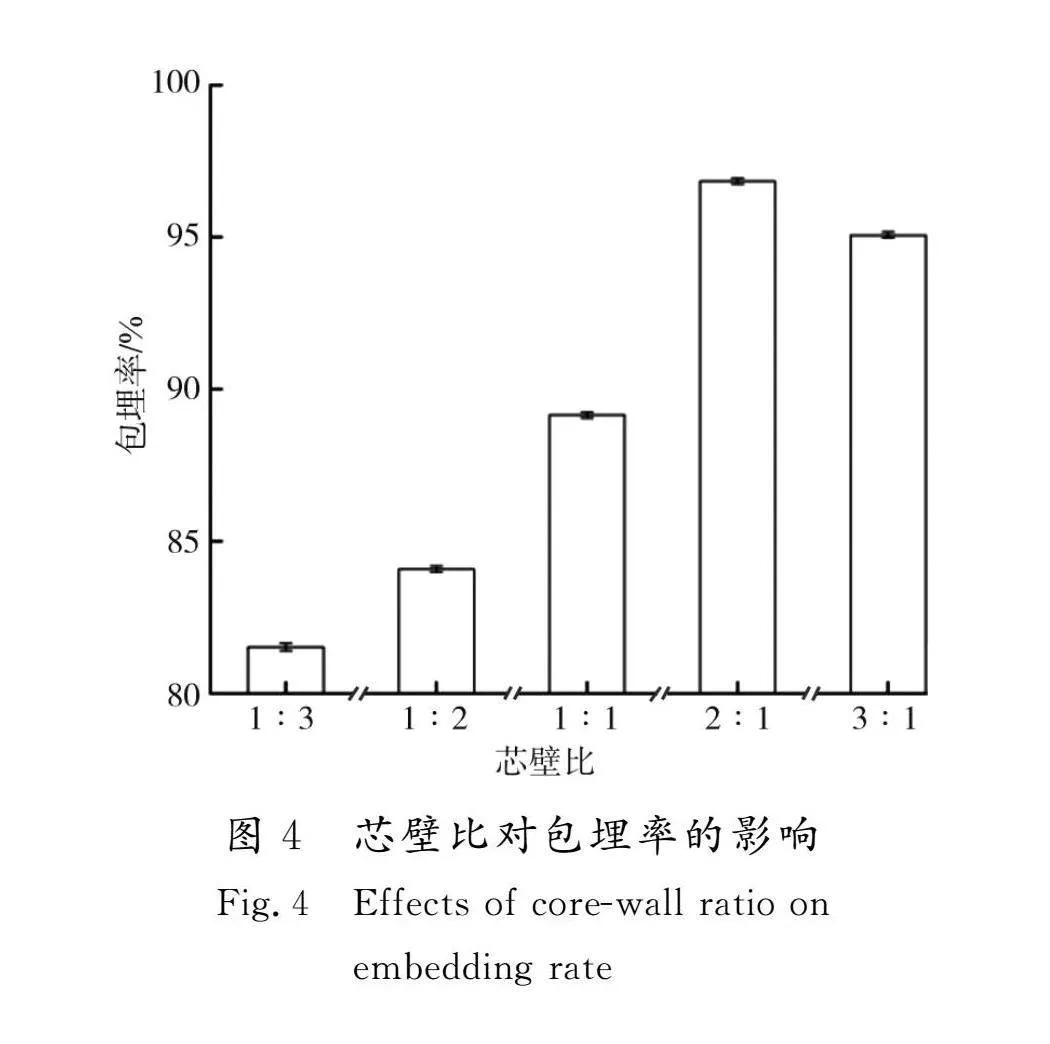
2.1.4 芯壁比对菜芙蓉花黄酮微胶囊包埋率的影响
芯壁比对菜芙蓉花黄酮微胶囊包埋率的影响见图4。当菜芙蓉花黄酮浓缩液体积与β-环糊精质量之比为1∶3时,包埋率最低为81.53%。这可能是由于过多的壁材β-环糊精分子空腔内疏水基团的相互竞争[20]影响了与芯材黄酮分子的充分接触。而随着芯壁比的增加,包埋率逐渐升高,当芯壁比达到2∶1时,包埋率最高为96.84%。当芯壁比继续增大到3∶1时,由于超过了β-环糊精的包埋限度,黄酮分子未能进入β-环糊精疏水空腔,致使黄酮包埋率下降。故选择最佳芯壁比为2∶1。
2.2 响应面法优化菜芙蓉花微胶囊制备工艺
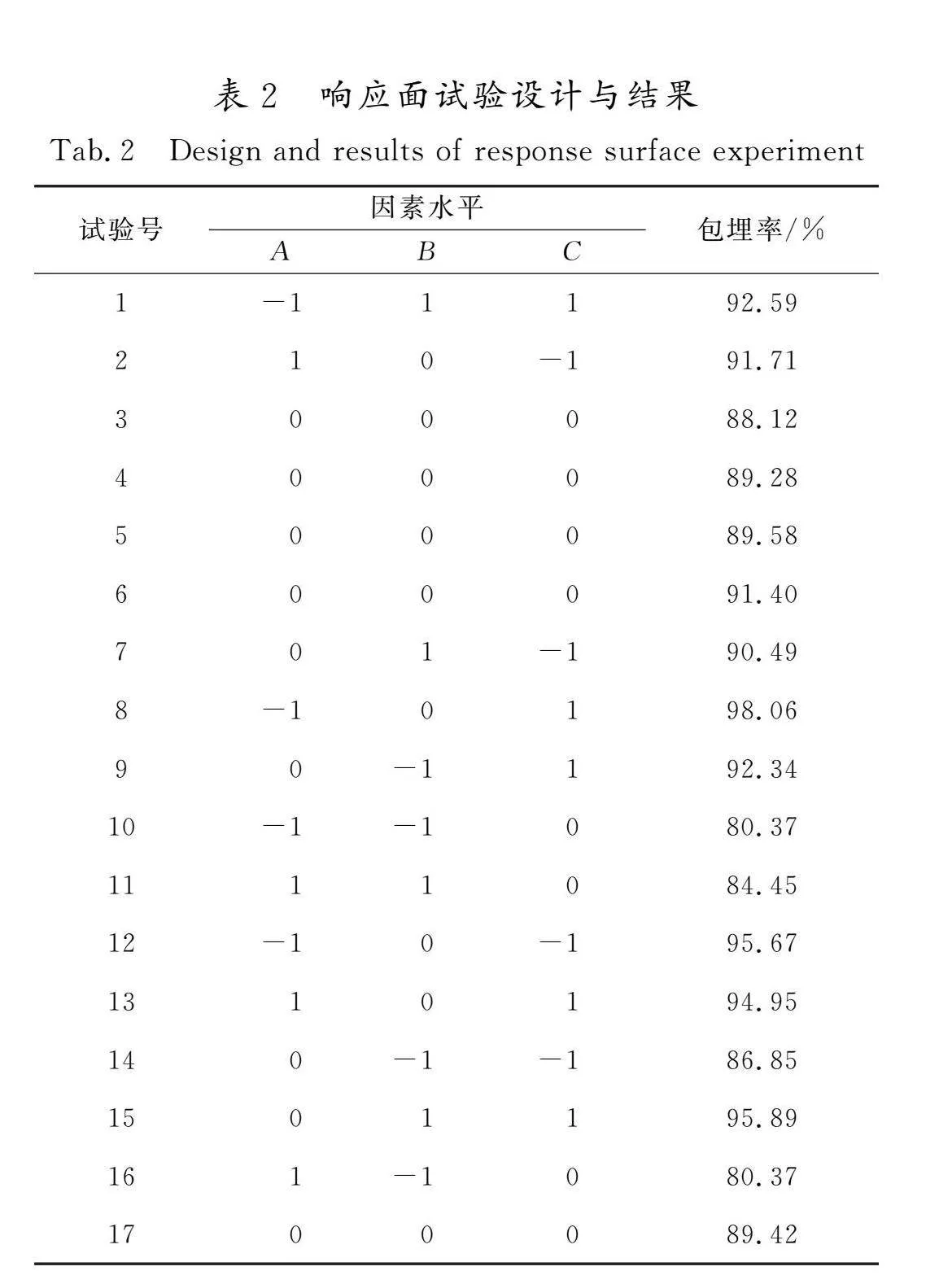
2.2.1 响应面试验结果
在单因素试验基础上,选择对黄酮微胶囊包埋率影响显著的超声温度、超声时间和芯壁比3个因素,通过Design-Expert软件设计实验。根据表1的因素水平,得到17个试验组,方案及结果如表2所示。响应值菜芙蓉花黄酮微胶囊包埋率(Y)对芯壁比(A)、超声时间(B)、超声温度(C)的二次多项式回归方程为Y=89.56-1.90A+2.94B+2.07C-2.04AB+0.21AC-0.023BC-0.71A2-4.41B2+6.24C2。
2.2.2 回归模型方差分析与响应面交互作用分析
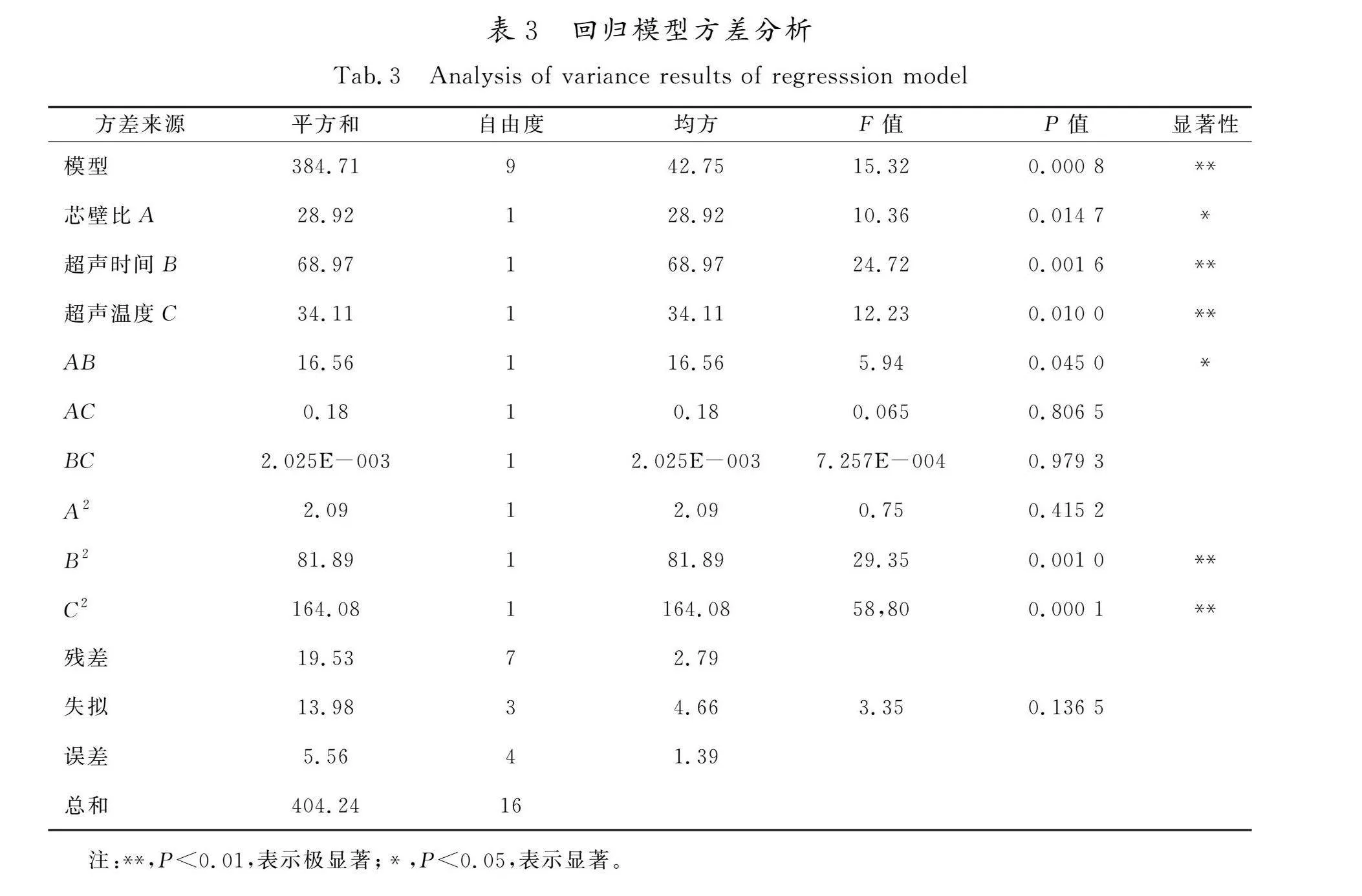
菜芙蓉花黄酮微胶囊包埋率的方差分析和显著性检验结果如表3所示,该回归模型P< 0.01,失拟值P=0.136 5>0.05,说明数据拟合效果好。R2=0.951 7,表明响应值包埋率的变化95.17%来自于所选变量。由F值可知各因素对菜芙蓉花黄酮微胶囊包埋率的影响排序为超声时间(B)>超声温度(C)>芯壁比(A)。一次项B、C和二次项中的B2和C2对包埋率都有极显著影响(P<0.01),一次项A和二次项中的AB达到显著水平(P<0.05),说明微胶囊包埋率与这3个因素存在非线性关系。
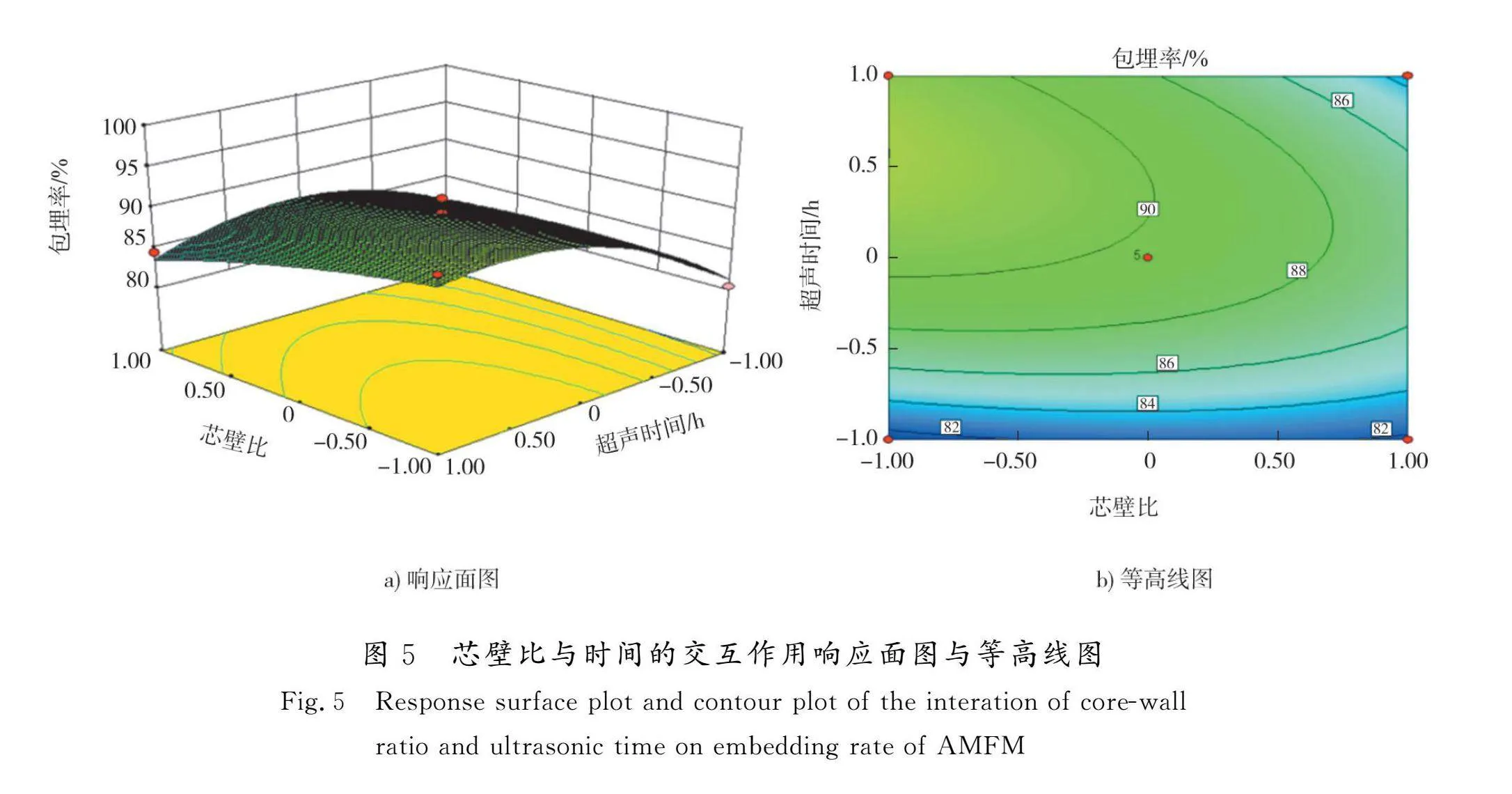
三维响应面图是2个因素的函数,将第3个因素保持在固定水平,以便更好地研究自变量及其相互作用的关系[21]。等高线的形状反映了因素间交互作用的大小。当等高线趋于椭圆形时则表明2个因素间的交互作用相对较强;呈圆形时,则交互作用较弱。芯壁比与时间的交互作用响应面图与等高线图如图5所示。根据响应面的最高点和等高线圆心分布可以看出:在所选范围内菜芙蓉花黄酮的包埋率存在极值,当芯壁比一定时,随着超声时间的延长,包埋率先升高后降低;当超声时间一定时,随着芯壁比的升高,包埋率先升高后降低。由等高线的形状可看出,时间和芯壁比的交互作用显著,与方差分析结果一致。
2.2.3 试验验证
依据数学回归方程对数据进行优化,得出最佳工艺参数为超声温度55.80 ℃,超声时间40 min,芯壁比1.58∶1,预测微胶囊包埋率为98.67%。结合实际操作,选取验证试验条件为超声温度56 ℃、超声时间40 min、芯壁比1.6∶1,3组平行实验获得的微胶囊包埋率为96.89%,接近预测值。
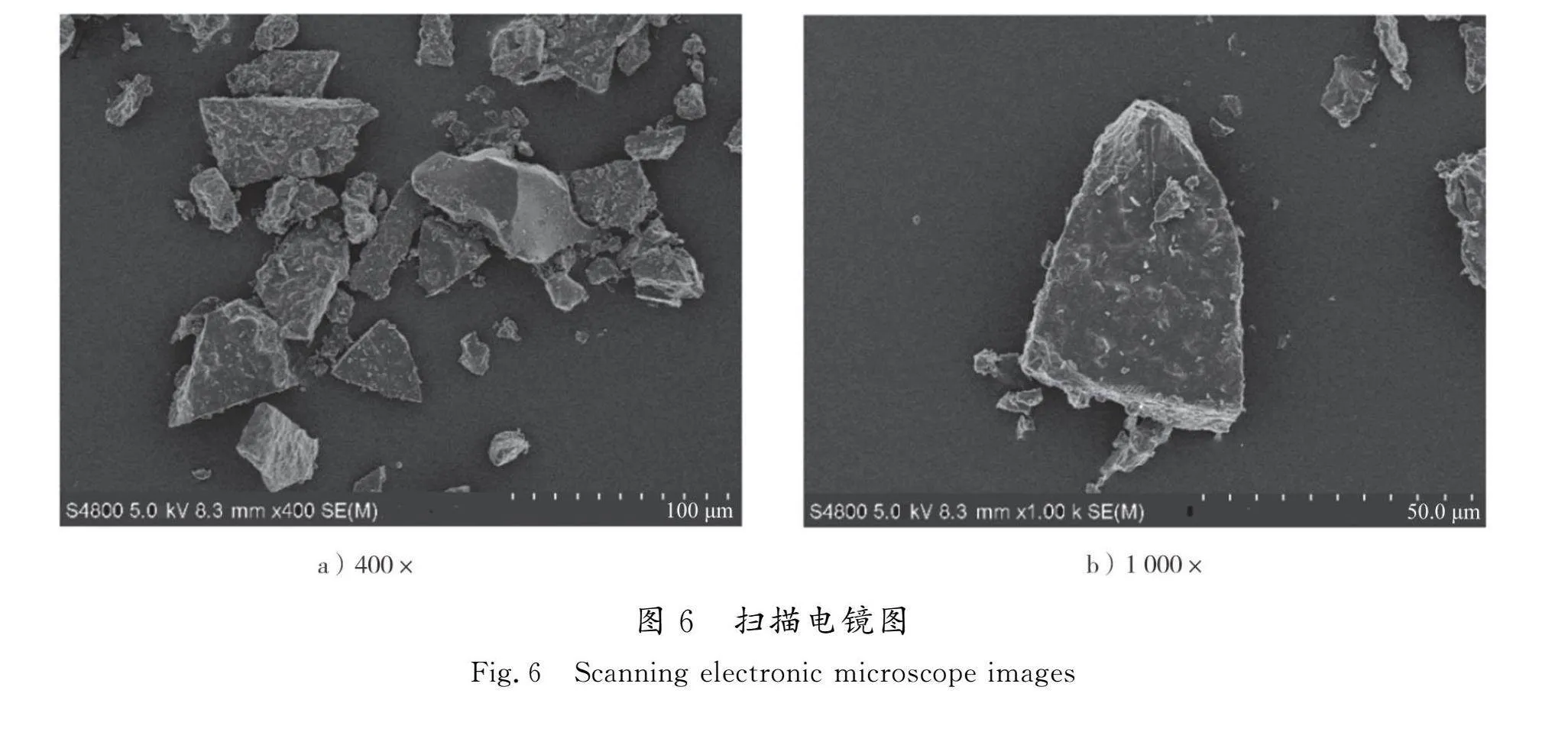
2.3 菜芙蓉花黄酮微胶囊超微结构
利用扫描电镜观察最佳工艺条件下制备的菜芙蓉花黄酮微胶囊,检测其质量。碳水化合物壁材包封芯材通常形成无定型玻璃状固体[22]。如图6所示,经过β-环糊精包埋后的黄酮微胶囊呈现为不同大小、无定型的玻璃状结构,表面还有微小凹陷。在真空冷冻干燥过程中,升华导致水分含量降低,留下脱水产物微胶囊呈现玻璃状。微胶囊表面的小凹陷可能是由于冻干过程中水分蒸发后被空气取代所致。这与诸梦洁[23]制备的β-环糊精包埋桑葚渣粗提物冷冻干燥后呈碎玻璃状微胶囊的形态一致。
2.4 菜芙蓉花黄酮红外光谱分析
红外光谱图为分子振-转光谱,每个官能团和化学键都有几种振动形式,可在红外光区找到相应的吸收峰位置,用于分析化合物特性以及物质之间的相互作用[24]。黄酮类化合物的结构式是由2个芳香环通过一个三碳链相连的。由图7可知:菜芙蓉花黄酮在3 380.48 cm-1处有宽的吸收峰,为酚羟基(—OH)伸缩振动;1 515.67 cm-1处为芳环骨架振动吸收峰;在1 452.56 cm-1处有苯环(CC)振动特征吸收峰;在927.60 cm-1处有C—O—C伸缩振动吸收峰[25];在667.04 cm-1处有苯环的—CH面外弯曲振动特征吸收峰。β-环糊精在3 355.66 cm-1处的吸收带对应的是羟基(—OH)的伸缩振动峰;在2 927.88 cm-1处的吸收峰对应的是亚甲基(—CH2)伸缩振动[26];1 078.30、1 028.25、939.09 cm-1处的吸收峰对应的是β-环糊精的特征峰[27]。微胶囊红外光谱分析结果显示,3 380.48 cm-1处的羟基的伸缩振动峰向3 417.47 cm-1偏移,可能是壁材与黄酮之间通过氢键相互作用结合[28]。微胶囊保留了黄酮在1 515.67 cm-1以及β-环糊精在1 078.30 cm-1处的特征峰,但吸收峰强度发生了减弱。微胶囊中的黄酮在667.04 cm-1处的—CH面外弯曲振动吸收峰、927.60 cm-1处C—O—C伸缩振动吸收峰消失,可能是由于黄酮进入β-环糊精的空腔后,导致振动受限所引起的[20]。在微胶囊的红外图谱中,并未出现新的特征吸收峰,说明在进行包埋的过程中未生成新的化学键,保证了芯材的完整性[29]。
2.5 菜芙蓉花黄酮微胶囊抗氧化性
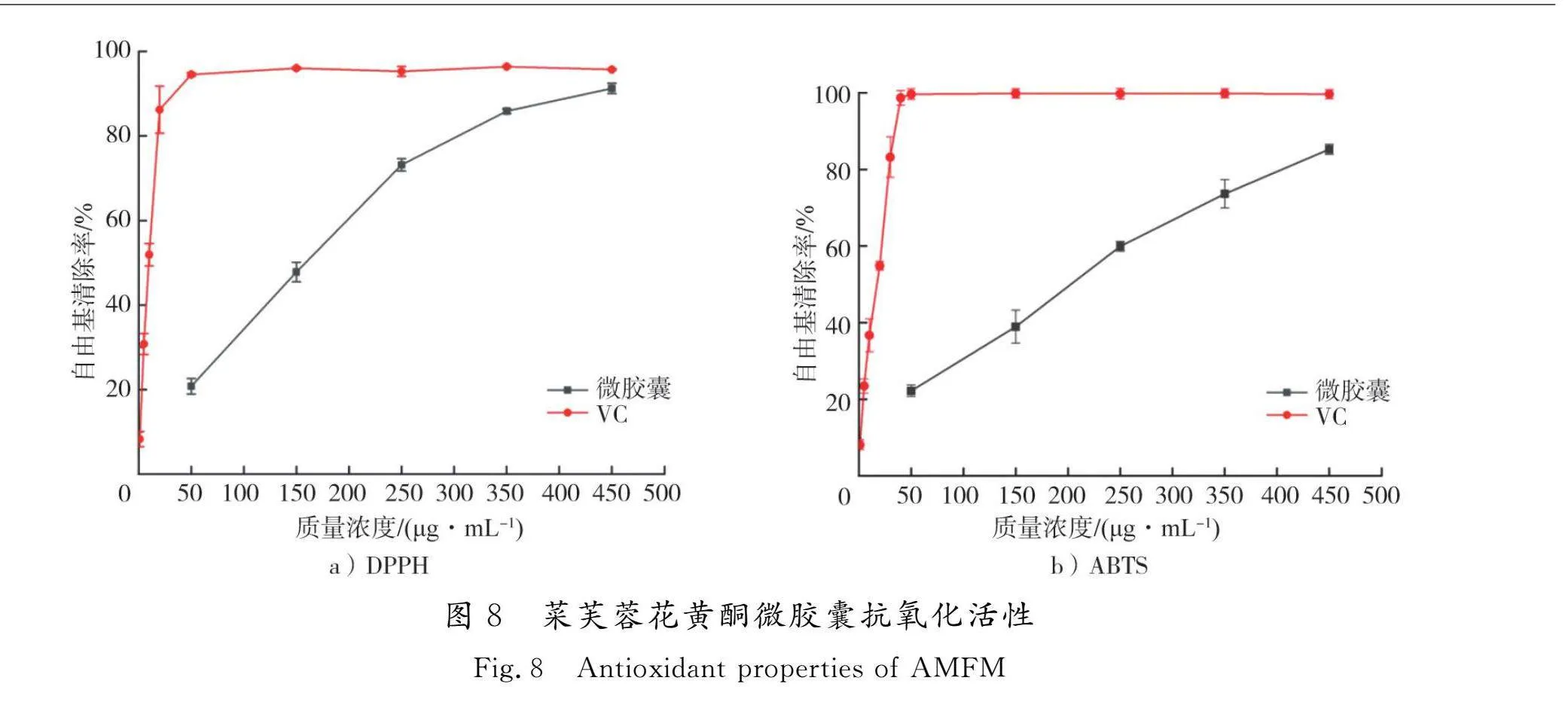
DPPH自由基是一种以氮为中心的稳定显色自由基[30]。由图8可知:随着微胶囊质量浓度的升高,对DPPH自由基清除能力呈现增大趋势,当质量浓度为450 μg/mL时,微胶囊对DPPH自由基的清除率为91.25%,EC50(50%最大清除率时微胶囊的质量浓度)为185.32 μg/mL,与30 μg/mL VC的清除率(95.07%)相当;过硫酸钾与ABTS反应生成阳离子自由基ABTS+,抗氧化剂与其结合使之褪色[31],在质量浓度为50~450 μg/mL时,微胶囊对ABTS自由基清除能力随着质量浓度的增加而增加,当质量浓度为450 μg/mL时,清除率最高为85.25%,EC50为289.74 μg/mL,与30 μg/mL VC的清除率(83.21%)相当。由此可见,菜芙蓉花黄酮微胶囊具有一定的清除DPPH自由基和ABTS自由基的能力,微胶囊化过程能够保持菜芙蓉花黄酮的抗氧化能力,具有保护天然抗氧化剂活性的潜力。
2.6 菜芙蓉花黄酮微胶囊贮藏稳定性试验
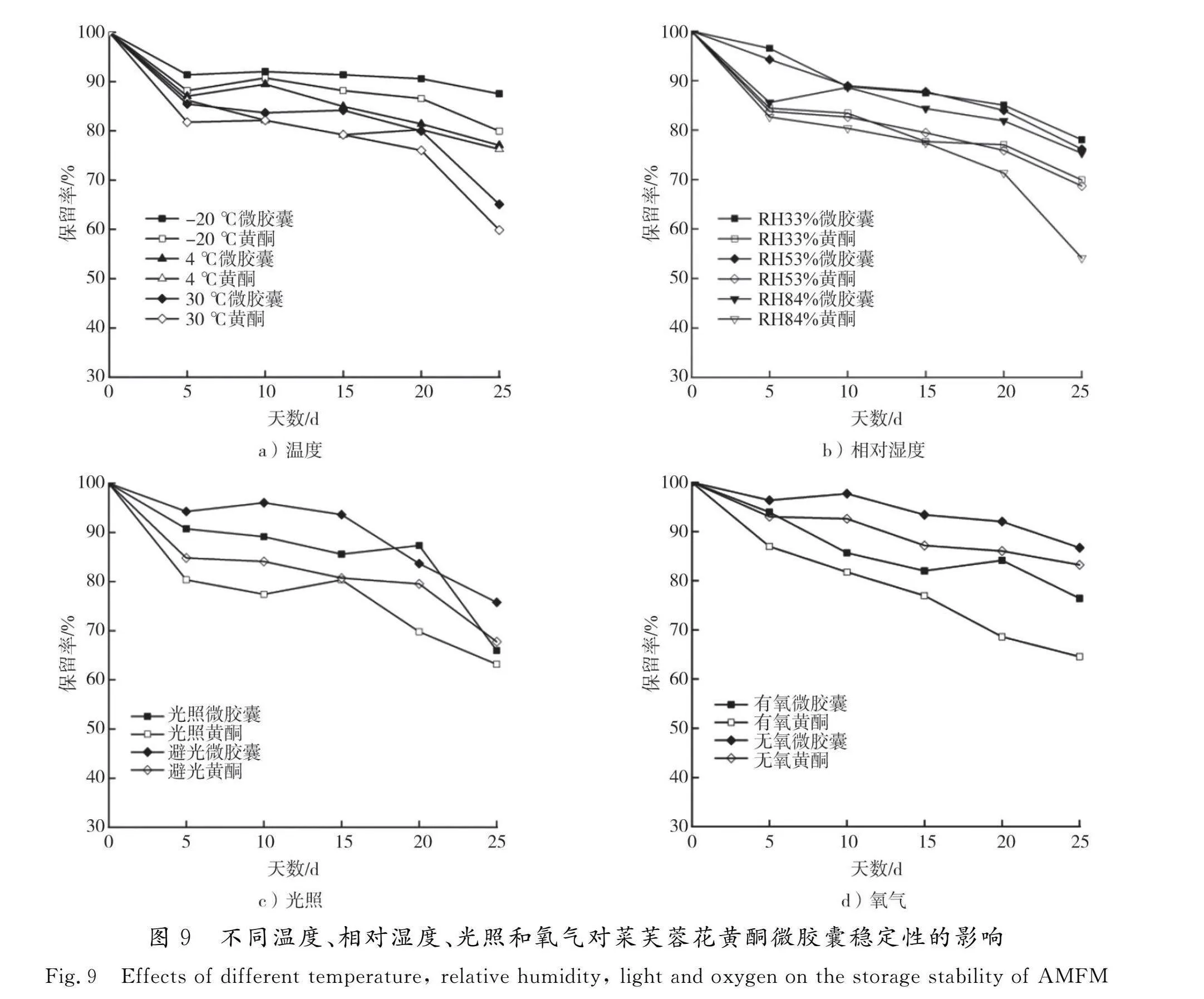
不同温度、相对湿度、光照和氧气对菜芙蓉花黄酮微胶囊稳定性的影响见图9。
由图9 a)可知:菜芙蓉花黄酮微胶囊和黄酮的保留率均随贮藏时间的延长而下降,温度越高保留率越低;-20 ℃下贮藏25 d后,菜芙蓉花黄酮微胶囊的保留率最高达87.51%,而黄酮的保留率为79.96%;4 ℃条件下二者差异不大,但在30 ℃时菜芙蓉花黄酮保留率急速下降为59.86%,微胶囊保留率为65.08%。由此可见,温度升高,微胶囊包膜老化破损,加快了黄酮释放速率,但在相同温度条件下,微胶囊的保留率均高于未包埋黄酮。
由图9 b)可知:在室温相对湿度为33%,53%和84%的条件下,贮藏25 d后菜芙蓉花黄酮微胶囊的保留率均保持在75%以上,而未包埋黄酮的保留率则差异较大;在第25 d时,相对湿度为33%和53%条件下,菜芙蓉花黄酮的保留率分别为69.92%和68.70%;而在相对湿度为84%的条件下,黄酮的保留率下降为53.88%。由此可见,微胶囊化的菜芙蓉花黄酮对相对湿度不敏感,稳定性较未包埋菜芙蓉花黄酮高。
由图9 c)可知:室温避光条件下贮藏25 d,菜芙蓉花黄酮微胶囊和黄酮的保留率均有所下降,二者的保留率分别为75.78%和67.75%;光照条件下,黄酮微胶囊和黄酮保留率急速下降,在第25 d时微胶囊和黄酮保留率分别为65.97%和63.17%。由此可见,微胶囊化可在一定程度上提高黄酮的贮藏稳定性,而且避光条件保留率更高,说明避光放置利于菜芙蓉花黄酮微胶囊的贮存。
由图9 d)可知:在室温无氧条件下贮存25 d后,菜芙蓉花黄酮微胶囊和菜芙蓉花黄酮的保留率分别为86.71%和82.23%,表明在无氧环境中黄酮稳定性较好;在有氧条件下贮存25 d后,二者的保留率均显著下降,而菜芙蓉花黄酮微胶囊的保留率较未包埋黄酮提高了18.35%。由此可见,贮藏环境中的氧气对菜芙蓉花黄酮及其微胶囊的稳定性均具有显著影响,而微胶囊化可以削弱菜芙蓉花黄酮被氧化的程度。
3 结 语
1)通过单因素和响应面试验,建立了超声温度、超声时间、芯壁比、超声功率与菜芙蓉花黄酮微胶囊包埋率之间的非线性回归方程,确定了最佳的包埋条件:超声功率210 W、超声温度56 ℃、超声时间40 min和芯壁比1.6 mL∶1 g。在此条件下,菜芙蓉花黄酮微胶囊包埋率高达96.89%。
2)扫描电镜照片显示,菜芙蓉花黄酮微胶囊呈现出形状不规则的玻璃状;微胶囊红外光谱峰较黄酮弱,且发生了偏移,表明壁材可以有效包裹菜芙蓉花黄酮。
3)微胶囊清除DPPH和ABTS自由基的EC50分别为185.32和289.74 μg/mL,表现出良好的抗氧化活性。在低温、避光、无氧和干燥的条件下贮藏,能够保持较高的黄酮保留率,有效提高菜芙蓉花黄酮微胶囊的稳定性。
本文优化了超声辅助冷冻干燥法制备菜芙蓉花黄酮微胶囊的工艺条件,对微胶囊进行了表征并考察了不同环境因素对其稳定性的影响。今后还应对菜芙蓉花黄酮微胶囊在胃肠消化过程中的释放特征开展进一步研究,为开发具有稳定性好、生物利用率高、抗氧化性强的高附加值食品提供原材料。
参考文献/References:
[1] HONE S, KANT R. Shoot borer earias vittella:A eCsaQxxUWH/xRXVEuj9JOj1B65gaXRA9T1GpGxRazgc=threat to the indigenous vegetable Pele Abelmoschus Manihot in the Pacific[J]. Multidisciplinary Digital Publishing Institute Proceedings, 2020, 36(1): 95-99.
[2] WANG Z, WANG S. Natural Nutritional Supplementary Food of Abelmoschus Manihot (LINN.)[P].WO:2007CN70933,2009-04-30.
[3] 宋彩萍. 金花葵全产业链发展新模式的探索[J]. 农业技术与装备,2020(9): 23-24.
SONG Caiping. Exploration of the new development model of the whole industrial chain of Hibiseu Manihot L.[J]. Agricultural Technology and Equipment,2020(9):23-24.
[4] 武阿锋, 姚树萍, 孙涛,等.菜芙蓉开发价值潜力研究[J].陕西农业科学,2019,65(2): 47-48.
WU Afeng, YAO Shuping, SUN Tao, et al. Study on development potential and value of vegetable lotus[J]. Shanxi Agricultural Science,2019,65(2):4AQ3jB/06tuOzifdY8H3X9I/lvJyChFKvmYGTM1x6EM4=7-48.
[5] 吴正超, 李亮亮, 徐铭泽, 等. 高效液相色谱法定量分析金花葵花中5种黄酮类物质[J].食品工业, 2019, 40(9): 284-287.
WU Zhengchao, LI Liangliang, XU Mingze, et al.Simultaneous determination of five flavonoids in the flowers of Abelmoschus Manihot by high performance liquid chromatography[J]. The Food Industry,2019,40(9):284-287.
[6] 张月琴. 金花葵黄酮颗粒剂的制备及抗氧化作用研究[D]. 宜春:宜春学院, 2023.
ZHANG Yueqin. Preparation of Abelmoschus Manihot Flavonoid Granulis and Study of Antioxidant [D]. Yichun: Yichun University,2023.
[7] 凡思华, 王文强, 高学军, 等. 类黄酮化合物在家畜生产中的应用研究进展[J].现代畜牧科技, 2023(9): 13-15.
FAN Sihua, WANG Wenqiang, GAO Xuejun, et al. Research progress on the application of flavonoid compounds in livestock production [J]. Modern Animal Husbandry Science and Technology, 2023(9):13-15.
[8] 李杰, 马艳莉, 课净璇, 等. 山茱萸黄酮微胶囊制备及贮存稳定性研究[J].中国食品添加剂, 2023, 34(6): 212-219.
LI Jie, MA Yanli, KE Jingxuan, et al. Study of preparation and storage stability of Cornus officinalis flavonoids microcapsules[J].Chinese Food Additives,2023, 34(6):212-219.
[9] FU Y, LIU W, SOLADOYE O P. Towards innovative food processing of flavonoid compounds: Insights into stability and bioactivity [J]. LWT, 2021.DOI:10.1016/J.LWT.2021.111968.
[10]MATENCIO A, NAVARRO-ORCAJADA S, CONESA I, et al. Evaluation of juice and milk “food models” fortified with oxyresveratrol and β-cyclodextrin [J]. Food Hydrocolloids, 2020.DOI:10.1016/j.foodhyd.2019.105250.
[11]POPOVIC' B M, BLAGOJEVIC' B, LATKOVIC' D, et al. A one step enhanced extraction and encapsulation system of cornelian cherry (Cornus mas L.) polyphenols and iridoids with β-cyclodextrin [J]. LWT, 2021.DOI:10.1016/J.LWT.2021.110884.
[12]魏姜勉. 刺槐花总黄酮微胶囊的制备及其储藏稳定性研究 [J]. 粮食与油脂, 2023, 36(6): 105-108.
WEI Jiangmian. Study on preparation and storage stability of total flavonoids microcapsule from Robinia Pseudoacaia L. flower[J]. Cereals & Oils, 2023,36(6): 105-108.
[13]MARTNEZ-RAMOS T, BENEDITO-FORT J, WATSON N J, et al. Effect of solvent composition and its interaction with ultrasonic energy on the ultrasound-assisted extraction of phenolic compounds from Mango peels (Mangifera Indica L.) [J]. Food and Bioproducts Processing, 2020, 122: 41-54.
[14]TENG X, ZHANG M, DEVAHASTIN S. New developments on ultrasound-assisted processing and flavor detection of spices: A review [J]. Ultrasonics Sonochemistry, 2019, 55: 297-307.
[15]杜星芳, 贾艳丽, 仇燕. 菜芙蓉多糖的表征与生物活性 [J]. 精细化工, 2020, 37(6): 1204-1211.
DU Xingfang, JIA Yanli, QIU Yan. Characterization and bioactivity of polysaccharide from Abelmoschus Manihot (L.) medic[J]. Fine Chemicals,2020,37(6):1204-1211.
[16]廖霞, 杨小兰, 李瑶, 等. 槲皮素微胶囊的贮藏稳定性及抗氧化活性 [J]. 食品科学, 2017, 38(1): 60-66.
LIAO Xia, YANG Xiaolan, LI Yao, et al. Storage stability and antioxidant activity of quercetin microcapsules [J]. Food Science,2017,38(1):60-66.
[17]管培燕, 刘美玲, 赵明玉. 香椿嫩叶及老叶中黄酮类物质的提取定量及抗氧化功能分析[J]. 中国食品添加剂, 2020, 31(11): 50-54.
GUAN Peiyan, LIU Meiling, ZHAO Mingyu. Exextraction, quantification and antioxidant function analysis of flavonoids in young and old leaves of Toona Sinensis[J]. Chinese Food Additives, 2020,31(11): 50-54.
[18]仇燕, 李俊英, 刘畅, 等. 菜芙蓉总黄酮纯化及其体内抗氧化性 [J]. 河北科技大学学报, 2016, 37(6): 587-593.
QIU Yan, LI Junying, LIU Chang, et al. Purification of total flavonoids of Abelmoschus Manihot (L.) medic and its antioxidant properties in vivo[J]. Journal of Hebei University of Science and Technology,2016,37(6):587-593.
[19]LIU Y, HAN J, WANG Y, et al. Selective separation of flavones and sugars from honeysuckle by alcohol/salt aqueous two-phase system and optimization of extraction process [J]. Separation and Purification Technology, 2013, 118: 776-783.
[20]孙亚利, 周文美, 黄永光, 等. 以聚合乳清蛋白为壁材的苦荞黄酮微胶囊化及其品质分析[J]. 食品科学, 2020, 41(12): 259-266.
SUN Yali, ZHOU Wenmei, HUANG Yongguang, et al. Microencapsulation and quality analysis of Tartary buckwheat flavonoids using polymerized whey protein as wall material [J]. Food Science,2020,41(12):259-266.
[21]AHMAD M, ASHRAF B, GANI A, et al. Microencapsulation of saffron anthocyanins using β glucan and β cyclodextrin: Microcapsule characterization, release behaviour & antioxidant potential during in-vitro digestion [J]. International Journal of Biological Macromolecules, 2018, 109: 435-442.
[22]LABUSCHAGNE P. Impact of wall material physicochemical characteristics on the stability of encapsulated phytochemicals: A review [J]. Food Research International, 2018, 107: 227-247.
[23]诸梦洁. 桑葚渣粗提物降糖活性成分稳定性研究及微胶囊制备[D]. 南京:南京农业大学, 2019.
ZHU Mengjie. Study on the Stability and Microcapsulation of Active Components in Mulberry Residue Crude Extract [D].Nanjing:Nanjing Agricultural University,2019.
[24]陈程莉, 李丰泉, 刁倩, 等. 黑枸杞花青素微胶囊优化及理化特性分析 [J]. 食品与发酵工业, 2020, 46(5): 208-214.
CHEN Chengli, LI Fengquan, DIAO Qian, et al. Optimization and analysis of physical and chemical properties of black Lycium Ruthenicun Murr anthocyanin microcapsules[J]. Food and Fermentation Industry,2020,46(5):208-214.
[25]朱俊玲, 梁凯, 王春艳, 等. 低共熔溶剂提取小米糠多酚及微胶囊制备 [J]. 中国食品学报, 2023, 23(12): 179-187.
ZHU Junling, LIANG Kai, WANG Chunyan, et al. Low eutectic solvent extraction of polyphenols from millet bran and its microcapsule preparation [J]. Journal of Chinese Institute of Food Science and Technology,2023, 23(12): 179-187.
[26]黄思卉. 基于有机金属卤素钙钛矿发光材料的制备及性能研究[D]. 上海: 华东师范大学,2020.
HUANG Sihui. Synthesis and Characterization of Luminescent Organomental Halide Perovskite Materials[D]. Shanghai: East China Normal University,2020.
[27]王仁杰, 王凯玉, 过科家, 等. Box-Behnken响应面法优化高良姜挥发油的包合工艺研究 [J]. 中国现代应用药学, 2020, 37(19): 2356-2361.
WANG Renjie, WANG Kaiyu, GUO Kejia, et al. Optimization for inclusion process of Alpinia Officinarum Hance volatile oil by Box-Behnken response surface methodology[J]. Chinese Journal of Modern Applied Pharmacy,2C4dcYKP9BRqvZAtnGnGZFg==020,37(19):2356-2361.
[28]李丹, 汪秀妹, 梁杰, 等. 复合凝聚法制备槲皮素微胶囊及其表征 [J]. 食品研究与开发, 2023, 44(15): 127-135.
LI Dan, WANG Xiumei, LIANG Jie, et al. Quercetin microcapsules: Preparation by composite condensation and characterization [J]. Food Research and Development,2023,44(15):127-135.
[29]李茂淋, 王三, 王毅, 等. 葛根素-猴头菇不溶性膳食纤维复合微胶囊的制备及理化性质的研究 [J/OL]. 食品工业科技,2023.DOI:10.13386/j.issn1002-0306.2023080261.
LI Maolin, WANG San, WANG Yi, et al. Puerarin-Hericium insoluble dietary fiber compound preparation ofmicrcocapsule and syudy of physical and chemical properties[J/OL]. Food Industry Science and Technology,2023.DOI:10.13386/j.issn1002-0306.2023080261.
[30]黄文清, 徐紫婷, 黄小梨, 等. 扁豆多肽微胶囊制备及体外缓释性和抗氧化性研究 [J]. 食品科技, 2023, 48(11): 224-230.
HUANG Wenqing, XU Ziting, HUANG Xiaoli, et al. Preparation of lentil polypeptide microcapsules and study on in vitro digestion, slow release and antioxidant[J]. Food Science and Technology,2023,48(11):224-230.
[31]王瑜婷, 曹嵌, 何荣荣, 等. 淫羊藿总黄酮提取工艺优化与抗氧化活性研究 [J]. 现代中药研究与实践, 2023, 37(3): 71-76.
WANG Yuting, CAO Qian, HE Rongrong, et al. Study on the optimization of extraction and the anti-oxidant activity of total flavonoids in Epimedii Folium[J]. Research and Practice on Chinese Medicines,2023,37(3):71-76.

