基于ARMS-PCR技术检测SLC39A13基因核苷酸多态性方法的建立







摘 要:为了实现核苷酸多态性(SNP)的精准分型,针对SLC39A13基因rs755555位点,建立基于荧光定量PCR的分子诊断技术。首先,分别设计rs755555位点及内参基因peptidylprolyl isomerase A(PPIA)的Taqman荧光ARMS-PCR检测引物和探针;其次,构建阳性对照质粒;最后,以基因分型精确度为指标,优化引物探针组合,以及检测试剂的 PCR 反应体系和反应条件。结果表明:野生型最优引物探针组合为WF1、R1、FP1、PIRF5、PIRR5、PIRP5,突变型最优引物探针组合为FMF3、R1、FP1、PIRF5、PIRR5、PIRP5;每个检测样品的最优反应体系为SLC39A13基因上下游引物探针各0.1 μL,内标上下游引物探针各0.1 μL,10 μL PerfectStartⅡ Probe qPCR SuperMix UDG,5.4 μL纯水,4 μL样品基因组。重复性实验和70个样品的检测验证,确认了检测体系的可行性,为研发SLC39A13基因rs755555位点多态性检测试剂盒提供了技术基础。
关键词:分子生物学;人SLC39A13基因;ARMS-PCR;核苷酸多态性检测;实时荧光定量PCR
中图分类号:Q789
文献标识码:A
DOI:10.7535/hbkd.2024yx05005
Establishment of a method for detecting nucleotide polymorphism
of SLC39A13 gene based on ARMS-PCR
GUO Bingqian1,LI Mengyu2,WANG Rui3,WANG Shusong4, FENG Huiyong1,LI Tianming1
(1.School of Food and Biology,Hebei University of Science and Technology,Shijiazhuang,Hebei 050018,China;
2.Forestry Institute,Northeast Forestry University,Harbin,Heilongjiang 150006,China;
3.Taiyuan Jinyu Clinical Inspection Office Company Limited,Taiyuan,Shanxi 030003,China;
4.Hebei Key Labratory of Reproductive Medicine, Hebei Hospital of Reproductive Health,
Shijiazhuang,Hebei 050071, China)
Abstract:In order to achieve its nucleotide polymorphism (SNP) accurate typing, this paper establishes a molecular diagnostic technique based on fluorescent quantitative PCR for accurate genotyping of the nucleotide polymorphism (SNP) at the rs755555 locus of the SLC39A13 gene. Firstly, Taqman fluorescent ARMS-PCR detection primers and probes were designed for the rs755555 locus and the internal reference gene peptidylprolyl isomerase A (PPIA). Secondly, positive control plasmids were constructed. Finally, based on genotyping accuracy, the primer and probe combinations were optimized, and the PCR reaction system and conditions for the detection reagents were optimized. The optimal primer and probe combination for the wild-type was: WF1, R1, FP1, PIRF5, PIRR5, PIRP5; the optimal combination for the mutant type was: FMF3, R1, FP1, PIRF5, PIRR5, PIRP5. The optimal reaction system for detecting samples was: 01 μL each of upstream and downstream primers and probes for the SLC39A13 gene, 01 μL each of upstream and downstream primers and probes for the internal standard, 10 μL PerfectStart Ⅱ Probe qPCR SuperMix UDG, 54 μL purified water, and 4 μL sample genome. The feasibility of this detection system was confirmed through reproducibility experiments and the detection of 70 samples. This provides a technical foundation for the development of a detection kit for the polymorphism at the rs755555 locus of the SLC39A13 gene.
Keywords:molecular biology;human SLC39A13 gene;ARMS-PCR;nucleotide polymorphism detection;real-time fluorescence quantitative PCR
锌是人体必需的微量元素,也是男性生殖的重要关联因子[1]。已有研究证实,缺锌会导致精子发生障碍、降低精液质量和生育力
[2-4]。锌吸收转运存在个体差异,但其遗传学机制尚未完全阐明,临床诊治男性不育时,精准补锌也缺乏依据[5]。人
SLC39A13基因编码锌转运体跨膜蛋白ZIP13[6]位于11号染色体p112,共有21个转录本,已知其表达水平与精子活力密切相关。通过对66例样本的测序分析及精液质量检测,初步发现ZIP13 基因rs755555位点的单核苷酸多态性(SNP)与精子活力高度关联,但对于该结果仍需要扩大样本量,并采用高可靠度的SNP检测技术进一步加以确认。
单核苷酸多态性是指同一物种同一基因不同个体之间或不同亚型之间在基因组水平上由于单个核苷酸不同所引起的DNA序列多态性[7-9],该生物个体内全部细胞的基因型相同,所以基因型具有可遗传性,可以稳定传递给下一代。该类生物在基因分型时,只有野生型、突变性、杂合型3种类型。在医学上,不同SNP基因型的人群对于某种疾病的易感程度是有差别的[10],所以SNP分型研究具有重要的医学意义,是精准医疗的基础[11]。目前,中国市场用于进行基因检测的技术主要包括全基因组测序技术、荧光原位杂交技术、荧光定量PCR技术、基因芯片技术等。其中荧光定量PCR技术具有灵敏度高、普及度高、检测时间短和成本低等优势[12-13],在目前临床分子诊断技术中应用最为成熟。
ARMS-PCR(amplification refractory mutation system PCR)即扩增阻滞突变系统PCR,通过引物3’末端引物设计控制等位基因特异性延伸,并结合Taqman探针的方法检测荧光信号值,从而判断野生型等位基因和突变型等位基因[14-15]。本研究采用ARMS-PCR和荧光定量PCR技术,以提高检测灵敏性、特异性及准确性为目标,设计、优化引物探针组合,优化检测试剂的PCR反应体系和反应条件,建立锌转运体跨膜蛋白相关基因SLC39A13核苷酸多态性检测方法,为研发 SLC39A13 基因rs755555位点基因多态性检测试剂盒提供技术基础。目前,SLC39A13基因的单核苷酸多态性的检测方法研究还属空白,因此,本研究具有较好的参考价值。
1 材料与方法
1.1 主要试剂与仪器
质粒小提中量试剂盒、超薄DNA产物纯化试剂盒、DNA回收试剂盒,天根生化科技(北京)有限公司提供;DNA提取试剂盒,简石生物技术(北京)有限公司提供;探针法qPCR试剂盒,含UDG(PerfectStart Probe qPCR SuperMix UDG),北京全式金生物技术有限公司提供;pfu聚合酶、dNTPs及其他PCR反应试剂,北京全式金生物技术有限公司提供;Taq DNA聚合酶,北京全式金生物技术有限公司提供;SpectraMax QuickDrop超微量分光光度计,实时荧光定量PCR仪,Quantstudio DX提供;DYY-6C电泳仪,北京市六一厂提供;PCR扩增仪,T100TMThermal Cycler;2×PerfectStar Ⅱ Probe qPCR SuperMix UDG,引物由金唯智生物公司合成。
1.2 实验样本
本次实验所需要的全血样本,由河北省生殖健康研究院提供。
1.3 实验方法
1.3.1 引物和探针的设计
ARMS-PCR检测方法是利用Taq DNA聚合酶(来自Thermus aquaticus)的扩增特性来完成靶标突变位点的检测。Taq DNA聚合酶在扩增过程中缺乏3’- 5’外切酶活性,因此采用等位基因特异的2条上游引物,两者在3’端核苷酸不同,一个对野生型等位基因特异,另一个对突变型等位基因特异。下游引物采用通用引物,在Taq DNA聚合酶作用下,与模板不完全匹配的上游引物将不能退火,不能生成PCR产物,而与模板匹配的引物体系则可扩增出产物。ARMS-PCR需要设计Taqman探针,探针分别连有2种不同的荧光染料,5’端为荧光基团,3’端连有通用的荧光淬灭基团。在靶基因扩增过程中,PCR引物和荧光标记探针在退火时均会与目标序列互补结合,Taq酶在延伸模板链延伸时遇到与模板稳定结合的探针,Taq酶的5’—3’外切核酸酶会将与模板结合的特异性探针降解,从而使探针上的荧光基团因为物理空间分离,淬灭效应消失,发出荧光,而不能顺利扩增的则没有荧光,因此,通过荧光定量PCR的Ct值的差异,确定SNP基因型。针对SLC39A13基因的rs755555位点,本研究野生基因型为CC,因此上游引物3’端为C;突变型基因型为TT,所以上游引物3’端为T;杂合型基因型为CT,2条引物均可扩增,只是扩增强度均减弱。根据上述原理,设计系列引物及探针,如表1所示。
1.3.2 DNA提取
DNA提取参考DNA提取试剂盒说明书。提取的核酸使用SpectraMax QuickDrop超微量分光光度计测定DNA的含量,于-20 ℃保存。
1.3.3 阳性对照质粒的构建
以河北省生殖健康研究院提供的人类基因组DNA作为模板,分别扩增 SLC39A13基因突变型、 SLC39A13 基因野生型,与扩增的内参基因PPIA融合,融合片段分别T克隆,获得转化子。经PCR验证,获得野生型和突变型基因克隆阳性转化子,提交测序,将测序正确的野生型对照质粒和突变型对照质粒冷冻保存,备用。将已经构建好的野生型和突变型质粒等比例混合,获得杂合基因型对照质粒。
1.3.4 Taqman荧光ARMS-PCR反应体系
每个检测样的ARMS-PCR反应体系试剂配比如表2所示,其中DNA模板分别为SLC39A13野生型人工合成质粒、SLC39A13突变型人工合成质粒以及杂合质粒和人类基因组DNA。采用表1中的引物和探针,依据实验不同进行组合,每例DNA模板同时在野生反应液和突变反应液中分别进行扩增,DNA聚合酶采用2×PerfectStart Ⅱ Probe qPCR SuperMix UDG。首先,混合配制野生型反应液的引物、探针,以及酶和突变型反应液的引物、探针,配制体积为全部样品所需的总量;然后,分装到PCR管中,分别加入各个模板样品。
1.3.5 Taqman荧光ARMS-PCR反应条件
本研究使用仪器为Quantstudio DX实时荧光定量PCR仪,配套使用软件为Quant StudioTM Test Development Software v1.0.1 ,实时荧光定量 PCR 反应的每个循环包括3个主要步骤,具体条件见表3。
1.3.6 检测结果的判读及分型
Ct值即荧光信号达到设定阈值线对应的循环数。若计算数值大于3,则该样品为野生型;若计算数值小于-3,则该样品为突变型;若计算数值小于3大于-3,则该样品为杂合型。
2 实验结果
2.1 以基因分型准确度为指标确定引物探针组合
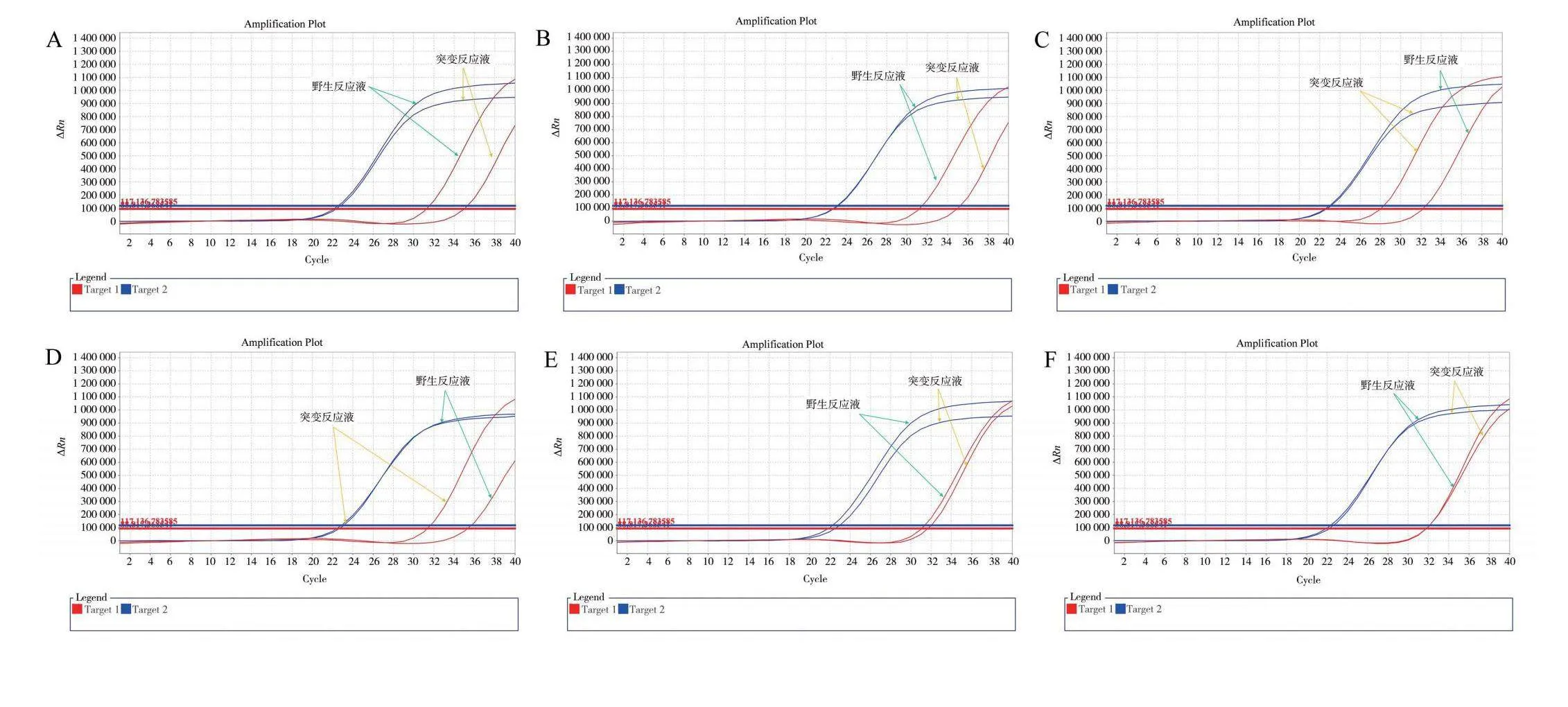
以制备的阳性对照质粒作为野生型、突变型和杂合型样品,同时选用野生型、突变型以及杂合型基因组各2例(基因组质量浓度稀释至10~15 ng/μL)样品进行检测。将表1中野生型上游引物与共用下游引物和探针以及内标上下游引物和探针一一进行组合,共16组,按照表2的体系分别配制野生型反应液和突变型反应液,引物探针加量0.2 μL。按照表3的反应条件设置PCR仪进行检测,依据“1.3.6”所述判定方法进行计算及判定分型结果,以分型准确性为依据进行优选。实验结果见图1和表4。
表4结果显示:有9组引物探针组合检测不准确(实验数据略);有6组引物探针组合虽然各样品基因分型准确,但其中有3组阴性对照的突变扩增体系的Ct值介于36~38之间(实验数据略);有3组引物探针组合的个别Ct差值接近安全区间边缘(实验数据略);有1组引物探针组合检测分型准确、Ct差值在安全区间内且阴性对照的Ct值大于38。得到野生型最优引物探针组合为WF1、R1、FP1、PIRF5、PIRR5、PIRP5,突变型最优引物探针组合为FMF3、R1、FP1、PIRF5、PIRR5、PIRP5。
2.2 PCR反应体系的优化
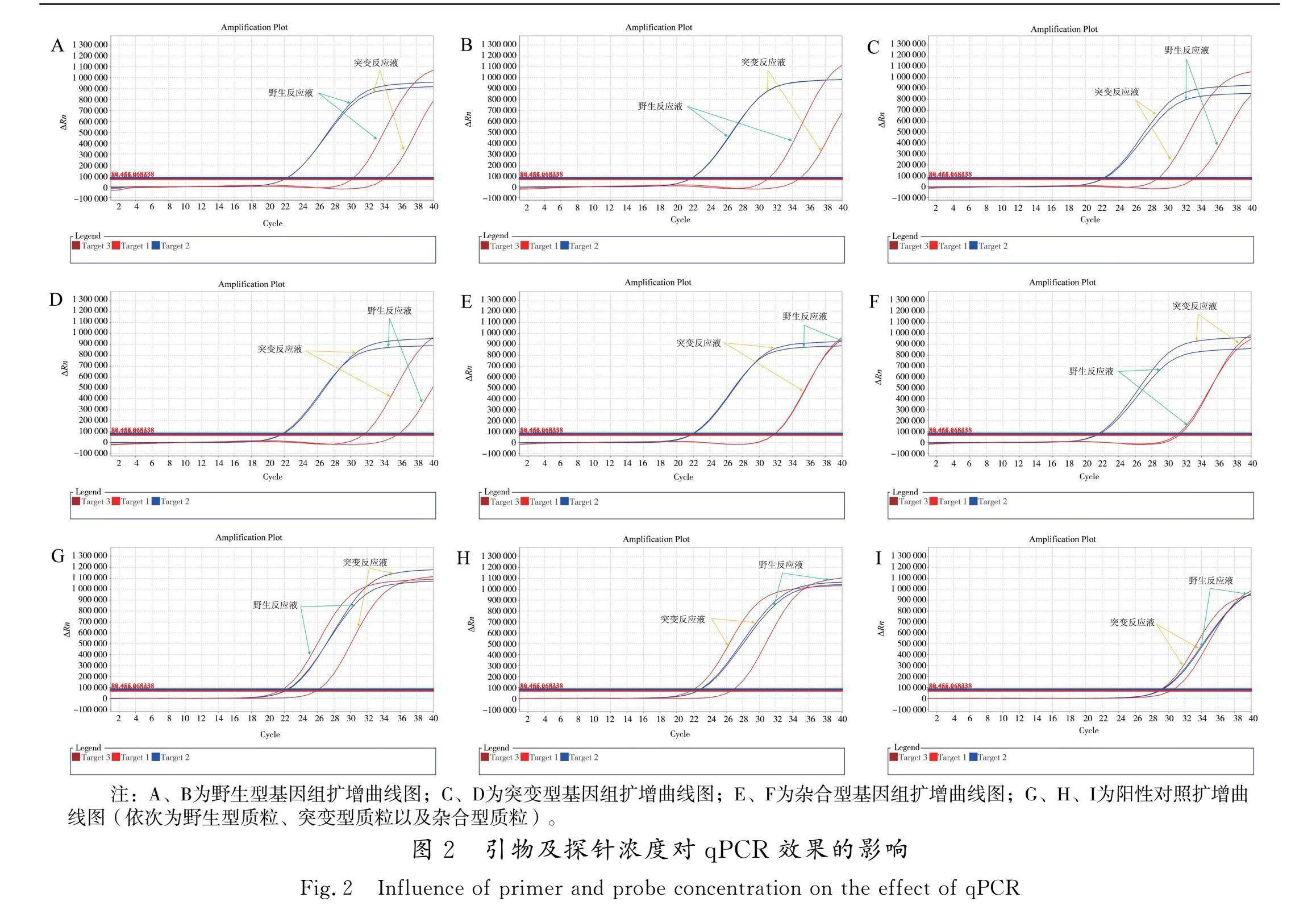
2.2.1 引物及探针浓度优化
以制备的阳性对照质粒作为野生型、突变型和杂合型样品,同时选用野生型、突变型以及杂合型基因组各2例(基因组质量浓度稀释至10~15 ng/μL)进行检测,使用“2.1”确定的最优引物探针组合。引物及探针浓度的优化方案一:引物及探针加量为0.2 μL,模板加量为2 μL,其他加量见表2;优化方案二:引物及探针加量为0.1 μL,模板加量为2 μL,其他加量见表2。使用“1.3.6”所述方法进行计算及基因分型判定。方案一的分型结果虽然都准确(实验数据略),但阴性对照的突变反应液Ct值为38.21,小于方案二,可能是因为引物探针浓度高,引物和探针之间存在的二聚体和发夹结构等造成了非特异扩增。为了减少对检测结果的干扰,也为了减少检测试剂用量,降低检测成本,所以采用方案二,即在PCR反应体系中引物及探针加量为0.1 μL更优,实验数据见表5,其扩增曲线见图2。
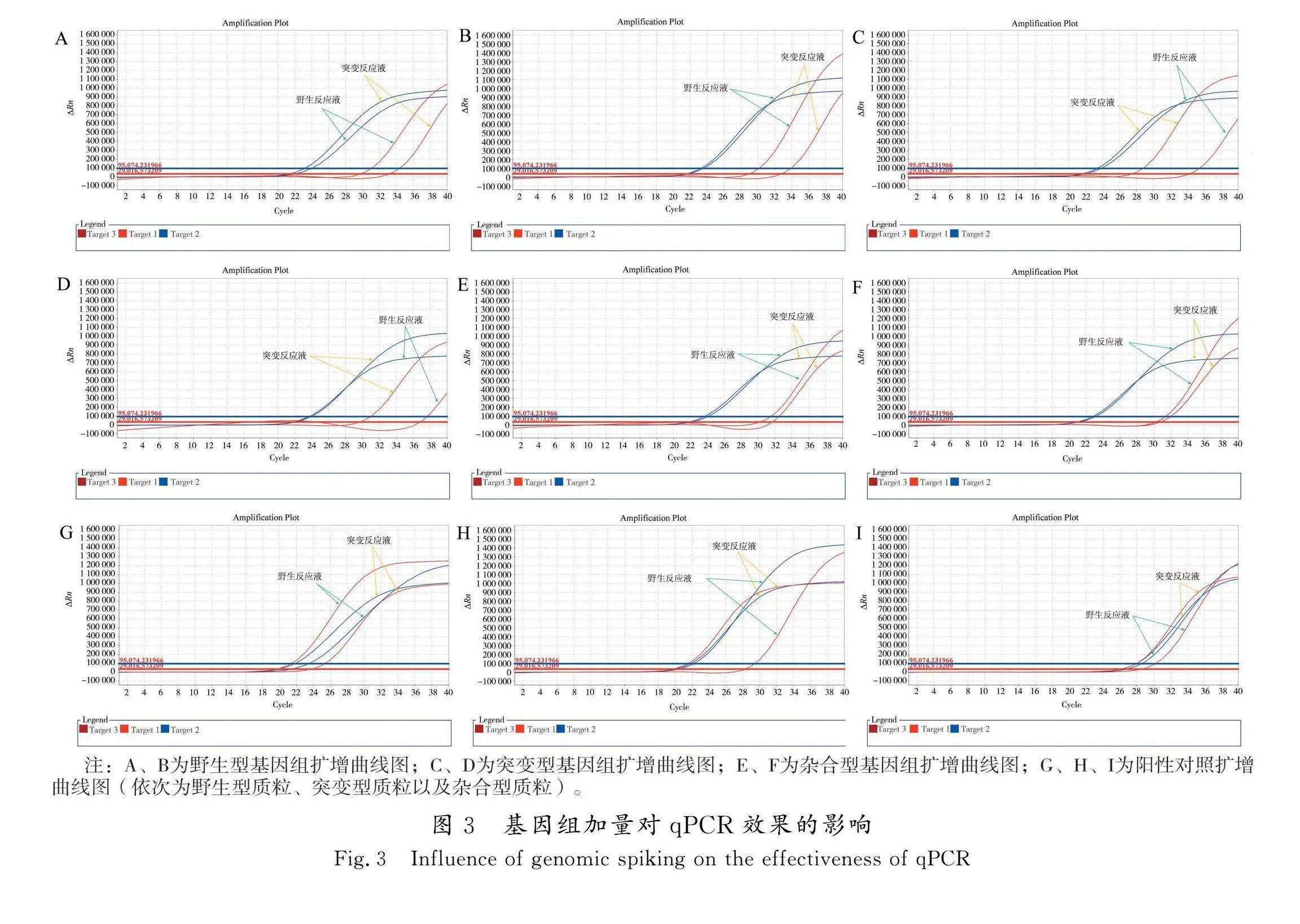
2.2.2 基因组加样量优化
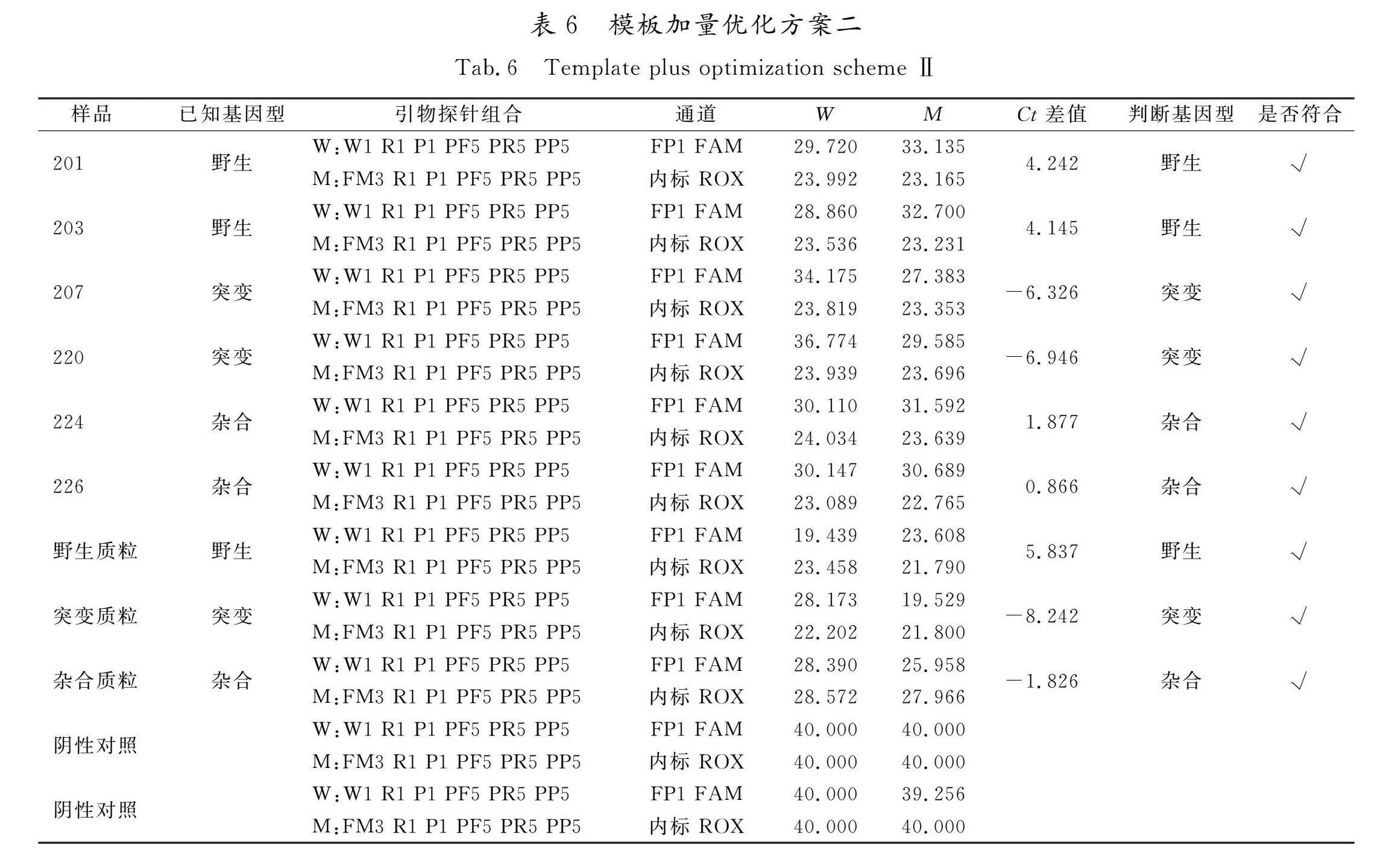
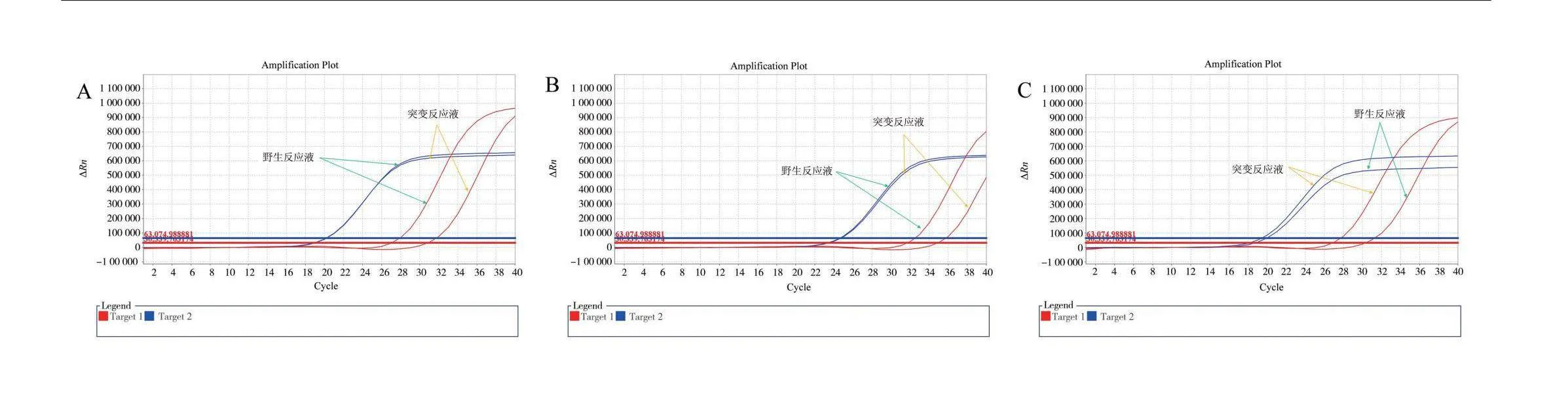
以制备的阳性对照质粒作为野生型、突变型和杂合型样品,同时选用野生型、突变型以及杂合型基因组各2例(基因组浓度稀释至10~15 ng/μL)进行检测,使用“2.1”确定的最优引物探针组合。优化方案一:引物及探针加量为0.1 μL,模板加量为2 μL,其他加量见表2;优化方案二:引物及探针加量为0.1 μL,模板加量为4 μL,其他加量见表2。使用“1.3.6”所述方法进行判定。方案一检测结果,每个样的3个重复实验中,有个别样出现没有扩增现象,造成分型不准。分析原因可能是由于模板加样量过少,容易造成取样量不足;而方案二增加了模板加入量,避免了这种操作误差,所有检测结果都分型准确。可见,方案二模板加样量4 μL更优。实验数据见表6,扩增曲线见图3。
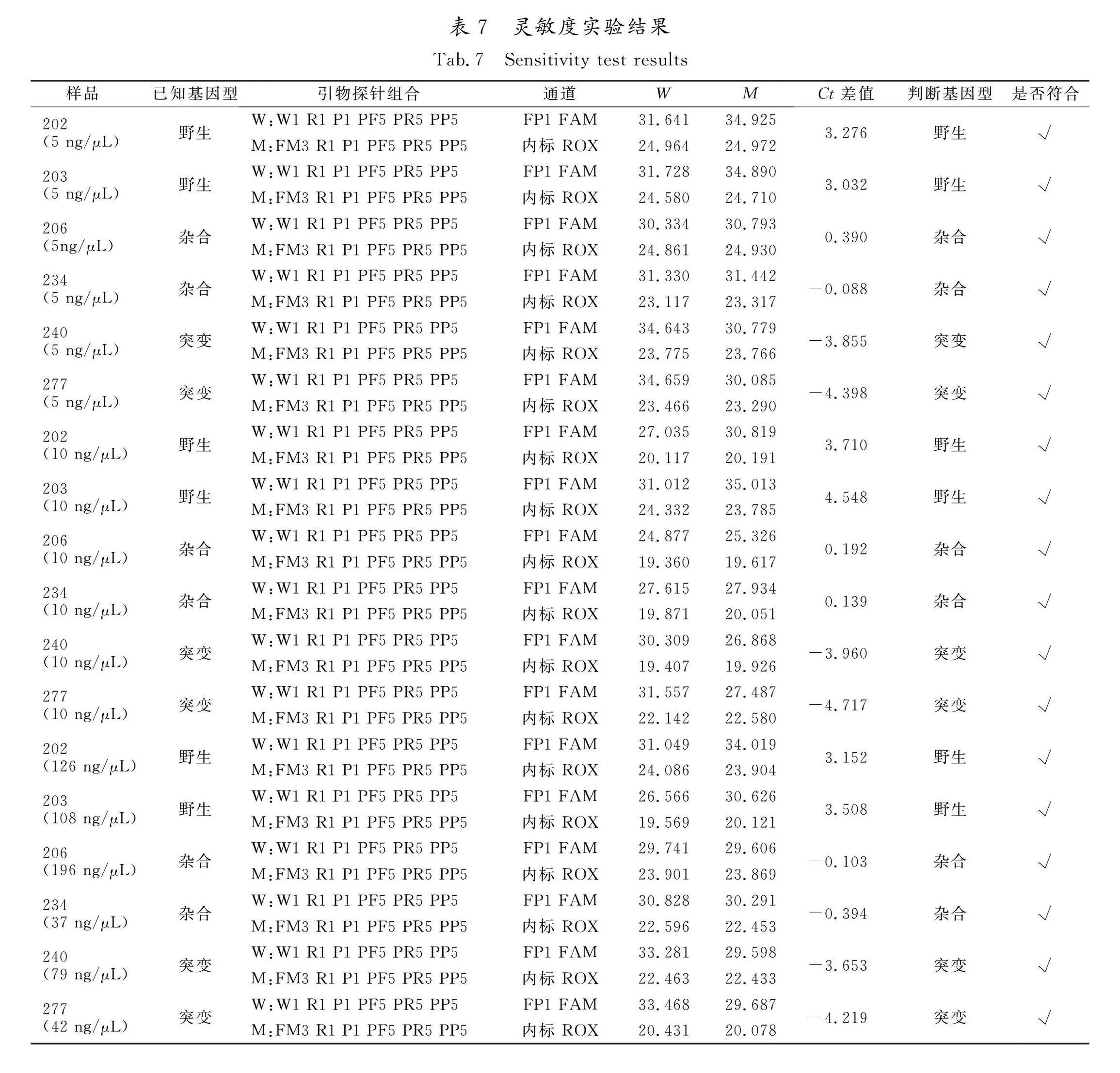
2.3 检测方法的灵敏度研究
为给开发试剂盒提供数据,验证了该检测方法的灵敏度。使用“2.1”确定的最优引物探针进行荧光定量PCR,PCR体系为“2.2”优化后的体系。以制备的阳性对照质粒作为野生型、突变型和杂合型样品,同时选用野生型、突变型以及杂合型基因组各2例,同一基因组选用稀释到5、10~15 ng/μL以及基因组原浓度3种溶液同时进行检测,用“1.3.6”所述方法进行判定。由分型准确性可知,3种质量浓度的溶液均可分型准确,说明该方法对模板浓度的要求不苛刻,对于基因组提取条件及质量要求更宽泛,适应性更强。实验结果也显示稀释到10~15 ng/μL的结果最佳。灵敏度实验数据见表7,扩增曲线见图4。
2.4 PCR引物探针组合、检测体系及检测条件可行性研究
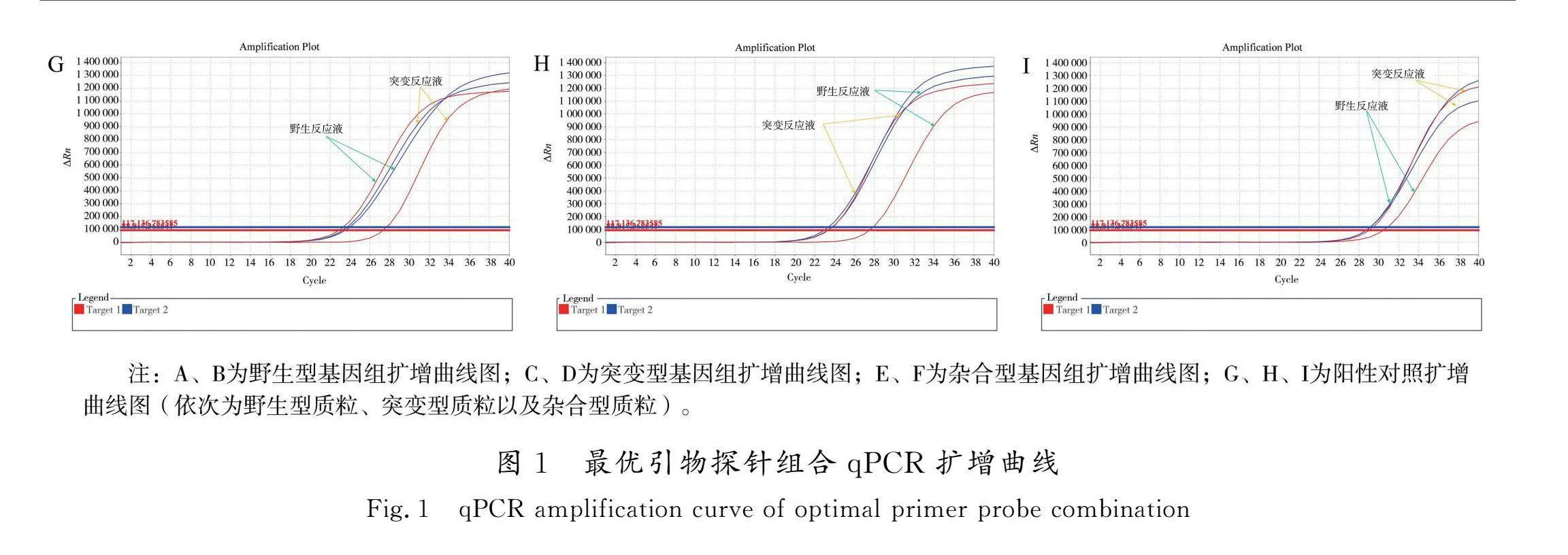
通过检测大量不同基因组样品,检验该PCR检测体系及检测条件的可行性。使用“2.1”确定的最优引物探针,PCR体系为“2.2”优化后的体系,进行荧光定量PCR。首先,选用10例基因组测序样品进行SNP检测,分型结果相符率达100%,见图5。此外,选用70个已采用质谱法SNP检测的样品(质谱法实验由河北省生殖健康研究院完成),采用上述最优条件及方法进行SNP检测,对其分型结果与质谱法结果相比较可知,分型结果相符率达100%[7],统计基因型数据见表8。通过大量样品检测,证明了该检测方法的稳定性和可行性,表明其有进一步开发应用的价值。
3 结 语
1)不孕不育症发病率持续上升,其中男性不育主要与精子质量有关,而锌作为人体必需的微量元素,对于保持精子活力是至关重要的[16]。锌离子的转运,是锌参与各类生理活动的重要环节。已有研究表明,锌离子跨膜运输需要锌转运蛋白协助[17-19],包括
SLC30A家族(ZNT)和SLC39A家族(ZIP)。围绕着这2个家族已经有大量研究。其中,人的SLC39A13基因编码锌转运体跨膜蛋白,是ZIP转运蛋白家族的LIV-1亚家族的一个成员,SLC39A13基因的单核苷酸多态性(SNP)影响了锌转运的强弱,进而影响了男性的精子质量。
2)本研究基于ARMS-PCR技术建立了锌转运基因核酸多态性分析方法,与其他检测技术相比,其优势在于成本低、操作方便、稳定性好、闭管操作,降低了交叉污染风险(每一个位点:3条引物、1条探针;对于MGB-PCR方法需要2条引物、2个探针,探针成本高)。此外,采用融合PCR制备各检测位点基因与内标基因融合的阳性对照品,简化了试剂配制操作,降低了检测信噪比。该方法在目前的文献和专利中未见报道。
3)本研究以提高检测灵敏性、特异性及准确性为目标,分别设计、评估和优选了SLC39A13基因rs755555位点及内参基因PPIA的检测引物和探针。通过优化引物、探针和模板加量,提高了检测的准确性、稳定性,降低了试剂成本。
4)通过检测大量样品,检验了方法的稳定性和可行性,为研发SLC39A13 基因rs755555位点多态性检测试剂盒提供了技术基础。
开发SLC39A13基因rs755555位点多态性检测试剂盒,可为诊断和治疗男性不育症精准用药提供一种检测手段和工具。
5)未来拟进一步建立高效的筛选评价体系,完成灵敏度、准确度、精密度、特异性、重复性和货架期稳定性等性能指标的验证。
参考文献/References:
[1] LUDMILA O,MAXIM K,ALEXANDER O.Effects of cigarette smoking on semen quality,reproductive hormone levels,metabolicprofile,zinc and sperm DNA fragmentation in men:Results from a population-based study[J].Frontiers in Endocrinology,2023. DOI:10.3389/fendo.2023.1255304.
[2] 张琴,苏占营,吴成亮.严重少弱精子症患者血液和精液中微量元素含量分析及相关性研究[J].现代医药卫生,2023,39(20):3459-3462.
ZHANG Qin,SU Zhanying,WU Chengliang.Correlation of trace elements in blood and semen of patients with severe oligozoospermia[J].Journal of Modern Medicine & Health,2023,39(20):3459-3462.
[3] 李秀秀,周黎明,史海跃,等.精浆中重金属元素含量对精液常规参数的影响[J].浙江医学,2023,45(6):572-576.
LI Xiuxiu,ZHOU Liming,SHI Haiyue,et al.Relationship between heavy metal contents in seminal plasma and routine parameters of semen[J].Zhejiang Medical Journal,2023,45(6):572-576.
[4] VASSAL M,PEREIRA C D,MARTINS F,et al.Different strategies to attenuate the toxic effects of zinc oxide nanoparticles on spermatogonia cells[J].Nanomaterials,2022. DOI: 10.3390/NANO12203561.
[5] AKBARI H,ELYASI L,KHALEGHI A A,et al.The effect of zinc supplementation on improving sperm parameters in infertile diabetic men[J].Journal of Obstetrics and Gynaecology of India,2023,73(4):316-321.
[6] CHENG Xinxin,WANG Jie,LIU Chunling,et al.Zinc transporter SLC39A13/ZIP13 facilitates the metastasis of human ovarian cancer cells via activating Src/FAK signaling pathway[J].Journal of Experimental & Clinical Cancer Research,2021. DOI: 10.1186/S13046-021-01999-3.
[7] 李逸豪,石冰洁,冯娅茹,等.AS-PCR法检测CLU基因SNP位点方法的建立[J].中国实验诊断学,2019,23(12):2163-2169.
LI Yihao,SHI Bingjie,FENG Yaru,et al.Establishment of AS-PCR method for detecting SNP locus of CLU gene[J].Chinese Journal of Laboratory Diagnosis,2019,23(12):2163-2169.
[8] 马成凤,李帆,吴曦,等.雄激素代谢相关基因AKR1C3、SHBG、SRD5A2单核苷酸多态性与指长比的相关性[J].宁夏医科大学学报,2023,45(10):994-1001.
MA Chengfeng,LI Fan,WU Xi,et al.Correlation between single nucleotide polymorphisms of androgen metabolism-related genes AKR1C3,SHBG,SRD5A2 and digit ratio[J].Journal of Ningxia Medical University,2023,45(10):994-1001.
[9] CHENG Chen,LI Shuzhen,WANG Boshi,et al.CATS derived SNPs discovery in the golden snub-nosed monkey (Rhinopithecus roxellanae)[J].Conservation Genetics Resources,2014,6:1-3.
[10]HANNEMANN J,RENDANT-GANTZBERG L,ZUMMACK J,et al.Single nucleotide polymorphisms in the arginase 1 and 2 genes are differentially associated with circulating l-Arginine concentration in unsupplemented and l-Arginine–supplemented adultss[J].The Journal of Nutrition,2021,151(4):763-771.
[11]沈影,夏霁,韩凤娟.基因单核苷酸多态性在卵巢癌精准医疗中的应用探析[J].中南药学,2020,18(4):627-629.
SHEN Ying,XIA Ji,HAN Fengjuan.Single nucleotide polymorphism in the precise treatment of ovarian cancer[J].Central South Pharmacy,2020,18(4):627-629.
[12]谢秀菊,夏启玉,刘帅,等.数字PCR和荧光定量PCR检测转基因番木瓜中外源基因拷贝数方法的建立及其应用[J].热带作物学报,2024,45(4):663-673.
XIE Xiuju,XIA Qiyu,LIU Shuai,et al.Establishment and application of digital PCR and fluorescence quantitative PCR for detection of the copy numbers of exogenous gene in transgenic papaya[J].Chinese Journal of Tropical Crops,2024,45(4):663-673.
[13]FILGUEIRA C P B,MOREIRA O C,CANTANHDE L M,et al.Comparison and clinical validation of qPCR assays targeting Leishmania 18S rDNA and HSP70 genes in patients with American Tegumentary Leishmaniasis[J].PLoS Neglected Tropical Diseases,2020.DOI: 10.1371/journal.pntd.0008750.
[14]VERENA P,ANTOINE S,REBECCA R L,et al.A novel tetra-primer ARMS-PCR approach for the molecular karyotyping of chromosomal inversion 2Ru in the main malaria vectors Anopheles gambiae and Anopheles coluzzii[J].Parasites & Vectors,2023. DOI: 10.1186/S13071-023-06014-6.
[15]YANG Hao,YANG Sen,XIA Xuhan,et al.Sensitive detection of a Single-Nucleotide polymorphism in foodborne pathogens using CRISPR/Cas12a-Signaling ARMS-PCR[J].Journal of Agricultural and Food Chemistry,2022,70(27):8451-8457.
[16]温馨.锌介导锌敏感受体GPR39调节精子活力的机制研究[D].唐山:华北理工大学,2022.
WEN Xin.Mechanism of Zinc-mediated Regulation of Sperm Motility by Zinc-sensitive Receptor GPR39[D].Tangshan:North China University of Science and Technology,2022.
[17]辛储林,陈名阳,胡亚荣,等.锌转运蛋白-9抑制高脂食物诱导小鼠前列腺炎的机制研究[J].中国现代医药杂志,2024,26(3):8-13.
XIN Chulin,CHEN Mingyang,HU Yarong,et al.Zinc transporter 9 inhibiting prostatitis induced by high-fat food in mice[J].Modern Medicine Journal of China,2024,26(3):8-13.
[18]臧杰,高明,虞武斌,等.锌转运蛋白4在乳腺癌发生发展中的调控作用及机制研究[J].浙江创伤外科,2024,29(1):1-6.
ZANG Jie,GAO Ming,YU Wubin,et al.Analysis of the regulatory role and mechanism of ZIP4 in the occurrence and development of breast cancer[J].Zhejiang Journal of Traumatic Surgery,2024,29(1):1-6.
[19]MORI H,GOJI A,HARA M.Upregulation of intracellular Zinc ion level after differentiation of the neural stem/progenitor cells in vitro with the changes in gene expression of Zinc transporters[J].Biological Trace Element Research,2024.DOI:10.1007/s12011-023-04033-z.

