化合物A34对糖尿病小鼠的降糖作用及机制探讨





摘 要:为研究一种新型可溶性环氧化物水解酶(soluble epoxide hydrolase,sEH)抑制剂(A34)对糖尿病小鼠的降糖作用,探讨其作用机制,连续5天给小鼠腹腔注射链脲佐菌素(streptozotocin,STZ,50 mg/(kg·d),诱导1型糖尿病(type 1 diabetes mellitus,T1DM)小鼠模型。通过饮水给药,考察A34对糖尿病小鼠饮水摄食量、非禁食血糖、空腹血糖、葡萄糖耐量和血浆胰岛素水平的影响,研究A34的降糖作用;通过研究胰岛中sEH表达水平、胰岛形态变化及血浆中细胞因子干扰素-γ(INF-γ)和白介素-4(IL-4)的含量,分析A34降糖的作用机制。结果表明:与模型组相比,A34有效改善了糖尿病小鼠多饮、多食症状及葡萄糖耐量情况(p<0.01),降低了空腹血糖和非禁食血糖(p<0.01),提高了血浆胰岛素水平(p<0.05);小鼠胰岛中sEH表达量降低(p<0.01),胰岛受损减轻,血浆中IFN-γ与IL-4含量比值降低(p<0.05)。A34可能通过调控促炎和抗炎细胞因子的动态平衡,保护胰岛β细胞免受损伤,从而改善小鼠胰岛β细胞功能,发挥降糖作用。
关键词:药物化学;可溶性环氧化物水解酶;1型糖尿病;葡萄糖耐量;胰岛β细胞;细胞因子
中图分类号:TQ463;R914.4
文献标识码:A
DOI:10.7535/hbkd.2024yx05003
Anti-diabetic effect and mechanism of compound A34 in diabetic mice
SUN Yanping ZHANG Xueyu TIAN Ye3,CHEN Meng DOU Shanshan LI Shuo
ZHANG Huimin SONG Huijia ZHAO Yanfang3,GAO Zibin1,2
(1.School of Chemical and Pharmaceutical Engineering,Hebei University of Science and Technology,
Shijiazhuang,Hebei 050018, China;
2.Hebei Province Key Laboratory of Molecular Chemistry for Drug, Shijiazhuang,Hebei 050018, China;
3.School of Pharmaceutical Engineering,Shenyang Pharmaceutical University, Shenyang,Liaoning 110016, China)
Abstract: In order to detemine the anti-diabetic effect and potential mechanism of a novel soluble epoxide hydrolas inhibitor (A34) on diabetic mice. Type 1 diabetes mellitus (T1DM) mice were induced by streptozotocin (50 mg/(kg·d) for 5 days, ip)and the hypoglycemic effect of A34 were evaluated by water and food intake, non-fasting and fasting blood glucose, glucose tolerance and plasma insulin level in diabetic mice after water administration.The underlying mechanism was explored via measuring the expression level of sEH in islets, the morphological change of islets and the concerntration of cytokines INF-γ and IL-4 in plasma. Compared with diabetic model group, the water and food intake(p<001, p<005), blood glucose (p<001), glucose tolerance (p<001) and plasma insulin level (p<005 ) were improved in A34 group. Additionally, A34 could protect pancreatic islet morphology, suppress sEH expression in islet (p<001), reduce the ratio of INF-γ to IL-4 in plasma(p<005 ). These results showed that A34 prevents hyperglycemia and β-cell dysfunction through regulating the dynamic balance of pro-inflammatory and anti-inflammatory cytokines in diabetic mice.
Keywords:medicinal chemistry;soluble epoxide hydolase;type 1 diabetes mellitus;glucose tolerance;islet β cell;cytokines
可溶性环氧化物水解酶(soluble epoxide hydrolase,sEH)是一种以环氧脂肪酸为底物的酶,能够将多不饱和脂肪酸的CYP450酶活性代谢产物——环氧脂肪酸水解成活性较低的二羟基脂肪酸[1]。环氧脂肪酸具有抗炎、抗氧化作用,在预防和治疗代谢性疾病和神经系统疾病中发挥着重要作用[2-3]。sEH在人体广泛分布,通过抑制sEH活性可以减少环氧脂肪酸的降解,起到治疗疾病的作用。近年来,多个sEH的小分子抑制剂被设计合成出来,并在多种疾病模型中表现出良好的治疗效果[4-5]。研究表明,患糖尿病时sEH在胰岛[6]、心脏[7]、视网膜[8]、肝脏[9]、脑血管[10]等的表达和活性升高,使用sEH抑制剂或基因敲除能够缓解高血糖症状,提高对胰岛素的敏感性,预防和治疗糖尿病及其并发症[11-12]。sEH的抑制剂GSK2256294已完成Ⅱ期临床研究,肥胖患者用药后可抑制其体内sEH活性,降低氧化应激[13]。
1型糖尿病(type 1 diabetes mellitus,T1DM)的发病与自身免疫缺陷相关,β细胞的自身免疫性破坏导致胰岛素分泌不足,血糖升高[14]。尽管sEH抑制剂能够通过多种作用途径发挥降血糖的作用[15-17],但其对T1DM中自身免疫反应的影响尚不明确。化合物N-(4-氯苯基)-4-(3-(4-氯苯基)-1-(2-吗啉代乙基)脲基)-3-甲基苯甲酰胺(A34)是本研究团队设计合成的新型sEH抑制剂,其结构见图1。
A34在体外具有良好的sEH抑制活性(IC50为0.04 nmol),在体内也表现出良好的抗炎活性[18]。目前,国内外尚无sEH抑制剂类药物上市。本文通过考察A34对T1DM的治疗作用,初步探讨其对免疫平衡的影响,为sEH抑制剂的研发提供实验依据,为糖尿病的治疗提供新的思路。
1 实验材料
1.1 主要药品及试剂
A34,由沈阳药科大学合成;链脲佐菌素,STZ,Sigma公司提供;超敏小鼠胰岛素试剂盒,易致生物科技有限公司提供;HE染色试剂盒,Sigma公司提供;干扰素-γ(INF-γ)、白介素-4(IL-4)检测试剂盒,南京建成生物工程研究所提供;兔SP试剂盒、DAB显色试剂盒,北京中杉金桥生物技术有限公司提供;Tris-EDTA抗原修复液、EPHX2兔多克隆抗体,Proteintech中国公司提供。
1.2 主要仪器
酶标仪,美国伯腾(BioTek)仪器有限公司提供;血糖测试仪,罗氏诊断产品有限公司提供;组织病理切片机,金华市华速科技有限公司提供;快速混匀器,常州博远实验分析仪器厂提供;生物显微镜,徕卡公司提供;电子天平,型号AL204、XP205,梅特勒-托利多仪器(上海)有限公司提供;高速冷冻离心机,安徽中科中佳科学仪器有限公司提供。
1.3 实验动物
SPF级雄性Balb/c小鼠(6~8周,体质量18~20 g),购自河北伊维沃生物科技有限公司,合格证编号为SCXK(冀)2020-002。将小鼠于室温(22 ± 2)℃、相对湿度55%±5%,以及12 h/12 h明暗交替环境下饲养。
2 实验方法
2.1 动物分组、造模及给药
将小鼠适应性喂养1周后,随机分为3组,正常对照组(Con组)、模型组(Mod组)和给药组(A34组)[19],其中正常对照组6只,模型组和给药组均12只,每笼6只进行喂养。模型组和给药组连续5 d按50 mg/kg剂量腹腔注射STZ的柠檬酸缓冲溶液(0.1 mol/L,pH值为4.5)进行造模;正常对照组注射同等剂量的柠檬酸盐缓冲液。实验期间,正常对照组饮用蒸馏水,模型组饮用2.5%羟丙基-β-环糊精水溶液,给药组造模前2天开始饮用2.5%羟丙基-β-环糊精增溶的质量浓度为0.025 mg/mL的A34水溶液,直至6周实验结束。
2.2 动物实验方案
每周测定小鼠饮水摄食量、非禁食血糖及空腹血糖;分别于造模第4周和第6周进行葡萄糖耐量实验;第6周糖耐量实验结束后第2天,采血分离小鼠血浆,测定血浆中胰岛素、INF-γ和IL-4含量,将小鼠胰腺组织制成石蜡切片,HE染色观察胰腺病理形态,通过免疫组织化学染色检测胰腺组织中sEH表达情况。
2.3 血糖检测
每周一上午9:00,对小鼠尾静脉采血,采用血糖测定仪测定小鼠非禁食血糖,随后禁食6 h(自由饮水),于下午15:00测定空腹血糖。
2.4 腹腔注射葡萄糖耐量实验(IPGTT)
将小鼠禁食6 h(9:00~15:00,自由饮水),测定空腹血糖,记为0 min血糖值,随后根据小鼠体质量按
1 g/kg剂量腹腔注射葡萄糖液,分别于糖负荷后的15、30、60、120 min尾静脉采血,测定血糖值,并计算时间血糖值曲线下面积AUC(min·mmol/L):
AUC=15×(BG0+BG15)/2+15×(BG15+BG30)/2+30×(BG30+BG60)/2+
60×(BG60+BG120)/2 。 (1)
式中:BG0、BG15、BG30、BG60、BG120分别代表0、15、30、60、120 min的血糖值。
2.5 血浆样品制备
从小鼠眼球取血,放入EDTA-K2抗凝管中,于室温、4 000 r/min条件下离心15 min,分离血浆,分装后于-20 ℃保存。
2.6 胰腺石蜡切片制备
采用颈椎脱臼方法,从小鼠腹腔剪取胰尾部分组织,用生理盐水冲洗干净后,置于4%多聚甲醛固定液中,于4 ℃条件固定24 h,用流水冲洗后,常规石蜡包埋,5 μm切片。
2.7 ELISA实验
参照各检测试剂盒说明书,检测各组小鼠血浆样品中胰岛素、IFN-γ和IL-4的含量。
2.8 HE染色
参照HE染色试剂盒说明书,石蜡切片脱腊水化后,用苏木素染色5 min,分化液分化30 s,用自来水冲洗2 min,伊红染色10 s,脱水透明封片,在生物显微镜下观察获得的图像。
2.9 免疫组织化学检测
参照兔SP试剂盒说明书,石蜡切片脱腊水化后,进行常规抗原修复、阻断、封闭操作。每个样本滴加适量稀释后的一抗,于37 ℃孵育1 h,PBS冲洗20 min,滴加生物素标记山羊抗兔lgG,室温孵育13 min,PBS冲洗20 min,再滴加辣根酶标记链酶卵白素工作液,室温孵育13 min,PBS冲洗20 min,DAB显色,苏木素复染细胞核,脱水封片,显微镜下观察采集的图像。采用Image-Pro Plus软件分析免疫组化图像,根据积分光密度(IOD)计算染色强度。
2.10 统计学处理
数据以均数±标准差(x±s)表示,采用SPSS统计软件进行数据处理。2组比较采用t检验,多组比较采用单因素方差分析(one-way ANOVA),两两比较分析采用Bonferroni法。假设检验水准按α=0.05判定,p<0.05为差异有统计学意义。
3 实验结果
3.1 A34对糖尿病小鼠饮食量的影响
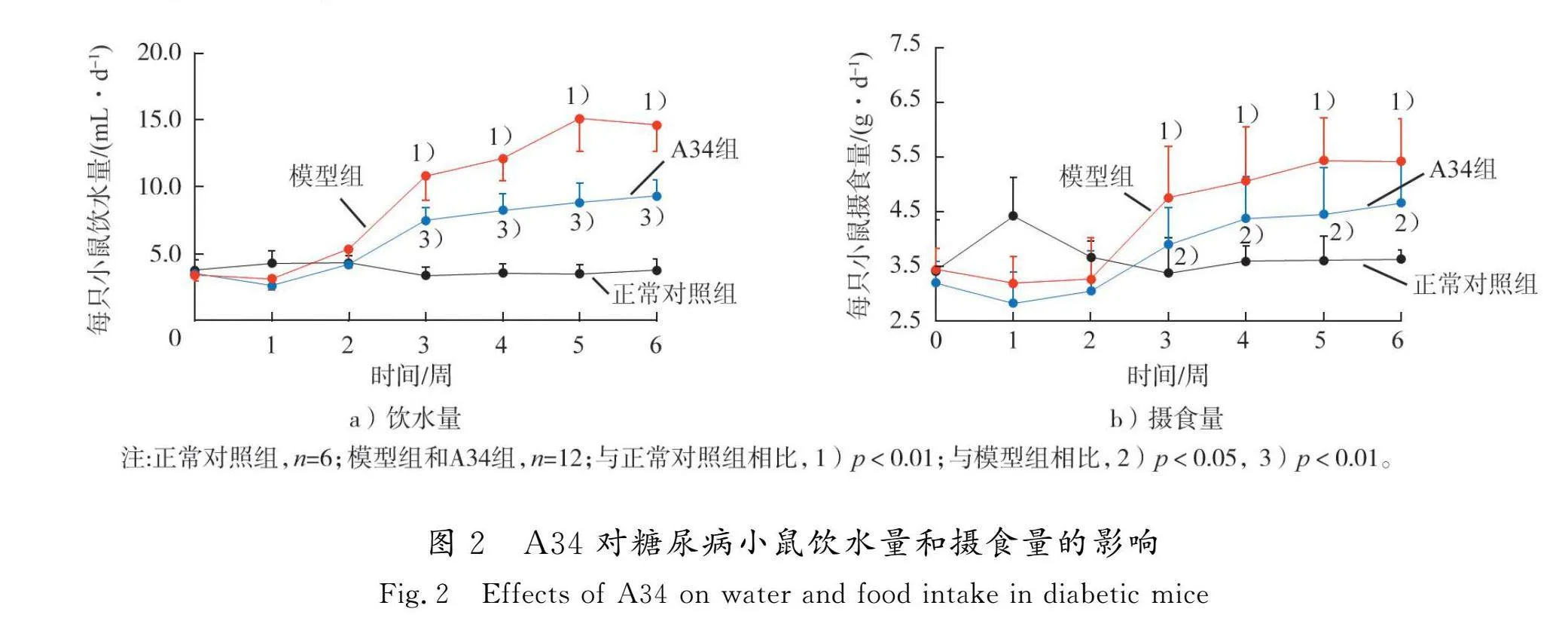
在整个实验周期内,正常对照组小鼠饮水量和摄食量维持在初始水平;造模3周后,与正常对照组相比,模型组小鼠饮水量和摄食量逐渐增加(p<0.01);与模型组相比,给予A34干预后,糖尿病小鼠饮水量和摄食量均降低(p<0.01,p<0.05),表明A34改善了糖尿病小鼠“多饮多食”的症状。结果见图2。
3.2 A34对糖尿病小鼠血糖的影响
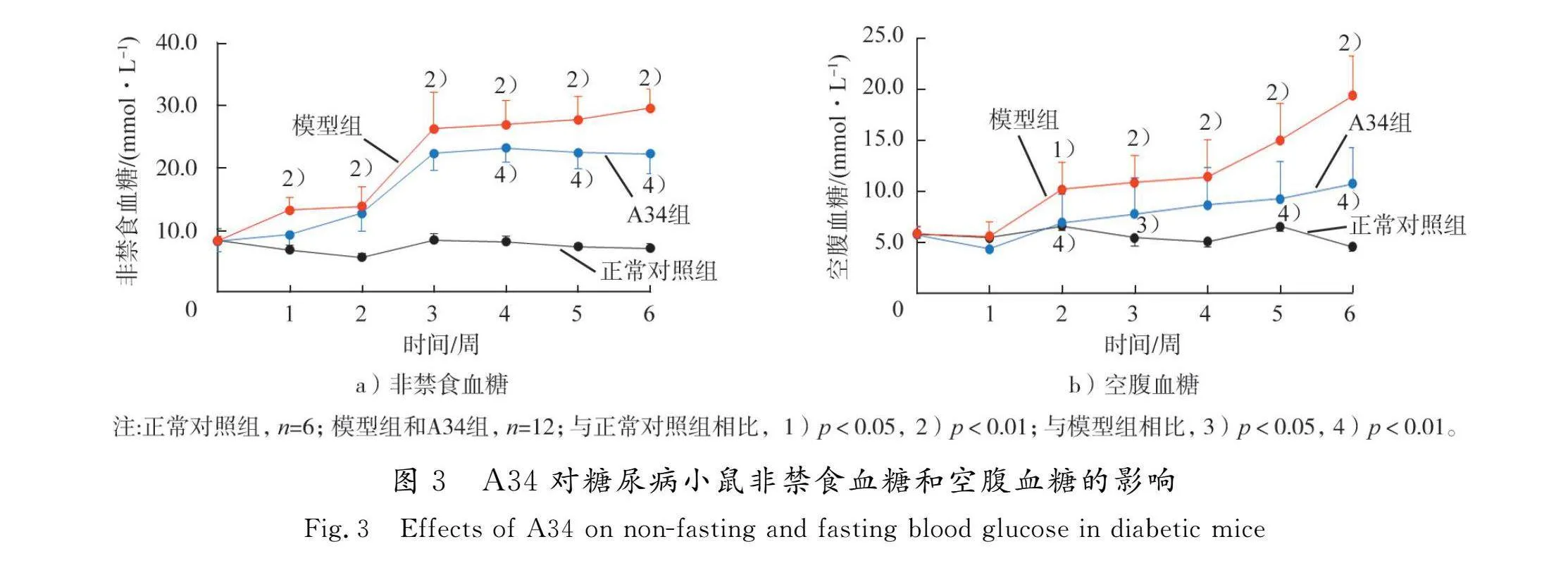
如图3所示,实验期间,正常对照组小鼠非禁食血糖和空腹血糖保持平稳。模型组小鼠非禁食血糖和空腹血糖均随造模时间延长逐渐升高,并分别于造模1周、2周后明显高于正常对照组(p<0.01,p<0.05);A34组非禁食血糖和空腹血糖随造模时间延长亦有升高趋势,但升高程度低于模型组,分别于造模4周、2周后显著低于模型组(p<0.01)。结果表明,A34能够缓解糖尿病小鼠的非禁食血糖和空腹血糖的升高,具有降糖作用。
3.3 A34对糖尿病小鼠葡萄糖耐量的改善作用
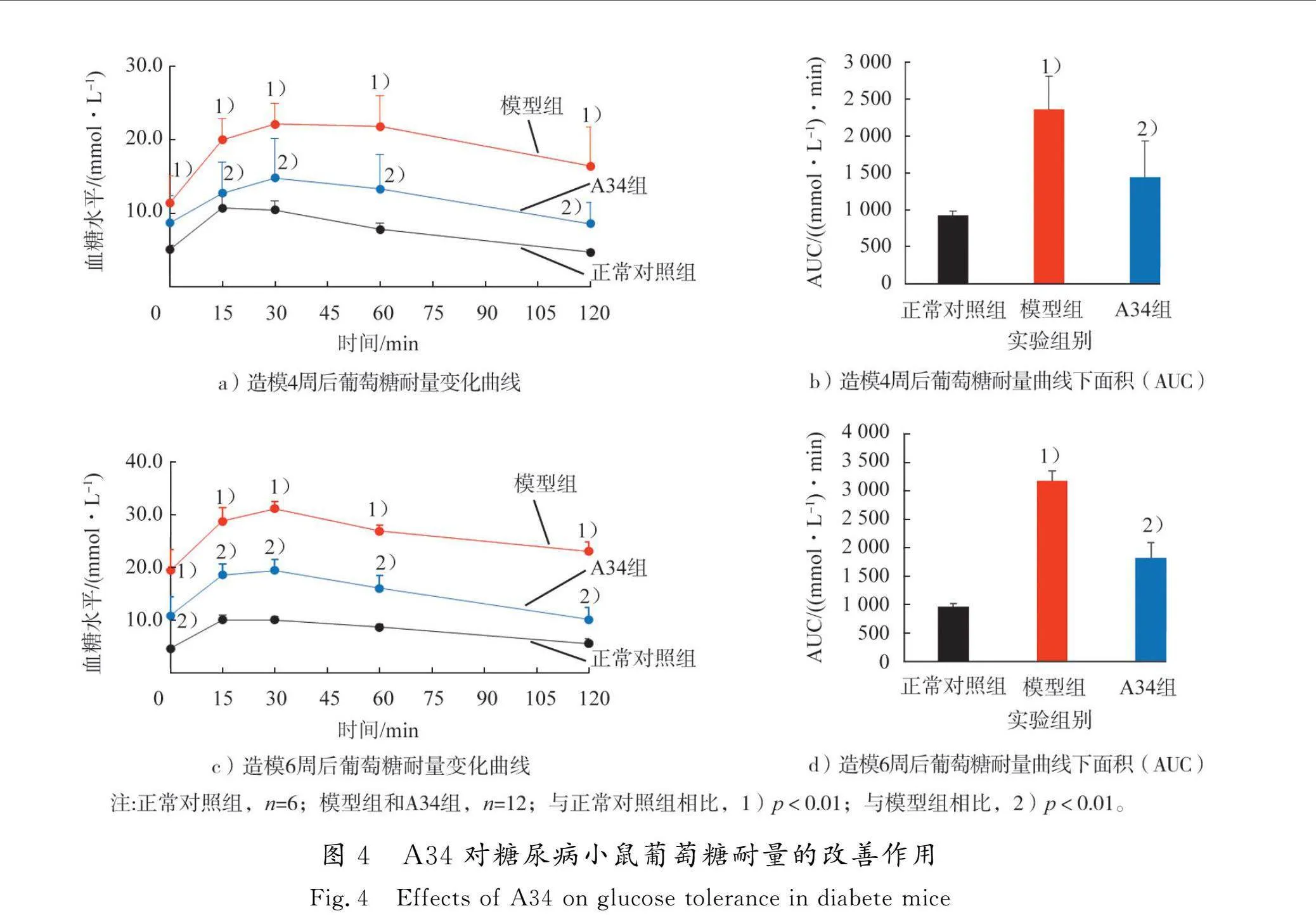
葡萄糖耐量实验是评价机体葡萄糖代谢能力的经典方法。分别于小鼠造模4周和6周时进行葡萄糖耐量实验,结果见图4。给予葡萄糖后,正常对照组小鼠血糖15 min达到峰值并于120 min时恢复至初始水平;模型组小鼠血糖30 min到达峰值,120 min时未恢复至初始水平;A34组小鼠血糖30 min达到峰值并于120 min时恢复至初始水平;与模型组相比,A34组注射葡萄糖后,血糖值与血糖曲线下面积均明显低于模型组(p<0.01)。结果表明:正常对照组小鼠胰岛功能良好,给予葡萄糖后,能迅速释放胰岛素调节血糖的稳态;模型组小鼠胰岛功能明显受损,胰岛素分泌延迟且不足。A34能够减轻STZ诱导的胰岛损伤,改善糖尿病小鼠对葡萄糖的调控能力,保护胰岛功能。
3.4 A34对糖尿病小鼠血浆胰岛素水平的影响
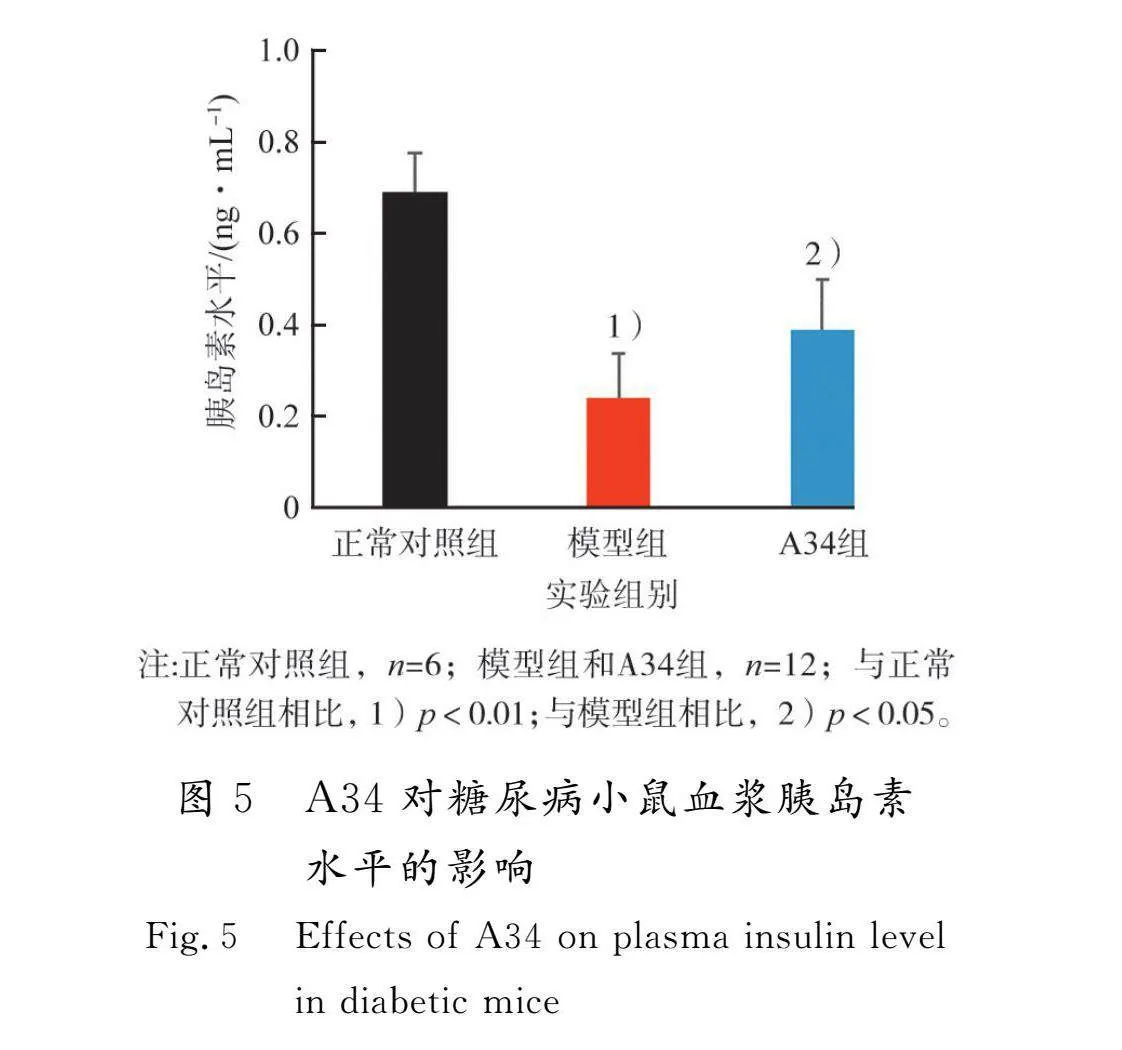
采用ELISA法测定血浆胰岛素含量,结果如图5所示。
由图5可知:正常对照组小鼠血浆胰岛素含量维持在较高水平((0.69±0.20)ng/mL),STZ能够破坏胰岛细胞,影响胰岛素分泌功能,导致模型组血浆胰岛素水平显著降低((0.24±0.10)ng/mL)(p<0.01);A34干预后,缓解了STZ造成的胰岛素缺乏((0.39±0.11)ng/mL)(p<0.05),保护了胰岛细胞功能。
3.5 A34对糖尿病小鼠胰岛形态的影响
HE染色结果如图6所示。
由图6可以看出:正常对照组小鼠的胰岛呈椭圆形,结构完整、边缘清晰,胰岛内β细胞大小均匀、饱满充盈、排列紧密;模型组小鼠的胰岛萎缩变形,边缘不清,结构紊乱,胰岛内β细胞肿胀、变形;与模型组相比,A34组小鼠胰岛形态结构较完整,β细胞肿胀、变形情况减轻。结果表明,A34能够缓解STZ诱导的胰岛萎缩变形和β细胞肿胀情况。
3.6 A34对糖尿病小鼠胰腺sEH表达量的影响
采用免疫组织化学染色考察胰岛中sEH的表达情况。结果如图7所示。
由图7可知:胰腺中sEH主要在胰岛细胞中表达,与正常对照组相比,模型组小鼠胰岛中sEH表达量明显增多(p<0.01);与模型组相比,给药组小鼠胰岛中sEH表达量明显降低(p<0.01)。结果表明,STZ诱导的糖尿病小鼠模型中,胰岛中sEH表达升高,A34能够降低糖尿病小鼠胰岛中sEH的表达量。
3.7 A34对糖尿病小鼠炎症因子IFN-γ与IL-4的影响
糖尿病是由T细胞介导的自身免疫性疾病,涉及慢性炎症过程。本研究采用ELISA法测定了小鼠血浆中促炎因子IFN-γ与抗炎因子IL-4水平,结果见表1。其中:正常对照组,n=6;模型组和A34组,n=9。
由表1可知:与正常对照组相比,模型组小鼠血浆IFN-γ水平、IFN-γ/IL-4比值均增高(p<0.05);与模型组相比,A34组小鼠血浆IL-4水平增高(p<0.01),IFN-γ/IL-4比值降低(p<0.05),INF-γ水平比较差异无统计学意义。这表明A34能够调控糖尿病小鼠血浆细胞因子水平,降低促炎因子和抗炎因子的比例,改善由细胞因子失衡导致的β细胞的炎性损伤。据有关文献报道,sEH抑制剂可以通过抑制NF-κB活化发挥抗炎作用[20]。根据本研究结果推测,A34可能是通过抑制NF-κB信号通路,减少机体炎症反应,降低胰岛β细胞凋亡,从而保护胰岛细胞功能,发挥降糖作用。
4 讨 论
T1DM是一种T细胞介导的自身免疫性疾病[21],其发病过程有多种免疫细胞参与,其中CD4+T淋巴细胞扮演了很重要的角色。CD4+T细胞根据分泌的细胞因子不同可分为T辅助细胞1(Th1)和T辅助细胞2(Th2)2种细胞亚群。在体内,Th1细胞主要分泌IFN-γ、TNF-α等促炎因子,Th2细胞主要分泌IL-4、IL-10等抗炎因子。正常机体内,Th1和Th2细胞亚群互相制约,达到平衡,维持机体免疫平衡。当平衡被破坏,Th1细胞亚群占优势时,就会诱发一系列炎症反应,炎症因子与免疫系统相互作用,引起胰岛β细胞结构与功能障碍[22],导致T1DM发生。
sEH是环氧脂肪酸的主要代谢酶,在多种疾病中sEH表达量增高、活性增强,而sEH抑制剂或者基因敲除sEH能够在疾病控制方面发挥重要作用。sEH抑制剂在胃肠道炎症模型小鼠中抑制了sEH活性,与模型组小鼠相比,sEH抑制剂治疗组显著减少了炎性细胞浸润,降低了促炎细胞因子IFN-γ和TNF-α的水平,下调了LTB4和5-HETE炎症介质,降低了活动性溃疡的发生率,延缓了疾病进展[23]。在蛙皮素或精氨酸诱导的小鼠急性胰腺炎模型中,胰腺中sEH表达量和活性均增强,而进行sEH基因敲除或使用sEH抑制剂TPPU之后,抑制了NF-κB炎症信号通路,减少了细胞死亡,改善了胰腺炎症状[24-25]。sEH抑制剂还能有效改善类风湿性关节炎[26]、牙周炎[27]等炎症性疾病。此外,在高脂饮食诱导的2型糖尿病小鼠模型及糖尿病患者中,胰岛β细胞中sEH表达量显著升高,而基因敲除sEH或者抑制sEH活性,减轻了胰岛β细胞氧化应激、细胞凋亡及去分化,改善了糖尿病症状[3]。在STZ诱导的T1DM小鼠模型中,基因敲除sEH或者通过sEH抑制剂治疗之后,能够减少胰岛细胞凋亡,增强胰岛β细胞葡萄糖刺激胰岛素分泌功能,改善胰岛素的敏感性,降低血糖[28-29]。
5 结 语
1)本文以新型sEH抑制剂A34作为药物,通过多参数考察验证了其对T1DM小鼠的降糖作用机制。结果表明,A34通过调控促炎和抗炎细胞因子的动态平衡,保护胰岛β细胞免受损伤,改善T1DM小鼠多饮、多食状况,缓解T1DM小鼠血糖的增长,提高糖尿病小鼠血浆胰岛素水平及对血糖的调控能力,具有显著的降血糖作用。
2)A34能够降低T1DM小鼠血浆IFN-γ/IL-4比值,这表明胰岛β细胞保护功能可能是通过调控淋巴细胞因子的释放、调节Th1/Th2 失衡状态以及减轻STZ所起的炎症免疫反应实现的。本研究的发现提示,A34可能对与炎症反应相关的一些其他疾病也有一定的治疗作用。
本研究仅对A34的降糖机制进行了初步探索,尚有不足之处。例如:未进行A34在体内对sEH抑制作用的研究;未明确A34的降糖作用是否通过抑制sEH、提高或维持环氧脂肪酸的水平来实现。后续还需通过体外细胞实验、基因敲除或过表达、液质联用技术等多种手段确认A34的降糖机制。
参考文献/References:
[1] SPECTOR A A.Arachidonic acid cytochrome P450 epoxygenasepathway[J].Journal of Lipid Research,2009,50 (supl):S52-S56.
[2] WAGNER K M,MCREYNOLDS C B,SCHMIDT W K,et al.Soluble epoxide hydrolase as a therapeutic target for pain,inflammatory and neurodegenerative diseases[J].Pharmacology & Therapeutics,2017,180:62-76.
[3] DOS S L R B,FLEMING I.Role of cytochrome P450-derived,polyunsaturated fatty acid mediators in diabetes and the metabolic syndrome[J].Prostaglandins & Other Lipid Mediators,2020. DOI:10.1016/j.prostaglandins.2019.106407.
[4] MALLIGA R I,KUNDU B,WOOD C M.Soluble epoxide hydrolase inhibitors:an overview and patent review from the last decade[J].Expert Opinion on Therapeutic Patents,2022,32(6):629-647.
[5] ZARRIELLO S,TUAZON J P,COREY S,et al.Humble beginnings with big goals:Small molecule soluble epoxide hydrolase inhibitors for treating CNS disorders[J].Progress in Neurobiology,2019,172:23-39.
[6] KOIKE S,HSU M F,BETTAIEB A,et al.Genetic deficiency or pharmacological inhibition of soluble epoxide hydrolase ameliorates high fat diet-induced pancreatic β-cell dysfunction and loss[J].Free Radical Biology & Medicine,2021,172:48-57.
[7] DEWEY S,LAI Xianyin,WITZMANN F A,et al.Proteomic analysis of hearts from Akita mice suggests that increases in soluble epoxide hydrolase and antioxidative programming are key changes in early stages of diabetic cardiomyopathy[J].Journal of Proteome Research,2013,12(9):3920-3933.
[8] HU Jiong,DZIUMBLA S,LIN Jihong,et al.Inhibition of soluble epoxide hydrolase prevents diabetic retinopathy[J].Nature,2017,552(7684):248-252.
[9] ZHANG Lening,VINCELETTE J,CHEN D,et al.Inhibition of soluble epoxide hydrolase attenuates endothelial dysfunction in animal models of diabetes,obesity and hypertension[J].European Journal of Pharmacology,2011,654(1):68-74.
[10]JOUIHAN S A,ZULOAGA K L,ZHANG Wenri,et al.Role of soluble epoxide hydrolase in exacerbation of stroke by streptozotocin-induced type 1 diabetes mellitus[J].Journal of Cerebral Blood Flow and Metabolism,2013,33(10):1650-1656.
[11]LURIA A,BETTAIEB A,XI Yannan,et al.Soluble epoxide hydrolase deficiency alters pancreatic islet size and improves glucose homeostasis in a model of insulin resistance[J].Proceedings of the National Academy of Sciences of the United States of America,2011,108(22):9038-9043.
[12]ANITA N Z,SWARDFAGER W.Soluble epoxide hydrolase and diabetes complications[J].International Journal of Molecular Sciences,2022. DOI:10.3390/IJMS23116232.
[13]JAMES R,JUSTIN R,DAVID W,et al.GSK2256294 Decreases sEH (soluble epoxide hydrolase) activity in plasma,muscle,and adipose and reduces f2-isoprostanes but does not alter insulin sensitivity in humans[J].Hypertension,2021,78(4):1092-1102.
[14]LI Ping,CHEN Yanli,LUO Luxiang,et al.Immunoregulatory effect of acanthopanax trifoliatus (L.) Merr. polysaccharide on T1DM mice[J].Drug Design,Development and Therapy,2021,15:2629-2639.
[15]LUO Pengcheng,CHANG Hsinhsin,ZHOU Yiqiang,et al.Inhibition or deletion of soluble epoxide hydrolase prevents hyperglycemia,promotes insulin secretion,and reduces islet apoptosis[J].The Journal of Pharmacology and Experimental Therapeutics,2010,334(2):430-438.
[16]CHEN Lingdan,FAN Cheng,ZHANG Yi,et al.Beneficial effects of inhibition of soluble epoxide hydrolase on glucose homeostasis and islet damage in a streptozotocin-induced diabetic mouse model[J].Prostaglandins & Other Lipid Mediators,2013,104/105:42-48.
[17]TIAN Ye,LI Shuo,DONG Kuan,et al.Discovery of benzamide derivatives containing urea moiety as soluble epoxide hydrolase inhibitors[J].Bioorganic Chemistry,2022. DOI:10.1016/J.BIOORG.2022.105898.
[18]崔玉琴,赵莺歌,田瑞琼,等.羧甲基壳聚糖接枝聚丙烯酸水凝胶的制备及体内外评价[J].河北科技大学学报,2015,36(5):504-510.
CUI Yuqin,ZHAO Yingge,TIAN Ruiqiong,et al.Preparation of carboxymethyl chitosan grafted polyacrylic acid hydrogel and its evaluation in vitro and in vivo[J].Journal of Hebei University of Science and Technology,2015,36(5):504-510.
[19]SHEN H C,HAMMOCK B D.Discovery of inhibitors of soluble epoxide hydrolase:A target with multiple potential therapeutic indications[J].Journal of Medicinal Chemistry,2012,55(5):1789-1808.
[20]侯文睿,谢胜男,鲁憬莉,等.RegⅢ/胰岛素原双基因质粒的构建及其对1型糖尿病小鼠的治疗作用[J].药学学报,2010,45(8):987-994.
HOU Wenrui,XIE Shengnan,LU Jingli,et al.Recombination of RegⅢ-proinsulin-pBudCE4.1 plasmid and its therapeutic effect on STZ-induced type 1 diabetes mellitus[J].Acta Pharmaceutica Sinica,2010,45(8):987-994.
[21]陈小娟,何福根,周迪夷.杜仲多糖对自发性2型糖尿病db/db小鼠糖脂代谢的影响[J].中国药学杂志,2020,55(17):1433-1438.
CHEN Xiaojuan,HE Fugen,ZHOU Diyi.Effect of Eucommiaulmoides polysaccharide on db/db diabetic mice′s glycolipid metabolism[J].Chinese Pharmaceutical Journal,2020,55(17):1433-1438.
[22]ZHANG Wanying,YANG A L,LIAO Jie,et al.Soluble epoxide hydrolase gene deficiency or inhibition attenuates chronic active inflammatory bowel disease in IL-10(-/-) mice[J].Digestive Diseases and Sciences,2012,57(10):2580-2591.
[23]BETTAIEB A,CHAHED S,TABET G,et al.Effects of soluble epoxide hydrolase deficiency on acute pancreatitis in mice[J].PLoS One,2014. DOI:10.1371/journal.pone.0113019.
[24]BETTAIEB A,CHAHED S,BACHAALANY S,et al.Soluble epoxide hydrolase pharmacological inhibition ameliorates experimental acute pancreatitis in mice[J].Molecular Pharmacology,2015,88(2):281-290.
[25]TRINDADE D S C A,CLEMENTE N J `T,ABDALLA H B,et al.Soluble epoxide hydrolase inhibitor,TPPU,increases regulatory T cells pathway in an arthritis model[J].FASEB Journal,2020,34(7):9074-9086.
[26]TRINDADE D S C A,BETTAIEB A,NAPIMOGA M H,et al.Soluble epoxide hydrolase pharmacological inhibition decreases alveolar bone loss by modulating host inflammatory response,RANK-related signaling,endoplasmic reticulum stress,and apoptosis[J].The Journal of Pharmacology and Experimental Therapeutics,2017,361(3):408-416.
[27]LUO Pengcheng,CHANG H H,ZHOU Yiqiang,et al.Inhibition or deletion of soluble epoxide hydrolase prevents hyperglycemia,promotes insulin secretion,and reduces islet apoptosis[J].The Journal of Pharmacology and Experimental Therapeutics,2010,334(2):430-438.
[28]CHEN L D, FAN C,ZHANG Y,et al.Beneficial effects of inhibition of soluble epoxide hydrolase on glucose homeostasis and islet damage in a streptozotocin-induced diabetic mouse model[J].Prostaglandins Other Lipid Mediat,2013,104/105:42-48.
[29]LUO P C,CHANG H H,ZHOU Y Q,et al.Inhibition or deletion of soluble epoxide hydrolase prevents hyperglycemia,promotes insulin secretion,and reduces islet apoptosis[J].Journal of Pharmacology and Experimental Therapeutics,2010,334:430-438.

